Conferencias clínico-patológicas: la importancia del diagnóstico multidisciplinar
Más datosEl paciente era un varón de 76 años que vivía en un ámbito urbano, no tenía alergias y no presentaba hábitos tóxicos. Respecto a sus antecedentes patológicos, destacaba la hipertensión arterial en tratamiento farmacológico con enalapril e hiperaldosteronismo primario debido a un nódulo suprarrenal, en tratamiento farmacológico con espironolactona, cuyo tratamiento quirúrgico fue desestimado por la situación de fragilidad clínica del paciente. Tres meses antes del episodio actual y debido a una nefropatía IgA en fase terminal, el paciente había recibido un trasplante renal de donante cadáver. Como complicaciones presentó una hepatitis tóxica medicamentosa por azitromicina y amoxicilina-clavulánico, normalizándose tras la retirada de los fármacos; un episodio de pielonefritis con hemocultivos positivos para M. Morganii tratado con ertapenem por vía endovenosa, y finalmente, un cuadro confusional orientado como un cuadro de toxicidad neurológica por carbapenémicos, experimentando una mejoría clínica tras el cese de tratamiento antibiótico y con TC craneal normal. El paciente presentó posteriormente una adecuada evolución tras el trasplante con valores de creatinina de 1,16 mg/dL. En el momento del presente ingreso recibía tratamiento inmunodepresor con tacrolimus 4 mg/24 h, micofenolato 500 mg/12 h y prednisona 20 mg/24 h.
El motivo de la consulta fue la aparición progresiva de síntomas neurológicos: inestabilidad de la marcha, desorientación témporo-espacial, alteración del lenguaje, incontinencia urinaria, disminución de la agudeza visual y aumento de somnolencia. El paciente llevaba una semana con esta clínica, sin fiebre ni otra sintomatología concomitante en los días previos. A su llegada a urgencias se encontraba hemodinámicamente estable, levemente hipertenso (PA 150/70 mmHg), afebril y con correctas saturaciones de oxígeno a aire ambiente. En la exploración física presentaba dificultad en el lenguaje y para la bipedestación, sin otros hallazgos significativos ni otros signos de focalidad neurológica. En la analítica general inicial destacaban una leucocitosis leve (11,58 x109/L), creatinina de 1,3 mg/dL, elevación de transaminasas (AAT 55 UI/L y ALAT 171 UI/L) un patrón colestásico (FA 226 UI/L y GGT 430 UI/L), y proteína C reactiva de 144 mg/dL. No se apreciaron alteraciones en el resto de los parámetros analíticos analizados. El sedimento urinario mostró bacteriuria sin piuria.
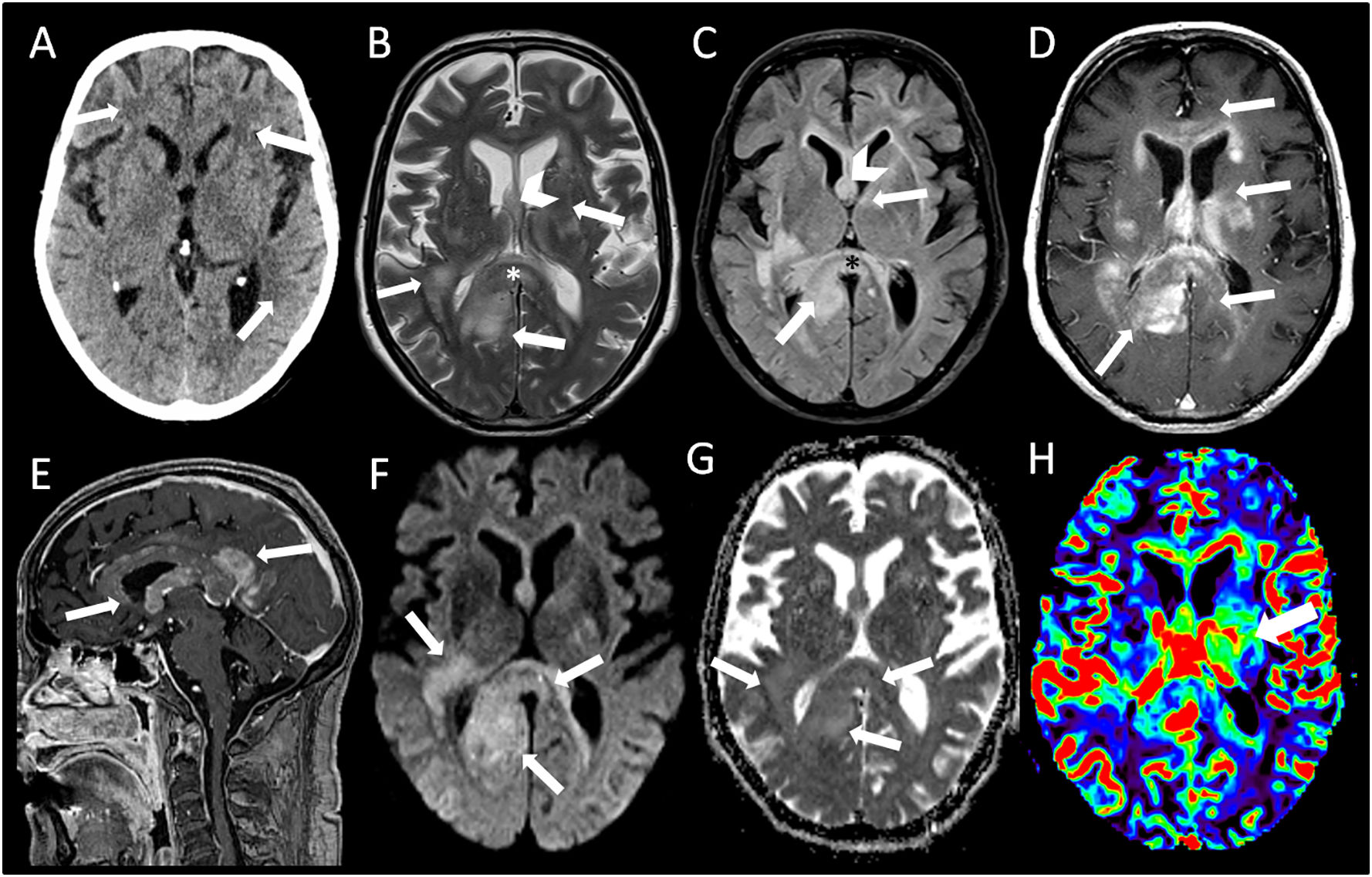
En una TC craneal (fig. 1A), se apreciaron hipodensidades parcheadas en sustancia blanca periventricular y subcortical en relación con cambios hipóxico-isquémicos crónicos, leucoaraiosis y discreto aumento del tamaño del sistema ventricular.
Múltiples lesiones hiperintensas en T2 (B) que de forma parcialmente confluente y expansiva afectan bilateralmente la sustancia blanca subcortical bifrontal, los centros semiovales y la corona radiata, la región gangliobasal y la sustancia blanca periventricular. También compromiso de la sustancia blanca profunda posterior del lóbulo temporal derecho. Las lesiones comprometen extensamente el cuerpo calloso en toda su extensión, el fórnix derecho, la comisura blanca anterior, cintillas ópticas bilaterales, el hipocampo derecho y el pedúnculo y tegmento mesencefálico izquierdo. Las lesiones tienen discreta hiperseñal a la difusión (F), y presentan un realce homogéneo y mal definido después de la administración del contraste (D,E). En el estudio de perfusión, alguna de las lesiones muestra aumento del volumen sanguíneo cerebral (H).
Al tercer día del ingreso, el paciente presentó clínica de disminución progresiva del estado de conciencia. La exploración respiratoria, cardíaca y abdominal no evidenció alteraciones. En la exploración neurológica, se apreció una puntuación en la escala de Glasgow de 11 (apertura ocular espontánea al llamado 4, emite sonidos 2, respuesta motora orientada al dolor 5), una desviación oculocefálica a la derecha, ausencia de emisión de lenguaje ni respuesta a órdenes, disminución de movilidad de hemicuerpo derecho y rigidez nucal.
Los análisis evidenciaron una discreta leucocitosis con neutrofilia (leucocitos 13.400/mm3), persistencia de la elevación de enzimas transaminasas y de patrón colestásico (AAT 60 UI/L, ALAT 166 UI/L, FA 206 UI/L, GGT 363 UI/L) y una proteína C reactiva de 2,2 mg/dL. El resto de la analítica no mostraba alteraciones destacables: Hb 12,9 g/dL, Hcto 40,6%, VCM 101,2 fL, plaquetas 303 x109/L, quick 88%, INR 1,08, glucosa 117 mg/dL, urea 41 mg/dL, creatinina 1,12 mg/dL, bili. Total 0,67 mg/dL, bili. Dir. 0,28 mg/dL, Na 144,7 mmol/L, K 3,02 mmol/L, Ca 8,9 mg/dL, amilasa 16 U/L, prots. 5,8 g/dL.
La radiografía de tórax fue normal. Una segunda TC craneal no mostró cambios respecto al TC craneal previo y en una punción lumbar se objetivó: proteínas 88 mg/dL, glucosa 74 mg/dL, células 5/mcL, hematies 0/mcL. Se realizaron PCR para diferentes microorganismos (Mycobacterium tuberculosis; Citomegalovirus; virus Epstein–Barr; Enterovirus; Paraechovirus; virus herpes simple 1 y 2; virus herpes 6 y 8; virus JC; virus varicela; virus BK; Toxoplasma gondii y Cryptococcus neoformans) y cultivos, resultando negativos. Se amplió un inmunofenotipado en líquido cefalorraquídeo (LCR) con resultado negativo.
Durante la revaloración del paciente se apreciaron clonías en la hemicara izquierda y el pie ipsilaterales; por lo que se solicitó un electroencefalograma (figs. 2A-C) que confirmó la sospecha de estado epiléptico, definido por un patrón de crisis electroclínicas focales prácticamente continuas caracterizadas por la sucesión de anomalías epileptiformes, que mostraban cambios secuenciales de morfología, frecuencia y distribución topográfica en las regiones temporo-parieto-occipitales del hemisferio derecho. Ante dichos hallazgos se orientó el caso como estado epiléptico sin síntomas motores prominentes y con alteración del nivel de consciencia de origen indeterminado en un paciente inmunodeprimido, por lo que, se pautó tratamiento con diazepam 5 mg y levetiracetam 3 g (fig. 2C). Además, como cumplía criterios de estado epiléptico refractario se administró lacosamida 400 mg, trasladándose a la Unidad de Cuidados Intensivos (UCI) para la inducción de coma anestésico, tras lo cual se pudo controlar la actividad crítica (fig. 2D).
Vídeo-EEG continuo. Montaje referencial (average). LFF 0,5 Hz, HFF 70 Hz, sensibilidad 20 μV/mm, barrido 15 mm/seg. Estado epiléptico focal con crisis electroclínicas durante > 10 min, con una prevalencia > 20% de la totalidad del registro (> 60 min). Selección de 3 épocas de registro de: A) 20 s; B) 12 s; y C) 7 s, que muestran un patrón crítico prácticamente continuo caracterizado por la sucesión de anomalías epileptiformes, de elevada amplitud y proyección topográfica, que muestran cambios secuenciales de morfología, frecuencia y distribución en regiones temporo-parieto-occipitales de hemisferio derecho (A y B). Patrón discontinuo tras la administración de DZP y LEV (C). D) Vídeo-EEG (UCI). Montaje referencial (average). LFF 0,5 Hz, HFF 70 Hz, sensibilidad 20 μV/mm, barrido 15 mm/seg. Remisión del estado epiléptico tras sedación (MDZ y RMF). Persisten ocasionales anomalías epileptiformes intercríticas en las regiones témporo-parieto-occipitales derechas (P8, O2).
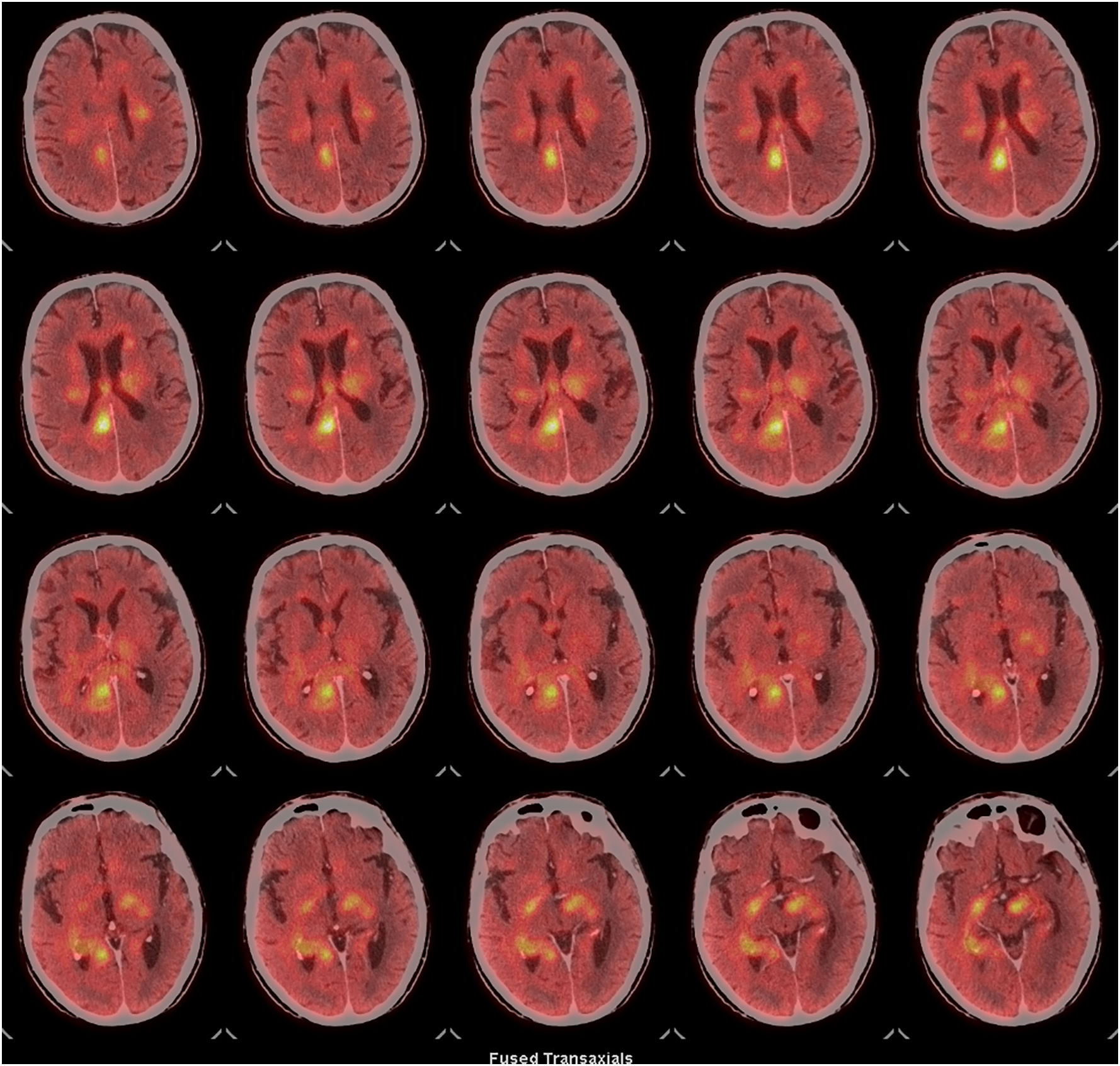
Durante su ingreso en UCI se practicó un fondo de ojo que no detectó la presencia de papiledema. La resonancia magnética (RM) mostró una afectación multifocal confluente bihemisférica de predominio central con extensión mesencefálica izquierda, cuyas características radiológicas sugerían como principal sospecha diagnóstica que se pudiera tratar de un linfoma cerebral (fig. 1B-H). La tomografia computarizada con emisión de positrones (PET/TC) mostró múltiples focos hipermetabólicos encefálicos concordantes con las lesiones descritas en la resonancia magnética y compatibles con un proceso linfoproliferativo de alto grado, SUV (Standarized Uptake Value) máxima de 10,9 (fig. 3). Debido a la situación clínica del paciente no fue posible realizar una biopsia cerebral para la obtención de material histológico.
PET-TC cerebral con 18F-FDG, cortes axiales. Múltiples focos hipermetabólicos en ambos hemiferios afectando a la sustancia blanca subcortical bifrontal, de los centros semiovales, de los núcleos de la base y de la corona radiada, así como la sustancia blanca periventricular, sustancia blanca del lóbulo temporal derecho. Marcado hipermetabolismo en todo el cuerpo calloso, fórnix derecho, comisura blanca anterior, cintas ópticas bilaterales, hipocampo derecho y pedúnculo cerebral izquierdo, la más destacable por su metabolismo localizada en el fórnix derecho. Hallazgos sugestivos de un proceso infiltrativo tumoral (alto grado).
Con los datos obtenidos se decidió intensificar el tratamiento con rituximab semanal, teniendo en cuenta la situación de fragilidad que presentaba el paciente. Transcurridos 10 días presentó una mala evolución neurológica y una pobre respuesta a glucocorticoides e inmunodepresores, por lo que se decidió conjuntamente con la familia limitar el esfuerzo terapéutico e iniciar medidas de comodidad. Finalmente, el paciente falleció tras 3 semanas de ingreso hospitalario.
Diagnóstico diferencialEn resumen, se trata de un varón de 76 años que presentó un cuadro inicial encefalopático, con alteración del lenguaje, visual y de la deambulación, que posteriormente progresó a una situación de estado epiléptico refractario con afectación del nivel de conciencia. En los antecedentes, destacaba haber recibido un trasplante renal 3 meses antes con tratamiento inmunodepresor. La analítica general no mostró hallazgos reseñables, exceptuando un aumento de transaminasas y patrón de colestasis. El estudio de LCR, incluyendo estudio microbiológico e inmunofenotipado, no mostró alteraciones bioquímicas. El fondo de ojo fue normal.
Ante un paciente inmunodeprimido con alteración del nivel de consciencia y clínica neurológica es importante plantear un amplio diagnóstico diferencial que valore al paciente en su conjunto. Inicialmente, es conveniente la realización de pruebas generales con el objetivo de descartar procesos sistémicos que interfieran en el estado del paciente (metabólicos, infecciosos, fallo orgánico o tóxicos), así como la revisión exhaustiva de la medicación del paciente. Adicionalmente, la realización de una prueba de neuroimagen (TC craneal y/o RM craneal) es útil en el estudio de procesos intracraneales causantes de dicha clínica como: eventos vasculares, masas cerebrales o abscesos. En caso de sospechar un proceso infeccioso de sistema nervioso central, debe realizarse una punción lumbar y completar el estudio con análisis de PCR para la detección de microorganismos en LCR, así como el inicio de antibioterapia y antiviroterapia empírica. Cabe destacar la importancia de sospechar un estado epiléptico, en cuyo caso es mandatoria la realización de un electroencefalograma1–3.
En casos de un estado epiléptico, es imprescindible completar el estudio etiológico, dado que es fundamental realizar el tratamiento de la causa además de la utilización de fármacos anticrisis. Las etiologías del estado epiléptico incluyen estados sintomáticos agudos (daño cerebral agudo de cualquier tipo, retirada de fármacos en los pacientes epilépticos, alteraciones tóxicas/metabólicas), estados sintomáticos retardados (lesiones crónicas en neuroimagen), estado sintomático progresivo (fundamentalmente tumores) o criptogénico (tras un estudio amplio no se encuentra causa aparente). Por tanto, el estudio etiológico inicial incluye las exploraciones habituales ante una disminución del nivel de consciencia (analítica, punción lumbar, neuroimagen). En casos de un estado epiléptico focal, es imprescindible completar la estudio por imagen con RM craneal si la TC no es concluyente.
Con relación al caso descrito, los procesos sistémicos fueron razonablemente descartados mediante las primeras pruebas realizadas durante su estancia en Urgencias (gasometría arterial, analítica general, radiografía de tórax y un sedimento urinario). Respecto a la neuroimagen, la TC craneal (fig. 1A) no evidenció alteraciones significativas en el parénquima cerebral con excepción de áreas hipodensas parcialmente confluentes en ambos hemisferios cerebrales (flechas) que sugerían cambios hipóxico-isquémicos crónicos. En las imágenes de RM cerebral (fig. 1B-H) se apreció la presencia de múltiples lesiones hiperintensas (flechas) en T2 (fig. 1B) y FLAIR (fig. 1C) con características confluentes en ambos hemisferios cerebrales con predilección en la región central donde se observa afectación del fórnix (cabeza de flecha) y cuerpo calloso (asterisco, *). En T1 después de la administración intravenosa de contraste (fig. 1D y E), la mayoría de las lesiones muestran un marcado realce (flecha). El estudio de difusión (fig. 1F) y mapa de coeficiente de difusión aparente (ADC-G) reveló que las zonas afectadas mostraban restricción heterogénea (flechas). El mapa de perfusión demostró un incremento del volumen sanguíneo cerebral (VSC-H) en la región talámica izquierda (flecha).
Tras el hallazgo de un patrón de afectación bihemisférica en el paciente, profundizaremos en el diagnóstico diferencial de estas lesiones. La afectación de predominio central y la afectación periventricular de la sustancia blanca con realce difuso, sin edema ni efecto de masa prominente, así como perfusión moderada orientó a que se tratase de un linfoma cerebral primario. Sin embargo, se debe considerar de que este tipo de afectación también puede verse en otro tipo de neoplasias como los gliomas malignos.
Debido al cuadro clínico presentado por el paciente, las principales entidades clínicas contempladas fueron: linfoma cerebral primario, glioblastoma multiforme, metástasis, procesos infecciosos (toxoplasmosis o abscesos cerebrales) y enfermedades desmielinizantes que pudieran ocasionar masas con tumefacción.
El linfoma cerebral primario supone un pequeño porcentaje de los tumores cerebrales; no obstante, constituyen la etiología más frecuente en los pacientes inmunodeprimidos, presentando un pico de incidencia a los 6 meses en los pacientes trasplantados2. Respecto a su localización, suelen presentarse con afectación bihemisférica y predominio de infiltración de la sustancia blanca periventricular, ganglios basales y el cuerpo calloso. Típicamente, proporcionan una imagen hiperdensa debido al gran componente de celularidad que presentan, lo que también ocasiona una importante restricción a la difusión; no es habitual la presencia de una masa heterogénea debido a hemorragia, calcificación o necrosis previa al tratamiento. La captación de contraste suele ser homogénea, aunque en los pacientes inmunocomprometidos puede presentarse con captación en anillo2–7. En la PET/TC suele apreciarse un patrón de metabolismo homogéneo y algunos autores han propuesto el uso de SUV máxima para la diferenciación de esta entidad con el glioblastoma multiforme, uno de los principales diagnósticos diferenciales y cuya detección mediante neuroimagen puede suponer un importante reto diagnóstico. Debido a la alta concentración de células y, por lo tanto, un mayor consumo de glucosa, el linfoma cerebral primario presentará una SUV máxima superior al glioblastoma8.
El resto de los tumores cerebrales primarios y las metástasis son el principal diagnóstico diferencial a tener en cuenta. Dependiendo de la localización de la masa cerebral, sus características radiológicas y los factores epidemiológicos del paciente harán más probable una etiología u otra. Uno de los principales tumores cerebrales a tener en cuenta es el glioblastoma multiforme, ya que supone un 15% de los tumores cerebrales primarios y su presentación puede ser muy variada4. En la mayoría de los casos se presenta como una masa heterogénea con necrosis central y edema vasogénico, así como una captación de contraste en anillo. Debido a alternar zonas con abundante celularidad con zonas necróticas presenta un patrón heterogéneo en las secuencias de difusión. En la PET/TC típicamente se apreciará un patrón no homogéneo y SUV máxima menor5,6,8.
En el espectro de las enfermedades infecciosas es destacable la infección por toxoplasma, ya que puede ser causa de lesiones multifocales en los pacientes inmunodeprimidos. No obstante, dicha afectación suele producirse en los pacientes con infección por VIH y presencia de CD4+ < 100 células/microL. Su presentación suele ser en anillo con necrosis central y extensa área edematosa6,9.
Con relación a las enfermedades desmielinizantes, ocasionalmente pueden presentarse como una masa tumefacta afectando principalmente a la sustancia blanca y con morfología de captación en anillo incompleto. En las secuencias de difusión suele apreciarse una masa heterogénea, debido a presentar zonas de alta celularidad junto con áreas de importante destrucción de mielina5.
Dado que se trata de un paciente portador de trasplante renal en tratamiento con inmunodepresión y por las características radiológicas de la lesión, se orientó el caso como un linfoma cerebral primario. La homogeneidad tanto en la resonancia magnética como en el PET-TC hacen que el diagnóstico de linfoma sea el más probable. Es destacable la importancia de la obtención de una muestra de anatomía patológica para la confirmación del diagnóstico e individualizar el tratamiento, no obstante, debido a la situación clínica del paciente esto no fue posible.
Diagnóstico del Dr. LázaroLa opción diagnóstica más probable sería linfoma cerebral primario.
Discusión anatomopatológica (Dr. Naranjo Ruiz-Atienza)En el estudio autópsico se observó una cardiomegalia de 450 g con hipertrofia ventricular izquierda concéntrica y lesiones de aterosclerosis coronaria (con obstrucción de hasta el 70% de la luz). La aorta abdominal mostraba cambios de calcificación y ulceración en su pared. Los riñones nativos presentaban un aspecto atrófico, con múltiples quistes en la superficie, una superficie rugosa, y una importante involución adiposa. Histológicamente se encontró una marcada nefroangiosclerosis. El aspecto macroscópico del injerto renal estaba conservado, sin alteraciones histológicas destacables.
En el estudio del sistema nervioso central se observó un encéfalo de 1.345 g, con leptomeninges lisas y brillantes, sin alteración en el patrón de circunvoluciones. Se encontraron lesiones de aterosclerosis no oclusiva en la arteria basilar, las arterias vertebrales y, en menor medida, en las arterias carótidas internas. En los cortes coronales seriados se observó un marcado engrosamiento del cuerpo calloso, y en menor medida de las cintillas ópticas y de la comisura blanca anterior. En ambos hemisferios la cápsula interna mostraba un ensanchamiento evidente, con una superficie rugosa, con borramiento de la cabeza del caudado, del hipotálamo y del tálamo izquierdos, y del núcleo geniculado lateral derecho. La cabeza del hipocampo derecho aparecía blanquecina y engrosada, nodular. En el tronco del encéfalo, el pedúnculo mesencefálico izquierdo presentaba un engrosamiento nodular, y la hemiprotuberancia homolateral mostró un borramiento de la trama de los núcleos de la base (fig. 4).
Imágenes macroscópicas de secciones coronales del hemisferio izquierdo (A, B), del hemisferio derecho (C), del mesencéfalo (D) y protuberancia (E). Se observa un engrosamiento del cuerpo calloso (A, B y C, asterisco rojo), de la comisura blanca anterior (B, flecha roja) y de las cintillas ópticas (B, flecha verde), afectación del cuerpo geniculado lateral (C, asterisco verde) y lesión nodular en la cabeza del hipocampo posterior derecho (C, flecha azul). Lesión nodular en mesencéfalo (D, asterisco azul) y en hemiprotuberancia izquierda (E, flecha negra).
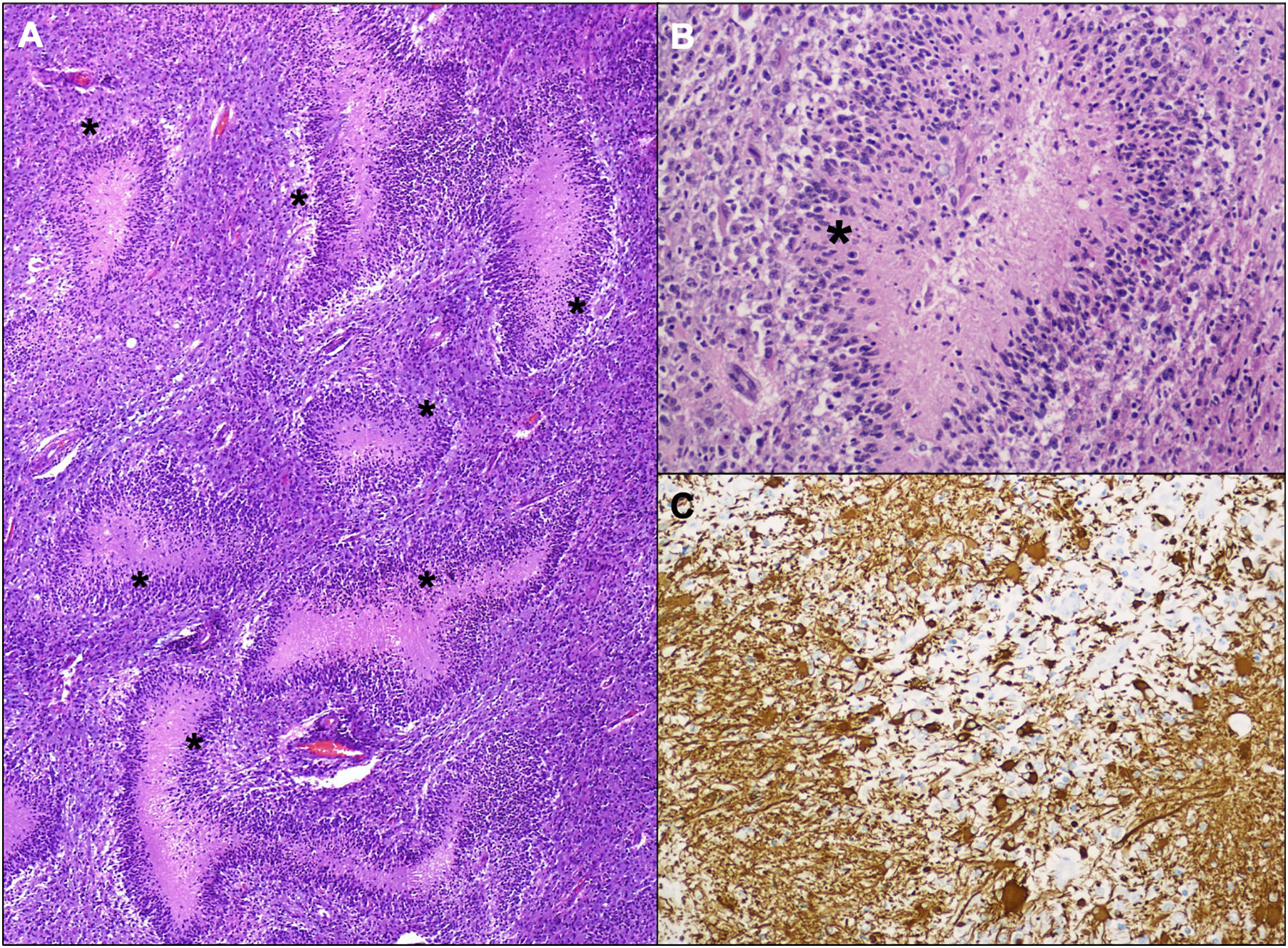
Histológicamente se observó en estas áreas una lesión densamente celular compuesta por núcleos hipercromáticos de mediano tamaño con frecuentes áreas de necrosis geográfica con seudoempalizada (fig. 5). En el estudio inmunohistoquímico se encontró expresión parcheada de proteína glial en algunas de estas células. No se identificó mutación de IDH1 R132H ni pérdida de expresión de ATRX. Con estos hallazgos morfológicos y este perfil inmunohistoquímico se realizó un diagnóstico de glioblastoma sin mutación de IDH, grado IV de la clasificación de la OMS de 201610, con afectación bilateral asimétrica, extensión desde polo frontal a polo occipital, marcada afectación hipocampal, de cuerpo calloso y mesencéfalo-protuberancial.
Imágenes histológicas de la lesión. A) Lesión densamente celular con frecuentes focos de necrosis serpinginosa (hematoxilina-eosina, 40×, asteriscos negros en áreas de necrosis). B) A mayor aumento se observa cariorrexis y necrosis central, con seudoempalizada, asterisco negro (hematoxilina-eosina, 200×). C) Estudio inmunohistoquímico de proteína glial acídica en el que se observa una expresión parcheada de la proteína (GFAP, 200×).
El glioblastoma es el extremo más agresivo del grupo de tumores cerebrales primarios más frecuentes, los astrocitomas infiltrantes. Estos tumores se clasifican en función de su grado histológico de malignidad en astrocitoma difuso (grado II, aumento de la densidad celular), astrocitoma anaplásico (grado III, con actividad mitósica) y glioblastoma (grado IV, con proliferación vascular y necrosis). Desde la última clasificación de tumores cerebrales de la OMS (2016) se añaden características moleculares a los criterios diagnósticos histológicos, en particular la presencia o ausencia de mutación en el gen de la isocitrato deshidrogenasa (IDH), enzima del ciclo de Krebs. La supervivencia en los pacientes con tumores con esta mutación es significativamente mayor que en los que no la presentan.
El desarrollo de tumores en los pacientes trasplantados se ha descrito y estudiado. Amplias series de pacientes que habían recibido un trasplante renal describen una incidencia de entre el 3,611 y el 12,3%12, hasta 12 veces mayor que en los pacientes no trasplantados. Los tumores más frecuentes fueron los de tracto genitourinario (del 22,3 al 32,1%) y gastrointestinal (del 25 al 30,7%). No se pudo encontrar una relación entre el régimen de inmunoterapia y el tiempo de desarrollo de la neoplasia o la supervivencia. Se describen ocasionales casos de glioblastoma en los pacientes trasplantados renales. La serie más larga, de 5 pacientes, muestra un periodo de latencia entre el trasplante y la aparición del tumor de al menos 4 años13. En el presente caso este tiempo fue muy inferior, de alrededor de 3 meses, por lo que la lesión podría haberse desarrollado antes del trasplante.
Diagnóstico global finalGlioblastoma multiforme.
Responsabilidades éticasSe han seguido los procedimientos éticos del centro para la publicación de este artículo.
Conflicto de interesesNo hay conflictos de interés por parte de los autores respecto a la presentación de este caso clínico-patológico.