La vigilancia de las enfermedades transmitidas por vectores es importante para establecer medidas de control en salud pública. Las poblaciones indígenas de Córdoba viven en condiciones geoclimáticas que favorecen la presencia de vectores que podrían permitir la diseminación y aparición de hantavirosis, rickettsiosis y fiebre por el virus Chikungunya.
ObjetivoEstablecer la seroprevalencia de Hantavirus, Rickettsia sp. y Chikungunya en la población indígena de Tuchín, Córdoba.
Materiales y métodosSe realizó un estudio descriptivo de corte transversal en 190 individuos del resguardo indígena del municipio de Tuchín; el muestreo fue realizado entre agosto y diciembre del 2012. La detección de anticuerpos IgG contra Hantavirus se llevó a cabo con la prueba IgG DxSelectTM (Focus Technologies, EL1600G, California, EE. UU.), anticuerpos IgG contra Rickettsia sp. se determinaron por inmunofluorescencia indirecta y se realizó detección de anticuerpos IgG contra el virus Chikungunya mediante ELISA de captura (Nova-Tec, inmunodiagnostica GmbH, CHIG0590, Alemania).
ResultadosDe 190 sueros analizados, el 5,2% (10/190) fueron positivos para Rickettsia sp. del grupo de la fiebre manchada, para Hantavirus 7 de 87 (8%) fueron positivos y no se encontraron positivos para Chikungunya. No se encontraron diferencias significativas (p≤0,05) entre los seropositivos de Hantavirus y Rickettsia sp. para las variables género, edad y ocupación.
ConclusionesLos hallazgos demuestran exposición previa a Rickettsia sp. y a Hantavirus en la población indígena de Tuchín. Los resultados pueden ser útiles para establecer una alerta sobre estas fiebres hemorrágicas. Aunque no se hallaron seropositivos para Chikungunya, este fue el primer trabajo de vigilancia epidemiológica realizado en Colombia sobre este virus.
Vector-borne disease surveillance is important for establishing control measures in public health. Indigenous populations of Cordoba live in climate conditions that favor the presence of vectors that might allow the spread and emergence of hantavirus cases, rickettsial and Chikungunya fever.
ObjectiveTo establish the prevalence of Hantavirus, Rickettsia sp. and Chikungunya in the indigenous population of Tuchín, Cordoba.
Materials and methodsA cross-sectional descriptive study on 190 individuals of the indigenous reservation of the municipality of Tuchín was carried out; the serum samples were collected between August and December of 2012. The following serology tests were performed: antibody IgG against Hantavirus IgGDxSelectTM (Focus Technologies, EL1600G, California, USA); indirect immunofluorescence technique for Rickettsia spotted fever group IgG and ELISA IgG antibodies against Chikungunya virus (Nova-Tec, diagnostic GmbH, CHIG0590, Germany).
ResultsOut of 190 analyzed sera, 5.2% (10/190) were positive for Rickettsia sp. spotted fever group, Hantavirus 7 of 87 (8.0%) and 0% for Chikungunya. Significant differences among those positive for Hantavirus and Rickettsia sp. for the variables gender, age and occupation were not found.
ConclusionsThe findings reveal the prevalence of Rickettsia sp. and Hantavirus in the indigenous population of Tuchín. These results are useful to establishing an alert regarding these hemorrhagic fevers. Although no positive result for Chikungunya virus was found, this is the first epidemiological surveillance study conducted in Colombia on this virus.
Las fiebres hemorrágicas se caracterizan por producir fiebre alta, manifestaciones hemorrágicas y neurológicas, con dificultad en su interpretación clínica debido a los múltiples diagnósticos diferenciales y a la aparición en zonas en zonas de alta vulnerabilidad social1–3. Los virus Chikungunya y Hanta, así como las bacterias del genero Rickettsia son agentes causales de fiebres hemorrágicas importantes en el mundo. Recientemente en Suramérica y Colombia se presentó de forma abrupta pero esperada, la entrada de Chikungunya4.
Colombia posee condiciones geoclimáticas que favorecen la presencia de diversos vectores, reservorios y animales susceptibles que podrían favorecer la diseminación de enfermedades infecciosas, emergentes y reemergentes como rabia, leptospirosis, rickettsiosis y fiebre amarilla3,5. Estas condiciones favorecerían la aparición de focos enzoóticos de Chikungunya, de Hantavirus y Rickettsia6–8. Además, la alerta mundial sobre la entrada de Chikungunya a las américas, justificaba en el momento de este estudio, una vigilancia de la actividad del virus.
Las poblaciones indígenas representan el 2,74% del total de los habitantes en Colombia; las comunidades indígenas de Tuchín forman parte del segundo resguardo indígena más importante del país y el principal resguardo en Córdoba, y poseen una población de 32.226 habitantes9. De esta población no se tenía información sobre la exposición previa a Hantavirus, Rikettsia y Chikungunya. En Córdoba para el 2013 se reportaron cifras alarmantes de los casos de dengue (n=1.621), dengue grave (n=43), malaria asociada (n=29), malaria complicada (n=15), malaria por Plasmodium falciparum (P. falciparum) (n=397), Plasmodium vivax (P. vivax) (n=2.815) y leptospirosis (n=9). En el municipio de Tuchín se reportaron cifras para dengue (n=20), malaria complicada (n=1), malaria por P. falciparum (n=1), P. vivax (n=36); esto revela un problema grave que requiere ser priorizado en salud pública10. El objetivo del presente estudio fue establecer la seroprevalencia de Hantavirus, Rickettsia sp. y Chikungunya en la población indígena de Tuchín, Córdoba.
Materiales y métodosTipo de estudio y población analizadaSe realizó un estudio descriptivo de corte transversal, con muestreo aleatorizado simple, el tamaño de la muestra fue determinado con base en la población total del municipio de Tuchín (32.226 habitantes), el cálculo se realizó estimando una probabilidad de 0,5 con un intervalo de confianza del 95% en un error máximo permisible de 0,07 para una muestra de 194,81. Un total de 190 muestras fueron recolectadas entre agosto y diciembre del 2012. Participaron en forma voluntaria personas sanas afiliadas a la entidad prestadora de salud indígena Manexka situada en el municipio de Tuchín que acudieron al laboratorio clínico para realización de exámenes de rutina no asociados a síndromes febriles. A los individuos se les extrajo una muestra de sangre periférica por venopunción con el sistema vacutainer® en tubo sin anticoagulante y se les pidió que rellenaran una encuesta epidemiológica que contenía: datos personales básicos y factores de riesgos asociados con la enfermedad. Las muestras obtenidas fueron transportadas en refrigeración al Instituto de Investigaciones Biológica del Trópico de la Universidad de Córdoba, donde fueron separadas y almacenadas a −90°C hasta su procesamiento.
Área de estudioEl departamento de Córdoba está situado en la zona noreste del Caribe colombiano. El municipio de Tuchín se encuentra ubicado al noroeste del departamento de Córdoba, con coordenadas 9° 08′ 57 «latitud norte» y 57° 30′ 44 «longitud oeste», con una extensión de 128km2 a 106 m.s.n.m y una temperatura promedio de 28°C9.
Determinación de anticuerpos IgG para HantavirusSe realizó la prueba IgG DxSelectTM (Focus Technologies, Cat: EL1600G, California, EE. UU.) utilizando como antígeno la proteína recombinante de la nucleocápside derivada de baculovirus de variantes de Hantaan Murino (VHT). El procedimiento fue realizado siguiendo las especificaciones del fabricante. Los resultados se reportaron como valores índice relativos al calibrador límite. Se consideraron positivas todas aquellas muestras cuyo valor índice relativo fue>1,10. Para esta prueba, se tomaron solo 87 sueros de las 190 personas ya que no se contaba con suficientes pruebas para el análisis de las muestras recolectadas; la elección de los sueros fue por conveniencia.
Determinación de anticuerpos de IgG para Rickettsia sp. del grupo de las fiebres manchadasEn 190 muestras de suero sanguíneo se realizó inmunofluorescencia indirecta descrita previamente por Pacheco et al.11 con algunas modificaciones; se utilizaron láminas de microscopia para fluorescencia con células Vero infectadas con la cepa Taiaçu de Rickettsia rickettsii de Brasil, donada por Marcelo Bahía Labruna (Universidad de São Paulo). Para los lavados se utilizó PBS 1X con tritón al 0,1% pH 7,2 durante 20min, en constante agitación; la dilución del conjugado se realizó a 1:1200 en PBS 1X anti-IgG humana marcada con isotiocianato de fluoresceína (Sigma–Aldrich, Cat 3512, Spruce Street, St Louis, EE. UU.). Se observó en un microscopio de fluorescencia con un aumento de 40X y 100X. Los sueros positivos se reconfirmaron 3 veces y fueron diluidos de 1:64 a 1:1024.
Determinación de anticuerpos IgG para virus ChikungunyaEn 190 muestras de suero sanguíneo se realizó la técnica de ELISA de captura Chikungunya virus IgG de Nova-Tec inmunodiagnostica GmbH (Cat: CHIG0590, Alemania). El procedimiento fue llevado a cabo siguiendo las especificaciones del fabricante; el valor del punto de corte (cut-off) que determinó la positividad de las muestras fue la media de las absorbancias de 0,44 DO con la cual se estableció el punto de corte.
Aspectos éticosEl presente estudio fue aprobado por el comité de ética del Instituto de Investigaciones Biológicas del Trópico, y se tuvieron en cuenta las normas técnicas, científicas y administrativas para la investigación en salud estipuladas por el ministerio de salud de Colombia según la resolución n.o 008430 de 199312; a los individuos que en forma voluntaria participaron se les explicó el propósito del estudio y firmaron un consentimiento informado. Todos los individuos estaban asociados a la IPS Manexka, encargada de la atención primaria del resguardo.
Análisis estadísticoLos datos fueron analizados utilizando Microsoft Excel®. Se aplicó la prueba de Chi-cuadrado, el nivel de significación fue del 5% (p=0,05) mediante el programa R-project 2.15.2.
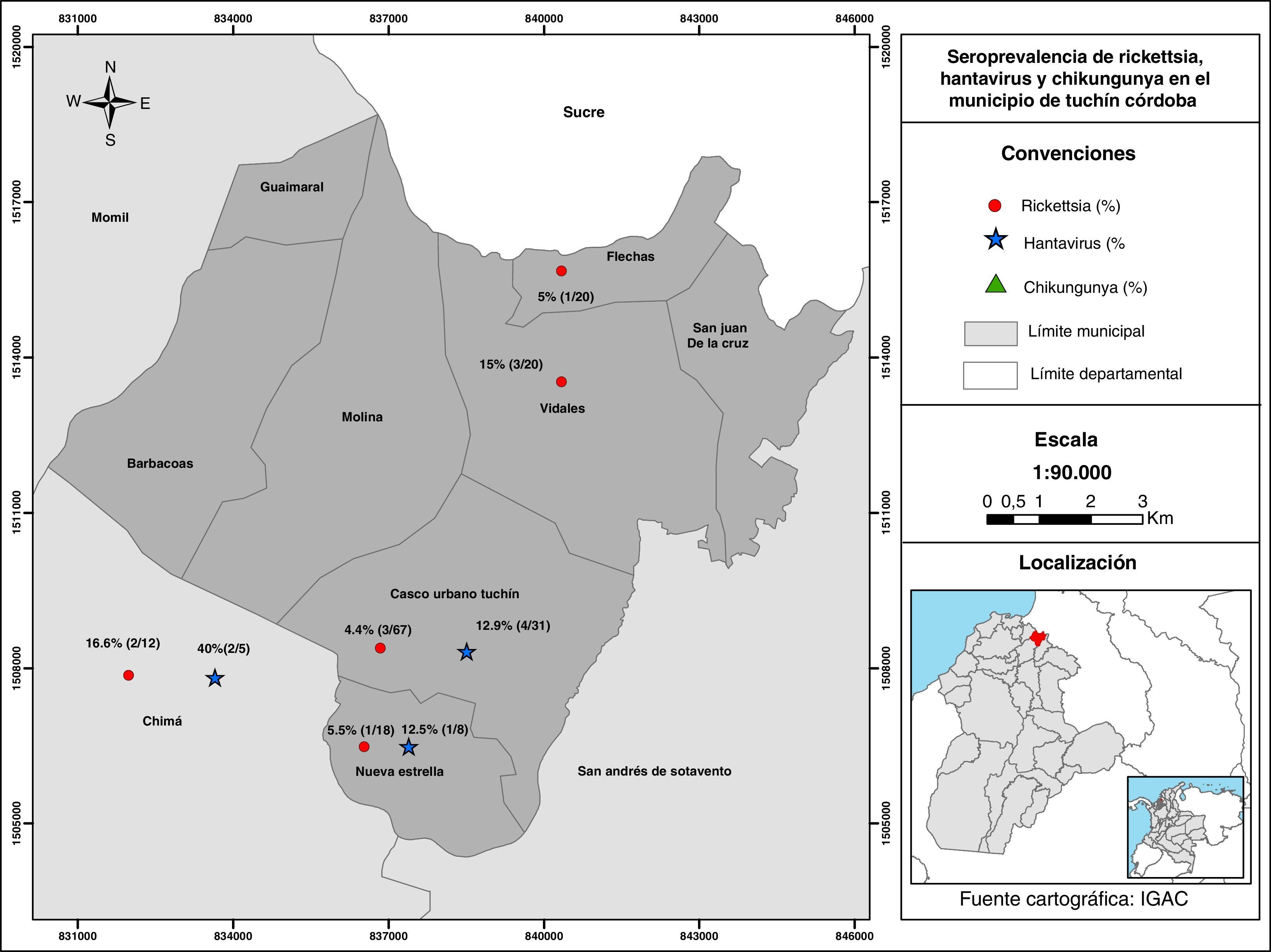
ResultadosDatos epidemiológicos de la población estudiadaDe las 190 personas incluidas en el estudio, 141 eran mujeres y 49 hombres, estratificados en 4 grupos etarios de la siguiente manera: 0 a 14 años (n=29), 15 a 30 años (n=87), 31 a 50 años (n=34) y mayores de 50 años (n=40) y con una mediana para edad de 25,5. Los sujetos pertenecían a 9 corregimientos del municipio de Tuchín distribuidos así: área urbana (n=67), Flechas (n=20), Vidales (n=20), Nueva Estrella (n=18), Molina (n=16), San Juan de la Cruz (n=12), Barbacoa (n=4) y Guaimaral (n=2); y a otros municipios aledaños como Mómil (n=9) Chimá (n=12) y San Andrés de Sotavento (n=10). Las principales ocupaciones de la población estudiada fueron: ama de casa (n=68), artesanos (n=48), estudiantes (n=28), sin ocupación (n=18) campesinos (n=14) y oficios varios (n=14). En el presente estudio se estableció una seroprevalencia para Hantavirus del 8% (7/87), para Rickettsia sp. del grupo de las fiebres manchadas (Rickettsia GFM) del 5,2% (10/190); para el virus Chikungunya no se encontró presencia de anticuerpos en la población.
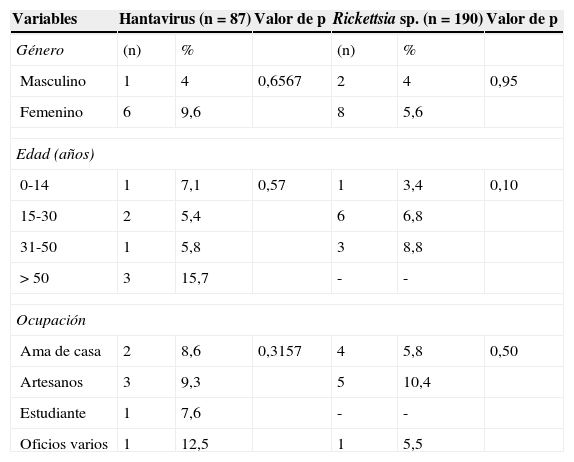
Seroprevalencia de Hantavirus y Rickettsia sp. del grupo de las fiebres manchadasEl 85% de los individuos seropositivos a estos agentes pertenecían al sexo femenino y la principal actividad laboral descrita fue la elaboración de artesanías. Los principales grupos de edad de los individuos seropositivos fueron los mayores de 50 años para Hantavirus y de 15 a 30 años para Rickettsia sp. Además no se encontraron diferencias estadísticamente significativas entre los individuos seropositivos de Hantavirus y Rickettsia sp. para las variables género, edad y ocupación (tabla 1).
Distribución de individuos seropositivos para Hantavirus y Rickettsia sp
| Variables | Hantavirus (n=87) | Valor de p | Rickettsia sp. (n=190) | Valor de p | ||
|---|---|---|---|---|---|---|
| Género | (n) | % | (n) | % | ||
| Masculino | 1 | 4 | 0,6567 | 2 | 4 | 0,95 |
| Femenino | 6 | 9,6 | 8 | 5,6 | ||
| Edad (años) | ||||||
| 0-14 | 1 | 7,1 | 0,57 | 1 | 3,4 | 0,10 |
| 15-30 | 2 | 5,4 | 6 | 6,8 | ||
| 31-50 | 1 | 5,8 | 3 | 8,8 | ||
| >50 | 3 | 15,7 | - | - | ||
| Ocupación | ||||||
| Ama de casa | 2 | 8,6 | 0,3157 | 4 | 5,8 | 0,50 |
| Artesanos | 3 | 9,3 | 5 | 10,4 | ||
| Estudiante | 1 | 7,6 | - | - | ||
| Oficios varios | 1 | 12,5 | 1 | 5,5 | ||
(-): valor=0.
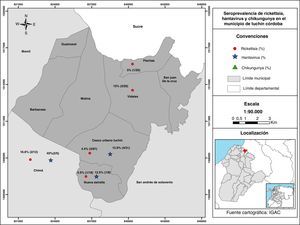
La distribución de los individuos seropositivos a Hantavirus se presentó de la siguiente manera: área urbana el 12,9% (4/31), Nueva Estrella el 12,5% (1/8) y Chima el 40% (2/5). En cuanto a los seropositivos a Rickettsia GFM se ubicaron en Vidales el 15% (3/20), Nueva estrella el 5,5% (1/18) y Chima el 16,6% (2/12) (fig. 1). Es importante señalar que las zonas urbanas y rurales en este resguardo son cercanas entre sí, con distancias entre la cabecera del municipio y el área rural de apenas unos 3km.
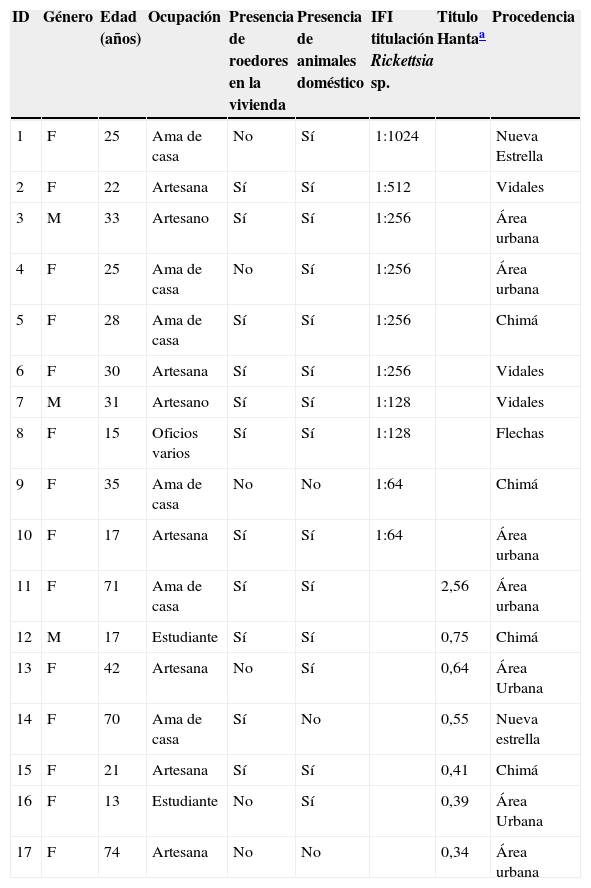
Datos epidemiológicos y titulación en individuos seropositivos a Rickettsia sp. del grupo de las fiebres manchadas y HantavirusLos individuos seropositivos a Rickettssia sp. fueron 10 y para hantavirus fueron 7, el rango de edad estuvo entre 13 y 74 años, y las principales actividades desarrolladas por los individuos fueron: ama de casa, artesanos y estudiantes. En la tabla 2 se relacionan los 17 individuos con resultados positivos a las pruebas de ELISA e inmunofluorescencia indirecta, los principales datos epidemiológicos y títulos máximos de anticuerpos de Rickettsia sp. GFM (1:1024 y 1:512) y por ELISA indirecta para Hantavirus; los individuos considerados positivos tuvieron un valor de densidad óptica>0,34.
Datos epidemiológicos de los individuos seropositivos para Hantavirus y Rickettsia sp. del grupo de las fiebres manchadas en Tuchín, Córdoba
| ID | Género | Edad (años) | Ocupación | Presencia de roedores en la vivienda | Presencia de animales doméstico | IFI titulación Rickettsia sp. | Titulo Hantaa | Procedencia |
|---|---|---|---|---|---|---|---|---|
| 1 | F | 25 | Ama de casa | No | Sí | 1:1024 | Nueva Estrella | |
| 2 | F | 22 | Artesana | Sí | Sí | 1:512 | Vidales | |
| 3 | M | 33 | Artesano | Sí | Sí | 1:256 | Área urbana | |
| 4 | F | 25 | Ama de casa | No | Sí | 1:256 | Área urbana | |
| 5 | F | 28 | Ama de casa | Sí | Sí | 1:256 | Chimá | |
| 6 | F | 30 | Artesana | Sí | Sí | 1:256 | Vidales | |
| 7 | M | 31 | Artesano | Sí | Sí | 1:128 | Vidales | |
| 8 | F | 15 | Oficios varios | Sí | Sí | 1:128 | Flechas | |
| 9 | F | 35 | Ama de casa | No | No | 1:64 | Chimá | |
| 10 | F | 17 | Artesana | Sí | Sí | 1:64 | Área urbana | |
| 11 | F | 71 | Ama de casa | Sí | Sí | 2,56 | Área urbana | |
| 12 | M | 17 | Estudiante | Sí | Sí | 0,75 | Chimá | |
| 13 | F | 42 | Artesana | No | Sí | 0,64 | Área Urbana | |
| 14 | F | 70 | Ama de casa | Sí | No | 0,55 | Nueva estrella | |
| 15 | F | 21 | Artesana | Sí | Sí | 0,41 | Chimá | |
| 16 | F | 13 | Estudiante | No | Sí | 0,39 | Área Urbana | |
| 17 | F | 74 | Artesana | No | No | 0,34 | Área urbana |
F: femenino; IFI: inmunofluorescencia indirecta; M: masculino.
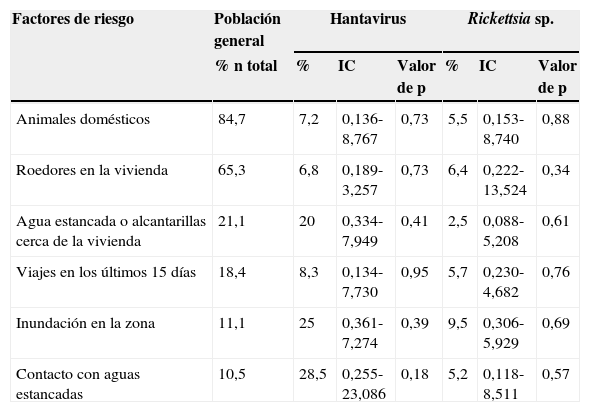
La evaluación general de los factores de riesgo en la población estudiada presentó la siguiente distribución: un 84,7% contacto con animales domésticos (perros, gatos, bovinos, asnos y equinos), un 65,3% presencia de roedores en la vivienda, un 21,1% presencia de agua estancada o alcantarillas cerca de la vivienda, un 18,4% viajes fuera del municipio en los últimos 15 días, un 11,1% inundación en la zona en los últimos 30 días y un 10,5% contacto con aguas estancadas; sin embargo, no se obtuvieron diferencias significativas entre los factores y las enfermedades estudiadas (tabla 3).
Factores de riesgo asociados a la seroprevalencia de Hantavirus y Rickettsia sp. del grupo de las fiebres manchadas
| Factores de riesgo | Población general | Hantavirus | Rickettsia sp. | ||||
|---|---|---|---|---|---|---|---|
| % n total | % | IC | Valor de p | % | IC | Valor de p | |
| Animales domésticos | 84,7 | 7,2 | 0,136-8,767 | 0,73 | 5,5 | 0,153-8,740 | 0,88 |
| Roedores en la vivienda | 65,3 | 6,8 | 0,189-3,257 | 0,73 | 6,4 | 0,222-13,524 | 0,34 |
| Agua estancada o alcantarillas cerca de la vivienda | 21,1 | 20 | 0,334-7,949 | 0,41 | 2,5 | 0,088-5,208 | 0,61 |
| Viajes en los últimos 15 días | 18,4 | 8,3 | 0,134-7,730 | 0,95 | 5,7 | 0,230-4,682 | 0,76 |
| Inundación en la zona | 11,1 | 25 | 0,361-7,274 | 0,39 | 9,5 | 0,306-5,929 | 0,69 |
| Contacto con aguas estancadas | 10,5 | 28,5 | 0,255-23,086 | 0,18 | 5,2 | 0,118-8,511 | 0,57 |
IC: intervalo de confianza.
Las fiebres hemorrágicas en el Caribe colombiano son una consulta frecuente en los hospitales regionales, sin embargo, en algunas áreas rurales de atención primaria, con excepción del dengue, poco se conoce sobre la presencia de otros agentes, como Rickettsia, Leptospira, Hantavirus y los virus mayaro, oropuche y arena. Debido a que la rickettsiosis y hantavirosis no son de reporte obligatorio en Colombia (sin embargo, actualmente la fiebre de Chikungunya es de reporte obligatorio en el país), es muy probable que se encuentren subdiagnosticadas, además de por el poco conocimiento epidemiológico y clínico que se tiene de ellas.
En Suramérica la prevalencia en humanos a Hantavirus oscila entre el 0,2% y el 14,3%13–15. En la prueba para detección de IgG contra Hantavirus el presente estudio utilizó como antígeno la proteína recombinante de la nucleocápside derivada de baculovirus de variantes de Hantaan Murino (VHT), el cual presenta reacción cruzada con las variantes patogénicas de Hantavirus de mayor relevancia clínica, p. ej., Seoul (SEO), Hantaan murino (HTN), Puumala (PUU), Dobrava (DOB), y Sin Nombre (SNV); se estableció una seroprevalencia del 8% para Hantavirus, resultado similar a los encontrados por Mattar y Parra del 13,5% en Córdoba16 y de Guzmán et al.17 quienes usaron 2 antígenos de Hantavirus y obtuvieron una seroprevalencia con el virus Maciel del 3,5% y con el antígeno Araracuara del 7,3% en trabajadores agrícolas de Córdoba16,17. En un estudio en Córdoba realizado por Alemán et al. en 20063 se reportó la presencia de especies de roedores de género Sigmodon, Zygodontomys, Oryzomys, Oligoryzomys, Heteromys y Proechimys, reservorios de Hantavirus y reportaron en roedores una prevalencia del 2,1%. Blanco et al.6 reportaron anticuerpos contra Hantavirus del 8,3% en las especies Zygodontomys brevicauda y Neacomys spinosus en el municipio de San Marcos en Sucre. En Necoclí (Antioquia) se reportó una estrecha relación entre una cepa de Hantavirus encontrada en roedores y el virus Calabazo de Panamá lo que podría indicar que los reportes en Córdoba, Sucre y Antioquia en humanos y roedores están relacionados con esta variante del virus Calabazo18,19. Recientemente, se diagnosticó el primer caso de Hantavirus en humanos en Colombia y fue precisamente en Montería20; el caso correspondió a una persona que realizaba actividades rurales, tenía exposición a roedores y tuvo un egreso del hospital sin complicaciones aparentes.
En Argentina y Brasil18,19 se han estudiado los factores de riesgo asociados a la enfermedad por Hantavirus y se identificó que las viviendas cerca de las zonas boscosas y exposición a excreciones de ratón son factores de riesgo importantes; con relación al presente estudio no se determinaron asociaciones entre los factores de riesgo evaluados y la seroprevalencia.
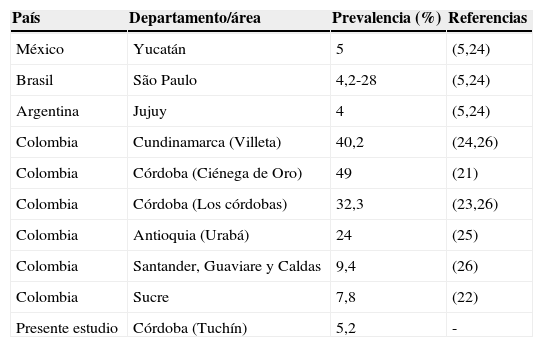
Respecto a Rickettsia sp., la seroprevalencia del 5,2% del presente estudio es baja comparada con otros estudios realizados en zonas cercanas en el departamento de Córdoba; Miranda et al.21 en 2001 reportaron en el municipio de Ciénega de Oro en una población rural una seroprevalencia del 49%. En otras regiones del país se han realizado estudios de seroprevalencia que oscilan entre el 7,8% y el 40,2% lo que demuestra la importancia de la vigilancia epidemiológica en población susceptible y vectores (tabla 4)21–26. Además en países de América Latina como Argentina, México y Brasil las cifras de seroprevalencia alcanzan el 28% en zonas endémicas (tabla 4)5,24.
Seroprevalencia para Rickettsia sp. del grupo de las fiebres manchadas
| País | Departamento/área | Prevalencia (%) | Referencias |
|---|---|---|---|
| México | Yucatán | 5 | (5,24) |
| Brasil | São Paulo | 4,2-28 | (5,24) |
| Argentina | Jujuy | 4 | (5,24) |
| Colombia | Cundinamarca (Villeta) | 40,2 | (24,26) |
| Colombia | Córdoba (Ciénega de Oro) | 49 | (21) |
| Colombia | Córdoba (Los córdobas) | 32,3 | (23,26) |
| Colombia | Antioquia (Urabá) | 24 | (25) |
| Colombia | Santander, Guaviare y Caldas | 9,4 | (26) |
| Colombia | Sucre | 7,8 | (22) |
| Presente estudio | Córdoba (Tuchín) | 5,2 | - |
En el presente estudio los individuos con anticuerpos a Rickettsia sp. GFM fueron mujeres que realizaban labores en la casa, mantenían contactos con animales domésticos y reportaron la presencia de roedores en la vivienda; en 2 personas sanas sin condición clínica de importancia se cuantificaron títulos de 1:1024 y 1:512. En algunos estudios se ha establecido que el contacto con roedores silvestres o sinantrópicos que son huéspedes frecuentes de artrópodos transmisores de rickettsias los convierte en potenciales reservorios que facilitan la transmisión25. Las mujeres seropositivas a rickettsias en el presente estudio reportaron tener un contacto estrecho con mascotas con las que conviven y que a su vez estas podrían ser portadoras de los vectores de esta enfermedad. Se ha documentado que los mamíferos son susceptibles tanto a la infección por rickettsias como a la picadura de la garrapata, cumpliendo con las condiciones mínimas para ser una fuente de infección y ayudar así a la diseminación del microorganismo en zonas endémico/enzoóticas25. La identificación de anticuerpos contra Rickettsia sp. en la población indígena del municipio de Tuchín y el antecedente del brote de rickettsiosis en el año 2007 en una zona rural del municipio de Los Córdoba23, con una mortalidad del 54%, condujo a que la zona se catalogara como endémica, la cual está ubicada a 184km del área estudiada en el presente trabajo, lo que demuestra la exposición al patógeno en varias zonas del departamento y la importancia de una vigilancia en poblaciones rurales, vectores y reservorios.
La fiebre Chikungunya se ha detectado en casi 40 países de Asia, África, Europa y las américas. La enfermedad se da en África, Asia y el subcontinente indio. En los últimos decenios los vectores de la enfermedad se han propagado a Europa y las américas4. En 2007 se notificó por vez primera la transmisión de la enfermedad en Europa, en un brote localizado en el nordeste de Italia. La OPS/OMS recibió, el 6 de diciembre de 2013, la confirmación de los primeros casos de transmisión autóctona del virus de Chikungunya en las américas27.
En Colombia el Instituto Nacional de Salud en el informe hasta la segunda semana del 2015 notifican al sistema de vigilancia 129.345 casos que fueron clasificados como: confirmados por clínica (n=126.761), confirmados por laboratorio (n=583) y casos sospechosos (n=2001). Se ha confirmado el virus Chikungunya en 26 municipios de 15 departamentos/distritos del país28.
La región del Caribe colombiano ha presentado la mayor cantidad de casos confirmados en el país, siendo reportados en Atlántico, Barranquilla, Bolívar, Cartagena, La Guajira, San Andrés y Providencia, Santa Marta y Sucre; asimismo se han notificado casos sospechosos en Cesar, Córdoba y Magdalena28.
En el presente estudio la ausencia de anticuerpos séricos para el virus Chikungunya no niega el riesgo de introducción ya que la zona de estudio es considerada como endémica para Aedes aegypti (A. aegypti) y Aedes albopictus (A. albopictus) los principales vectores del virus dengue en el país y vector potencial de este alfvirus29. Sin embargo, el presente estudio fue realizado previo a la introducción del virus en Suramérica y el país, lo que confirma que el virus estaba ausente hasta su introducción en el país en julio del 2014. Actualmente ya existen casos autóctonos de Chikungunya en el Caribe colombiano. Ante la progresión de la transmisión autóctona del Chikungunya en las américas y teniendo en cuenta que en el país existe una alta infestación de los 2 vectores transmisores de la enfermedad, se presentan condiciones de vulnerabilidad y receptividad para la introducción del virus en el país. Sumado al inminente problema de Chikungunya, existen otros 2 agentes protagonistas de fiebres tropicales, el virus de Oropuche de la familia Buyanviridae y el virus Mayaro un alfavirus. Ambos con una presentación clínica muy similar a la del dengue y Chikungunya30. La presencia de estos virus no se conoce en Colombia, sin embargo, debido a la existencia de los vectores Culicoides paraensis vector para Oropuche y para Mayaro, Haemagogus, A. aegypti y A. albopictus abundantes en las costas y bosques húmedos colombianos, hay un riesgo de introducción en esta zona.
En conclusión, este es el primer estudio de vigilancia epidemiológica sobre Hantavirus, Rickettsia sp. y Chikungunya, que se lleva a cabo en el resguardo indígena de Tuchín, y los resultados permiten mostrar la importancia de promover la salud ocupacional y la educación de las comunidades expuestas, especialmente con rickettsias y Hantavirus. Existe un posible riesgo para la salud pública de los habitantes por Rickettsia sp. y Hantavirus para las personas que habitan las zonas rurales, urbanas y peridomésticas en estrecho contacto con los posibles focos enzoóticos de los microorganismos estudiados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste proyecto fue financiado en su totalidad por el Instituto de Investigaciones Biológicas del Trópico de la Universidad de Córdoba.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a Marcelo Bahía Labruna Ph.D., Universidad de São Paulo Brazil, quien donó la cepa de Rickettsia rickettsii. A los funcionarios Katherine Bertel, del laboratorio clínico IPS Maneska, y Saul Lucas de la Secretaria de Salud del municipio de Tuchín quienes facilitaron el acercamiento a la comunidad indígena.