La coinfección entre Mycobacterium tuberculosis y Nocardia es poco frecuente, con una prevalencia entre el 1 y el 6%; es más frecuente en los pacientes infectados por el virus de la inmunodeficiencia humana. Las manifestaciones clínicas y radiológicas de la nocardiosis y la tuberculosis pulmonar suelen ser muy similares, lo cual dificulta el diagnóstico y puede retrasar el tratamiento específico. Existen pocos casos reportados en la literatura. Se reportan 3 casos de pacientes que presentaron datos compatibles con tuberculosis pulmonar, por lo que se realizó tinción de Ziehl-Neelsen en esputo, y se reportan bacilos ácido-alcohol resistentes compatibles con Mycobacterium tuberculosis y Nocardia, iniciándose tratamiento específico, con el cual presentaron mejoría clínica.
Coinfection with Mycobacterium tuberculosis and Nocardia is rare, with a prevalence between 1-6%, and is more frequent in patients infected with HIV. Clinical and radiological manifestations of nocardiosis and pulmonary tuberculosis are very similar, making difficult the diagnosis and delaying the specific treatment. There are few cases reported in the literature. We report 3 cases of patients who presented with pulmonary tuberculosis-compatible data, whose sputum Ziehl-Neelsen staining test revealed acid-fast bacilli compatible with Mycobacterium tuberculosis and Nocardia. Specific treatment resulted in clinical improvement.
Nocardia spp. es un actinomiceto grampositivo aerobio ramificado, parcialmente ácido-alcohol resistente, produce infecciones localizadas o diseminadas y compromete el pulmón en el 75% de los casos. Afecta principalmente a pacientes con compromiso de la inmunidad celular o con enfermedad pulmonar crónica como tuberculosis o EPOC, sin embargo, aunque menos frecuente, también puede presentarse en pacientes inmunocompetentes1,2.
El diagnóstico de la nocardiosis pulmonar consiste en el aislamiento de Nocardia sp. en el esputo, y el tratamiento consiste en la administración de trimetoprima (TMP) sulfametoxazol (SMX) durante 6 meses, existiendo cierto grado de resistencia2.
La tuberculosis pulmonar es producida por Mycobacterium tuberculosis (M. tuberculosis), caracterizada por síntomas insidiosos e inespecíficos que pueden confundirse con otras entidades patológicas, provocando retraso en el diagnóstico y en el tratamiento3.
El tratamiento de la tuberculosis pulmonar y la nocardiosis pulmonar son diferentes, por lo que es esencial la correcta identificación del agente para evitar una terapia ineficaz4.
La coexistencia entre la nocardiosis y la tuberculosis pulmonar oscila entre el 1 y el 6%. Pocos informes de casos de infección concomitante han sido publicados.
Se exponen 3 casos de pacientes que presentaron nocardiosis pulmonar coexistente con tuberculosis pulmonar.
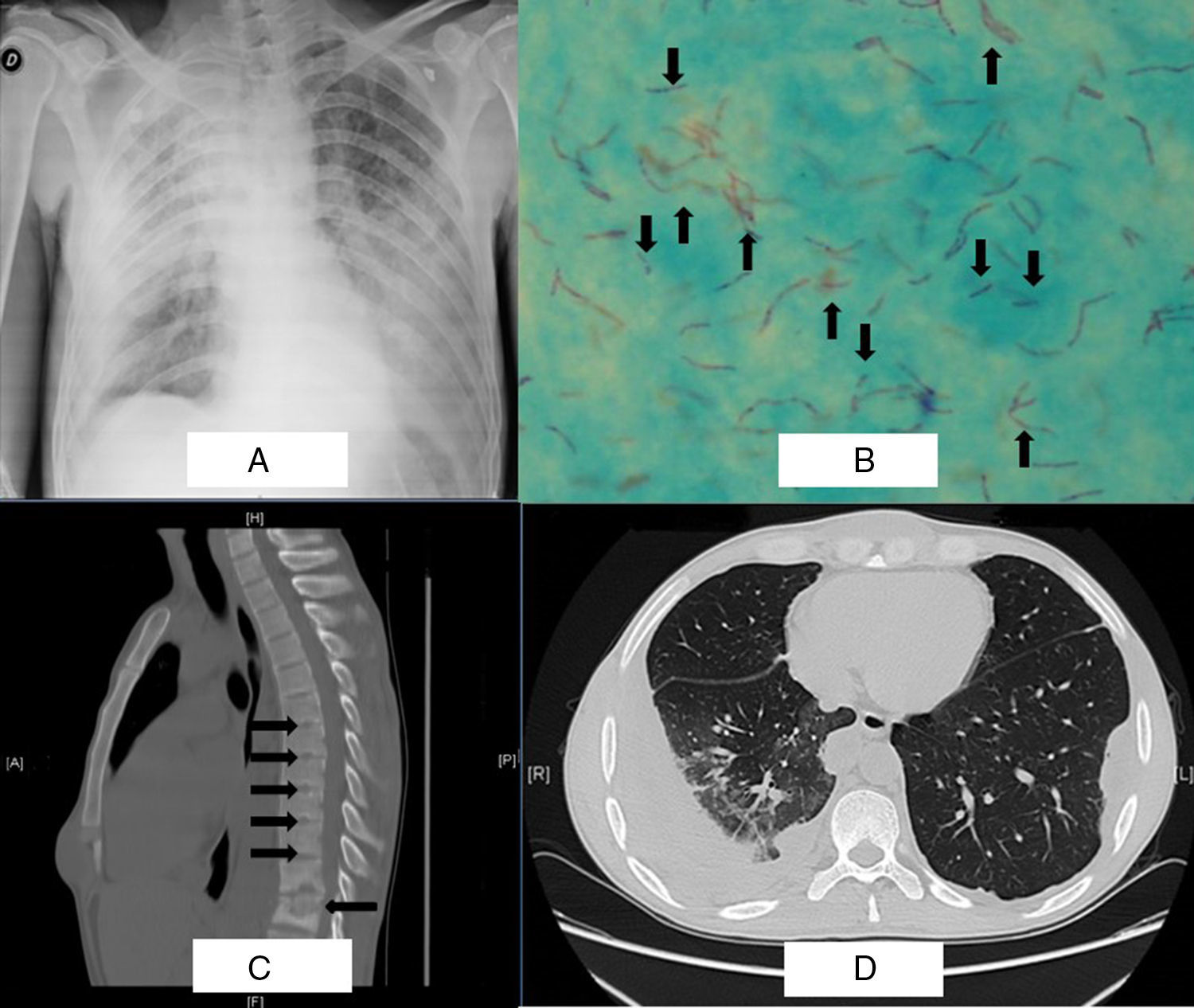
Caso 1Hombre de 33 años de edad, exrecluso, inició su padecimiento 2 meses previos a su ingreso al presentar fiebre de 38°C, tos productiva con esputo amarillento, dolor torácico, pérdida ponderal, diaforesis nocturna y malestar general. A la exploración física se encontró campos pulmonares con disminución de los ruidos respiratorios y las vibraciones vocales en hemitórax derecho, pectoriloquia áfona, matidez a la percusión; estaba taquicárdico y polipneico. Paraclínicos: Hb 9,6g/dL; linfopenia 0,7×103/μL; trombocitopenia 121×103/μL; ELISA para VIH negativo. En la radiografía de tórax anteroposterior se observa imagen radiopaca heterogénea en lóbulo superior derecho e inferior izquierdo, patrón nodular, aumento de los espacios intercostales, vidrio deslustrado (fig. 1A). Se sospechó neumonía adquirida en la comunidad y se inició tratamiento con ceftriaxona un gramo iv cada 12h. Se solicitó detección de bacilos ácido-alcohol resistentes (BAAR) en esputo: se reportaron abundantes estructuras filamentosas y ramificadas compatibles con Nocardia (fig. 1B flechas arriba) y bacilos compatibles con M. tuberculosis (fig. 1B flechas abajo), los cuales se corroboraron mediante cultivos positivos para M. tuberculosis (Löwenstein-Jensen) y Nocardia (agar chocolate). Se administró tratamiento con TMP SMX y DOTBAL (rifampizina, pirazinamida, etambutol, isoniazida). Persistió con fiebre y expresó paraparesia, por lo que se solicitó tomografía simple y contrastada de tórax en la cual se observó absceso paraespinal a nivel de las vértebras T11-T12, presencia de nódulos de Schmorl a nivel de las vértebras T6-T10 (fig. 1C flechas derecha), aplastamiento de T12 (fig. 1C flecha izquierda), derrame pleural derecho, imagen en árbol de gemación y vidrio deslustrado (fig. 1D). Se realizó el diagnóstico de enfermedad de Pott y se inició prednisona 1mg/kg, con dosis de reducción semanal. Después de 2 semanas de tratamiento presentó mejoría clínica, con recuperación de la fuerza de las extremidades inferiores; se egresó y se realizó seguimiento en consulta externa. Cumplió con 6 meses de tratamiento a base de TMP SMX y DOTBAL, con resultados de BAAR en esputo negativos.
A) Radiografía de tórax anteroposterior con patrón nodular, e imágenes radiopacas en lóbulo superior derecho e inferior izquierdo. B) Tinción de de Ziehl-Neelsen donde se observan estructuras filamentosas y ramificadas compatibles con Nocardia (flechas arriba) y bacilos compatibles con M. tuberculosis (flechas abajo). C) Tomografía de tórax: corte axial en ventana para mediastino reporta nódulos de Schmorl a nivel de T6-T10 (flechas derecha), aplastamiento de T12 (flecha izquierda) derrame pleural derecho. D) Imagen en árbol de gemación y vidrio deslustrado.
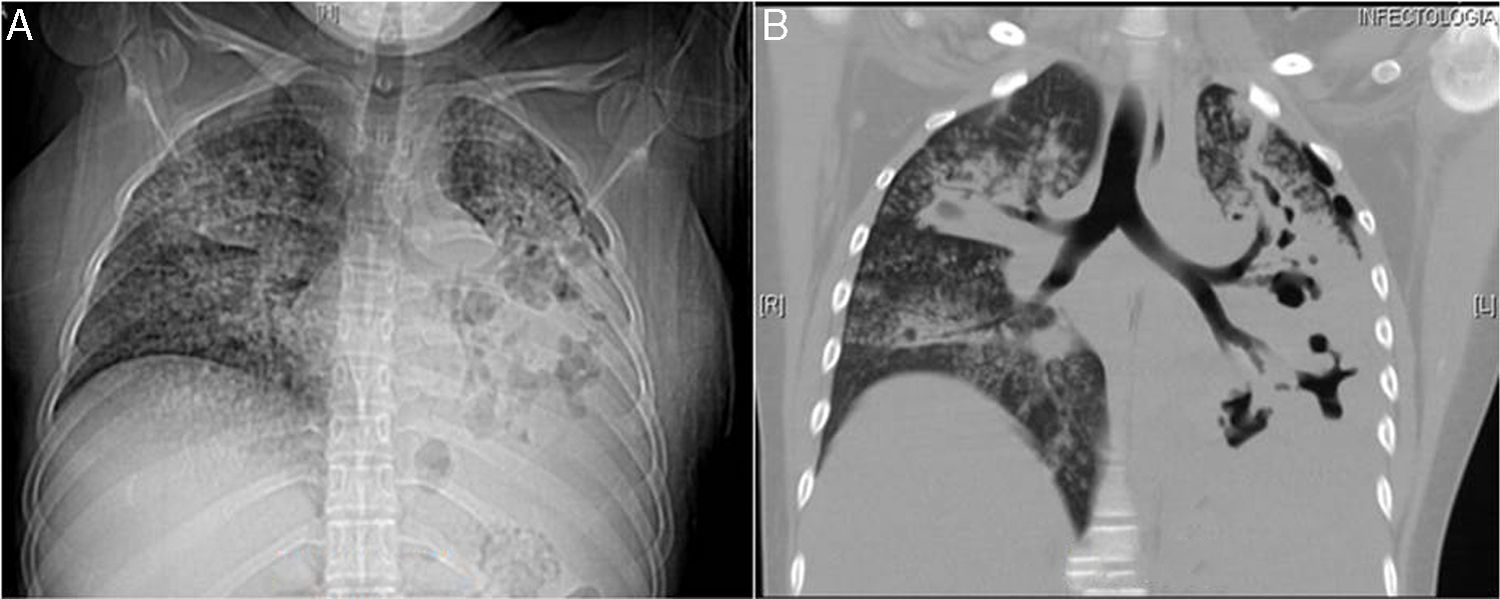
Paciente femenina de 23 años de edad, COMBE positivo (hermano). Inició su padecimiento una semana previa a su ingreso con tos con esputo amarillento, acompañada de disnea progresiva hasta pequeños esfuerzos, incremento de tos, acompañada con expectoración hemoptoica, diaforesis nocturna, pérdida de peso, sin fiebre, por lo que se hospitalizó. A la exploración física presentaba mal estado general, taquicardia, estaba polipneica, con maniobras de amplexión y amplexación disminuidas, disminución de los ruidos respiratorios subescapulares bilaterales, crépitos bilaterales, pectoriloquia áfona. Paraclínicos a su ingreso: leucocitos 33,2×103/μL; neutrófilos 29,8×103/μL; linfocitos 2,4×103/μL; Hb 10,4g/dL; plaquetas 767×103/μL; PCR 15,2mg/dl; ELISA para VIH negativo. En la radiografía de tórax se observó múltiples zonas cavitarias, zona de condensación basal izquierda, presencia de patrón reticulonodular (fig. 2A). Se inició cefalosporina de tercera generación. Se realizó tomografía axial computarizada de tórax en ventana para mediastino en la que se observó afectación del espacio intersticial de tipo reticulonodular con predominio izquierdo, cavernas en pulmón izquierdo de localización principalmente apical con probable fístula al espacio pleural y zona de condensación bilateral (fig. 2B). Se solicitó BAAR en esputo donde se observaron bacilos alcohol resistentes compatibles con M. tuberculosis, y estructuras filamentosas y ramificadas compatibles con Nocardia. Se realizó cultivo de esputo Löwenstein-Jensen para M. tuberculosis y agar chocolate para Nocardia en los que se confirmó la presencia de estos agentes. Se inicia DOTBAL y TMP SMX por 6 meses. Presentó adecuada evolución; se egresó con seguimiento en la consulta externa.
A) Radiografía de tórax: se observa múltiples zonas cavitarias, zona de condensación basal izquierda, patrón reticulonodular. B) Reconstrucción coronal de tomografía de tórax en ventana para mediastino con afectación del espacio intersticial de tipo reticulonodular con predominio derecho, cavernas en pulmón izquierdo.
Paciente masculino de 41 años de edad, con el antecedente de diabetes mellitus diagnosticada a los 30 años, en tratamiento con insulina de acción intermedia con mal apego al manejo. Inició su padecimiento 6 meses previos a su ingreso al presentar tos inicialmente seca, posteriormente productiva, con esputo amarillento; 4 meses previos a su ingreso presentó fiebre de 39°C, sin predominio de horario, 3 veces por semana. Una semana previa a su ingreso presentó disnea progresiva de medianos a pequeños esfuerzos, con pérdida de peso aproximadamente de 10 kg en el último mes, por lo que acudió a hospitalización. A la exploración física se observa presencia de crépitos bilaterales, frémito vocal aumentado en hemitórax izquierdo. Paraclínicos: leucocitos 16,2×103/μL; neutrófilos 13,4×103/μL; linfocitos 2,5×103/μL; Hb 8,8g/dL; plaquetas 642×103/μL; glucosa 223mg/dL; ELISA para VIH negativo. Radiografía de tórax con presencia de patrón reticulonodular bilateral, BAAR en esputo que reportó bacilos ácido-alcohol resistentes compatibles con M. tuberculosis, y estructuras filamentosas y ramificadas compatibles con Nocardia; se realizó cultivo de esputo con lo que se confirmó el diagnóstico (Löwenstein-Jensen para M. tuberculosis y agar chocolate para Nocardia). Se inició DOTBAL y TMP SMX por 6 meses: presentó mejoría clínica con disminución de la disnea, egresándose con seguimiento en la consulta externa. BAAR de control negativos.
DiscusiónLa coexistencia de tuberculosis y nocardiosis pulmonar es poco frecuente, suele presentarse con mayor frecuencia en pacientes afectados por el virus de la inmunodeficiencia humana (VIH), especialmente en países con una alta incidencia de tuberculosis pulmonar, como es el caso de México, que ocupa el tercer lugar en América Latina en incidencia de tuberculosis pulmonar5.
La nocardiosis pulmonar es una entidad difícil de diagnosticar debido a las características clínicas y radiológicas inespecíficas, por lo que en ocasiones su hallazgo es fortuito tras el examen al microscopio rutinario de las muestras o el procesamiento de esputos para micobacterias, hongos o legionella6. El diagnóstico de nocardiosis pulmonar depende del aislamiento del organismo en las secreciones respiratorias mediante BAAR o cultivo. Por su parte, M. tuberculosis es un organismo de crecimiento lento que requiere la incubación prolongada durante al menos 4-6 semanas5,6. En nuestros pacientes ambos agentes se confirmaron mediante cultivo, previa detección en las baciloscopias.
La Nocardia se relaciona estructural y taxonómicamente con las micobacterias. Habita en el suelo y es una posible causa de infección pulmonar y sistémica en pacientes inmunocomprometidos7.
La mayoría de los casos de infección por Nocardia son de tipo pulmonar, N. asteroides es el principal patógeno. La nocardiosis pulmonar es difícil de diferenciar de la tuberculosis y las 2 infecciones pueden coexistir6.
La norcadiosis suele afectar principalmente a pacientes con alteraciones de la inmunidad celular, como es el caso de pacientes con VIH, trasplantados, con neoplasias o que están empleando glucocorticoides. Uno de nuestros pacientes era portador de diabetes mellitus, lo que le condicionaba un factor de riesgo para inmunosupresión. En un 20% de los casos los pacientes no presentan compromiso inmunológico, sin embargo, sí tienen factores de riesgo que predisponen a la infección por Nocardia como es el caso de tuberculosis pulmonar, bronquiectasias o EPOC. La tuberculosis pulmonar es la principal causa de la interrupción del parénquima pulmonar, pudiendo ocasionar bronquiectasias, en especial en las zonas endémicas8. Nuestros pacientes contaban con pruebas para VIH negativas, sin embargo, tenían factores de riesgo para el desarrollo de Nocardia como la presencia de bronquiectasias y, clínicamente, presentaban formas avanzadas de tuberculosis pulmonar con interrupción del parénquima. De igual manera, se confirmó la tuberculosis pulmonar mediante cultivo positivo.
Uno de nuestros pacientes presentó enfermedad de Pott, por lo cual se inició manejo con glucocorticoide para mejorar la respuesta al tratamiento y disminuir el daño a órganos adyacentes.
Existen pacientes con el diagnóstico de tuberculosis pulmonar que no responden adecuadamente al tratamiento antifímico, sin presentar mejoría radiológica, clínica ni en las baciloscopias. En ellos debería descartarse la coexistencia de Nocardia. De igual manera, la infección por Nocardia es una enfermedad poco frecuente difícil de encontrar en pacientes con ELISA para VIH negativo, pero que puede sospecharse cuando existe una enfermedad pulmonar previa, como en el caso de nuestros pacientes. Con un adecuado diagnóstico se reduce la estancia intrahospitalaria y la morbimortalidad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaramos que no existen conflictos de intereses en la publicación de este trabajo y hemos seguido los protocolos establecidos en nuestra institución para la publicación de este material.