El diagnóstico certero de la patología mamaria adquiere particular relevancia a causa del aumento en la frecuencia universal de casos de cáncer mamario, y de la importancia de su descubrimiento en etapas tempranas de la enfermedad. Esto ha sido demostrado en las campañas de tamizaje con mastografías, pues en los países que se llevan a cabo se ha logrado disminuir la mortalidad por cáncer mamario y otorgar una mejor calidad de vida a las mujeres supervivientes a esa enfermedad.
En la actualidad, contamos con una amplia gama de métodos de imagen que nos permiten acercarnos a la posibilidad de lograr diagnósticos tempranos y conocer el avance del padecimiento con mayor precisión. Ahora bien, es menester contar con la capacitación de los radiólogos y personal técnico en esta variada metodología, así como desarrollar las habilidades y así conjuntar, tanto la información clínica, como los hallazgos de imagen para la integración de un diagnóstico que permita establecer tratamientos médicos o quirúrgicos adecuados y oportunos. Las variedades técnicas en uso para el diagnóstico temprano y certero de la patología mamaria son analizadas y discutidas en este artículo.
The diagnostic accuracy in cases of breast pathology is particularly relevant because an important increment of mammary cancer has been observed all over the world, as well as the knowledge that when it is discovered at an early stage of the disease, the figures of mortality descend dramatically and the survival of patients, with a better life quality, is substantially improved.
The early diagnosis of breast cancer must be made through image methods; the mammary screening programs, with mammography, have been successful in detecting the disease in a large number of patients globally.
On the other hand, such precise diagnosis requires, in a large number of cases, the use of other image technologies to confirm the presence of this malignancy and to let us know the progression and extent of the disease. Therefore several image methods should be applied, along with the accurate clinical information to achieve an early diagnosis of breast cancer. Those multimodal techniques are presented and discussed in this paper.
Pagina nueva 1
Introducción
El cáncer mamario es considerado un problema de salud universal, llevando al desarrollo de diversos métodos de imagen para permitir su detección, diagnóstico precoz y lo más certero posible, con el propósito de establecer de manera temprana el tratamiento que permita curar en algunos casos la enfermedad, o por lo menos mejorar el pronóstico, la sobrevida y optimizar la calidad de vida, en las mujeres supervivientes de tal padecimiento.
Es de gran utilidad conocer los alcances y limitaciones de los variados métodos de imagen para estudiar la patología mamaria, así como la combinación de ellos, sus cualidades, fallas y en cuáles casos está indicado el realizar dos o más estudios de imagen.
Métodos de imagen
Mastografía
La mastografía sigue siendo el único método para tamizaje en la población general1,2. La Sociedad Americana de cáncer, la recomienda en mujeres mayores de 40 años y en aquellas de menor edad, con factores de riesgo para búsqueda de cánceres clínicamente ocultos1. En México, a partir del año 2006, el cáncer de mama ocupa el primer lugar como causa de muerte por neoplasia maligna en mujeres de 25 años en adelante, y ha desplazado de esta posición al cáncer cervicouterino3.
Se ha demostrado significativa reducción en la tasa de mortalidad por cáncer de mama, en pacientes que son sometidas a mastografía anual1. En estados unidos se reporta en un 24%, en un estudio italiano hasta en un 50% y en el sueco en un 39%4.
La mastografía es menos sensible y específica en mujeres con mama densa, en terapia hormonal de reemplazo (THR) y en jóvenes.
De acuerdo a la edad de la paciente y a la densidad del tejido mamario, otras series demuestran una sensibilidad que varía del 63% para el extremadamente denso, hasta en un 87% en el fibroadiposo; 69% en mujeres de 40 a 44 años y 83% para aquellas de 80 a 89 años5.
La especificidad es del 89% para tejido extremadamente denso, y 97% para fibroadiposo. En mujeres sin THR, la especificidad es del 91% en aquellas de 40 a 44 años y del 94% en las de 80 a 89 años, con THR es del 92% para todas las edades5.
Del 10% al 20% de los cánceres palpables, pueden no ser visibles por mastografía convencional, este porcentaje se disminuye con la técnica digital debido a su constante calidad y contraste de la imagen, así como por su amplio rango dinámico2.
La mastografía digital representa un avance tecnológico en relación al sistema análogo4, sobre todo en mama densa y en la identificación y caracterización de microcalcificaciones, es significativamente superior a la analógica para la visibilidad del cáncer mamario, independientemente de la variedad histológica y la densidad mamaria6.
El costo del equipo es 3 a 5 veces más, que en el sistema convencional.
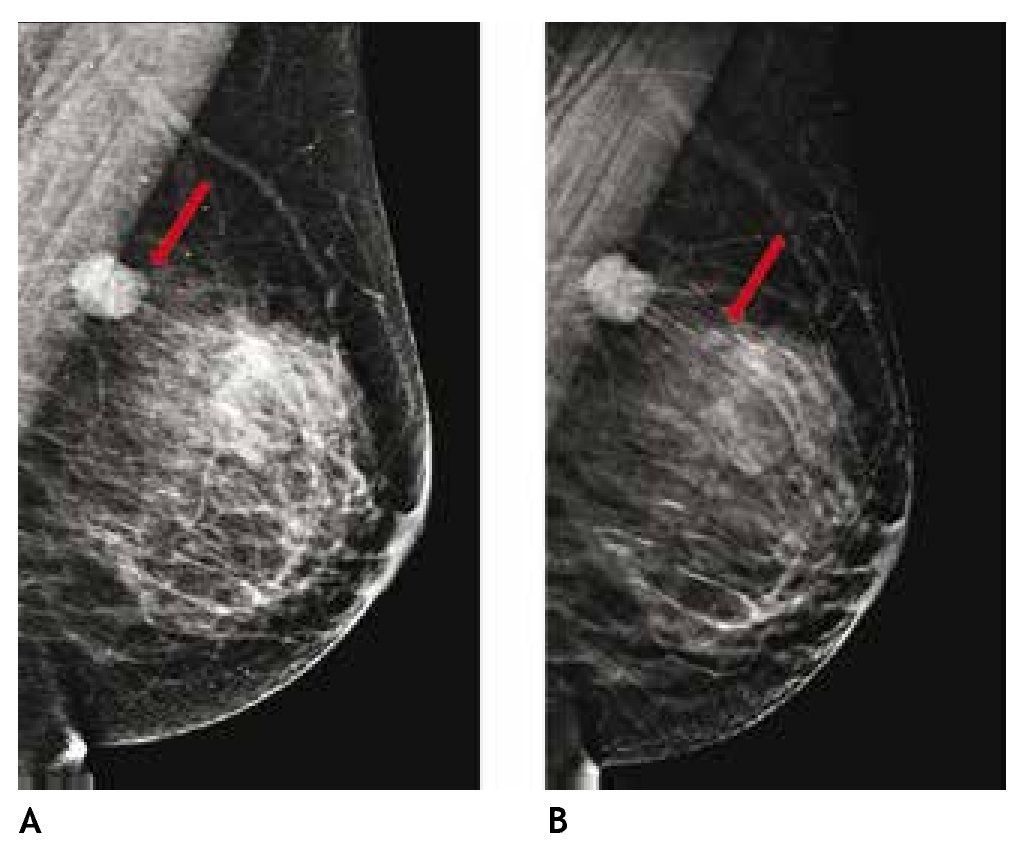
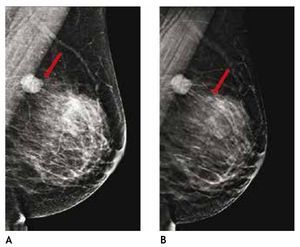
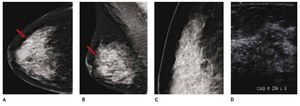
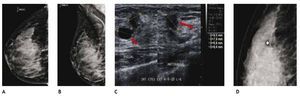
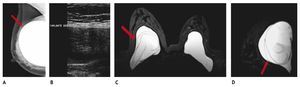
Otra de las ventajas del sistema digital son la rapidez en la adquisición con almacenamiento de la imagen, cada componente puede ser optimizado y/o manipulado para hacer más evidentes los hallazgos de una lesión sospechosa, y también ofrece la posibilidad de aplicaciones avanzadas no existentes en el sistema analógico, como la telemedicina, sustracción por energía dual, mastografía contrastada, biopsia digital y tomosíntesis (mastografía tridimensional), ésta última ya aceptada por la FDA a partir de enero del 2011, la cual consiste en una serie de imágenes tridimensionales, adquiridas en diferentes ángulos de la glándula mamaria, con baja dosis de radiación ionizante, lo cual elimina sobreposición de estructuras, y permite mejor valoración de los márgenes de una lesión (figs. 1A y B), reduce el número de proyecciones adicionales y por lo tanto, de compresiones mamarias así como de falsas positivas. Esta nueva tecnología es de gran utilidad en mama densa, asimetrías y distorsiones de la arquitectura6.
Figura 1A) Mastografía digital: tumoración de contornos microlobulados en CSI. B) Tomosíntesis, se aprecian contornos espiculados con mayor claridad (flecha), BIRADS 5: cáncer ductal infiltrante.
La detección asistida por computadora (CAD) puede ser utilizada tanto en la mastografía analógica como en la digital, funciona como un segundo lector y aumenta en combinación con el radiólogo, la sensibilidad en la detección del cáncer mamario hasta en un 19.5%.
La mastografía digitalizada o indirecta (CR) utiliza un mastógrafo analógico, y a través de una computadora copia la imagen latente en una placa luminiscente generalmente de fósforo. Este proceso dura aproximadamente de 5 a 10 minutos pero si es mayor de este tiempo, la imagen se degrada y produce múltiples artificios. Posteriormente, es leída en un digitalizador láser; en este sistema no es posible la telemedicina debido a que son imágenes de 35 a 60 Mb.
La detección de calcificaciones es igual a la de un mastógrafo analógico; este sistema tiene menor costo que la mastografía digital y aún no está aceptada por la FDA; es de gran utilidad en radiología convencional7.
Ultrasonido
Después de la mastografía, el ultrasonido es la modalidad más utilizada. Su papel principal está en el diagnóstico de quistes, caracterización de masas palpables mastográficamente indeterminadas, asimetrías en la densidad y distorsiones de la arquitectura.
Se ha reportado una sensibilidad del 68% al 98% en la detección del carcinoma lobulillar infiltrante (CLI), en combinación con la mastografía. El ultrasonido es superior en identificar multifocalidad, multicentricidad, al comparar con la exploración clínica y la mastografía. También juega un papel importante en la toma de biopsias, y para localizar lesiones cuando son visibles a través de este método o son apreciadas en una sola proyección mastográfica6.
Es la técnica de elección en mujeres menores de 30 años, embarazadas y en periodo de lactancia; es útil en la valoración de la región axilar cuando existe el diagnóstico de cáncer para establecer la sospecha de metástasis4, así también para evaluar los implantes mamarios y sus complicaciones.
Aunque el ultrasonido no es parte del protocolo estándar en la detección del cáncer mamario (tamizaje), puede ser útil en mujeres con mastografía normal y mama densa2.
La exploración dirigida es rutinariamente usada en la mastografía diagnóstica para evaluar regiones de interés1.
Resonancia magnética (RM)
Con el progreso en el campo de la imagen mamaria, la RM actualmente se usa como una herramienta complementaria, la cual no sustituye a la mastografía y al ultrasonido en el diagnóstico de la patología mamaria2.
Las ventajas de la RM para la evaluación diagnóstica del cáncer mamario es el alto contraste de tejidos blandos, imagen multiplanar que permite la adquisición de cortes finos contiguos, con representación tridimensional y la ausencia de radiación ionizante1. Ha demostrado alta sensibilidad en la detección de cáncer ductal infiltrante del 94% al 100%8, y en otras variedades histológicas la resonancia contrastada (dinámica) es mayor al 90%1, pero no ha sido ampliamente aceptada para tamizaje, debido a la variable especificidad reportada del 37% al 97%7, y otros la mencionan del 37% al 100%1.
Entre las aplicaciones clínicas más frecuentes de la RM están: la etapificación del cáncer mamario, ya que permite la medición precisa del tumor y respuesta a quimioterapia neoadyuvante, valoración de componente intraductal e invasión a otras estructuras, diagnóstico diferencial entre recurrencia vs. cicatriz, búsqueda de tumor primario oculto con metástasis axilares, valoración de implantes y sus complicaciones, tamizaje en pacientes con factores de alto riesgo, investigación de la etiología de galactorrea en pacientes con mastografía, ultrasonido y ductografía negativos; para localizaciones y biopsias en aquellas lesiones visibles únicamente por este método1,2.
Se recomienda en mujeres de alto riesgo para cáncer mamario, hereditario y de ovario, entre 20 a 25 años de edad, tamizaje con mastografía y RM contrastada.
La neovascularidad de los cánceres mamarios es visible en la RM contrastada y ocurre a través de la fuga de los capilares, pero también puede acontecer en el tejido benigno, cambios fibroquísticos, fibroadenomas, mastitis, cicatriz radial, hiperplasia ductal atípica, ganglios linfáticos e intramamarios, así también en la neoplasia lobulillar in situ, por lo que este hallazgo por sí sólo, no establece el diagnóstico de cáncer.
El ciclo menstrual ocasiona variaciones fisiológicas regionales en el reforzamiento del parénquima mamario normal, el cual simula una lesión o puede ocultar una verdadera1, también puede haber otros falsos positivos en las mujeres premenopáusicas y durante THR1.
Integración de la metodología
La integración de la metodología al trabajo diario, nos permitirá encontrar mayor número de tumoraciones malignas, en estadios cada vez más tempranos.
El cáncer mamario ductal infiltrante (CDI) es la variedad histológica más frecuente, debido a su tipo de crecimiento y presencia de microcalcificaciones en la mayoría de ellos, es fácil detectarlo y diagnosticarlo a través de mastografía.
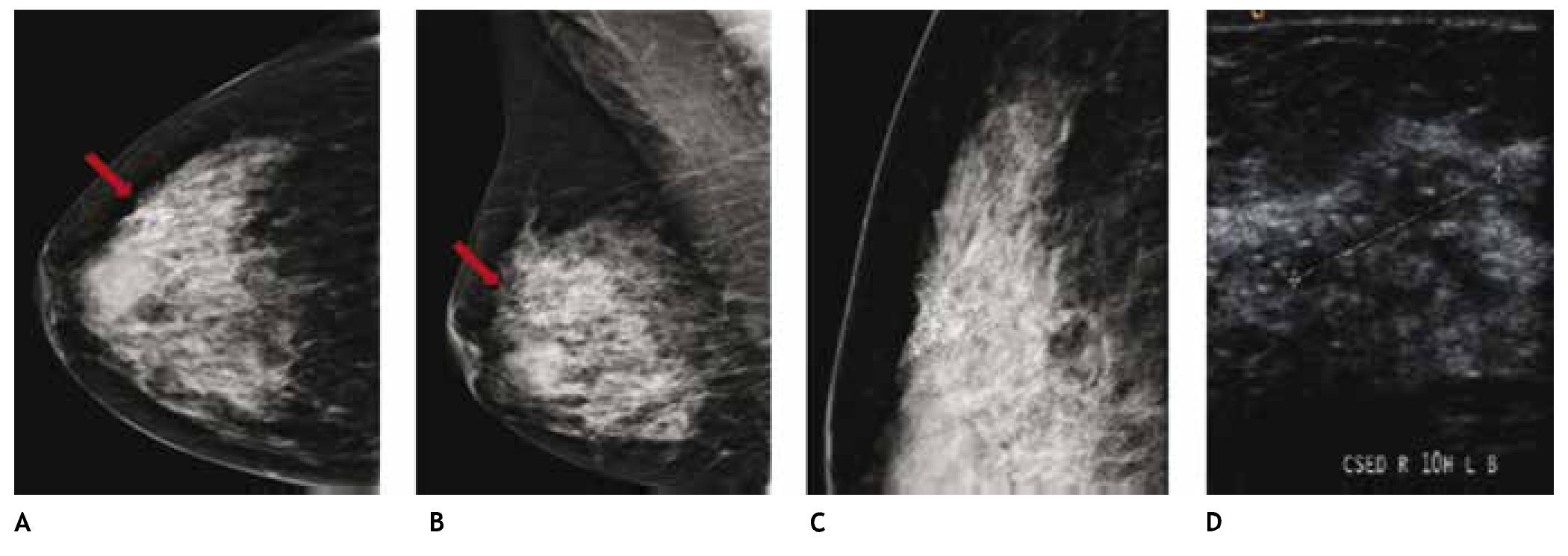
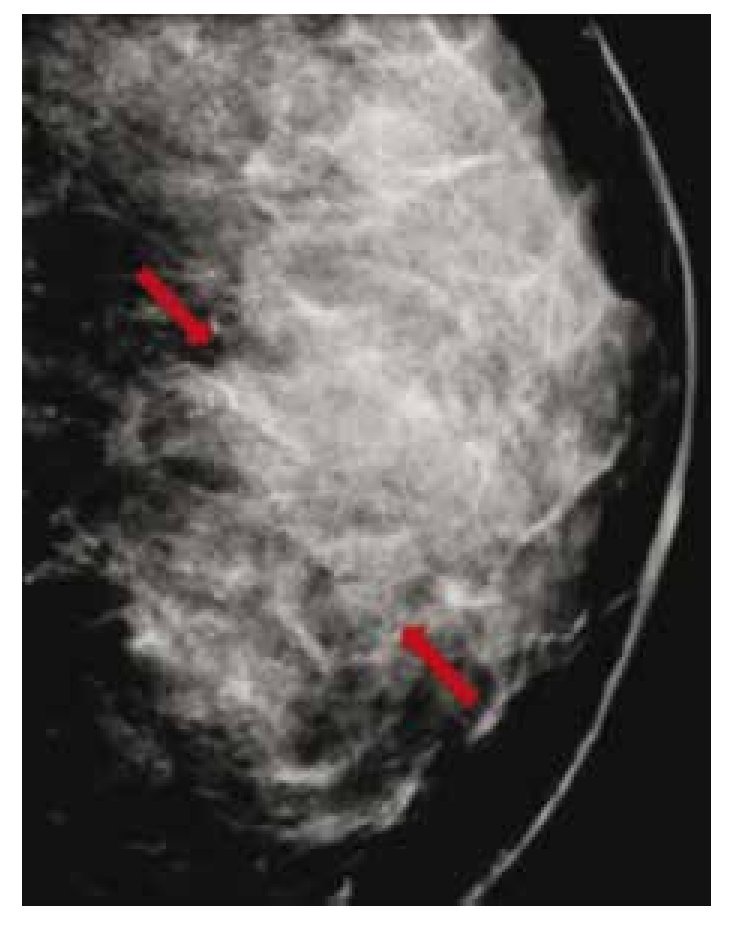
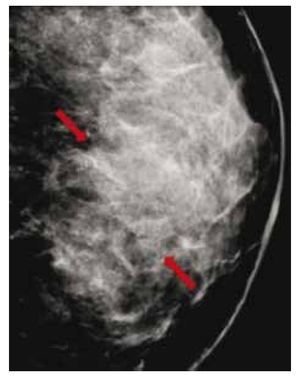
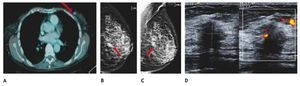
El carcinoma ductal in situ (CDIS), se presenta comúnmente con microcalcificaciones agrupadas en el 62% a 72%9 (figs. 2A-D) y gracias a esta tecnología su frecuencia relativa ha aumentado en los últimos años, así como la detección de lesiones precursoras o limítrofes como la hiperplasia ductal con atipia (fig. 3).
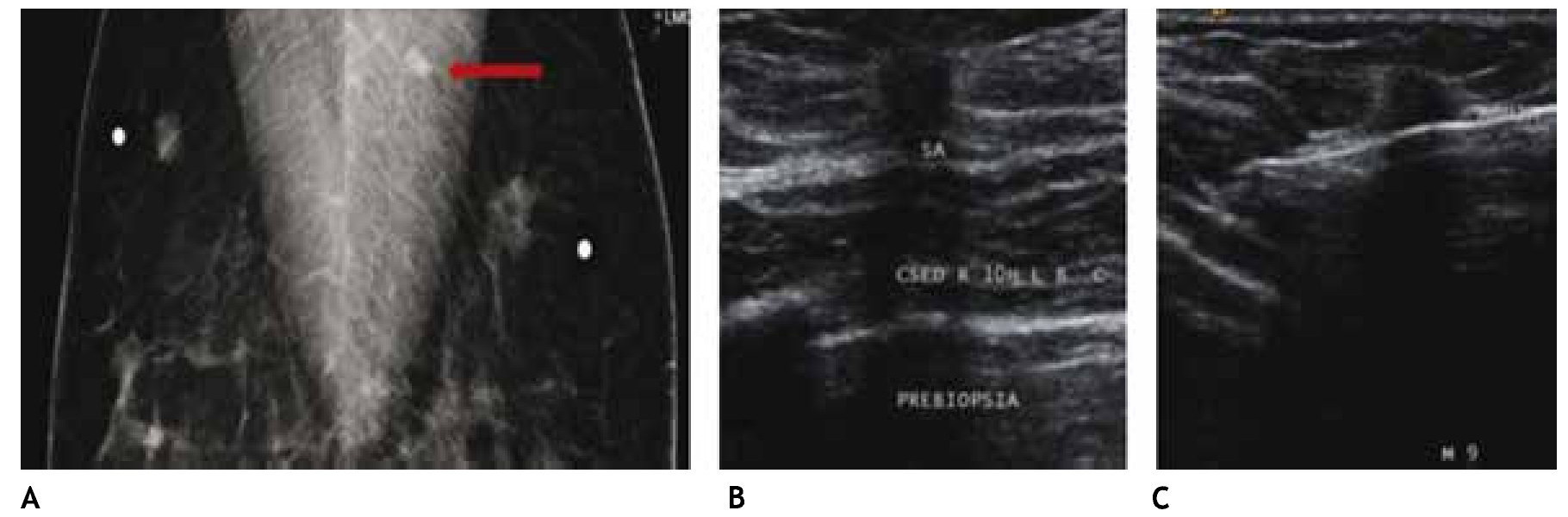
Figura 2 A), B) y C) Paciente de 48 años, asintomática, calcificaciones agrupadas polimorfas con distribución segmentaria CSED (flechas). D) ultrasonido, tumoración mixta, BIRADS 5: cáncer ductal in situ de alto grado.
Figura 3 Asintomática, paciente de 41 años con grupos de microcalcificaciones polimorfas izquierdas de distribución lineal (flechas), BIRADS 4C: hiperplasia ductal con atipia.
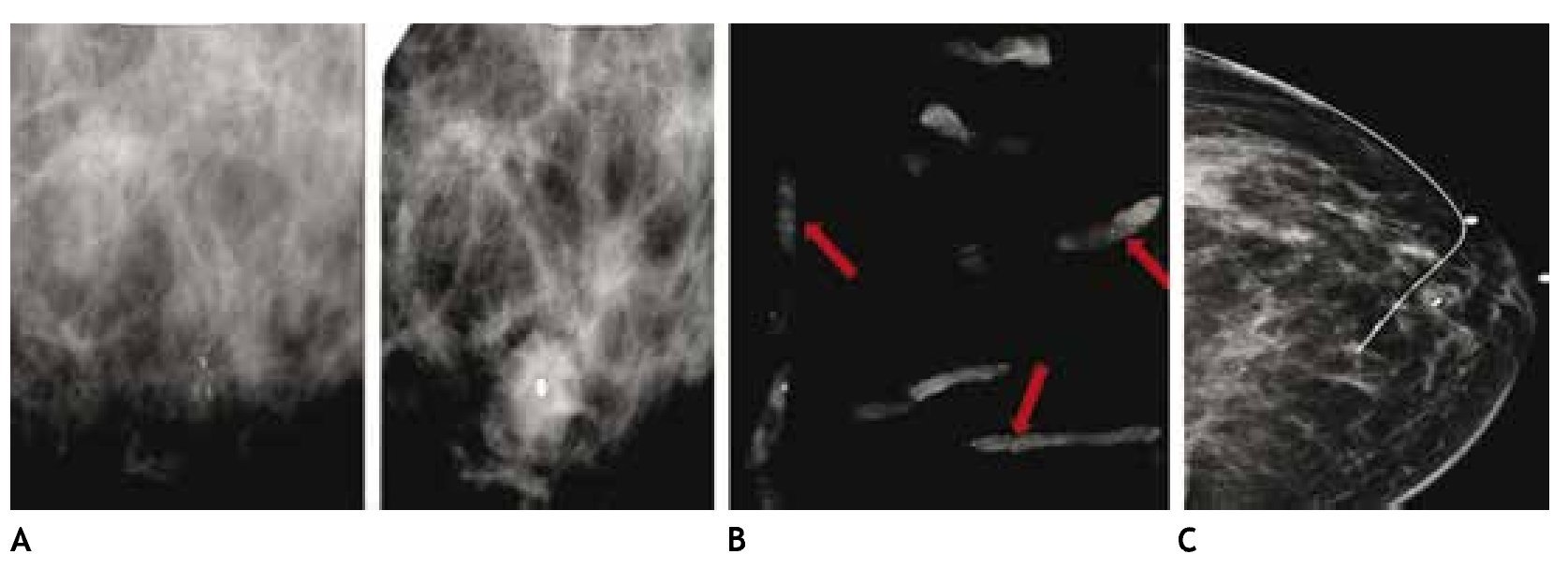
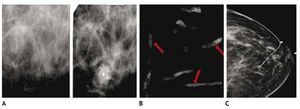
En estas lesiones no palpables, es de gran utilidad la estereotaxia, sistema utilizado ya sea en la mastografía analógica como en la digital, para efectuar la biopsia precisa y exacta, generalmente de microcalcificaciones, mediante pistolas de corte aspiración y vacío, con la paciente sentada o en la mesa prona (figs. 4A y B).
Figura 4 A) Paciente de 51 años, asintomática. Biopsia estereotáxica con sistema corte aspiración, imagen de localización y clip de titanio, rodeado por serohematoma. B) Radiografía de fragmentos con microcalcificaciones (flechas): cáncer ductal in situ con áreas de invasor. C) Marcaje mamario de clip, guiado por radiografía, previo a tratamiento conservador (mismo caso).
También es posible llevar a cabo localizaciones o marcajes mamarios con colocación de un arpón, previo a la biopsia excisional, a través de rejillas fenestradas (fig. 4C).
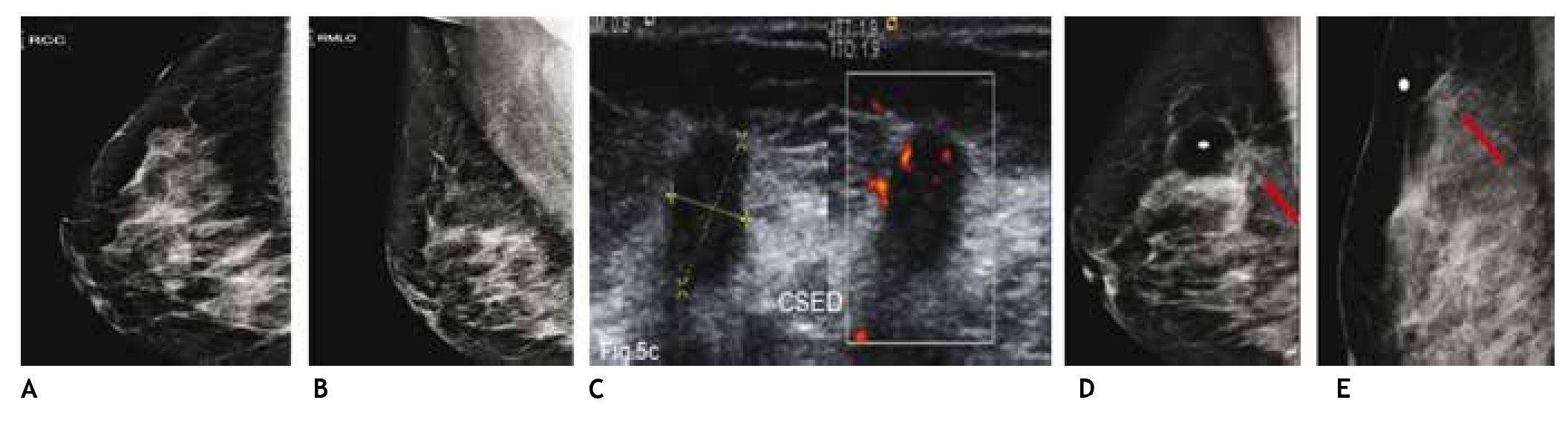
El ultrasonido es capaz de detectar lesiones ocultas independientemente del tipo de patrón mamario, las cuales no son visibles en la mastografía, por lo que al identificar tumoraciones sospechosas en el ultrasonido y colocar marca metálica en la piel de la paciente y efectuar proyecciones mastográficas complementarias, nos permite su localización y caracterización (figs. 5A-E).
Figura 5 A) y B) Paciente de 50 años, asintomática. Tejido heterogéneamente denso, se recomienda ultrasonido. C) Tumoración hipoecoica, microlobulada y vascularizada CSED. D) y E) Proyecciones complementarias con marcas en piel, tumoración espiculada (flechas), BIRADS 5: cáncer ductal infiltrante.
Independientemente de la variedad histológica, el ultrasonido ofrece una primera oportunidad de etapificación del cáncer mamario, ya que es más sensible que la mastografía.
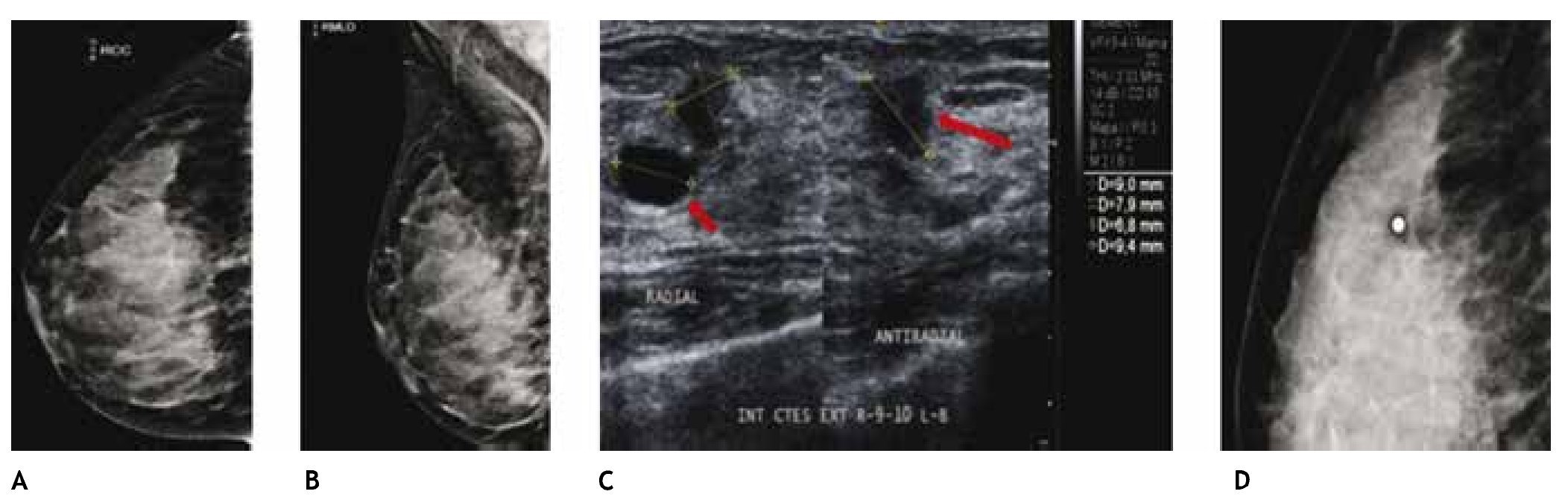
El CLI es de difícil diagnóstico en la mastografía, ya que su presentación más frecuente es como una tumoración con densidad similar al tejido mamario, generalmente sin microcalcificaciones o distorsión de la arquitectura en el 10% a 34%, seguido de asimetría en la densidad; otra de sus características relevantes y que lo hacen más agresivo en relación al cDi, es la mayor frecuencia de multicentricidad y bilateralidad, por lo que el ultrasonido juega un papel importante en el diagnóstico de esta variedad histológica (figs. 6A-D).
Figura 6 A) y B) Paciente asintomática de 44 años de edad. Tejido heterogéneamente denso, por lo que se recomienda ultrasonido. C) Quiste simple (flecha corta) y tumoración hipoecoica e irregular (flecha larga). D) Tumoración no identificada en la magnificación, BIRADS 4 C: cáncer lobulillar infiltrante.
La sensibilidad en la mastografía en el CLI tiene un rango del 75% al 81%, cabe mencionar que hasta en un 8% al 16% pueden encontrarse hallazgos benignos o un estudio normal; se ha reportado una tasa de falsos negativos mayor al 19%6.
El ultrasonido mamario se ha convertido en el estudio de elección para procedimientos de intervención, sean marcajes o localizaciones de lesiones no palpables, previo a biopsia excisional y como guía de biopsias percutáneas, en tumores visibles a través de este método de imagen (figs. 7A-C).
Figura 7 A) Paciente de 65 años, tumoración izquierda palpable espiculada con microcalcificaciones y ganglio axilar indeterminado (flecha). Tumoración derecha microlobulada, BIRADS 5 bilateral. B) Masa hipoecoica derecha: cáncer tubular. C) Biopsia izquierda con ultrasonido, trayecto de la aguja en tiempo real: cáncer ductal infiltrante con componente in situ y metástasis ganglionar axilar homolateral.
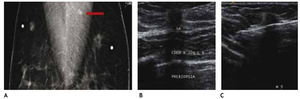
El ultrasonido es utilizado en la mayoría de las mastografías diagnósticas, sobre todo en el estudio de patología benigna y permite la evaluación inicial de la paciente con implantes mamarios y complicaciones, como la ruptura extracapsular (figs. 8A y B). El estudio de la región retroareolar, proporciona información detallada de los conductos galactóforos.
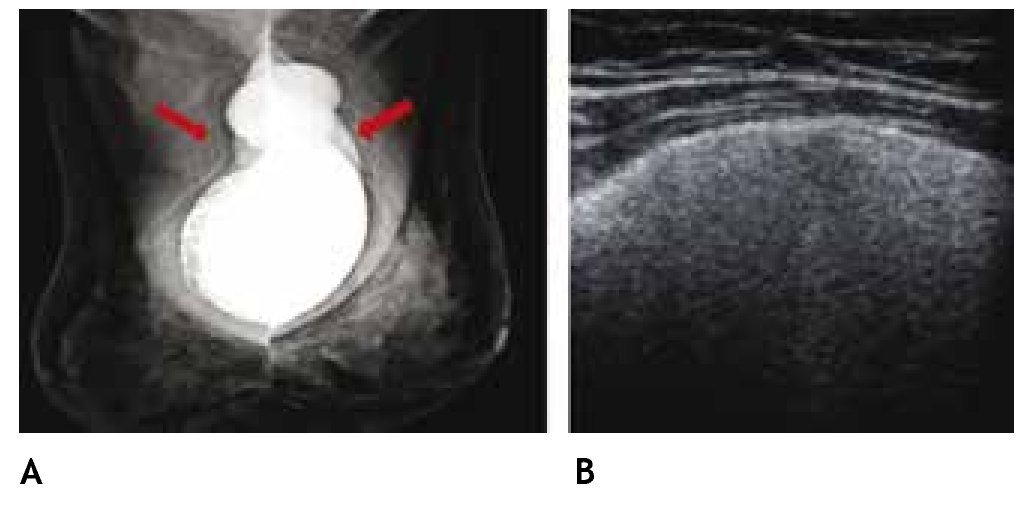
Figura 8 A) Mamaplastía de aumento hace 15 años. Radiografía de mínima compresión, prótesis de silicón, subpectorales, con calcificación de la cápsula fibrosa derecha y silicón libre bilateral (flechas). B) Ultrasonido con signo de la "tormenta de nieve", BIRADS 2: ruptura extracapsular.
En pacientes con mastografía de tamizaje y mama densa, el ultrasonido complementario ha demostrado mayor detección de cánceres, pero desafortunadamente eleva los costos de los programas de tamizaje y las falsas positivas.
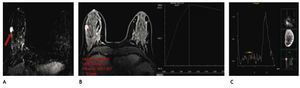
La RM contrastada muestra captación en la mayoría de los cánceres ductales infiltrantes, en el estudio dinámico el reforzamiento poscontraste se lleva a cabo con la obtención de imágenes en diferentes intervalos de tiempo, lo cual permite tener diversos patrones de perfusión, con respecto al tejido normal.
Los fibroadenomas y otros tumores benignos, así como algunos de bajo grado de malignidad tienden a reforzar de forma continua en un periodo de tiempo, curva tipo 1 (benigna) y las lesiones que refuerzan rápidamente y luego se mantienen en meseta, muestran una curva tipo 2 (indeterminada), es decir 50% para lesiones benignas y la otra mitad para malignas; las que se lavan en forma inmediata, curva tipo 3 (maligna) (figs. 9A y B).
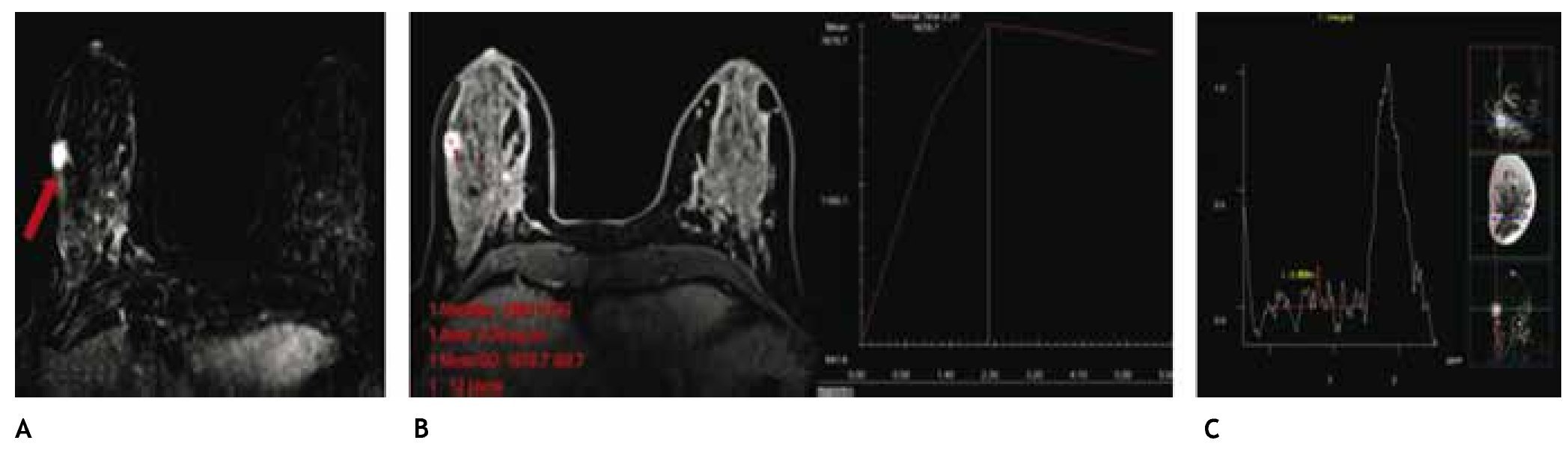
Figura 9 A) Resonancia magnética contrastada (paciente de la fig. 6), tumoración única espiculada, vascularizada en CSED (flecha). B) Curva de perfusión tipo 3 (maligna). C) Colina en la espectroscopia: cáncer lobulillar infiltrante.
La sobreposición de estos patrones vasculares enfatiza la necesidad de evaluar la morfología de una tumoración, no sólo en la resonancia, sino también con los métodos convencionales. El sistema BIRADS del colegio Americano de radiología, ha establecido un léxico para la integración de los tres métodos (mastografía, ultrasonido y RM)10; pero ante una paciente con lesión clínicamente sospechosa no debe contraindicarse la biopsia, a pesar de existir hallazgos negativos en los métodos de imagen.
También se lleva a cabo a través de la RM la espectroscopía, la cual tiene la capacidad de detectar cambios metabólicos en el tejido mamario para la caracterización de una lesión a través de la cuantificación de colina (Cho), marcador de proliferación celular que apoya el diagnóstico de malignidad (fig. 9C).
En la práctica diaria se debe implementar también el uso de marcadores oleosos, previo a la obtención de imágenes en RM, colocados en aquellos casos donde una tumoración fue visible a través de ultrasonido y se quiere observar su comportamiento vascular y morfológico en la RM, ya que la ubicación tridimensional se torna difícil, debido a que la mastografía se efectúa en bipedestación, el ultrasonido en decúbito dorsal y la RM en decúbito ventral; también se colocan marcadores en el caso de cicatrices quirúrgicas o tumoraciones palpables.
Se recomienda posterior a un hallazgo de sospecha de malignidad en la RM, no visible en los métodos convencionales, efectuar una segunda revisión intencionada mediante ultrasonido y de confirmarse, se prefiere efectuar la biopsia o localización a través de este método.
En el CDIS, la mastografía es el estudio ideal debido a la visualización de microcalcificaciones agrupadas, las cuales no son detectadas a través de ultrasonido ni de RM, y el patrón de reforzamiento en esta variedad puede ser negativo, probablemente debido a los vasos de neoformación (curvilíneos, segmentarios y regionales). En algunos casos, el reforzamiento se encuentra asociado a componente infiltrante, en donde este estudio cobra importancia para determinar la extensión, ya que ha demostrado ser superior a la mastografía y al ultrasonido para valorar multifocalidad, multicentricidad y bilateralidad, así como en la medición del tumor y búsqueda de metástasis axilares.
La sensibilidad en esta entidad es menor, oscilando entre 40% al 70%, debido a la ausencia de neoangiogénesis, lo que explica altos falsos negativos, también puede ocurrir en el CLI y mucinoso2.
La RM contrastada influye en la decisión terapéutica del cáncer mamario, si se quiere realizar cirugía conservadora, en el postoperatorio para determinar enfermedad residual o cuando existe duda en los márgenes quirúrgicos o el patólogo reporta resección incompleta; en la búsqueda de recidivas, sobre todo en mamas radiadas, donde la densidad mamaria dificulta la lectura en la mastografía y para la diferenciación entre cicatriz quirúrgica vs. recurrencia tumoral.
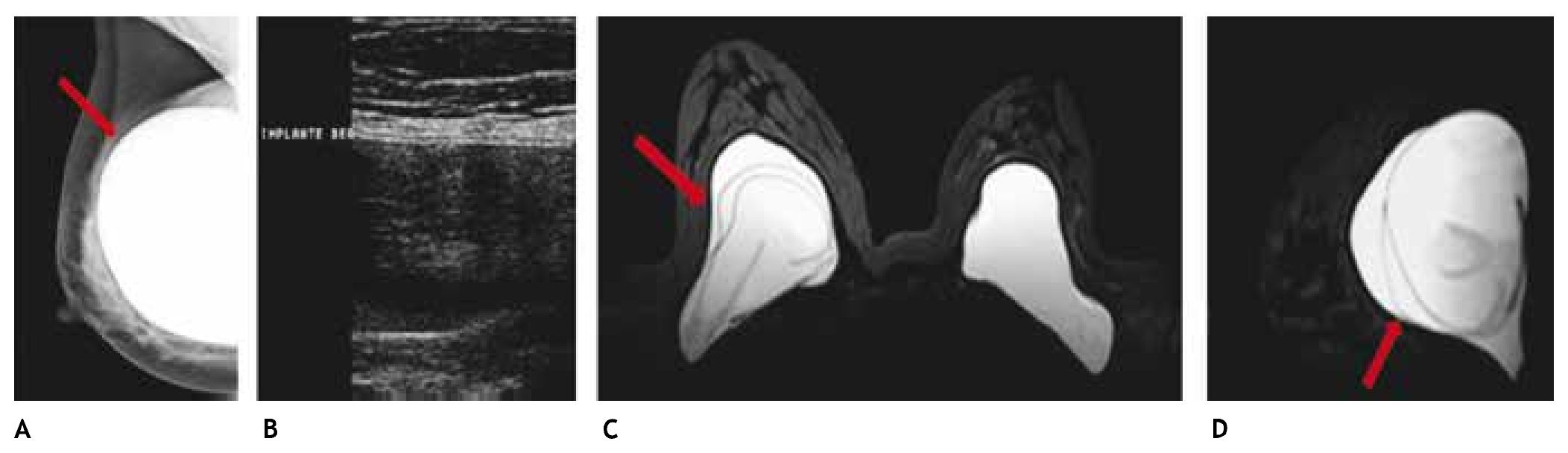
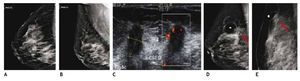
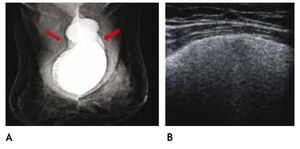
Es el método de elección en la paciente con mamaplastía de aumento y probabilidad de cáncer mamario, así como en la valoración de la integridad de los implantes, sobre todo cuando se sospecha ruptura intracapsular, la cual no se observa en la mastografía y la sensibilidad en el ultrasonido es baja para esta complicación, en este caso puede efectuarse la RM sin contraste, o en la sospecha de otras complicaciones de las prótesis (figs. 10A-D).
Figura 10 A) Paciente asintomática de 41 años, prótesis mamaria derecha de silicón, subpectoral con deformidad del contorno superior (flecha). B) Agujero negro derecho con "signo de la escalera", descartar ruptura intracapsular, BIRADS 0, se recomienda resonancia simple. C) y D) Secuencia para silicón con "signo de Linguini" derecho, ruptura intracapsular (flechas); prótesis izquierda sin alteraciones: BIRADS 2.
Se puede utilizar para excluir malignidad, en aquellas pacientes con hallazgos clínicos, mastográfico y de ultrasonido negativos11.
La tomografía por emisión de positrones (PET), la cual fusiona tomografía computada, con estudio de medicina nuclear, es otro método de imagen diagnóstica, morfológico y funcional que permite valorar básicamente la extensión de la enfermedad mamaria maligna. Sin embargo, trabajos recientes mencionan la utilidad en el diagnóstico primario del cáncer mamario con equipos dedicados de mastografía y medicina nuclear (PEM)12.
También ha demostrado ser útil en pacientes con sospecha de enfermedad metastásica sin diagnóstico de cáncer mamario establecido, por lo que se debe realizar mastografía en caso de identificar zonas de hipermetabolismo en el tejido mamario (figs. 11A-D).
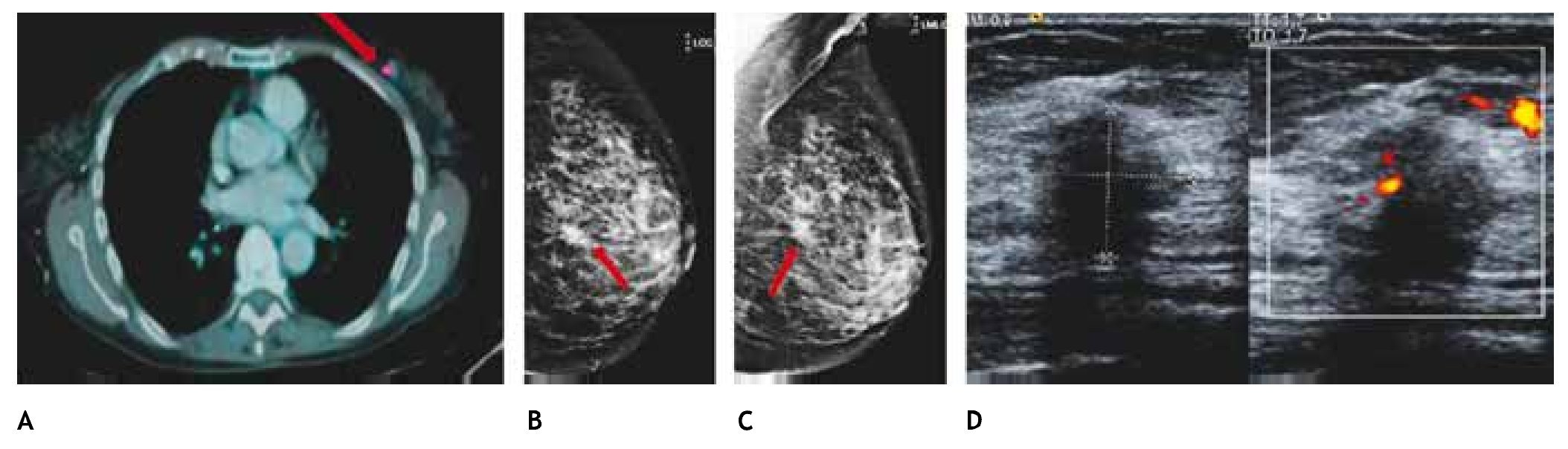
Figura 11 A) Paciente de 77 años con antecedente de linfoma no Hodgkin (PET-CT), tumoración mamaria izquierda con captación de 18-FDG (flecha). B) y C) Mastografía con tumoración espiculada en CSEI (flechas). D) Tumoración hipoecoica, irregular y vascularizada, BIRADS 5: cáncer ductal infiltrante.
Diversos estudios12-14 han informado la capacidad del PET-CT para demostrar enfermedad maligna oculta y establecen que este estudio tiene alta sensibilidad para recurrencia (92% al 100%), en comparación con los métodos de exploración convencional, especialmente para metástasis ósea o ganglionar. El PET-CT es menos sensible para recurrencia local que la RM. Es útil en la planeación de la escisión quirúrgica en pacientes con múltiples focos de enfermedad.
La alta sensibilidad de la RM sobre el PET-CT, es probablemente debido a su mejor resolución espacial que permite una mejor detección de lesiones menores de 10 mm. la RM y el PET-CT con FDG son técnicas diagnósticas limitadas en la detección del CDIS, o cuando el tumor mide menos de 3 mm, debido a su baja angiogénesis15.
Conclusiones
La mastografía es el método de elección para tamizaje y diagnóstico de la patología mamaria.
El ultrasonido mamario es una valiosa herramienta complementaria a la mastografía diagnóstica.
La RM es otra modalidad de imagen también complementaria a las anteriores, la cual ayuda al diagnóstico y manejo de la patología mamaria.
El PET-CT es un método de imagen diagnóstica, morfológico y funcional, útil para la etapificación del cáncer mamario.
Financiamiento
No se recibió ningún patrocinio para llevar a cabo este artículo.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
* Autor para correspondencia:
Rafael Checa n° 3, Colonia San Ángel, Delegación Álvaro Obregón,
C.P. 01000, México D.F., México.
Teléfono: (55) 5481 1980-89. Celular: (04455) 2737 2548. Fax: 5550 1620, 5682 0104.
Correo electrónico: maria1@prodigy.net.mx (M. C. Lara-Tamburrino).