Los Virus del Papiloma Humano (VPH) oncogénicos especialmente el VPH 16, ocasionan carcinomas anogenitales. Actualmente, se considera que también participan en la génesis de algunos casos de carcinomas escamosos de cabeza y cuello (CCECyC). En varios estudios se ha demostrado que los carcinomas de amígdala y orofaringe contienen VPH ADN, con mayor frecuencia que los carcinomas localizados en otros sitios de la cabeza y cuello. Asimismo, se ha observado que los pacientes con cáncer anogenital tienen un riesgo 4.3 veces mayor, que la población en general de padecer cáncer amidgalino. La forma en cómo el VPH infecta el tracto respiratorio superior no es del todo clara, sin embargo, existen datos epidemiológicos que sugieren una transmisión sexual. En tres estudios de casos-controles, los pacientes con cáncer oral tenían mayor número de parejas sexuales que los controles.
El aumento en la incidencia del carcinoma epidermoide orofaríngeo, se atribuye al incremento en el número de casos del mismo asociado al VPH. La incidencia de estos va en aumento, de manera que este tipo de neoplasia se considera como un tipo especial de carcinoma epidermoide con una etiología íntimamente relacionada con el VPH. En algunos estudios epidemiológicos, el origen anatómico del tumor (por ejemplo, orofaringe) se utiliza como un marcador subrogado que pone de manifiesto la infección por el VPH.
Los cambios en los patrones de conducta sexual representan la causa más probable del incremento en la frecuencia de carcinoma epidermoide orofaríngeo VPH positivo. También, en los últimos 50 años, este tipo de carcinoma ha cambiado de queratinizante a no queratinizante. La incidencia del VPH en el carcinoma epidermoide orofaríngeo se ha duplicado, particularmente en los hombres.
Oncogenic human papillomaviruses (HPVs), especially HPV type 16, cause anogenital epithelial cancers and are suspected of causing epithelial cancers of the head and neck. In several studies, tonsillar and oropharyngeal carcinomas contained HPV DNA more commonly than cancers at other head and neck sites, in line with findings that patients with a history of anogenital cancer have 4.3 times the risk for tonsillar cancer of the general population.
How HPV infects the upper respiratory tract is not firmly established, but epidemiologic evidence suggests sexual transmission. In three case-control studies, patients with oral cancer had more sexual partners than controls.
The increasing incidence of oropharyngeal squamous cell carcinomas is believed to be due to the growing proportion of HPV-positive oropharyngeal squamous cell carcinoma. Oropharyngeal squamous cell carcinomas incidence is on the rise and it is a distinct subset of head and neck squamous cell carcinoma with a well-established etiologic link to HPV; in epidemiologic studies, anatomical site of tumor origin (ie, oropharynx) is used as a surrogate marker of HPV status.
Changing patterns of sexual behavior represent the most widely accepted explanation for the increase in HPV-positive oropharyngeal squamous cell carcinomas. Also, in a 50-year period, the predominant morphologic oropharyngeal squamous cell carcinomas type changed from keratinizing to nonkeratinizing, and the incidence of HPV in oropharyngeal squamous cell carcinomas doubled, most significantly in men.
INTRODUCCIÓN
El carcinoma de células escamosas de cabeza y cuello (CCECyC) ocupa el sexto lugar en prevalencia a nivel mundial, con más de 600 000 nuevos casos por año, presenta una sobrevida a cinco años de 40% a 50%,1 dos terceras partes de las cuales se encuentran en países en vías de desarrollo.2 En 2008, se reportaron 223 000 muertes a causa de esta neoplasia.
Factores como el consumo de tabaco y alcohol (los cuales al parecer ejercen un efecto sinérgico), así como deficiencias inmunes se han asociado a esta neoplasia. Debido a las intensas campañas contra el tabaquismo, la incidencia del CCECyC ha disminuido en años recientes. En contraste, los casos de carcinoma de células escamosas de orofaringe y lengua se han incrementado, los cuales se asocian a infección por Virus del Papiloma Humano (VPH).3 Como sucede en varios (sino en todos) tipos de cáncer, el pronóstico depende de la etapa clínica, la cual se determina en base a la extensión del tumor, presencia de ganglios linfáticos con metástasis y metástasis a distancia. Recientemente, se ha establecido la importancia de la presencia del VPH y tabaquismo, como factores de significancia pronóstica.
Aproximadamente entre 15% y 20% de los casos se han asociado a la infección VPH. En México en el año 2008, se estimó en hombres y mujeres una tasa de incidencia de cáncer de cavidad oral de 2.6 y 1.7 por cada 100000, respectivamente. Sin embargo, no se cuenta con registros actualizados sobre CCECyC.4
Se ha establecido que los tumores asociados a VPH y los negativos a VPH son entidades diferentes, con características fenotípicas tales como pobre diferenciación, escasa queratinización y fenotipo basaloide, en contraste con los tumores de amigdalas VPH negativas, los cuales son típicamente queratinizantes.5 De manera semejante al cáncer cervicouterino, se ha identificado que los tumores negativos a VPH tienen mutaciones en TP53. Sisk6 reportó 13% de mutaciones de TP53 en tumores VPH positivos, comparados con 35% de mutaciones en tumores negativos a VPH.
Se ha sugerido dos vías en el desarrollo de cáncer de orofaringe, uno de ellos involucrados con la exposición a tabaco y alcohol, y otro inducido por la inestabilidad genética debido a la infección de VPH.7
VIRUS DEL PAPILOMA HUMANO
Desde la década de los años 70´s, se propuso la participación del VPH en el desarrollo de cáncer, en particular en cáncer cervicouterino.8 Actualmente, se estima que 4% de todos los tipos de cáncer se atribuyen a la infección por VPH.9 Ya está bien establecido que en cáncer cervicouterino es el factor etiológico más relevante, presentándose en prácticamente 100% de los casos.10 La infección por VPH también se ha asociado a cáncer de vulva, vagina, ano, pene y CCECyC. Sin embargo, se sugiere que cuando se haya establecido con mayor certeza la relación con CCECyC, la proporción de tumores asociados a VPH incrementará.11
La principal vía de transmisión del VPH es por vía sexual. A nivel celular al parecer la vía de entrada del virus depende de receptores celulares, tales como alfa 6 integrina12 y heparán sulfato,13 así como endocitosis vía clatrina.14 La infección por VPH se inicia en células basales y/o columnares del cérvix, donde se mantiene de manera episomal en bajo número de copias, entre 50 a 100 copias.15 El ciclo de vida viral se encuentra estrechamente ligado al programa de diferenciación epitelial,16 ya que utiliza la maquinaria celular para su regulación.
Los tipos de VPH son definidos en base a su homología en la secuencia. Actualmente se conocen 130 tipos virales, 40 de los cuales infectan la región genitourinaria y son clasificados en alto (VPH-ar) y bajo riesgo (VPH-br), debido a su asociación a lesiones neoplásicas malignas. Los tipos virales de alto riesgo según la clasificación de Muñoz17 son: 16, 18, 31, 33, 35, 39, 45, 51, 56, 52, 58, 59, 68, 73, 82. De los cuales, los VPH 16 y 18 son los más importantes debido a que representan el 70% de los casos de cáncer cervicouterino. Los VPH de bajo riesgo son: 6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81 y CP6108.
Un evento característico de los VPH-ar es la integración, mientras que los VPH-br se mantiene de forma episomal. Los VPH-ar pueden integrarse al genoma del hospedero -lo cual se considera un evento raro-, generando inestabilidad genómica, la cual facilita la inmortalización celular y la transformación.18 Los VPH-br tales como los tipos 6 y 11, pueden inducir proliferación epitelial, la cual se manifiesta como verrugas o papilomas cutáneos, aunque generalmente dichas lesiones son autolimitantes.
El VPH es un virus desnudo de DNA de doble cadena, de aproximadamente 8 Kb, conformado por los genes tempranos E1 y E2 involucrados en la replicación y transcripción viral, E4 y E5 que participan en interacciones con receptores de factores de crecimiento y citoqueratinas, y los oncogenes virales E6 y E7 principales responsables de la inmortalización y transformación celular. Los genes tardíos L1 y L2 son los responsables de codificar proteínas que forman la cápside viral.19
Las proteínas E6 y E7 son las principales responsables de las capacidades oncogéncias, y de transformación en epitelios escamosos. La expresión de E6 de VPH-ar induce proliferación en células epiteliales, pérdida de diferenciación y formación de tumores. La expresión de E6 es suficiente para la inmortalización, este coopera con E7 para inducir transformación en cultivos de queratinocitos primarios.20 Sin embargo, las proteínas E6 de los VPH-br no tienen estas características. El potencial oncogénico de las proteínas E6 de los VPH-ar se debe principalmente a la interacción e inactivación de proteínas celulares, tales como genes supresores de tumores. La primera actividad identificada de las proteínas E6 de VPH-ar fue la capacidad de formar complejos con TP53,21así como de su inactivación por degradación vía ubiquitina-proteosoma, lo cual es de suma relevancia debido a su función como gen maestro en el control de diversos procesos celulares.
El producto del gen TP53 no es el único blanco celular que es inactivado por E6 de HPV-ar. Diversas proteínas celulares que participan en la regulación de apoptosis son afectadas por las oncoproteínas E6, tales como BAK, FAS, FADD, inhibiendo la apoptosis. Otras participan en la reparación de daño al DNA, tales como XRCC1 y O6MGT. Por lo cual, E6 inhibe la reparación del DNA. Además de la interacción e inactivación de proteínas, también tiene efectos en la actividad transcripcional de genes como TERT (telomerasa transcriptasa inversa), BIRC5 (survivina) y MYC. Se han caracterizado los residuos que intervienen en las interacción con algunas proteínas, tal es el caso de la proteína con dominios PDZ, como SCRIB y DLG.22 Estudios genéticos han demostrado que variaciones naturales en la secuencia de aminoácidos de la oncoproteína E6 de VPH 16, generan diferencias en cuanto a la eficiencia de degradación de proteínas celulares tales como BAX y TP53.23
VIRUS DEL PAPILOMA HUMANO EN CABEZA Y CUELLO
En comparación al cáncer de cabeza y cuello de células escamosas, tradicionalmente asociado al hábito tabáquico, el carcinoma de orofarínge asociado a VPH tiene mejor respuesta a tratamiento, con una tasa de sobrevida a cinco años del 80%, en comparación al 40% en pacientes negativos a VPH en etapas clínicas III y IV.24 Se ha determinado que VPH 16 y 18 son los más comunes en cáncer de orofarínge, sin embargo también se ha detectado VPH 6 y 11 en carcinomas de cabeza y cuello.25
Un meta-análisis sobre la prevalencia de VPH en CCECyC, muestra la presencia de VPH en 25% de los casos, de los cuales 86% corresponden a VPH 16. Los CCECyC negativos a VPH se asocian a mutaciones en TP53.26
El VPH tipo 16 es particularmente asociado a cáncer de orofaringe, con una presencia de hasta 72%. Asimismo, otros estudios han conformado esta fuerte asociación.11,27
Stransky y colaboradores28 encontraron mediante secuenciación masiva de tumores de cabeza y cuello, 19% de los casos positivos a VPH 16, así como una correlación inversa con mutaciones en TP53. Estos datos son compatibles con otro trabajo, donde reportan 20% de VPH en tumores de cabeza y cuello, lo cual se correlacionó con activación de la vía mTOR.29 Mientras que en cáncer de laringe se detecta VPH 16 en 27% de los casos.30
Un estudio reciente demuestra que pacientes con cáncer de orofaringe VPH positivos, tiene mejor sobrevida global, control local y regional en un periodo de seis años que pacientes VPH negativos, sin embargo el control a distancia fue similar entre ambos grupos.31 Series de casos analizados en México, no mostraron asociación significativa de la presencia de VPH con el pronóstico, siendo VPH 16 el de mayor prevalencia.32,33 Un estudio multinacional (Estados Unidos de Norteamérica, Brasil y México) reportó una prevalencia de 4% de VPH en cavidad oral de hombres sanos, de los cuales 1.3% corresponde a VPH de alto riesgo, siendo el más frecuente VPH 16.32
Una de las explicaciones en cuanto al mejor pronóstico de pacientes con CCECyC y VPH, es debido a que el gen TP53 no se encuentra mutado a diferencia de los VPH negativos, donde se reportan mutaciones de TP53. Este gen es un factor proapoptótico y de senescencia en respuesta a daño a DNA inducido por fármacos, así como un potente inductor del arresto del ciclo celular.
Ang24 propone una clasificación de pacientes en base a la presencia de VPH, consumo de tabaco y estatus de nódulos linfáticos. Los pacientes con VPH se consideran de bajo riesgo, mientras que pacientes con VPH positivo, consumo de tabaco y nódulos positivos se clasifican en riesgo intermedio. Así, pacientes VPH negativos se consideran de alto riesgo a excepción de no fumadores en etapas T2 y T3, los cuales se clasifican como de riesgo intermedio.
Debido al significado pronóstico de la presencia de VPH en cáncer de cabeza y cuello, la American Joint Committee on Cancer Stading Criteria recomienda la determinación de la presencia de VPH en cáncer oral y de faringe.
ALTERACIONES MOLECULARES
Más del 95% de los tumores de cabeza y cuello son de tipo escamoso, lo que supondría ser una enfermedad homogénea, sin embargo, se han observado distintos patrones pronósticos y agentes causales. A nivel histológico pueden distinguirse varios subtipos.33 Sin embargo, a nivel molecular tanto por perfiles de expresión como de alteraciones en DNA ha revelado una alta heterogeneidad tumoral.1 En este sentido, diversas evidencias sugieren un modelo de progresión molecular a partir de lesiones premalignas a malignas, muy semejante al modelo de progresión de cáncer cervicouterino.7
MUTACIONES
Una de las alteraciones mejor caracterizadas es la sobreexpresión del receptor del factor de crecimiento epidermal (EGFR). El EGFR pertenece a la familia de receptores, la cual se compone de cuatro miembros: EGFR, ERBB2, ERBB3 y ERBB4, la cual a su vez pertenece a la superfamilia de receptores tirosina cinasa. Esta familia de receptores fue la primera que se identificó en cáncer.34 Los genes codifican proteínas transmembranales, involucradas en la señalización celular en respuesta a ligando (EGF, TGF-α, anfiregulina, epiregulina, betacelulina, HB-EGF). Una vez que el receptor y el ligando interaccionan, se induce una homodimerización o heterodimerización y posterior autofosforilación de residuos de tirosinas del dominio intracelular, que disparan la señalización celular que deriva en diversos efectos, tales como inducción de la proliferación, inhibición de la apoptosis, cambios en la expresión génica y rearreglos del citoesqueleto, entre otros. La translocación nuclear de EGFR es importante para la señalización y el rápido crecimiento celular, dicha translocación es inhibida por tratamiento con el anticuerpo monoclonal quimérico C225 (cetuximab), el cual también inhibe la fosforilación de EGFR.7
Estudios recientes basados en secuenciación masiva, revelan que la tasa de mutación de los tumores negativos a VPH es el doble que los VPH positivos (4.83/ Mb en los tumores negativos a VPH en comparación con 2.28/Mb). Por otra parte, el tipo de mutaciones también es diferente, encontrando la transversión G>T más frecuentemente en tumores VPH negativos. En este estudio se identificaron mutaciones en genes previamente reportados en cáncer de cabeza y cuello, tales como TP53, CDKN2A, HRAS, PTEN y PIKCA. Así como nuevas mutaciones en genes como NOTCH1, NOTCH2, NOTCH3, IRF6 y TP63. Estos datos dan nuevos fundamentos sobre la caracterización de tumores de cabeza y cuello, así como de su relación con VPH, por lo que generan nuevas perspectivas en cuanto a la proposición de estrategias terapéuticas.28 En este sentido, un estudio independiente basado en secuenciación masiva también encontró mutaciones en NOTCH1, 40% de las cuales predicen un producto truncado.35 Se ha reportado la pérdida del gen supresor ATM (Ataxia telangiectasia) en 60% de los casos, sin embargo no se asoció con la sobrevida, respuesta a tratamiento.36
PERFILES DE EXPRESIÓN
Mediante análisis de los perfiles de expresión, Chung y colaboradores reportaron cuatro subtipos moleculares de cáncer de cabeza y cuello, dichos subtipos se asociaron con diferencias en la sobrevida libre de recurrencia. Uno de los subtipos incluye la vía de señalización de EGFR, otro con enriquecimiento mesenquimal, un subtipo normal-like, y el cuarto caracterizado por altos niveles de enzimas antioxidantes.37
Análisis globales de expresión basados en microarreglos han identificado genes diferencialmente expresados. Tumores de cabeza y cuello positivos a VPH sobreexpresan genes tales como SYCP2 (proteína del complejo sináptonemal), RFC5 (factor de replicación 5), CDKN2C y DNMT1 (DNA metil-trasferasa), respecto a tumores negativos a VPH. Mientras que genes involucrados en la proteólisis tales como calicreínas 6, 7, 8, 10,11, MMP13 y CRABP2 (proteína celular de unión a ácido retinoico 2), son poco expresados en tumores positivos a VPH.38,39
ALTERACIONES CROMOSÓMICAS
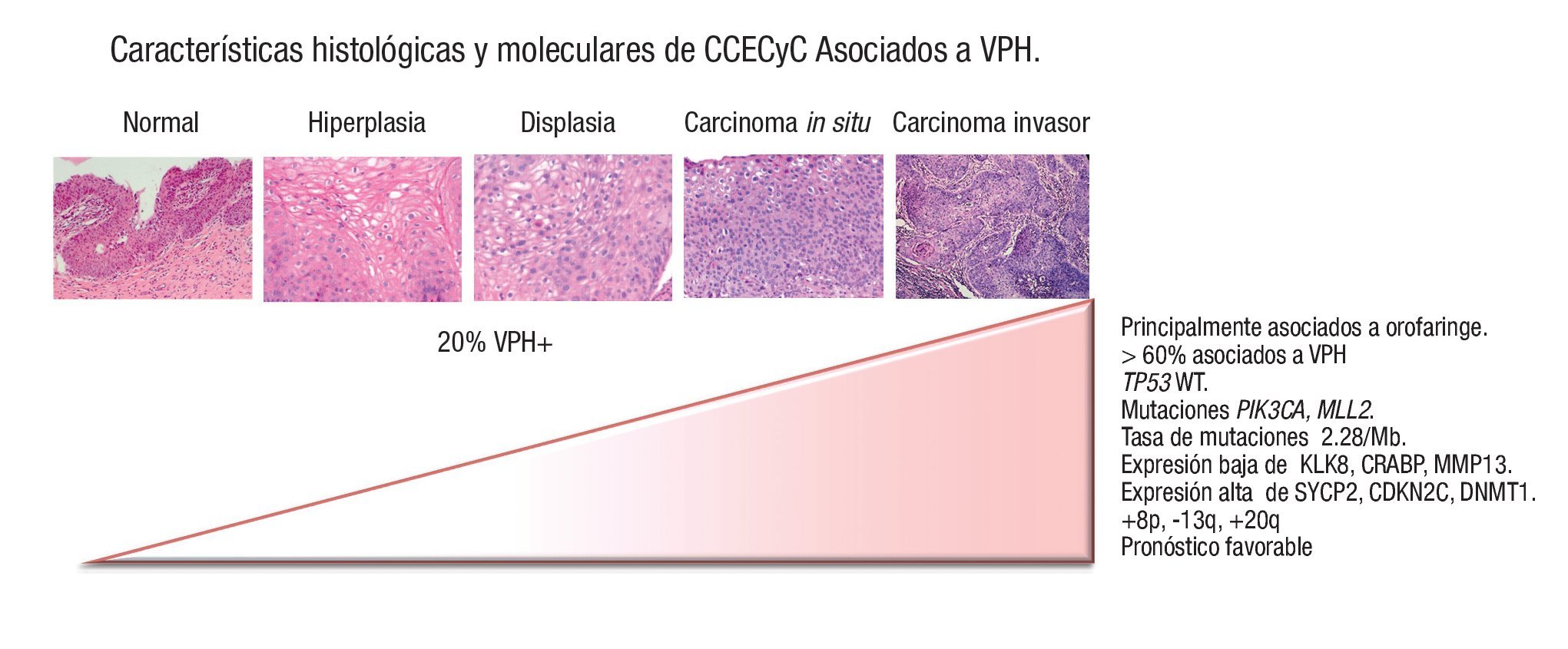
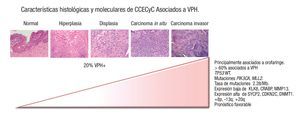
Analizando el conjunto de desbalances cromosómicos que se presentan en cáncer de cabeza y cuello, se determinaron ganancias en las regiones cromosómicas 8q y 20q y pérdida de 13q en los tumores VPH positivos, respecto a los negativos. Mientras que los tumores negativos a VPH se caracterizan por pérdidas en 3p, 5q, 8p, y ganancias de 11q. Los autores concluyen que los tumores asociados a la infección por VPH presentan alteraciones cromosómicas comunes en tumores de origen epitelial escamoso, independientemente del sitio anatómico, por lo que posiblemente dichas alteraciones sean consecuencia de la carcinogénesis inducida por VPH40 (Figura 1).
Figura 1. Espectro de lesiones escamosas asociadas a virus del papiloma humano. A mayor grado, mayor posibilidad de asociación con el mismo.
TRATAMIENTO
Esta neoplasia presenta altas tasas de persistencia local, así como de desarrollo de un segundo tumor primario, el tratamiento de la enfermedad en etapas tempranas involucra cirugía y radioterapia, pacientes en etapas clínicas II-IV tienen una sobrevida a cinco años del 30% al 40%.41 El conocimiento de las alteraciones biológicas de estos tumores ha dado pauta al desarrollo de terapias dirigidas, en algunos casos con éxito. Durante las pasadas dos décadas, la calidad de vida de los pacientes con CCECyC ha incrementado como resultado del uso de cirugías avanzadas, técnicas radioterapéuticas, así como por el desarrollo de nuevas terapias dirigidas. En este sentido, la FDA aprobó en 2006 Erbitux (cetuximab) en combinación con radioterapia para el tratamiento de pacientes con cáncer de cabeza y cuello no resectable, debido a que ha mostrado una mejoría en la sobrevida, dicha aprobación es debido a un estudio donde se demostraba que prolongaba la sobrevida en 20 meses en pacientes tratados con radioterapia, en comparación con pacientes que sólo recibieron radioterapia.
En noviembre de 2011, se aprobó el uso de cetuximab en combinación con 5-FU como primera línea de tratamiento para pacientes con enfermedad locoregional recurrente y/o metastásica de CCECyC.
CONCLUSIONES Y PERSPECTIVAS
Es necesario contar con un adecuado registro a nivel nacional sobre CCECyC, ya que si bien existen estudios en población mexicana, los datos generados se basan en diferentes centros de referencia.
Desde el punto de vista clínico, la importancia de la presencia de VPH en CCECyC se basa en la observación de un mejor pronóstico de los pacientes, por lo cual la detección molecular del VPH debe realizarse con métodos sensibles y específicos, que cuenten con aprobación diagnóstica. Actualmente, se cuenta con métodos validados, que van desde la simple identificación de VPH de alto o bajo riesgo (Hybrid Capture 2TM), hasta la detección y tipificación con método de hibridación reversa (Linear Array®, InnoLipa®). Dicha detección sería importante, ya que los pacientes negativos a VPH son considerados de alto riesgo debido a mal pronóstico, por lo que se consideraría el desarrollo de nuevos esquemas terapéuticos o combinaciones de los que ya existen.
Análisis moleculares y comportamiento clínico han dado evidencias de que el CCECyC es una entidad compleja. Avances en cuanto a análisis de tipo masivo o de alto rendimiento, han permitido identificar mutaciones, alteraciones cromosómicas y perfiles de expresión característicos de tumores infectados con VPH. La identificación de grupos de alteraciones o firmas moleculares, así como la definición de los mecanismos de progresión tumoral pueden facilitar la identificación de marcadores pronóstico, así como el diseño de terapias dirigidas al tratamiento de este tipo de neoplasia.
Correspondencia:
Dra. Isabel Alvarado-Cabrero.
Departamento de Patología, Hospital de Oncología, Centro Médico Nacional Siglo XXI, IMSS.
Av. Cuauhtémoc 330, Colonia Doctores.
C.P. 06700. México D.F., México.
Teléfono: 5627 6900, extensión 22733. Fax: (55) 5513 5395.
Correo electrónico: keme2.tijax12@gmail.com