El conocimiento de la resistencia antibiótica en una determinada área sanitaria es fundamental para aplicar adecuadamente la Política de Antibióticos. Se entiende como «Política de Antibióticos» el uso de unas normas de aplicación y consumo de los agentes antimicrobianos, así como de enseñanza y control continuos, para conseguir el tratamiento antibiótico más eficaz, más racional y menos costoso posible.
Hemos realizado un estudio sobre la susceptibilidad antimicrobiana durante el período comprendido entre los años 2000 y 2005 en el Área Sanitaria Oeste de Valladolid, correspondiente al Hospital Universitario Río Hortega, que comprende una población de aproximadamente 235.0000 habitantes.
Los microorganismos testados proceden de aislamientos de diferentes muestras de pacientes con procesos infecciosos, que se consideran los agentes causales. Se presentan aquellos aislados de forma más frecuente.
Los antibióticos testados fueron los adecuados que muestran, tanto in vitro como in vivo, una actividad aceptable frente a cada especie aislada. Se han tenido en cuenta los criterios de: eficacia clínica, prevalencia de la resistencia, menor posibilidad de hacer resistencia, indicaciones de uso clínico y ser de primera elección o de alternativa en un tratamiento. Los resultados se expresaron en porcentajes de susceptibilidad o sensibilidad a los antibióticos considerados.
En cuanto a los criterios de sensibilidad, se siguieron los difundidos por el National Committee on Clinical Laboratory Standards de Estados Unidos. La categoría sensible a un antibiótico dado implica que la infección originada por la bacteria aislada puede tratarse de forma adecuada con la posología habitual de dicho antibiótico. La categoría resistente implica que las bacterias aisladas no son inhibidas con la posología habitual de dicho antibiótico.
Los antibióticos tipo estudiados siguieron las líneas generales. Los antibióticos siguientes representaban a los de su grupo: ampicilina (derivados y a amoxicilina), amoxicilina-ácido clavulánico (ampi/sulbactam), cefalotina (cefazolina, cefaclor, cefradina, cefalexina, etc.), cefoxitina (cefmetazol), cefotaxime (cefatriaxona). Imipenem, meropenem, gentamicina (netilmicina, tobramicina), ciprofloxacino (ofloxacino), ofloxacino (levofloxacino). En Enterococcus: Genta-sinergia (gentamicina, tobramicina, netilmicina y amicacina). Estrepto-sinergia (estreptomicina).
Los resultados obtenidos en el estudio se han agruparon en actividades antibióticas diferentes:
- 1.
Actividad antibiótica frente a grampositivos: a) actividad antibiótica frente a Staphylococcus aureus; b) actividad antibiótica frente a Staphylococcus epidermidis; c) actividad antibiótica frente a Enteroccoccus faecalis; d) actividad antibiótica frente a Enterococcus faecium, y e) actividad antibiótica frente a Streptococcus agalactiae.
- 2.
Actividad antibiótica frente a gramnegativos: a) actividad antibiótica frente a Enterobacteriaceae; b) actividad antibiótica frente a Escherichia coli; c) actividad antibiótica frente a Klebsiella pneumoniae y Klebsiella oxitoca; d) actividad antibiótica frente a Enterobacter cloacae; e) actividad antibiótica frente a Serratia marcescens; f) actividad antibiótica frente a Proteus mirabilis, y g) actividad antibiótica frente a Morganella morganii.
- 3.
Actividad antibiótica frente a bacilos gramnegativos no fermentadores: a) actividad antibiótica frente a Pseudomonas aeruginosa; b) actividad antibiótica frente a Acinetobacter baumannii, y c) actividad antibiótica frente a Stenotrophomonas maltophilia.
- 4.
Actividad antibiótica frente a misceláneos: a) actividad antibiótica frente a Branhamella catarrhalis, y b) actividad antibiótica frente a Haemophilia influenzae.
Por tanto, aunque hay muchas bacterias resistentes a los antibióticos, hay ciertas cepas que causan frecuentemente infecciones y no pueden tratarse con antibióticos normales, por lo que es necesario cambiar los regímenes terapéuticos habituales. Estas bacterias suelen ser particularmente virulentas y causan infecciones serias.
Knowledge of the antibiotic resistance in a specific healthcare area is essential for suitable application of the antibiotic policy, which can be understood as the use of recommendations for the application and consumption of antimicrobial agents, as well as for education and continual surveillance to achieve the most effective, rational and least expensive antibiotic therapy possible.
We performed a study of antimicrobial susceptibility between 2000 and 2005 in the Health Area of the West of Valladolid (Spain) corresponding to the Rio Hortega University Hospital, with a catchment area of approximately 235,0000 inhabitants.
The microorganisms tested were obtained from isolates of distinct samples from patients with infectious processes. The agents were considered causal. The most frequently isolated agents were described.
The antibiotics tested were those that showed acceptable in vitro and in vivo activity against each isolated species. The criteria considered were clinical effectiveness, the prevalence of resistance, a low possibility of developing resistance, indications for clinical use and being the first treatment choice or alternative. The results were expressed in percentages of susceptibility or sensitivity to the antibiotics analyzed.
The sensitivity criteria of the National Committee on Clinical Laboratory Standards (USA) were followed. The category of SENSITIVE to a given antibiotic implies that the infection caused by the isolated bacterium can suitably be treated with the routine dosage of this antibiotic. The RESISTANT category implies that isolated bacteria are not inhibited with the routine dosage of this antibiotic.
The antibiotic types studied followed general lines and the following agents were taken as representative of their class: Ampicillin (ampicillin and amoxicillin derivatives), Amoxicillin/clavulanic acid(ampicillin/sulbactam), Cefalotin (cefazolin, cefaclor, cephradine, cefalexin, etc), Cefoxitin (cefmetazole), Cefotaxime (ceftriaxone, imipenem, meropenem), Gentamicin (netilmicin, tobramycin), Ciprofloxacin (ofloxacin), Ofloxacin (levofloxacin). In Enterococci: Gentamicin synergy (gentamicin, tobramycin, netilmicin and amikacin). Streptomycin synergy (streptomycin).
The results obtained in the study were grouped in different antibiotic activities:
- 1.
Antibiotic activity against Gram-positive bacteria: a. Antibiotic activity against to Staphylococcus aureus. b. Antibiotic activity against S epidermidis. c. Antibiotic activity against Enterococcus faecalis d. Antibiotic activity against E. faecium. e. Antibiotic activity against Streptococcus agalactiae.
- 2.
Antibiotic activity against Gram-negative bacteria. a. Antibiotic activity against Enterobacteriaceae. Antibiotic activity against Escherichia coli. Antibiotic activity against Klebsiella pneumoniae and K. oxytoca. Antibiotic activity against Enterobacter cloacae. Antibiotic activity against Serratia marcescens. Antibiotic activity against Proteus mirabilis. Antibiotic activity against Morganella morganii.
- 3.
Antibiotic activity against Non-fermenting Gram-negative bacilli (NFGNB). Antibiotic activity against Pseudomonas aeruginosa. Antibiotic activity against Acinetobacter baumannii. Antibiotic activity against Stenotrophomonas maltophilia.
- 4.
Antibiotic activity against miscellaneous microorganisms. a. Antibiotic activity against Branhamella catarrhalis. b. Antibiotic activity against Haemophilus influenzae.
Therefore, although many antibiotic-resistant bacteria exist, there are some strains that frequently cause infections and cannot be treated with common antibiotics. Consequently routinely-used therapeutic regimens should be changed. These bacteria are usually particularly virulent and cause serious infections.
Osasun-eremu jakin bateko erresistentzia antibiotikoa zenbaterainokoa den jakitea funtsekoa da antibiotiko-politika egokia bideratu ahal izateko. Antibiotiko-politika esapideak mikrobioen kontrako eragileak aplikatu eta kontsumitzeko arau jakin batzuk eta irakaskuntza eta kontrol iraunkorra erabiltzea esan nahi du, terapeutika antibiotiko eraginkorragoa, arrazionalagoa eta ahalik eta merkeena lortzeari begira.
Rio Hortega Unibertsitate Erietxeari dagokion Valladolid Ekialdeko Osasun Eremuan suszeptibilitate antimikrobianoari buruzko ikerketa bat egin dugu, 2000 eta 2005 bitarteko aldia kontuan hartuta; guztira, 235.000 biztanle biltzen ditu eremu horrek.
Testen bidez aztertutako mikroorganismoak prozesu infekziotsuak zituzten gaixoen laginetatik atera dira, agente kausalak kontuan hartuta. Sarrien isolatutakoak aurkeztu dira.
Testen bidez aztertutako antibiotikoak egokiak izan ziren, isolatutako espezie bakoitzari aurre egiteko jarduera onargarria izan zuten in vitro nahiz in vivo. Honako irizpide hauek hartu dira kontuan: eraginkortasun klinikoa, erresistentziaren prebalentzia, erresistentzia gauzatzeko aukera gutxiago, erabilera klinikorako jarraibideak, eta tratamenduan lehenetsitakoa edo aukerakoa izatea. Emaitzak adierazteko, aztertutako antibiotikoekiko suszeptibilitatearen edo sentiberatasunaren ehunekoak eman dira.
Sentiberatasun-irizpideei dagokienez, NCCLSk (AEB) zabaldutakoei jarraitu zaie. Antibiotiko jakin batekiko SENTIBERA kategoriak esan nahi du isolatutako bakterioak sorturiko infekzioa modu egokian tratatu daitekeela antibiotiko horren ohiko posologiarekin. ERRESISTENTEA kategoriak, berriz, esan nahi du isolatutako bakterioak inhibitzerik ez dagoela antibiotiko horren ohiko posologiarekin.
Aztertutako antibiotikoetan, ikuspegi orokorra hartu da kontuan, eta antibiotiko hauek erabili dira beren taldekoen erakusgarri: Anpizilina (eratorriak eta a amoxizilina), Amoxi/klabua (anpi/sulbaktama), Zefalotina (Zefazolina, zefaklorra, zefradina, zefalexina, etab.), Zefoxitina (zefmetazola), Zefotaximea (zefatriaxona).
Imipenema, meropenema), Gentamizina (netilmizina, tobramizina), Ziprofloxazinoa (ofloxazinoa), Ofloxazinoa (lebofloxazinoa). Enterokokoetan: Genta-sinergia (gentamizina, tobramizina, netilmizina eta amikazina). Estrepto-sinergia (estreptomizina).
Ikerketan lortutako emaitzak honako jarduera antibiotiko hauen arabera sailkatu dira:
- 1.
Grampositiboen kontrako jarduera antibiotikoa: a. S aureusen kontrako jarduera antibiotikoa. b. S epidermidisen kontrako jarduera antibiotikoa. c. Enteroccoccus faecalisen kontrako jarduera antibiotikoa. d. Enterococcus faeciumen kontrako jarduera antibiotikoa. e. S agalactiaeren kontrako jarduera antibiotikoa.
- 2.
Gramnegatiboen kontrako jarduera antibiotikoa. a. Enterobacteriaceaeren kontrako jarduera antibiotikoa. Escherichia coliren kontrako jarduera antibiotikoa. Klebsiella pneumoniae eta oxitoca espezieen kontrako jarduera antibiotikoa. Enterobacter cloacaeren kontrako jarduera antibiotikoa. Serratia marcescensiren kontrako jarduera antibiotikoa. Proteus mirabilisen kontrako jarduera antibiotikoa. Morganella morganiiren kontrako jarduera antibiotikoa.
- 3.
BGNNFren kontrako jarduera antibiotikoa (Bazilo Gramnegatibo Ez-hartzitzaileak). Pseudomonas aeruginosaren kontrako jarduera antibiotikoa. Acinetobacter baumanniiren kontrako jarduera antibiotikoa. Stenotrophomonas maltophiliaren kontrako jarduera antibiotikoa.
- 4.
Nahas-mahaseko bakterioen kontrako jarduera antibiotikoa. Branhamella catarrhalisen kontrako jarduera antibiotikoa. H influenzaeren kontrako jarduera antibiotikoa.
Hortaz, antibiotikoei erresistentzia dieten bakterio asko dauden arren, badira andui batzuk infekzioak sortu ohi dituztenak eta ezin trata daitezkeenak antibiotiko arruntekin, eta, beraz, ohiko erregimen terapeutikoak aldatzea eskatzen dutenak. Bakterio horiek bereziki indartsuak izaten dira, eta infekzio handiak eragiten dituzte.
La aparición de cepas bacterianas resistentes a antibióticos es un grave problema de salud pública, dado que los antibióticos son indispensables para el tratamiento de las infecciones. Así, la aparición de los antibióticos se considera uno de los mayores éxitos. Pero con el tiempo, las bacterias han desarrollado mecanismos para evitar su efecto, con lo que se dificulta el tratamiento de las infecciones y aumenta el riesgo de adquirirlas1–6.
Aunque la resistencia a antibióticos es un proceso natural de la bacteria, que trata de sobrevivir al efecto del antibiótico modificando su material genético, su velocidad de aparición se ha incrementado de forma sustancial en los últimos años, en paralelo al aumento del consumo de antibióticos. Por lo tanto, una correlación positiva entre el consumo de antibióticos y la aparición de resistencias7–11.
Las resistencias afectan a toda la población, ya que la bacteria se hace insensible al tratamiento de uno o varios antibióticos, independientemente de si el paciente infectado haya tomado en algún momento estos antibióticos. Por tanto, un uso irresponsable de los antibióticos hará que no se puedan beneficiar de ellos los pacientes que los requieran12,13. En España, en niños menores de 14 años se han detectado importantes resistencias a fluoroquinolonas, aunque este grupo de antibióticos no suele utilizarse para tratar las infecciones en este colectivo14–18.
Las infecciones causadas por bacterias resistentes no responden al tratamiento, prolongan el proceso infeccioso y, por tanto, la probabilidad de contagio y de aparición de complicaciones19–21. La velocidad de aparición de resistencias es mayor que la aparición de nuevos antibióticos, por lo que no es descabellado imaginar que pueda alcanzarse la situación en la que no se disponga de ningún antibiótico para el tratamiento de algunas infecciones bacterianas22–27.
España se encuentra entre los países europeos con un consumo mayor de antibióticos y, como consecuencia, con un porcentaje mayor de cepas bacterianas resistentes20,28–30. Por ejemplo, un tercio de las cepas de Streptococcus pneumoniae, causante de la aparición de neumonías, son resistentes a penicilina, el 30% de las cepas de estafilococos son resistentes a oxiciclina y el 60% de las cepas invasivas de Escherichia coli, causante de muchas de las infecciones urinarias, son resistentes a la ampilicina31–38.
Más de un 85% del consumo de antibióticos es extrahospitalario, y de éste una gran parte lo ocupa el tratamiento de las infecciones respiratorias tanto en niños como en adultos, que en la mayoría de los casos no requieren tratamiento antibiótico al tratarse de procesos víricos39–43.
ObjetivosEl conocimiento de la resistencia antibiótica en una determinada área sanitaria es fundamental para aplicar adecuadamente la Política de Antibióticos. Se entiende como «Política de Antibióticos» el uso de unas normas de aplicación y consumo de los agentes antimicrobianos, así como de enseñanza y control continuos, para conseguir el tratamiento antibiótico más eficaz, más racional y menos costoso posible.
Hemos realizado un estudio sobre la susceptibilidad antimicrobiana durante el período comprendido entre los años 2000 y 2005.
Material y métodosEl estudio se ha realizado en el Área Sanitaria Oeste de Valladolid, correspondiente al Hospital Universitario Río Hortega, que comprende un área de población protegida de unos 235.000 habitantes. Hemos estudiado todas las muestras que se han recibido en la Sección de Microbiología de este hospital entre los años 2000 y 2005, ambos incluidos.
Bacterias estudiadasLos microorganismos testados proceden de aislamientos de diferentes muestras de pacientes con procesos infecciosos, que se consideran los agentes causales. Se presentan aquellos aislados de forma más frecuente.
Antibióticos testadosSon los antibióticos adecuados que muestran, tanto in vitro como in vivo, una actividad aceptable frente a cada especie aislada. Se han tenido en cuenta los criterios siguientes: eficacia clínica, prevalencia de la resistencia, menor posibilidad de hacer resistencia, indicaciones de uso clínico y ser de primera elección o de alternativa en un tratamiento.
ResultadosSe expresan en porcentajes de susceptibilidad o sensibilidad a los antibióticos considerados.
Criterios de sensibilidadSe siguen los difundidos por el National Committee on Clinical Laboratory Standards de Estados Unidos en su documento M100-S16, volumen 26, número 3 de enero de 2006. La categoría sensible o susceptible a un antibiótico dado implica que la infección originada por la bacteria aislada puede tratarse de forma adecuada con la posología habitual de dicho antibiótico. La categoría resistente implica que las bacterias aisladas no son inhibidas con la posología habitual de dicho antibiótico.
Antibióticos tipoEn líneas generales, en la tabla 1 se indican los antibióticos que representan a los de su grupo.
Antibióticos tipo
| Antibiótico | Representa a: |
| Ampicilina | Derivados y a amoxicilina |
| Amoxicilina-ácido clavulánico | Ampi/sulbactam |
| Cefalotina | Cefazolina, cefaclor, cefradina, cefalexina, etc. |
| Cefoxitina | Cefmetazol |
| Cefotaxima | Cefatriaxona |
| Imipenem | Meropenem |
| Gentamicina | Netilmicina (tobramicina) |
| Ciprofloxacino | Ofloxacino |
| Ofloxacino | Levofloxacino |
| En Enterococcus: | |
| Genta-sin | Gentamicina, tobramicina, netilmicina y amicacina |
| Estrepto-sin | Estreptomicina |
Estrepto-sin: estreptomicina sinergia; Genta-sin: gentamicina sinergia.
Véase la tabla 2.
Abreviaturas
| Abreviatura | Significado |
| NCCLS (EE.UU.) | Comisión Nacional para el Control de la Normalización de los Laboratorios. Actualmente CLSI (Instituto para la normalización clínica y los laboratorios) |
| SAMR, SARM, MRSA | Staphylococcus aureus resistentes a meticilina. También se extrapola a cloxacilina |
| SEMR, SERM, MRSE | Staphylococcus epidermidis resistentes a meticilina. También se extrapola a cloxacilina |
| CMI | Concentración mínima inhibitoria. Es la mínima concentración de un determinado antibiótico que inhibe el desarrollo de un microorganismo |
| Strep-sin | «positiva». Significa que la resistencia de Enterococcus a estreptomicina es de nivel bajo, y se observa un efecto sinérgico entre estreptomicina y los betalactámicos o vancomicina |
| Strep-sin | «negativa». Significa que la resistencia de Enterococcus a estreptomicina es de nivel alto (RAN-estr), sin que se observe un efecto sinérgico entre estreptomicina y los betalactámicos o vancomicina |
| Genta-sin | «positiva». Significa que la resistencia de Enterococcus a gentamicina es de nivel bajo, y se observa un efecto sinérgico entre gentamicina, netilmicina, tobramicina o amicacina y los antibióticos betalactámicos o vancomicina |
| Genta-sin | «negativa». Significa que la resistencia de Enterococcus a gentamicina es de nivel alto (RAN-genta), sin que se observe un efecto sinérgico entre gentamicina, netilmicina, tobramicina o amicacina y los antibióticos betalactámicos o vancomicina |
| Microbiología tiene que informar del comportamiento de Enterococcus especialmente en infecciones sistémicas y en endocarditis | |
| Streptococcus grupo A | Streptococcus pyogenes |
| Streptococcus grupo B | Streptococcus agalactiae |
| Betalactamasa (en Haemophilus influenzae) | Porcentaje de cepas de H. influenzae que presentan este enzima inactivante de determinados antibióticos betalactámicos. Serán sensibles a la acción de betalactámicos con inhibidores de betalactamasas |
| Resistencia cromosómica (en H. influenzae) | Porcentaje de cepas de H. influenzae resistentes a betalactámicos por mecanismos no enzimáticos. No serán sensibles a la acción de betalactámicos con inhibidores de betalactamasas |
| BLEA | Betalactamasas de espectro ampliado. Enzimas que pueden estar presentes en determinadas bacterias gramnegativas y que inactivan a las cefalosporinas de tercera generación. Se expresa en porcentajes. En el antibiograma figura en caso de positividad |
| RAN | Resistencia de alto nivel que se presenta en Enterococcus |
| I. A Aminoglucósidos. Si es frente a estreptomicina (RAN-E positiva), significa que no se observará efecto sinérgico en asociación con betalactámicos o vancomicina. Frente a gentamicina (RAN-G positiva), significa que no se observará efecto sinérgico de gentamicina, netilmicina, tobramicina, amicacina en asociación con betalactámicos o vancomicina | |
| II. A Vancomicina |
RAN: resistencia a alto nivel.
Staphylococcus aureus y Staphylococcus epidermidis que son resistentes a oxacilina (SAMR o SEMR) deben considerarse asimismo resistentes a otros betalactámicos, así como a cefamicinas (cefoxitina), amoxicilina-ácido clavulánico, ampi/sulbactam, piperacilina/tazobactam e imipenem. Las resistencias pueden ampliarse a los aminoglucósidos (gentamicina, netilmicina, etc.), quinolonas, macrólidos, clindamicina y tetraciclinas. Es importante realizar las pruebas de susceptibilidad.
EnterococcusPor no ser eficaces clínicamente, no se testan las cefalosporinas, aminoglucósidos, clindamicina y trimeto-sulfa.
Las cepas no productoras de betalactamasas, que son sensibles a penicilina y ampicilina, también serán sensibles a amoxicilina y a combinaciones con inhibidores de betalactamasas. Las cepas no productoras de betalactamasas y resistentes a penicilina o a ampicilina (concentración mínima inhibitoria > 16μg/ml), también serán resistentes a ureidopenicilinas y a carbapenemes. Las productoras de betalactamasas serán resistentes a penicilina, ampicilina y ureidopenicilinas, pero sensibles a carbapenemes y a combinaciones con inhibidores de betalactamasas.
Frente a las infecciones sistémicas por Enterococcus (endocarditis), no son eficaces ni los antibióticos que actúan a nivel de la pared bacteriana (betalactámicos, vancomicina), ni los aminoglucósidos si se utilizan de forma individual. Lo correcto es asociar penicilina, ampicilina o vancomicina a un aminoglucósido (gentamicina, estreptomicina, etc.), ya que se consigue una acción sinérgica bactericida. Sin embargo, aparecen con frecuencia cepas de Enterococcus con resistencia de alto nivel (RAN) a aminoglucósidos, sin que se produzca efecto sinérgico. En la información del antibiograma que facilita el Laboratorio de Microbiología, figurará siempre frente a Enterococcus el dato de Estrep-sin (efecto sinérgico con estreptomicina) y de Genta-sin (efecto sinérgico con gentamicina).
Streptococcus pneumoniaeAquellos sensibles a penicilina pueden considerarse sensibles asimismo a ampicilina, amoxicilina, amoxicilina-ácico clavulánico, ampi/sulbactam, cefaclor, cefixima, cefepime, cefatriaxona, cefotaxima, cefuroxima, imipenem y meropenem.
Streptococcus betahemolítico grupos A y BComentario similar al expuesto para S. pneumoniae.
ResultadosLos resultados obtenidos en el estudio se han agrupado en diferentes actividades antibióticas: a) actividad antibiótica frente a grampositivos; b) actividad antibiótica frente a gramnegativos; c) actividad antibiótica frente a bacilos gramnegativos no fermentadores (BGNNF), y d) actividad antibiótica frente a misceláneos. Y cada una de ellas se dividida en otros subgrupos.
- 1.
Actividad antibiótica frente a grampositivos
- a.
Actividad antibiótica frente a Staphylococcus aureus aparece recogida en la tabla 3.
Tabla 3.Estudio de la actividad antibiótica frente a Staphylococcus aureus
Año 2000 2001 2002 2003 2004 2005 N.° de cepas 678 400 542 561 586 629 Antibiótico Penicilina 7 12 8 7 8 7 Cloxacilina 66 75 66 70 67 64 Amoxicilina-ácido clavulánico 66 75 66 70 67 64 Gentamicina 82 91 88 96 96 95 Trimeto-sulfa 94 99 99 99 99 99 Ofloxacino 73 63 70 82 Levofloxacino 65 62 Fosfomicina 80 90 95 94 Clindamicina 81 89 85 91 92 88 Eritromicina 57 69 63 72 64 61 Linezolid 100 100 Quinu-dalf 100 100 Rifampicina 98 98 99 99 99 99 Tetraciclina 89 92 93 94 97 95 Teicoplanina 99 100 100 100 100 100 Vancomicina 100 100 100 100 100 100 SARM 34 25 34 30 33 36 beta-lasa 93 88 92 93 92 93 SARM: Staphylococcus aureus resistentes a meticilina.
- b.
Actividad antibiótica frente a Staphylococcus epidermidis (tabla 4).
Tabla 4.Actividad antibiótica frente a Staphylococcus epidermidis
Año 2000 2001 2002 2003 2004 2005 N.° de cepas 199 170 165 163 181 212 Antibiótico Penicilina 2 3 3 2 2 4 Cloxacilina 32 35 30 33 37 24 Amoxicilina-ácido clavulánico 32 35 30 33 37 24 Gentamicina 53 63 56 59 61 67 Trimeto-sulfa 75 78 81 79 75 79 Ofloxacino 52 45 56 67 Levofloxacino 52 44 Fosfomicina 76 71 74 63 Clindamicina 60 58 55 56 59 60 Eritromicina 33 31 28 31 36 29 Linezolid 100 100 Quinu-dalfo 99 100 Rifampicina 93 95 95 98 88 93 Tetraciclina 64 72 76 74 73 73 Teicoplanina 81 93 92 96 82 89 Vancomicina 100 100 100 99 99 98 SEMR 68 65 70 67 63 76 beta-lasa 98 97 97 98 98 96 SEMR: Staphylococcus epidermidis resistentes a meticilina.
- c.
Actividad antibiótica frente a Enteroccoccus faecalis (tabla 5).
Tabla 5.Actividad antibiótica frente a Enterococcus faecalis
Año 2000 2001 2002 2003 2004 2005 N.° de cepas 283 179 247 234 220 309 Antibiótico Penicilina 79 98 99 97 96 97 Ampicilina 99 99 99 100 100 100 Ampicilina-sulbac 100 Imipenem 98 99 99 100 98 100 Eritromicina 22 25 29 17 22 Quinu-dalfo 1 2 2 1 0 Tetraciclina 26 22 32 32 23 Ciprofloxacino 64 67 71 66 71 Ofloxacino 48 60 61 60 Levofloxacino 68 68 73 73 74 Moxifloxacino 75 Trimeto-sulfa 10 2 2 1 Estrep-sin 54 58 49 60 54 54 Genta-sin 65 75 72 70 71 76 Linezolid 100 Teicoplanina 99 100 100 100 100 99 Vancomicina 97 100 100 100 100 99 RAN a E 46 42 51 40 46 46 RAN a G 35 25 28 30 29 24 RAN a E: resistencia de nivel alto que se presenta en Enterococcus.
- d.
Actividad antibiótica frente a Enterococcus faecium (tabla 6).
Tabla 6.Actividad antibiótica frente a Enterococcus faecium
Año 2000 2001 2002 2003 2004 2005 N.° de cepas 26 8 23 28 32 41 Antibiótico Penicilina 35 50 15 22 30 17 Ampicilina 46 67 20 26 30 29 Imipenem 67 20 26 30 29 Eritromicina 0 9 10 6 10 Quinu-dalfo 17 5 26 41 60 Tetraciclina 50 83 76 69 76 Ciprofloxacino 50 9 24 19 12 Ofloxacino 33 5 9 10 Levofloxacino 50 10 35 26 14 Moxifloxacino 11 Trimeto-sulfa 0 0 12 3 5 Fosfomicina 4 100 80 80 Linezolid 97 Teicoplanina 100 88 100 97 100 98 Vancomicina 81 88 100 100 100 100 Estrep-sin 54 67 25 30 33 29 Genta-sin 96 83 95 87 81 71 RAN a E 46 33 75 70 67 71 RAN a G 4 17 5 13 19 29 RAN a E: resistencia de nivel alto que se presenta en Enterococcus.
- e.
Actividad antibiótica frente a Streptococcus agalactiae (tabla 7).
Tabla 7.Actividad antibiótica frente a Staphylococcus agalactiae
Año 2000 2001 2002 2003 2004 2005 Semestre N.° de cepas 291 257 411 430 382 364 Antibiótico Penicilina 95 99 99 99 100 100 Ampicilina 96 100 100 100 100 100 Imipenem 100 100 100 100 100 100 Cefuroxima 98 99 97 96 98 99 Clindamicina 86 89 83 75 77 85 Eritromicina 80 81 80 73 73 80 Qinu-dalfo 99 92 91 95 98 Fosfomicina 76 85 100 100 100 Ofloxacino 99 86 90 91 88 Levofloxacino 100 99 99 99 99 Trimeto-sulfa 98 93 98 99 99 Teicoplanina 100 100 100 100 100 100 Vancomicina 100 100 100 100 100 100 Linezolid 100
- a.
- 2.
Actividad antibiótica frente a gramnegativos
- a.
Actividad antibiótica frente a Enterobacteriaceae.
- 1.
Actividad antibiótica frente a Escherichia coli (tabla 8).
Tabla 8.Actividad antibiótica frente a Escherichia coli
Año 2000 2001 2002 2003 2004 2005 N.° de cepas 2020 1555 2069 2101 2242 2450 Antibiótico Ampicilina 48 44 40 40 40 36 Amoxicilina-ácido clavulánico 69 87 87 87 86 84 Imipenem 100 100 100 100 100 100 Meropenem 100 100 100 100 100 100 Ertapenem 100 Piperacilina 50 61 54 56 51 49 Piperacilina- tazobactam 99 99 99 97 97 Cefalotina 38 54 88 50 47 40 Cefoxitina 91 92 93 91 92 92 Cefuroxima 81 86 76 84 80 Cefotaxima 98 97 96 96 94 91 Cefepima 93 97 96 96 94 91 Ceftazidima 97 96 96 94 91 Gentamicina 93 94 93 93 91 90 Tobramicina 95 95 94 91 88 Amicacina 100 100 100 100 100 100 Ciprofloxacino 82 82 80 75 72 68 Ofloxacino 82 85 75 72 67 Norfloxacino 81 75 72 68 Fosfomicina 97 Trimeto-sulfa 70 73 71 70 69 66 BLEA 6 BLEA: betalactamasas de espectro ampliado.
- 2.
Actividad antibiótica frente a Klebsiella pneumoniae y Klebsiella oxitoca (tabla 9).
Tabla 9.Actividad antibiótica frente a Klebsiella pneumoniae y oxitoca
K. pneumoniae K. oxytoca Año 2000 2001 2002 2003 2004 2005 2000 2001 2002 2003 2004 2005 N.° de cepas 120 100 134 153 182 228 82 60 69 63 89 70 Antibiótico Ampicilina 14 0 0 0 0 0 0 0 0 0 0 0 Amoxicilina-ácido clavulánico 78 98 95 96 93 87 66 86 87 88 86 92 Imipenem 100 100 100 100 100 100 100 100 100 100 100 100 Meropenem 100 100 100 100 100 100 100 100 100 100 Ertapenem 100 100 Piperacilina 1 0 1 0 0 0 0 2 0 0 Piperacilina- tazobactam 100 97 98 96 85 90 94 87 85 96 Cefalotina 76 93 92 92 90 80 49 78 82 82 81 88 Cefuroxima 95 91 93 90 87 73 87 83 81 86 Cefoxitina 88 96 96 95 95 92 78 100 100 96 94 100 Cefotaxima 98 100 99 100 95 95 94 98 99 100 99 100 Cefepima 94 100 99 100 96 95 85 98 99 100 99 100 Ceftazidima 100 99 99 96 95 98 99 100 99 100 Gentamicina 97 97 99 99 97 99 98 100 100 98 96 99 Tobramicina 98 100 99 97 100 100 100 100 97 99 Amicacina 100 100 100 100 100 100 100 100 100 100 100 100 Ciprofloxacino 92 88 93 96 94 92 98 88 96 87 85 94 Ofloxacino 87 95 97 93 92 92 97 88 89 93 Norfloxacino 94 97 95 92 99 94 96 94 Fosfomicina 71 63 Trimeto-sulfa 95 94 99 98 94 95 92 85 96 95 94 99 BLEA 2 19 BLEA: betalactamasas de espectro ampliado.
- 3.
Actividad antibiótica frente a Enterobacter cloacae (tabla 10).
Tabla 10.Actividad antibiótica frente a Enterobacter cloacae
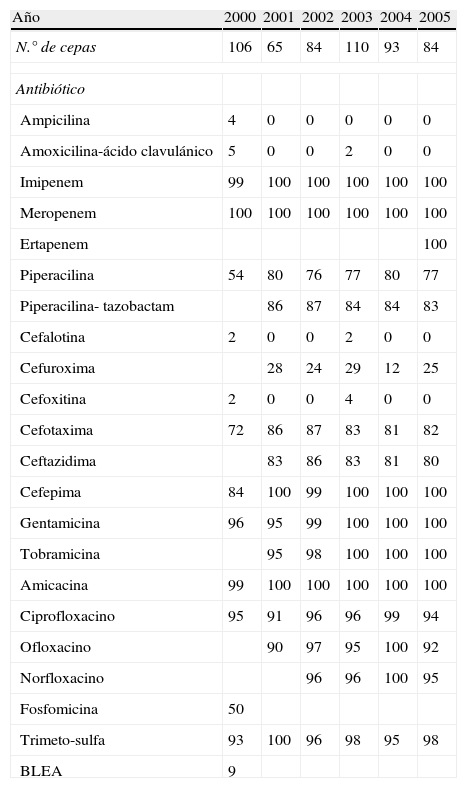
Año 2000 2001 2002 2003 2004 2005 N.° de cepas 106 65 84 110 93 84 Antibiótico Ampicilina 4 0 0 0 0 0 Amoxicilina-ácido clavulánico 5 0 0 2 0 0 Imipenem 99 100 100 100 100 100 Meropenem 100 100 100 100 100 100 Ertapenem 100 Piperacilina 54 80 76 77 80 77 Piperacilina- tazobactam 86 87 84 84 83 Cefalotina 2 0 0 2 0 0 Cefuroxima 28 24 29 12 25 Cefoxitina 2 0 0 4 0 0 Cefotaxima 72 86 87 83 81 82 Ceftazidima 83 86 83 81 80 Cefepima 84 100 99 100 100 100 Gentamicina 96 95 99 100 100 100 Tobramicina 95 98 100 100 100 Amicacina 99 100 100 100 100 100 Ciprofloxacino 95 91 96 96 99 94 Ofloxacino 90 97 95 100 92 Norfloxacino 96 96 100 95 Fosfomicina 50 Trimeto-sulfa 93 100 96 98 95 98 BLEA 9 BLEA: betalactamasas de espectro ampliado.
- 4.
Actividad antibiótica frente a Serratia marcescens (tabla 11).
Tabla 11.Actividad antibiótica frente a Serratia marcescens
Año 2000 2001 2002 2003 2004 2005 N.° de cepas 25 17 36 21 25 23 Antibiótico Ampicilina 6 6 33 0 0 0 Amoxicilina-ácido clavulánico 9 8 43 0 0 0 Imipenem 100 100 97 100 100 100 Meropenem 100 100 97 100 100 100 Ertapenem 100 Piperacilina 71 100 92 100 100 100 Piperacilina-tazobactam 100 92 100 100 100 Cefalotina 0 0 0 0 0 0 Cefuroxima 0 0 0 0 0 0 Cefoxitina 53 38 57 40 43 33 Cefotaxima 77 100 94 100 100 100 Ceftazidima 100 92 100 100 100 Cefepima 95 94 97 100 100 100 Gentamicina 100 100 100 100 100 100 Tobramicina 82 86 86 88 87 Amicacina 100 100 100 100 100 100 Ciprofloxacino 96 76 94 81 96 96 Ofloxacino 69 86 90 86 100 Norfloxacino 87 97 86 96 96 Fosfomicina 77 Trimeto-sulfa 96 100 100 100 100 100 BLEA 0 BLEA: betalactamasas de espectro ampliado.
- 5.
Actividad antibiótica frente a Proteus mirabilis (tabla 12).
Tabla 12.Actividad antibiótica frente a Proteus mirabilis
Año 2000 2001 2002 2003 2004 2005 N.° de cepas 200 118 194 232 181 183 Antibiótico Ampicilina 54 67 60 66 51 56 Amoxicilina-ácido clavulánico 90 98 97 95 97 96 Imipenem 100 100 100 100 83 100 Meropenem 100 100 100 100 100 100 Ertapenem 100 Piperacilina 52 90 89 91 84 90 Piperacilina-tazobactam 100 100 100 99 100 Cefalotina 62 93 91 92 90 90 Cefoxitina 99 98 97 97 97 99 Cefuroxima 98 98 97 98 98 Cefotaxima 99 100 100 100 100 100 Ceftazidima 100 100 100 100 100 Cefepima 94 100 100 100 100 100 Gentamicina 90 90 88 89 87 90 Tobramicina 98 90 91 90 94 Amicacina 99 100 100 100 99 99 Ciprofloxacino 93 92 88 82 76 81 Ofloxacino 93 91 87 78 80 Norfloxacino 97 97 94 94 Fosfomicina 79 Trimeto-sulfa 54 64 65 68 64 67 BLEA 0 BLEA: betalactamasas de espectro ampliado.
- 6.
Actividad antibiótica frente a Morganella morganii (tabla 13).
Tabla 13.Actividad antibiótica frente a Morganella morganii
Año 2000 2001 2002 2003 2004 2005 N.° de cepas 39 22 39 28 37 23 Antibiótico Ampicilina 5 0 0 0 5 0 Amoxicilina-ácido clavulánico 3 0 0 0 9 0 Imipenem 100 100 100 100 100 100 Meropenem 100 100 100 100 100 100 Ertapenem 100 Piperacilina 47 86 77 82 84 83 Piperacilina-tazobactam 100 100 96 100 96 Cefalotina 0 0 0 0 0 0 Cefoxitina 60 75 49 38 37 38 Cefuroxima 0 0 0 5 0 Cefotaxima 86 85 93 92 96 Ceftazidima 82 82 93 92 87 Cefepima 100 100 100 100 100 100 Gentamicina 87 95 79 86 89 78 Tobramicina 100 92 89 89 87 Amicacina 100 100 100 100 100 100 Ciprofloxacino 95 95 79 75 68 74 Ofloxacino 95 86 73 66 76 Norfloxacino 90 93 84 87 Fosfomicina 8 Trimeto-sulfa 72 86 69 54 65 78 BLEA 0 BLEA: betalactamasas de espectro ampliado.
- 1.
- a.
- 3.
Actividad antibiótica frente a BGNNF
- a.
Actividad antibiótica frente a Pseudomonas aeruginosa (tabla 14).
Tabla 14.Actividad antibiótica frente a Pseudomonas aeruginosa
Año 2000 2001 2002 2003 2004 2005 N.° de cepas 375 257 368 378 423 333 Antibiótico Ampi-sulbactam 3 2 1 1 1 2 Imipenem 85 89 87 87 80 83 Meropenem 92 92 90 90 85 91 Piperacilina 91 92 88 89 91 92 Piperacilina-tazobactam 91 98 90 93 95 95 Ceftazidima 86 84 82 78 72 80 Cefepima 79 87 85 84 83 88 Gentamicina 74 75 75 75 72 74 Tobramicina 89 87 88 85 78 80 Amicacina 91 93 95 73 Ciprofloxacino 71 70 59 65 62 60 Levofloxacino 71 60 68 63 62 Trimeto-sulfa 5 2 2 1 0 2 - b.
Actividad antibiótica frente a Acinetobacter baumannii (tabla 15).
Tabla 15.Actividad antibiótica frente a Acinetobacter baumannii
Año 2000 2001 2002 2003 2004 2005 N.° de cepas 111 180 185 199 127 114 Antibiótico Ampi-sulbactam 4 47 82 60 80 43 Imipenem 26 52 97 63 58 80 Meropenem 34 82 99 78 61 78 Piperacilina 4 6 6 13 12 12 Piperacilina-tazobactam 4 39 61 43 34 48 Cefotaxima 2 3 3 5 4 1 Ceftazidima 5 4 5 10 13 17 Cefepima 10 9 10 14 19 28 Gentamicina 5 8 10 20 46 24 Tobramicina 21 22 25 42 59 76 Amicacina 19 87 88 95 65 Ciprofloxacino 10 4 6 11 9 15 Levofloxacino 5 6 11 13 33 Trimeto-sulfa 14 18 24 41 58 70 - c.
Actividad antibiótica frente a Stenotrophomonas maltophilia (tabla 16).
Tabla 16.Actividad antibiótica frente a Stenotrophomonas maltophilia
Año 2000 2001 2002 2003 2004 2005 N.° de cepas 9 19 29 22 28 22 Antibiótico Ampi-sulbactam 33 14 5 13 5 12 Imipenem 11 0 0 0 0 0 Meropenem 44 32 10 14 15 11 Piperacilina 67 6 17 14 15 21 Piperacilina-tazobactam 83 68 77 52 89 Cefotaxima 0 0 0 0 0 6 Ceftazidima 44 74 54 55 52 78 Cefepima 33 26 17 36 37 42 Gentamicina 22 21 17 23 33 32 Tobramicina 56 26 14 41 59 39 Ciprofloxacino 33 37 34 64 42 58 Trimeto-sulfa 95 97 97 95
- a.
- 4.
Actividad antibiótica frente a misceláneos
- a.
Actividad antibiótica frente a Branhamella catarrhalis (tabla 17).
Tabla 17.Actividad antibiótica frente a Branhamella catarrhalis
Año 2001 2002 2003 2004 2005 N.° de cepas 20 24 25 20 20 Antibióticos Ampìcilina 11 33 24 32 25 Amoxicilina-ácido clavulánico 100 100 100 100 100 Cefuroxima 100 100 100 100 100 Ceftriaxona 100 100 100 100 100 Ciprofloxacino 100 100 100 100 100 Beta-lasa 89 67 76 68 75 - b.
Actividad antibiótica frente a Haemophilus influenzae.
- a.
- 5.
Actividad antibiótica frente a gramnegativos
- a.
Actividad antibiótica frente a Enterobacteriaceae.
- 1.
Actividad antibiótica frente a Escherichia coli (tabla 8).
- 2.
Actividad antibiótica frente a Klebsiella pneumoniae y Klebsiella oxitoca (tabla 9).
- 3.
Actividad antibiótica frente a Enterobacter cloacae (tabla 10).
- 4.
Actividad antibiótica frente a Serratia marcescens (tabla 11).
- 5.
Actividad antibiótica frente a Proteus mirabilis (tabla 12).
- 6.
Actividad antibiótica frente a Morganella morganii (tabla 13).
- 1.
- a.
- 6.
Actividad antibiótica frente a BGNNF
- 7.
Actividad antibiótica frente a misceláneos
- a.
Actividad antibiótica frente a Branhamella catarrhalis (tabla 17).
- b.
Actividad antibiótica frente a Haemophilus influenzae (tabla 18).
Tabla 18.Actividad antibiótica frente a Haemophilus influenzae
Año 2000 2001 2002 2003 2004 2005 N.° de cepas 229 58 101 112 82 70 Antibiótico Ampicilina 80 84 86 81 79 82 Amoxicilina-ácido clavulánico 98 100 100 99 100 99 Cefuroxima 98 100 100 100 100 100 Cefatriaxona 100 100 100 100 100 100 Ciprofloxacino 100 98 100 100 99 100 Beta-lasa 18 16 14 18 21 17 Res. cromosómica 2 0 0 1 0 1
- a.
Hoy se sabe que los antibióticos están perdiendo rápidamente su eficacia. Debido a su uso excesivo y a su mala utilización, las bacterias son cada vez más resistentes a muchos de los antibióticos para tratar graves infecciones en los hospitales3,4,14,20. Aunque hay bacterias resistentes a los antibióticos, hay ciertas cepas que causan frecuentemente infecciones y no pueden tratarse con antibióticos normales, por lo que es necesario cambiar los regímenes habituales. Estas bacterias suelen ser particularmente virulentas y causan serias infecciones. Los fenotipos de resistencia atípicos sólo pueden detectarse a través de ensayos de susceptibilidad antibiótica. A menudo, la alternativa a los antibióticos es menos eficaz o incluso tóxica para el paciente, y el resultado clínico, malo10,13,20.
Los resultados de las pruebas de susceptibilidad antimicrobiana se basan en interpretaciones fenotípicas de laboratorio y el microorganismo es informado como susceptible o resistente a un antibiótico determinado.
En los últimos años, el conocimiento de los mecanismos moleculares de resistencia a antibióticos se ha extendido inmensamente. La disponibilidad de un número mayor de antimicrobianos ha permitido una mejor individualización de problemas clínicos específicos. También, los avances en los procesos bioquímicos y genéticos de los determinantes de resistencia hacen que podamos interpretar y predecir el éxito de un tratamiento específico en diversas circunstancias3,10,20,39. El uso de técnicas de biología molecular en el seguimiento de aislamientos bacterianos resistentes nos indica que el problema de resistencia en muchos casos se debe a la expansión clonal de ciertas cepas en un nicho biológico determinado. Así, los antibióticos betalactámicos son los compuestos más utilizados en la comunidad y en el medio hospitalario37,39,43.
A la hora de evaluar los resultados obtenidos, es conveniente tener en cuenta las consideraciones siguientes, que son: a) el número de cepas testadas cada año es representativo para obtener conclusiones válidas; b) los datos se han extraído de un sistema automático de susceptibildad en un período de 6 años, durante los cuales se han producido cambios en el panel de antibióticos testados, así como, en ciertos casos, en el punto de corte de la categoría sensible, y c) los resultados expresan porcentajes de sensibilidad de la bacterias a los antibióticos, obviando las categorías intermedias y resistentes.
Respecto a la resistencia a meticilina (o cloxacilina), esta oscila en S. aureus entre el 25 y el 36% y en S. epidermidis entre el 63 y el 76%. Estos son resultados similares a los descritos por otros autores7,36,44 sin observar resistencias a vancomicina. Similares niveles de resistencia se revelan en las quinolonas fluoradas y en los macrólidos. Linezolid, quinu-dalfo, cotrimoxazol, rifampicina, fosfomicina, gentamicina y las lincosamidas muestran buena actividad frente a S. aureus. En S. epidermidis, la multirresistencia es frecuente y afecta a gentamicina (67% de cepas sensibles), a las quinolonas y al grupo MLS. Se observa una pérdida progresiva de sensibilidad a vancomicina. Linezolid y quinu-dalfo mantienen su actividad frente al 100% de las cepas ensayadas.
La ampicilina y derivados muestran una actividad alta frente a E. faecalis, al igual que los glucopéptidos y el linezolid. La resistencia de alto nivel a gentamicina osciló entre el 24 y el 35%. E. faecium, aunque no muy frecuente, presenta una resistencia elevada, con cepas resistentes a glucopéptidos, que puede ser achacable, en parte, a una identificación incorrecta45. S. agalactiae se muestra muy sensible a los antibióticos ensayados, y el grupo MLS es el menos activo.
Por tanto, los betalactámicos siguen siendo todavía una alternativa terapéutica en el tratamiento de infecciones, tanto adquiridas en la comunidad, como en el medio hospitalario. Además, la disponibilidad de un gran número de ellos hace que hayan diferentes alternativas, aunque su resistencia ha producido una limitación notable en la efectividad de su uso46.
Al igual que otros autores47,48, se observa una disminución de la sensibilidad a las quinolonas, no solamente en E. coli, sino también en Proteus y en Morganella. No obstante, su actividad se mantiene en el resto de las enterobacterias testadas (Klebsiella, Enterobacter y Serratia). Por otra parte, se detectó mediante sistemas automatizados BLEA durante el año 2000, y se observó una incidencia del 6, el 2, el 19 y el 9% en E. coli, K. pneumoniae, K. oxytoca y E. cloacae, respectivamente. En las restantes especies no se observó ninguna BLEA. Como otros estudios3,5–47 muestran, la presencia de estas cepas es cada vez más alta, sabiendo que, desde el punto de vista terapéutico, representan un grave problema a la hora de abordar un tratamiento idóneo. Los carbapenemes (imipenem, meropenem y ertapenem) se muestran muy activos, al igual que los aminoglucósidos, aunque gentamicina presenta una actividad del 90, el 90 y el 78% frente a E. coli, P. mirabilis y M. morganii, respectivamente.
Las cefalosporinas de la tercera y cuarta generación presentan un comportamiento similar, aunque cefotaxima solamente abarca al 91% de las cepas de E .coli, al 82% de E. cloacae y al 96% de M. morganii. La piperacilina (tazobactam) muestra buena actividad, superior a piperacilina, como es natural, mantenida en el tiempo. Por último, un antibiótico digno de atención es cotrimoxazol, el cual, después de haber salido al mercado terapéutico en la década de 1970, mantiene intactas muchas de sus prestaciones iniciales, y sirve como antibiótico de elección o de alternativa en muchos procesos infecciosos donde se asienten tanto bacterias grampositivas como negativas. La fosfomicina, por sus propiedades farmacocinéticas y de tolerancia, también debería figurar entre los recursos terapéuticos. Su no inclusión en los sistemas automatizados merma estas posibilidades.
Los BGNNF representan un grave problema terapéutico en todos los procesos infecciosos en los que se ven involucrados. Frente a P. aeruginosa, los carbapenemes muestran resultados similares a los de otros estudios multicéntricos, mejor actividad en piperacilina-tazobactam y menor en las quinolonas y aminoglucósidos. No se considera probada la presencia de cepas productoras de metalo-betalactamasas48. A. baumannii no representa un grave problema epidemiológico en este hospital. Sin embargo, presenta una sensibilidad baja a los antibióticos. Ampi-sulbactam se muestra similar a otros autores; sin embargo, los carbapenemes (imipenem y meropenem) muestran actividad del 80 y el 78%, respectivamente46. De los aminoglucósidos, tobramicina se muestra superior (actividad del 76%). También conviene observar la tendencia creciente de actividad de cotrimoxazol (70% en 2005). Finalmente, frente a S. maltophilia, piperacilina tazobactam, ceftazidima y, especialmente, cotrimoxazol son los que se muestran más activos.
La actividad antibiótica frente H. influenzae es, en general, buena, con cifras del 100% en quinolonas y cefalosporinas de la tercera generación. La resistencia a ampicilina es variable, alrededor del 20%. La resistencia cromosómica es asimismo muy baja o inexistente. Finalmente, frente a B. catarrhalis los antibióticos testados muestran una actividad elevada, excepto frente a ampicilina, consecuencia de la alta incidencia de cepas productoras de betalactamasa.
Así pues, el conocimiento de la resistencia antibiótica en una determinada área sanitaria es fundamental para aplicar de forma adecuada una Política de Antibióticos, con el uso de unas normas de aplicación y consumo de los agentes antimicrobianos, así como de enseñanza y control continuos, para conseguir el tratamiento antibiótico más eficaz, más racional y menos costoso posible.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.