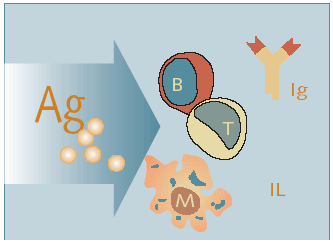Inmunonutrientes
La interacción entre inmunidad y nutrición es un fenómeno apasionante y complejo. Los alimentos en su conjunto y sus componentes en particular ejercen un importante papel en el desarrollo y en la preservación del sistema inmunitario. En el presente artículo se revisan los nutrientes que ejercen una mayor influencia en el funcionamiento de dicho sistema.
La infección, desde tiempo inmemorial, ha desempeñado un papel importante en el control demográfico humano. Las epidemias, en siglos pasados, han devastado entre el 50% y el 90% de algunos pueblos, hecho que podría relacionarse fácilmente con déficits nutricionales previos.
En el momento actual, algunas poblaciones asiáticas y africanas, con alta tasa de marasmo, siguen presentando una elevada mortalidad por enfermedades infecciosas.
La industrialización y el progreso científico del mundo occidental han conducido de forma indirecta a una explosión demográfica. En los últimos 300 años, la población mundial ha aumentado desde 500 a 6.000 millones de habitantes, en paralelo a una mejoría en los métodos agrícolas y a una mayor posibilidad de obtención de alimentos. Todo parece indicar que a mejor nutrición, menos infecciones aunque, evidentemente, se trata de una observación empírica1.
En las últimas décadas la relación desnutrición-infección se ha hecho más patente. A nivel hospitalario, el grado de desnutrición es importante, observándose una correlación entre el grado de desnutrición y la presencia de complicaciones infecciosas. Así, por ejemplo, en grandes quemados se ha evidenciado claramente el efecto que la desnutrición ejerce en el desarrollo de la infección.
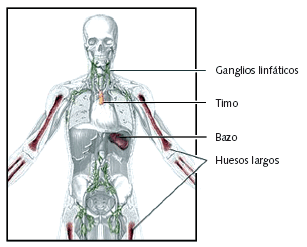
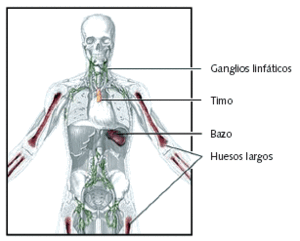
Fig. 1. Estructuras que forman parte del sistema inmunitario
Mecanismos inmunológicos frente a la infección
El sistema inmunitario constituye uno de los mecanismos de defensa más importantes contra los agentes agresores externos (bacterias, virus, parásitos, etc.), y también frente a otros internos (sirvan como ejemplo las células tumorales, capaces de producir autoanticuerpos). Este sistema se compone de dos partes: el sistema inmunológico inespecífico o innato y el sistema de adaptación o sistema inmunológico específico. Aunque, en general, ambos sistemas funcionan simultáneamente, tienen algunas características peculiares que merece la pena describir.
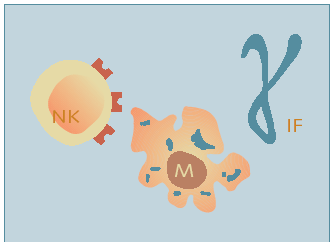
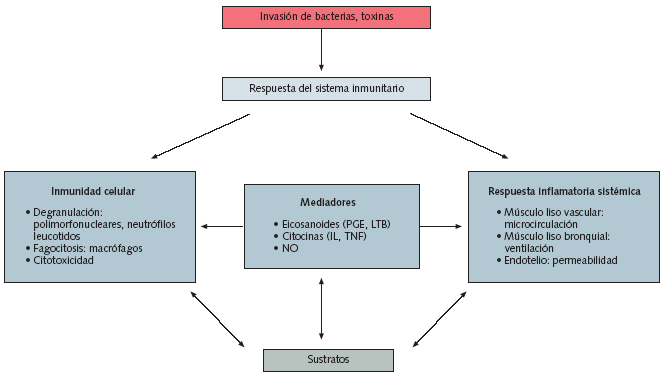
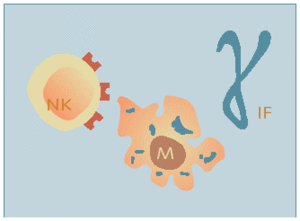
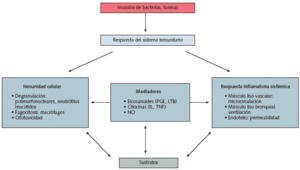
El sistema inmunológico inespecífico está integrado, por una parte, por barreras anatómicas, y por otra, por un sistema de fagocitos, mecanismo por el que se produce la ingestión celular de material extraño. En las lesiones, los microorganismos, con sus endotoxinas, pueden activar el sistema de complemento y hacer que los mastocitos se degranulen.
El sistema de complemento es un mecanismo complejo de cascada de proteínas que promueve las funciones de fagocitosis, neutralización viral y destrucción de células infectadas por virus. Los defectos en el sistema de complemento se asocian con un aumento de la susceptibilidad a las infecciones bacterianas. La degranulación de los mastocitos produce liberación de histamina. Estos mediadores inflamatorios, junto con los productos derivados de la destrucción de la membrana celular, aumentan la permeabilidad vascular, causando un cúmulo de proteínas de fase aguda y de complejos inmunes que promueve la fase celular de la inflamación aguda.
La fase celular del sistema inmunológico inespecífico incluye fagocitos circulantes y fijos. Inicialmente, los neutrófilos se adhieren a los microorganismos patógenos para, después, fagocitarlos y aniquilarlos. La fagocitosis se ve facilitada por el fenómeno denominado opsonización o revestimiento de las bacterias con el complemento o las inmunoglobulinas. Las opsoninas activan los neutrófilos, tras lo que se produce un mecanismo oxidativo que incluye la formación de peróxido de hidrógeno y radicales libres de oxígeno. Estas sustancias aniquilan las bacterias y los neutrófilos, con liberación de productos de desecho tóxicos. Aunque esta respuesta es beneficiosa cuando se realiza de manera moderada, la prolongación de la fase inflamatoria puede ser lesiva para el huésped.
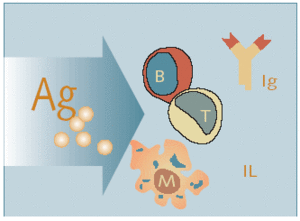
El sistema inmunológico específico lo constituyen la inmunidad humoral y la inmunidad mediada por células. Los linfocitos B que maduran en la médula ósea responden a la estimulación de ciertos antígenos para convertirse en células plasmáticas que sintetizan y segregan anticuerpos: las inmunoglobulinas. La inmunidad mediada por células se basa fundamentalmente en los linfocitos T derivados del timo.
Las células que poseen antígenos son responsables del desencadenamiento de la respuesta inmunitaria. La interacción entre los antígenos y los macrófagos conduce a la producción de interleucina-1 (IL-1) por medio del metabolismo del ácido araquidónico. Esta IL-1, producida por los macrófagos, hace que las células T produzcan interleucina-2 (IL-2) y otras linfocinas. La producción de IL-2 ayuda a estimular las células T y B para formar clones que transportan receptores específicos al antígeno sensibilizado. Así se constituye la memoria de células que, tras una nueva exposición al mismo antígeno, proliferan y liberan linfocinas que, en colaboración con los macrófagos, pueden destruir el antígeno.
Los efectos en la inmunidad mediada por células se relacionan con infecciones por bacterias, micobacterias, virus, hongos y parásitos.
Las células T son las causantes de la hipersensibilidad retardada, del rechazo de injertos, de la destrucción de microorganismos patógenos y de la destrucción de células malignas y, además, reúnen las características de otras células inmunológicas. Las subpoblaciones de células T incluyen las células T helper, que pueden ayudar a las células plasmáticas a producir anticuerpos y liberar linfocinas que modulan la interacción entre linfocitos y otras células. Las células T supresoras pueden destruir células diana, inhibir la respuesta de anticuerpos o inhibir la respuesta inflamatoria.
Fig. 2. Inmunidad innata o inespecífica
Fig. 3. Inmunidad adquirida o específica
Inmunidad e inmunonutrientes
En general, la inmunodepresión resultante de una desnutrición caloricoproteica crónica puede ser corregida con un soporte nutricional que revierta la desnutrición. Los enfermos agudos con sepsis pueden, sin embargo, padecer una situación de inmunodepresión sin ayuno o desnutrición previa. En tales circunstancias, la nutrición convencional enteral o parenteral puede prevenir una situación de desnutrición generalizada posterior, pero no hay evidencia de que disminuya la morbilidad y la mortalidad de manera significativa. Parece ser que ciertos componentes de las formulaciones de nutrición enteral o parenteral pueden afectar de manera adversa la función inmunológica, mientras que otros pueden restablecer la función inmunológica deprimida o aumentar las respuestas. Esta afirmación induce a seleccionar los nutrientes y su vía de administración, con el fin de mejorar la respuesta del sistema inmunitario.
Por otra parte, si se desea tener una visión global del problema desnutrición-inmunidad, conviene recordar las máximas de un clásico como Chandra sobre los nutrientes y la inmunidad:
Las alteraciones de la respuesta inmunitaria se dan precozmente ante una reducción de la ingesta de micronutrientes.
El grado de inmunocompetencia está relacionado con el tipo de nutriente implicado, sus interacciones con otros nutrientes esenciales, la gravedad del déficit, la presencia de enfermedades concomitantes y la edad del sujeto.
Las anomalías inmunitarias son predictivas de la evolución y, en especial, de la morbimortalidad.
El aporte excesivo de algunos micronutrientes se asocia con pruebas inmunológicas alteradas.
Las pruebas de inmunocompetencia son útiles para valorar tanto las necesidades fisiológicas como los valores de seguridad en los aportes de micronutrientes.
Hoy día se debate si la composición de la dieta puede condicionar la respuesta metabólica e inflamatoria a las agresiones, de forma que incida en la evolución clínica del paciente. Este concepto contradice la antigua consideración de que nutrir consiste sólo en administrar calorías, proteínas y oligoelementos para mantener la función del organismo, ya que se debe ir más allá en el ideal de modular la dieta, diseñándola específicamente para cada proceso patológico.
Por tanto, del concepto de nutriente como toda sustancia asimilable contenida en los alimentos, que permite al organismo obtener energía, construir y reparar tejidos y regular los procesos metabólicos, se ha pasado al de inmunonutriente, que es una sustancia que, a diferencia de un nutriente convencional, es capaz de mejorar el sistema inmunitario2.
Hasta la fecha se han identificado numerosos componentes de la dieta que poseen acción inmunoestimuladora. Se ha descubierto que algunos péptidos de la dieta (derivados de la caseína, la soja y otras proteínas), la arginina, la glutamina, los ácidos nucleicos y las vitaminas A, C y E, estimulan la función inmunológica. Además se ha observado que la relación entre los ácidos grasos poliinsaturados de las series *-3 y *-6 altera la composición y fluidez de la membrana plasmática, modifica el flujo de los canales iónicos, los mecanismos de marcaje celular, la respuesta a los eicosanoides, la liberación de citocinas y la respuesta inmunitaria celular.
A partir de estudios realizados en animales se han desarrollado varias fórmulas de nutrición enteral para estimular el sistema inmunitario y reducir así las infecciones en pacientes críticos. Los nutrientes más estudiados y que se han incluido en las preparaciones comerciales son los aminoácidos arginina y glutamina, los ácidos grasos de la serie *-3 y los nucleótidos.
Fig. 4. Acciones de los patógenos en la respuesta inmune sistémica
Inmunonutrientes
Describiremos, a continuación, las características de los inmunonutrientes anteriormente citados: glutamina, arginina, ácidos grasos de la serie *-3 y nucleótidos.
Glutamina
La glutamina es un aminoácido no esencial, sintetizado básicamente en el músculo esquelético y ampliamente distribuido en el organismo; actualmente es considerado como un aminoácido semiesencial en determinados procesos patológicos, en los que las demandas superan el aporte.
La glutamina tiene un papel relevante en el sistema inmunitario por múltiples vías: por una parte, como donante de nitrógeno para la síntesis de purinas y pirimidinas, la formación de dinucleótido de nicotinamida y adenina (NAD) y aminoazúcares, así como sustrato para la formación de arginina, y por otra, como sustrato energético para los enterocitos, las células de división rápida, los linfocitos y los macrófagos.
Hay evidencias de que en situaciones de hipercatabolismo e hipermetabolismo se produce una importante disminución de los niveles de glutamina intracelular a nivel muscular; esta respuesta se ha demostrado después de intervenciones quirúrgicas programadas, traumatismos graves, quemados, infecciones y pancreatitis, sin tener en cuenta el estado nutricional. Se ha observado una reducción del 50% del pool de glutamina libre en el músculo en respuesta a traumatismos, infecciones y en la malnutrición. Estos hechos sugieren que la glutamina es un aminoácido semiesencial durante los episodios de hipercatabolismo, así como en traumatismos y episodios de sepsis.
Numerosos estudios experimentales confirman la hipótesis de que los suplementos de glutamina en nutrición enteral y parenteral se asocian con incremento del grosor de la mucosa intestinal y la cantidad de ADN de la proteínas y reducción de la translocación bacteriana después de la radiación. Disminuye los efectos adversos de la enterocolitis inducida experimentalmente, preserva la mucosa intestinal durante la nutrición parenteral y aumenta la hiperplasia después de pequeñas radiaciones intestinales en ratas. In vitro, se ha demostrado que la glutamina reduce la histolisis. Todos estos efectos juntos mantienen la proliferación celular, lo que desempeña un papel primordial en la prevención de la atrofia de la mucosa intestinal.
También se ha comunicado que los suplementos con glutamina restablecen la inmunoglobulina A de las mucosas, aumentan la inmunidad del tracto respiratorio superior, previenen la sepsis intestinal derivada de la ictericia obstructiva y aumentan la eliminación bacteriana en peritonitis.
Además, se ha indicado también que dichos suplementos aumentan la actividad citotóxica de las células natural killer y mantienen una adecuada proliferación y función de los linfocitos, células killer y macrófagos.
Todos estos efectos ponen de relieve que con la repleción de glutamina puede ser recuperarse la función de defensa celular in vitro e in vivo.
Arginina
La arginina es un aminoácido dibásico que se obtiene tanto de fuentes dietéticas, como por vía endógena.
La síntesis endógena de este aminoácido tiene lugar fundamentalmente en el riñón, a partir de la citrulina procedente del intestino y de un donante de nitrógeno, que generalmente es el ácido aspártico. El intestino delgado transforma los aminoácidos de la dieta, incluyendo la glutamina, en citrulina. En condiciones normales, esta vía de síntesis representa un 20% del consumo diario de arginina.
La arginina es el sustrato metabólico de 2 enzimas: la arginasa y la óxido nítrico sintetasa. La primera da lugar a urea y ornitina, mientras que la segunda genera óxido nítrico. Esta segunda enzima tiene 3 isoformas: 2 constitutivas (óxido nítrico sintetasa endotelial y óxido nítrico sintetasa neuronal) y una inducible, la cual es especialmente importante en procesos patológicos en los que predomina la respuesta inflamatoria; por el contrario, en situaciones de normalidad, se expresa mayoritariamente la actividad de la arginasa y la producción de metabolitos relacionados con la ornitina.
Actualmente, la arginina es considerada como un aminoácido semiesencial, que se convierte en esencial durante las fases de crecimiento. También puede tener dicho carácter esencial en situaciones hipermetabólicas y sépticas.
Este aminoácido ejerce una gran cantidad de funciones, que pueden agruparse en 3 líneas:
- A través de la vía del glutamato, la arginina produce un aumento en la cantidad de prolina e hidroxiprolina, necesarias para la síntesis de tejido conectivo.
- Estimula la secreción de una gran variedad de hormonas, especialmente de la hormona de crecimiento, la prolactina, la insulina y el glucagón.
- Mejora la función inmunológica celular, tiene efectos anticatabólicos y desempeña un importante papel en el ciclo de la urea gracias a la eliminación del organismo de compuestos nitrogenados no esenciales.
Además de todas estas acciones, como ya se ha mencionado anteriormente, la arginina se metaboliza a óxido nítrico a través de la óxido nítrico sintetasa; de hecho, este aminoácido es el único precursor del óxido nítrico, molécula que, a pesar de su corta vida, desempeña importantes funciones en el organismo: interviene en la circulación sistémica y esplácnica, regulando la presión arterial, la conservación de la perfusión de los órganos y la interacción del endotelio vascular con las plaquetas y leucocitos plasmáticos; además, se le ha implicado en la neurotransmisión y en el sistema inmunológico.
Ácidos grasos w-3
Observaciones recientes han puesto de manifiesto que los lípidos de la dieta, además de servir como fuente de ácidos grasos esenciales, fuente calórica y como vehículos de vitaminas liposolubles, pueden afectar de manera importante al sistema inmunitario.
Por otra parte, aunque la membrana celular tiene capacidad para funcionar normalmente con una amplia variedad de composición de ácidos grasos, cuando por alguna causa se produce una alteración de estas membranas celulares en relación con su composición grasa, se producen importantes efectos biológicos que inciden en la respuesta inmunológica.
El interés de los ácidos grasos w-3 en inmunonutrición se basa en que su metabolización da lugar a los ácidos eicosapentanoico y docosahexanoico, que favorecen el sistema inmunitario mediante competición con el ácido araquidónico, un ácido graso w-6 que, en concentraciones elevadas, deprime el sistema inmunitario y favorece la respuesta inflamatoria.
La sustitución de los ácidos grasos w-6 por los ácidos grasos w-3 altera la composición de la membrana celular y modifica el equilibrio en la producción de leucotrienos y prostaglandinas. Esto ocasiona una reducción de las prostaglandinas y los tromboxanos dienoicos, así como de los leucotrienos tetraenoicos, mientras que se incrementan las prostaglandinas y los tromboxanos trienoicos, así como los leucotrienos pentaenoicos. En general, los efectos inflamatorios de los mediadores derivados de los ácidos grasos w-3 son menos marcados y menos inmunodepresores que los derivados del ácido araquidónico.
No obstante, conviene recordar que los ácidos grasos w-3 también se comportan como inmunodepresores para la proliferación linfocitaria, la actividad natural killer y la presentación de antígenos.
Así pues, el cociente w-3/w-6 en las fórmulas de nutrición enteral puede ser importante para optimizar la función inmunitaria. Obviamente, la cuestión es saber cuál es la proporción ideal para que la respuesta inmunitaria sea la adecuada en cada momento.
Nucleótidos
Los nucleótidos son esenciales para la síntesis de ARN, ADN y para los compuestos transportadores de energía.
La hipersensibilidad cutánea retardada, la proliferación linfocítica estimulada por mitógenos, el rechazo de injertos y la enfermedad del huésped frente a un injerto se suprimen con una dieta sin nucleótidos. Ante esto, podría pensarse que en situaciones de disminución de las defensas del huésped sería deseable una suplementación en la dieta con nucleótidos, o al menos uracilo, ante la sospecha de que estén alterados los mecanismos de síntesis de novo a partir de aminoácidos, bases o nucleótidos procedentes de la degradación celular.
Añadir a la dieta ARN al 0,25%, previene la inmunodepresión. No proporcionar nucleótidos suprime de manera selectiva las células T helper y la producción de interleucina 2.
Actualmente se sabe que las células T helper y las poblaciones de macrófagos se benefician de la suplementación con ARN, aunque los mecanismos inmunológicos no están claros. *
Bibliografía general
Celaya S, León Cinto C. Inmunidad y nutrición: conceptos al final del siglo XX. En: Miján de la Torre A, editor. Nutrición clínica: bases y fundamentos. Barcelona: Doyma; 2000. p. 181-203.
Culebras-Fernández JM, de Paz-Arias R, Jonquera-Plaza F, García de Lorenzo A. Nutrición en el paciente quirúrgico: inmunonutrición. Nutr Hosp. 2001; 16(3):67-77.
De Pablo MA, Alvarez de Cienfuegos G. Modulatory effects of dietary lipids on immune system functions. Immunol Cell Biol. 2000; 78(1):31-9.
Eboy D, Lieberman MD, Fahey TJ, Daly JM. Immunonutrition: The role of arginine. Nutrition 1998;14:611-7.
Field CJ. Use of T cell function to determine the effect of physiologically active food components. Am J Clin. 2000;71:S1720-5.
García de Lorenzo A, Zarazaga A, García Luna PP, González-Huix F, López-Martínez J, Miján A et al. Clinical evidence for enteral nutritional support with glutamine: a systematic review. Nutrition 2003;19:805-11.
Grimble RF. Dietary lipids and the inflammatory response. Proc Nutr Soc. 1998;57:555-62.
Houdijk AP. Glutamina-enriched enteral nutrition in patients with multiple trauma. Lancet 1998:1533.
Montejo JC, Zarazaga A, López-Martínez J, Urrutia G, Roque M, Blesa AL et al. Spanish Society of Intensive Care Medicine and Coronary Units. Immunonutrition in the intensive care unit. A systematic review and consensus statement. Clin Nutr. 2003;22:221-33.
Ortiz C, Celaya S. Nutrición-Inmunidad. En: Celaya S, editor. Tratado de Nutrición Artificial. Madrid: Aula Médica; 1998. p. 83-93.
Raynard B, Nitenberg G, Gory Delabaere G, Bourhis JH, Bachmann P, Bensadoun RJ et al. Féderation Nationale des Centres de Lutte Contre le Cancer. Standards, options et recommandations pour la nutrition artificielle au tours et au décours de la greffe de cellules souches hématopoïétiques. Bull Cancer 2002; 89:381-400.
Rodrigo Casanova MP, García Pena JM. The effect of the composition of the enteral nutrition on infection in the critical patient. Nutr Hop. 1997;12:80-4.
Sanhueza JC, Nieto SJ, Valenzuela AB. Acido linoléico conjugado: un ácido graso con isomería trans potencialmente beneficioso. Rev Chil Nutr. 2002;29(2):98-105.
Sanz A, Celaya S, Gracia P, Gracia ML, Albero R. Inmunonutrición. Endocrinol Nutr. 2004; 51(4):202-17.
Schloerb PR. Inmune-enhacing diets: products, components, and their rationales. J Par Enter Nutr. 2001;25:S3-7.
Slobodianik NH. Desequilibrios nutricionales e inmunidad. Informe ALAC, Ciencia y Ética 1999;IV(2):37.
Suchner U, Jun KS, Furst P. The scientific basis of immunonutrition. Clinical Nutrition and Metabolism Group Symposium on Nutrition in the severely-injures patient. Proc Nutr Soc. 2000;59:553-63.
Notas
1. Alexander JW. Nutrition and infection. New perspectives for an old problem. Arch Sug. 1986;121:966-72.
2. Chandra RK. Nutrition and immunity: lessons from the past and new insights into the future. Am J Clin Nutr. 1991;53:1.087-101.