La guía clínica para el manejo de la sepsis recomienda usar muestras de sangre arterial para el control glucémico. Un estudio multicéntrico en 86 unidades de cuidados intensivos españolas reveló que el 85,4% de estas utilizaban punción capilar.
ObjetivoAnalizar la fiabilidad de la glucemia comparando diferentes muestras sanguíneas (arterial, venosa, capilar) e instrumentos (glucómetros, gasómetros, laboratorio central). Secundariamente, estimar el efecto de variables confusoras y el rendimiento de los instrumentos de medición determinados por las diferentes normas de calidad.
MetodologíaRevisión sistemática y metanálisis con búsqueda en las bases de datos PubMed, CINAHL y Embase en septiembre-2021 y septiembre-2022, sin límites temporales ni idiomáticos. Fuentes de literatura gris: DART-Europe, OpenGrey y Google Académico. Resultados resumidos mediante síntesis cualitativa (descripción de resultados, características de los estudios) y cuantitativa (metanálisis para evaluar la diferencia de medias estandarizadas). Calidad metodológica de artículos evaluada con Quality Assessment of Diagnostic Accuracy Studies-2. Protocolo: https://osf.io/ DOI 10.17605/OSF.IO/T8KYP.
ResultadosSe incluyeron un total de 32 artículos y 5.451 pacientes. No se obtuvieron discrepancias entre muestras arteriales con glucómetro vs. laboratorio (sesgo [IC95%]: 0,01 [−0,12 a 0,14] mg/dL). En cambio, muestras arteriales con gasómetro sí sobreestimaron de forma significativa (sesgo [IC95%]: 0,12 [0,01 a 0,24] mg/dL). La misma tendencia presentan capilares con glucómetro, aunque no de forma significativa (sesgo [IC95%]: 0,07 [−0,02 a 0,15] mg/dL). Hay discrepancia entre los estudios sobre el efecto del hematocrito y el equilibrio ácido-base. El mayor consenso se da en la poca concordancia del glucómetro con muestras capilares vs. laboratorio en presencia de shock y soporte vasopresor, situación de fallo renal o durante el tratamiento con vitamina C.
ConclusionesLa evidencia hasta el momento recomienda el uso de sangre arterial con gasómetro para una mejor fiabilidad del análisis glucémico y menor efecto de posibles variables confusoras, frecuentemente presentes en el enfermo crítico adulto.
The clinical guideline for the management of sepsis recommends using arterial blood samples for glycaemic control. A multicentre study in 86 Spanish intensive care units revealed that 85.4% of these used capillary puncture.
ObjectiveTo analyse the reliability of glycaemia by comparing different blood samples (arterial, venous, capillary) and instruments (glucometers, gasometers, central laboratory). Secondarily, to estimate the effect of confounding variables and the performance of measuring instruments as determined by different quality standards.
MethodologySystematic review and meta-analysis with search in PubMed, CINAHL and Embase databases in September-2021 and September-2022, with no time or language limits. Grey literature sources: DART-Europe, OpenGrey and Google Scholar. Results summarised by qualitative (description of results, study characteristics) and quantitative (meta-analysis to assess standardised mean difference) synthesis. Methodological quality of articles assessed with Quality Assessment of Diagnostic Accuracy Studies-2. Protocol: https://osf.io/ DOI 10.17605/OSF.IO/T8KYP.
ResultsA total of 32 articles and 5451 patients were included. No discrepancies were obtained between arterial glucometer vs. laboratory samples (bias [95%CI]: 0.01 [−0.12 to 0.14] mg/dL). In contrast, arterial samples with a gasometer did significantly overestimate (bias [95%CI]: 0.12 [0.01 to 0.24] mg/dL). The same trend is seen in capillaries with a glucometer, although not significantly (bias [95%CI]: 0.07 [−0.02 to 0.15] mg/dL). There is discrepancy between studies on the effect of haematocrit and acid-base balance. The greatest consensus is on the poor agreement of glucometer with capillary vs. laboratory samples in the presence of shock and vasopressor support, renal failure or during vitamin C treatment.
ConclusionsThe evidence to date recommends the use of arterial blood with a blood glucose meter for better reliability of glycaemic analysis and less effect of possible confounding variables, frequently present in the critically ill adult patient.
Según la guía clínica para el manejo de la sepsis Surviving Sepsis Campaign1, debe administrarse insulina intravenosa con valores de glucemia>180mg/dL y mantener esta en un rango entre 140-180mg/dL (recomendación fuerte). Aunque en esta última actualización de la guía clínica de la sepsis1 no se reportan recomendaciones sobre cómo monitorizar la glucemia, en la guía de 20162 se establece que debe ser controlada cada 1-2h hasta la estabilización de las cifras de glucemia y tasas de infusión de insulina. Se recomienda usar muestras de sangre arterial para el control de la glucemia en lugar de sangre capilar (recomendación débil, evidencia de baja calidad) debido a una posible falta de precisión, especialmente en los rangos de hipoglucemia e hiperglucemia y en pacientes en situación de shock con tratamiento vasopresor2.
Los glucómetros a pie de cama solo deberían usarse cuando el paciente no porta catéteres para obtener muestras de sangre venosa o arterial, siendo, por tanto, la única alternativa la punción capilar3. Los glucómetros de última generación son los más prometedores en cuanto a fiabilidad, pero se ha de tener especial precaución ante determinados factores que pueden incrementar la imprecisión de este dispositivo, como el hematocrito, la presión parcial de oxígeno y fármacos vasoactivos4,5.
La más reciente revisión sistemática encontrada en la literatura6, de 2013, concluyó que el método más fiable para el análisis de la glucemia es sangre arterial con analizador de gases, seguido de sangre arterial con glucómetro. No obstante, en el rango de hipoglucemia (<81mg/dL), la incidencia de error en los dispositivos con muestras arteriales fue mayor que en los rangos de normoglucemia (odds ratio de error gasómetro vs. glucómetro: 1,86 vs. 2,33).
En el marco del estudio multicéntrico nacional MOviPre, para analizar la movilización precoz en las unidades de cuidados intensivos (UCI) de España, y dado que la hiperglucemia es un factor de riesgo de debilidad muscular, se preguntó a los investigadores colaboradores qué tipo de muestra sanguínea y tipo de analizador usaban para el análisis de la glucemia7. El 85,4% de las UCI utilizaban, para el análisis de la glucemia, la punción capilar, y glucómetros el 94,4%. De los glucómetros utilizados, solo el 36,2% era AccuChek®, glucómetro con capacidad para disminuir el sesgo que el hematocrito genera en la medición de la glucemia, y solo una UCI (1,2%) usaba Stata-Strip®, glucómetro de última generación. Estos resultados son ratificados por García del Moral-Martín et al.8 en Andalucía, en una muestra amplia y homogénea, en cuanto a representatividad por comunidad autónoma. Sin embargo, aunque la evidencia con respecto a cómo debe realizarse la monitorización de la glucemia está publicada hace más de un lustro, no ha habido traslación a la práctica.
Teniendo en cuenta que la guía más reciente1 sobre el manejo de la sepsis no evalúa cómo monitorizar la glucemia y recomienda ampliar la investigación para mejorar la seguridad en el control glucémico, consideramos oportuno llevar a cabo una revisión que pueda aportar nueva evidencia en la monitorización de la glucosa en el paciente crítico adulto, analizando la fiabilidad de esta entre las diferentes muestras sanguíneas e instrumentos, y secundariamente, estimar el efecto de las variables confusoras y el rendimiento de los instrumentos de medición determinados por las diferentes normas de calidad.
La pregunta para esta revisión fue elaborada usando el acrónimo PICOS (paciente/población, intervención, comparación, outcome-resultados, tipo de estudio), donde cada ítem corresponde a: (P) pacientes críticos adultos tratados en UCI, que pueden ser de diferentes tipos: médicas, quirúrgicas, polivalentes, cardiológicas, neurológicas y también unidades de críticos en urgencias; (I) estudios en los que se evalúe la precisión del análisis de la glucemia usando glucómetros o analizadores de gases; (C) con o sin comparación con valores de glucemia analizados en laboratorio central; (O) la magnitud de la diferencia en la comparación de las mediciones de glucemia de las diferentes muestras, según los instrumentos y los métodos de análisis utilizados (resultado principal) y el rendimiento de los glucómetros y/o analizadores de gases según los diferentes criterios de calidad o intercambiabilidad (resultado secundario), y análisis de la influencia de posibles variables confusoras sobre la imprecisión de la medición (resultado secundario), y (S) estudios observacionales, experimentales y cuasiexperimentales.
La pregunta de investigación fue: ¿qué tipo de sangre (arterial, venosa, capilar) e instrumento de análisis (glucómetro, analizador de gases) debo usar para la medición de la glucemia a pie de cama en el paciente crítico adulto?
MetodologíaRevisión sistemática y metanálisis de acuerdo con la metodología de la Joanna Briggs Institute (JBI) de revisiones de exactitud de pruebas diagnósticas e informada con arreglo a las directrices Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA)9,10. El protocolo del estudio ha sido publicado en OSF (https://osf.io/ DOI 10.17605/OSF.IO/T8KYP).
Criterios de elegibilidadPara dar respuesta a la pregunta de investigación, se realizó una búsqueda bibliográfica en cualquier idioma de publicación y sin exclusión por fechas de publicación, con los siguientes criterios de inclusión: (1) tipo de estudios: ensayos clínicos aleatorizados y no aleatorizados, estudios antes y después, estudios observacionales, prospectivos y retrospectivos, casos-control y transversales, y estudios cualitativos; (2) estudios cuyo resumen reporte las comparaciones implementadas con los distintos instrumentos de análisis (coeficiente de correlación intraclase, Bland y Altman); (3) que tuvieran como participantes pacientes críticos adultos; (4) en los que se analizara la precisión del análisis de la glucemia mediante instrumentos a pie de cabecera (point of care [POC]) usando glucómetros o analizadores de gases, y que expresen los resultados conforme a la concordancia entre valores de glucemia entre los diferentes instrumentos y muestras (arterial, venosa o capilar).
Fueron excluidos aquellos estudios que evaluaron la glucemia con muestras de sangre humana manipulada en laboratorio y los que analizaron los dispositivos de monitorización continua de glucosa intersticial. Se excluyeron los estudios realizados en unidades de grandes quemados, resúmenes de congreso, libros y editoriales, siguiendo las recomendaciones para una revisión sistemática.
Fuentes de información y estrategia de búsquedaEn septiembre de 2021 realizamos una búsqueda preliminar para la localización de revisiones sistemáticas publicadas o en curso, así como para identificar artículos potencialmente relevantes e identificar términos y descriptores relevantes para la búsqueda definitiva. Las bases consultadas fueron PROSPERO (https://www.crd.york.ac.uk/prospero/), Cochrane Database of Systematic Reviews (Wiley, 1995-), PubMed (1945-), Embase (Elsevier, 1947-), JBI EBP Database (Ovid) y ClinicalTrials.gov.
La búsqueda bibliográfica definitiva para identificar documentos potencialmente relevantes se realizó en septiembre de 2021 y se actualizó en septiembre de 2022, e incluyó las bases de datos PubMed (1946-), Embase (Elsevier, 1947-) y CINAHL (EBSCO, 1937-).
Las estrategias de búsqueda fueron redactadas por una bibliotecaria experimentada (CCA) y revisadas por otro especialista en información (JMM) antes de su ejecución mediante la lista de comprobación Peer Review of Electronic Search Strategies11. La estrategia de búsqueda para cada base de datos se detalla en el material suplementario (Tabla S1). La búsqueda se diseñó con ayuda de las siguientes herramientas: Yale MeSH Analyzer12, PubReMiner13 y Polyglot Search Translator14.
La búsqueda en bases de datos electrónicas se complementó con la búsqueda en DART-Europe para acceso a tesis, OpenGrey y Google Académico, y se contactó a expertos. Además, se realizó una búsqueda suplementaria en las listas de referencias de los trabajos de los estudios seleccionados para su inclusión en esta revisión con el fin de identificar estudios relevantes adicionales, y a continuación se llevó a cabo una búsqueda sistemática de citas recopilando todos los estudios que citaban los artículos seleccionados para su inclusión utilizando CitationChaser (https://estech.shinyapps.io/citationchaser/)15.
Cuando fue necesario, se contactó con los autores de los artículos y resúmenes clave para solicitar más información sobre sus estudios.
Los resultados finales de la búsqueda se exportaron a Zotero y se eliminaron los duplicados.
Proceso de selecciónPreviamente al proceso de selección de estudios, realizamos una prueba piloto con 15 artículos en cada una de las 2 fases del proceso de cribado, considerando como criterio de consenso una coincidencia en más del 75%; las 2 revisoras obtuvieron un acuerdo del 96%. Se cribaron todas las referencias, de forma independiente, a través de los títulos y resúmenes conforme a los criterios de inclusión detallados previamente. Después de la selección de títulos y resúmenes, se recuperaron los textos completos de los artículos restantes. Posteriormente, se revisaron, también de forma independiente, los textos completos conforme a los criterios de inclusión. Las discrepancias se resolvieron por consenso. Las referencias resultantes fueron cargadas en el programa Rayyan (https://www.rayyan.ai/)16.
Extracción de datosSe utilizó un formulario estandarizado (inicialmente pilotado en 5 estudios incluidos). Las revisoras realizaron una extracción de datos de los estudios seleccionados: primer autor, año de publicación y país, metodología, número de pacientes, número de muestras pareadas, tipo de muestra utilizada, instrumentos utilizados, método de análisis de los instrumentos, resultados de fiabilidad, variables confusoras analizadas, análisis según los criterios de calidad y conclusiones de los autores.
Evaluación crítica de los estudiosLa calidad metodológica de los artículos seleccionados fue evaluada de forma independiente por 2 revisoras, mediante la herramienta Quality Assessment of Diagnostic Accuracy Studies-2 (QUADAS-2)17. Posteriormente se hizo una puesta en común y se resolvieron las discrepancias de forma consensuada.
Análisis de datosLos resultados se resumieron mediante síntesis cualitativa y cuantitativa. En la síntesis cualitativa se elaboró un cuadro con la descripción de los resultados y características de los estudios. En la síntesis cuantitativa, se realizó un metanálisis para evaluar la magnitud de la diferencia en los resultados. Todos los métodos metanalíticos utilizados en este estudio se basaron en la guía de Harrer et al.18.
Se utilizó el software R versión 4.0.3 para todos los análisis y gráficos. Todos los estudios con datos suficientes para calcular la diferencia de medias estandarizadas se incluyeron en los metanálisis. A partir de la mediana y el rango se calcularon las medias de los estudios que no presentaron los resultados con esta métrica19. Las desviaciones estándar no disponibles se calcularon utilizando el valor p, el valor t tabulado, la diferencia de medias y el error estándar20.
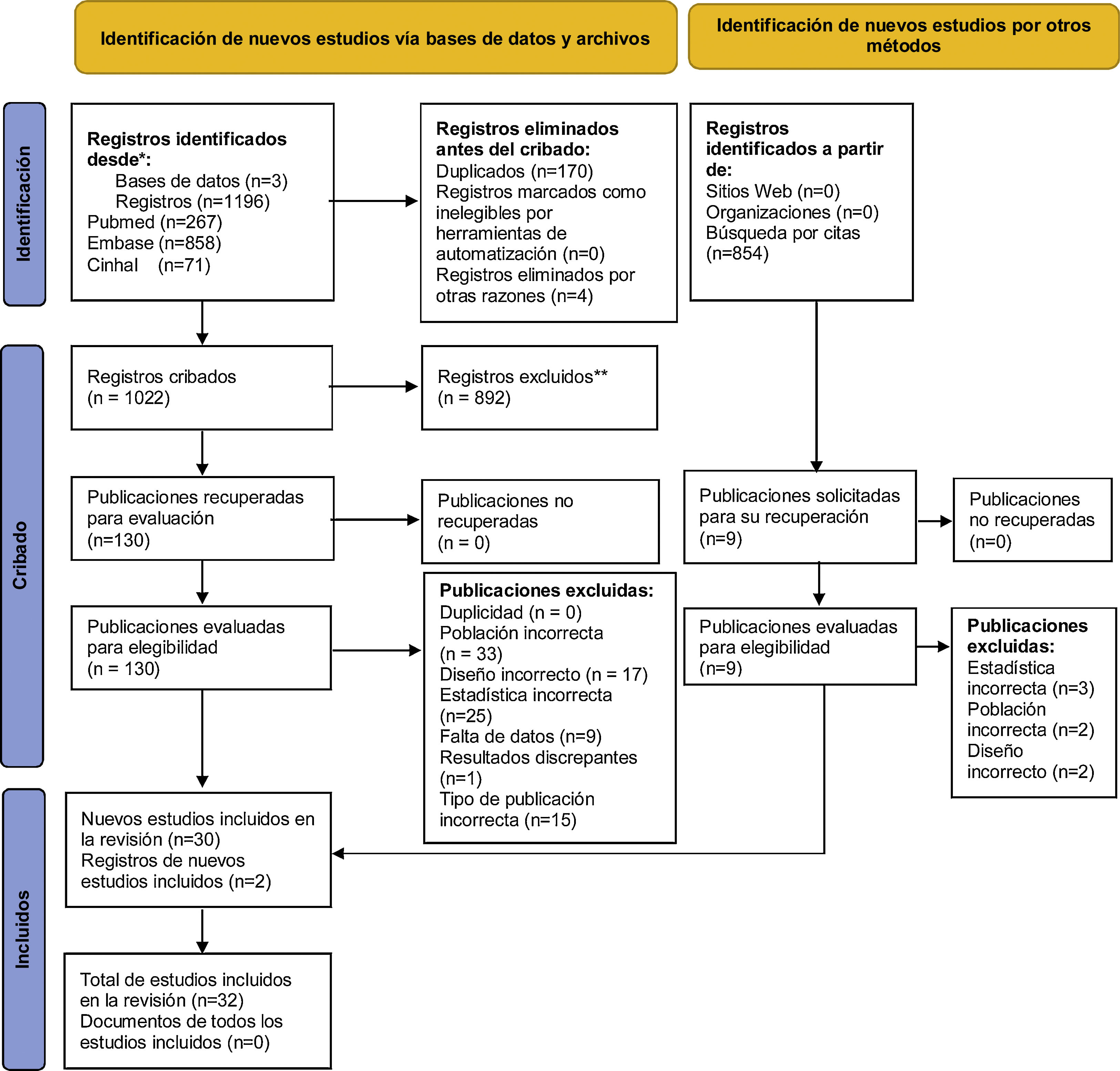
ResultadosSe analizaron 1.196 resúmenes procedentes de la búsqueda en las bases de datos, de los que 130 fueron evaluados a texto completo. De estos, se incluyeron 30 artículos más 2 localizados a partir de una revisión secundaria de búsqueda por citas. El proceso de selección se registró con suficiente detalle para completar un diagrama de flujo PRISMA (fig. 1) y una lista de estudios excluidos con las razones de las exclusiones.
De los 32 estudios incluidos, 26 son observacionales prospectivos, 5 son retrospectivos y uno de casos y controles. Se comparan diferentes instrumentos en 10 estudios, diferentes muestras en 2 y diferentes muestras e instrumentos en 20 estudios. El total de los pacientes analizados en los 32 estudios fue de 5.451 (tabla 1).
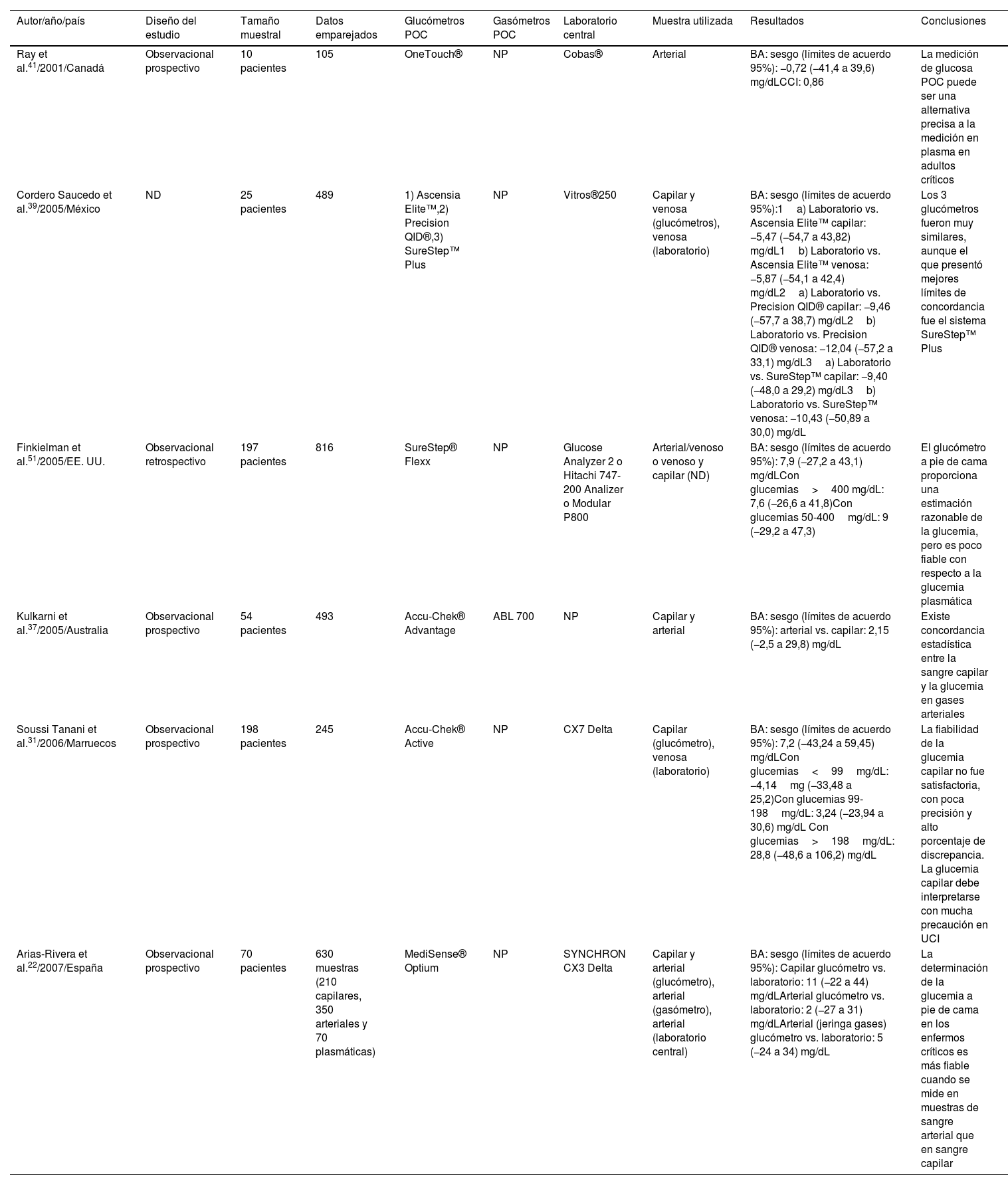
Características y resultados de los estudios incluidos en la revisión sistemática (n=32)
| Autor/año/país | Diseño del estudio | Tamaño muestral | Datos emparejados | Glucómetros POC | Gasómetros POC | Laboratorio central | Muestra utilizada | Resultados | Conclusiones |
|---|---|---|---|---|---|---|---|---|---|
| Ray et al.41/2001/Canadá | Observacional prospectivo | 10 pacientes | 105 | OneTouch® | NP | Cobas® | Arterial | BA: sesgo (límites de acuerdo 95%): −0,72 (−41,4 a 39,6) mg/dLCCI: 0,86 | La medición de glucosa POC puede ser una alternativa precisa a la medición en plasma en adultos críticos |
| Cordero Saucedo et al.39/2005/México | ND | 25 pacientes | 489 | 1) Ascensia Elite™,2) Precision QID®,3) SureStep™ Plus | NP | Vitros®250 | Capilar y venosa (glucómetros), venosa (laboratorio) | BA: sesgo (límites de acuerdo 95%):1a) Laboratorio vs. Ascensia Elite™ capilar: −5,47 (−54,7 a 43,82) mg/dL1b) Laboratorio vs. Ascensia Elite™ venosa: −5,87 (−54,1 a 42,4) mg/dL2a) Laboratorio vs. Precision QID® capilar: −9,46 (−57,7 a 38,7) mg/dL2b) Laboratorio vs. Precision QID® venosa: −12,04 (−57,2 a 33,1) mg/dL3a) Laboratorio vs. SureStep™ capilar: −9,40 (−48,0 a 29,2) mg/dL3b) Laboratorio vs. SureStep™ venosa: −10,43 (−50,89 a 30,0) mg/dL | Los 3 glucómetros fueron muy similares, aunque el que presentó mejores límites de concordancia fue el sistema SureStep™ Plus |
| Finkielman et al.51/2005/EE. UU. | Observacional retrospectivo | 197 pacientes | 816 | SureStep® Flexx | NP | Glucose Analyzer 2 o Hitachi 747-200 Analizer o Modular P800 | Arterial/venoso o venoso y capilar (ND) | BA: sesgo (límites de acuerdo 95%): 7,9 (−27,2 a 43,1) mg/dLCon glucemias>400 mg/dL: 7,6 (−26,6 a 41,8)Con glucemias 50-400mg/dL: 9 (−29,2 a 47,3) | El glucómetro a pie de cama proporciona una estimación razonable de la glucemia, pero es poco fiable con respecto a la glucemia plasmática |
| Kulkarni et al.37/2005/Australia | Observacional prospectivo | 54 pacientes | 493 | Accu-Chek® Advantage | ABL 700 | NP | Capilar y arterial | BA: sesgo (límites de acuerdo 95%): arterial vs. capilar: 2,15 (−2,5 a 29,8) mg/dL | Existe concordancia estadística entre la sangre capilar y la glucemia en gases arteriales |
| Soussi Tanani et al.31/2006/Marruecos | Observacional prospectivo | 198 pacientes | 245 | Accu-Chek® Active | NP | CX7 Delta | Capilar (glucómetro), venosa (laboratorio) | BA: sesgo (límites de acuerdo 95%): 7,2 (−43,24 a 59,45) mg/dLCon glucemias<99mg/dL: −4,14mg (−33,48 a 25,2)Con glucemias 99-198mg/dL: 3,24 (−23,94 a 30,6) mg/dL Con glucemias>198mg/dL: 28,8 (−48,6 a 106,2) mg/dL | La fiabilidad de la glucemia capilar no fue satisfactoria, con poca precisión y alto porcentaje de discrepancia. La glucemia capilar debe interpretarse con mucha precaución en UCI |
| Arias-Rivera et al.22/2007/España | Observacional prospectivo | 70 pacientes | 630 muestras (210 capilares, 350 arteriales y 70 plasmáticas) | MediSense® Optium | NP | SYNCHRON CX3 Delta | Capilar y arterial (glucómetro), arterial (gasómetro), arterial (laboratorio central) | BA: sesgo (límites de acuerdo 95%): Capilar glucómetro vs. laboratorio: 11 (−22 a 44) mg/dLArterial glucómetro vs. laboratorio: 2 (−27 a 31) mg/dLArterial (jeringa gases) glucómetro vs. laboratorio: 5 (−24 a 34) mg/dL | La determinación de la glucemia a pie de cama en los enfermos críticos es más fiable cuando se mide en muestras de sangre arterial que en sangre capilar |
| Autor/año/país | Diseño del estudio | Tamaño muestral | Datos emparejados | Glucómetros POC | Gasómetros POC | Laboratorio central | Muestra utilizada | Resultados | Conclusiones |
|---|---|---|---|---|---|---|---|---|---|
| Critchell et al.28/2007/EE. UU. | Observacional prospectivo | 80 pacientes | 277 | Accu-Chek® Inform | NP | Coulter LX-20 | Capilar y venosa | BA: sesgo (límites de acuerdo 95%):Capilar vs. laboratorio: 8,6 (−28,6 a 45,8) mg/dL | La glucemia capilar no ha cumplido los requisitos reglamentarios de precisión y, por lo tanto, esta técnica de medición y/o el glucómetro deben utilizarse con gran precaución en pacientes con protocolos glucémicos estrictos; pueden dar lugar a episodios de hipoglucemia no detectada |
| Karon et al.35/2007/EE. UU. | ND | 20 pacientes | 96 | Accu-Chek® Inform | NP | Double P | Arteriales, capilares y venosas (glucómetro)Arteriales o venosas (laboratorio) | BA: sesgo (RIC):Capilar vs. laboratorio (arterial o venoso): 2 (−27 a 29) mg/dLCon glucemias<160mg/dL: −3 (−7 a 3) mg/dLCon glucemias≥160mg/dL: 10 (1 a 16) mg/dLArterial glucómetro vs. laboratorio (arterial o venoso): 15 (−3 a 33) mg/dLCon glucemias<160mg/dL: 10 (7 a 13) mg/dLCon glucemias≥160mg/dL: 18 (13 a 26) mg/dLVenoso glucómetro vs. laboratorio (arterial o venoso): 15 (−28 a 58) mg/dLCon glucemias<160mg/dL: 9 (−1 a 12) mg/dLCon glucemias≥160mg/dL: 26 (15 a 41) mg/dLCCI: sangre capilar-glucómetro vs. laboratorio: 0,94Glucosa venosa-glucómetro vs. laboratorio: 0,92Glucosa arterial-glucómetro vs. laboratorio: 0,94 | No se han encontrado diferencias entre la medida capilar y el laboratorio, por lo que el glucómetro con muestra capilar es apropiado para medir glucemias. Las glucemias arterial y venosa medidas con el glucómetro fueron significativamente superiores a la del laboratorio central. Las diferencias entre los niveles de glucosa en sangre total arterial y venosa y en plasma de laboratorio aumentaron en función de la concentración de glucosa |
| Lacara et al.21/2007/EE. UU. | Comparación de métodos | 49 pacientes | 49 (42 arteriales y 7 venosas) | SureStep® Pro | NP | Model RxL | Capilar, arterial/venosa (glucómetro), arterial/venosa (laboratorio) | BA: sesgo (límites de acuerdo 95%):1) Arterial/venoso laboratorio vs. capilar glucómetro: 2,1 (−22,5 a 26,7) mg/dL2) Arterial/venoso laboratorio vs. arterial/venoso glucómetro: 0,6 (−20,6 a 21,8) mg/dL3) Arterial laboratorio vs. capilar glucómetro: 1 (−19,6 a 21,6) mg/dL4) Arterial laboratorio vs. arterial glucómetro: −0,1 (−21,6 a 22,6) mg/dL | Los hallazgos validaron la práctica en UCI de obtener sangre para pruebas con glucómetro a partir de catéteres arteriales o venosos en lugar de una fuente de punción digital. El sesgo y la precisión del análisis de glucosa capilar fue ligeramente más alto que el sesgo y precisión de muestras arteriales o venosas, pero las diferencias no fueron estadísticamente significativas |
| Desachy et al.27/2008/Francia | Prospectivo | 85 pacientes | 273 | Accu-Chek® | NP | Dimension Vista® | Capilar y sangre total venosa o arterial (glucómetro), sangre total venosa o arterial (laboratorio) | BA: sesgo (límites de acuerdo 95%):Capilar vs. laboratorio: 1,5 (−55,3 a 58,3) mg/dLSangre total glucómetro vs. laboratorio: 1,4 (−39,5 a 2,4) mg/dL | Las mediciones a pie de cama en sangre total deberían preferirse a las pruebas de sangre capilar. Los resultados deben interpretarse con cuidado |
| Hoedemaekers et al.45/2008/Países Bajos | Observacional prospectivo | 32 pacientes | 32 | NP | RAPIDLab® | Aeroset® (Abbott) | Arterial | BA: sesgo (IC95%): −2,7 (−22,34 a 16,94) mg/dL | ND |
| 85 pacientes | 197 | Accu-Chek® | RAPIDLab® | NP | Arterial | BA: sesgo (IC95%): −1,8 (−22,66 a 16,94) mg/dL | |||
| 53 pacientes | 82 | 1) Accu-Chek®2) Precision®3) HemCue® | RAPIDLab® | NP | Arterial | BA: sesgo (IC95%):1) −1,8 (−32,43 a 28,83) mg/dL2) 1,8 (−25,22 a 27,02) mg/dL3) −2,7 (−22,34 a 16,94) mg/dL | |||
| Vlasselaers et al.44/2008/Bélgica | Observacional prospectivo | 37 pacientes | 452 | 1) Accu-Chek® Inform2) HemoCue® Glucose 201 | ABL 700 | NP | Arterial | BA: sesgo (límites de acuerdo 95%):1) ABL 700 vs. Accu-Chek®: −6,3 (−26,5 a 14,0) mg/dL2) ABL 700 vs. HemoCue®: −10,9 (−29,5 a 7,6) mg/dL | Ninguno de los glucómetros mostró una completa fiabilidad clínica.Accu-Chek® parece un dispositivo más preciso, pero es imprevisible en cuanto a la dirección del error de medición.HemoCue® es algo menos preciso, pero el error de medición es más persistente, en particular sobreestimando la glucemia real |
| Cook et al.24/2009/EE. UU. | Comparación de método | 67 pacientes | ND | SureStep® Flexx | NP | Olympus AU640 | Capilar y venosa (glucómetro), venosa (laboratorio) | BA: sesgo (límites de acuerdo 95%):Capilar glucómetro vs. laboratorio: 9,54 (−12,5 a 31,5) mg/dLVenosa glucómetro vs. laboratorio: 9,51 (−10,3 a 26,5) mg/dLCapilar glucómetro vs. venosa glucómetro: 0,03 (−24 a 24,1) mg/dL | La magnitud de las diferencias entre POC y laboratorio es tal que el uso de un dispositivo POC en situaciones en las que es necesario conocer valores de glucosa precisos puede conducir a decisiones terapéuticas erróneas |
| Meynaar et al.42/2009/Países Bajos | Observacional prospectivo | 32 pacientes | 239 | AccuChek® | NP | Abbott Architect CI 8200 | Arterial | 239 pares:CCI (IC95%): 0,934 (0,915-0,948)BA sesgo (IC95%): 11 (9-13) mg/dL, p<0,00132 pacientes:CCI (IC95%): 0,939 (0,880-0,970)BA sesgo (IC95%): 13 (9-16) mg/dL, p<0,001 | La medición de glucosa mediante AccuChek® da valores similares a los de suero con sangre total |
| Autor/año/país | Diseño del estudio | Tamaño muestral | Datos emparejados | Glucómetros POC | Gasómetros POC | Laboratorio central | Muestra utilizada | Resultados | Conclusiones |
|---|---|---|---|---|---|---|---|---|---|
| Pulzi et al.29/2009/Brasil | Observacional transversal | 40 pacientes | 40 | FreeStyle® Optium | NP | Olympus Au640e | Capilar y arterial (glucómetro), arterial y venosa (laboratorio) | BA: sesgo (límites de acuerdo 95%):Capilar glucómetro vs. arterial laboratorio: −9,87 (−72,12 a 52,37) mg/dLArterial glucómetro vs. arterial laboratorio: −6,75 (−44,13 a 30,63) mg/dLVenoso laboratorio vs. arterial laboratorio: −4,20 (−59,81 a 51,41) mg/dL | Los glucómetros sobreestiman la glucosa en sangre, pudiendo exponer a los pacientes a eventos hipoglucémicos más frecuentes. La determinación arterial con glucómetro es el más representativo y debería adoptarse como alternativa al laboratorio central |
| Shearer et al.25/2009/EE. UU. | Comparación de métodos | 62 pacientes | ND | SureStep® Flexx | NP | Olympus AU 604 | Capilar y venosa (glucómetro), venoso (laboratorio) | BA: sesgo (límites de acuerdo 95%):Venoso glucómetro vs. laboratorio: 7,0 (−21,1 a 35,0) mg/dLCapilar glucómetro vs. laboratorio: 8,7 (−18,7 a 36,1) mg/dLCapilar glucómetro vs. venosa glucómetro: 1,7 (−31 a 34,5) mg/dL | La magnitud de las diferencias halladas entre el POC y el laboratorio pone en duda la práctica generalizada de utilizar las pruebas de glucosa POC en la gestión de la glucosa. No se hallaron diferencias entre las muestras capilares y las venosas con los POC |
| Fekih et al.33/2010/Túnez | Prospectivo comparativo no aleatorizado | 43 pacientes (Grupo 1: 23; Grupo 2: 20) | ND | Accu-Chek® | NP | Dade-Behring Multichannel Analyzer | Capilar (glucómetro), venosa (laboratorio) | BA: sesgo (límites de acuerdo 95%):Grupo 1 (pacientes estables): 0,9 (−74,34 a 72,54) mg/dLGrupo 2 (pacientes con catecolaminas): 5,22 (−90,9 a 101,34) mg/dL | ND |
| Juneja et al.46/2011/India | Prospectivo, casos y controles | 200 pacientes: 100 casos con soporte vasopresor y 100 controles sin apoyo vasopresor | 200 | OneTouch® Ultra | NP | NP | Capilar y arterial | BA casos: sesgo (límites de acuerdo 95%): 7,28 (−49,1 a 63,7) mg/dLBA controles: sesgo (límites de acuerdo 95%): −0,43 (−26,1 a 25,2) mg/dL | La monitorización de la glucemia capilar solo es fiable en un grupo de pacientes de UCI. Se debe tener precaución en pacientes con shock, donde es preferible la sangre arterial para la monitorización de la glucosa |
| Stadlbauer et al.47/2011/Austria | Observacional prospectivo | 17 pacientes | 74 | NP | 1) Cobas B®2212) ABL800 Flex3) GEM® Premier™ | Modular | Arterial | BAa: sesgo (límites de acuerdo 95%):1) 8,36 (−5,35 a 22,08) mg/dL2) 7,57 (−1,85 a 16,99) mg/dL3) 4,56 (−7,91 a 17,03) mg/dL | La correlación entre los 3 diferentes gasómetros POC y el laboratorio central fue buena |
| Castaño López et al.50/2012/España | Observacional prospectivo | 89 pacientes | 89 | StatStrip® | NP | Cobas®6000 | Sangre total (no especifican si arterial o venosa) | CCI (IC95%): 0,99 (0,98-0,99)BA: sesgo (±1,96 DE): 5,9 (−15,7 a 27,5) mg/dL | El glucómetro evaluado presenta buena precisión al compararlo con el laboratorio |
| DuBose et al.26/2012/EE. UU. | Observacional retrospectivo | 1.215 pacientes | 1.935 | Accu-Chek® Advantage | NP | LX20 | Capilar (glucómetro), arterial o venosa (laboratorio) | BA: sesgo (límites de acuerdo 95%): 12,4 (−22,4 a 47,2) mg/dLCon shock: 13,4 (−27,1 a 53,9) mg/dLNo shock: 12,6 (−20,6 a 45,8) mg/dL | La correlación entre valores de glucosa capilar y de laboratorio en estados de shock y sin shock es baja |
| Autor/año/país | Diseño del estudio | Tamaño muestral | Datos emparejados | Glucómetros POC | Gasómetros POC | Laboratorio central | Muestra utilizada | Resultados | Conclusiones |
|---|---|---|---|---|---|---|---|---|---|
| Lonjaret et al.30/2012/Francia | Observacional | 75 pacientes | 302 | CONTOUR® TS | NP | Olympus AU 2007 | Arterial y capilar (glucómetro), arterial (laboratorio) | CCI (IC95%) laboratorio vs. glucómetro capilar: 0,91 (0,89 a 0,93)CCI (IC95%) laboratorio vs. glucómetro arterial: 0,92 (0,90 a 0,93) | Las POC en pacientes críticos mediante un glucómetro no son precisas. La precisión parece ser ligeramente mejor en las muestras de sangre arterial que en las capilares |
| Watkinson et al.43/2012/RU | Observacional prospectivo | 206 pacientes | ND | 1) Precision PCx®2) HemoCue® 201 DM | Radiometer 700 | 1) Siemens ADVIA®24002) YSI 2300 STAT plus™ | Arterial | BA: sesgo (límites de acuerdo 95%):1) YSI 2300 STAT plus glucosa sangre total vs. glucosa en plasma: 14,4 (−1,8 a 30,6) mg/dL2) Precision PCx vs. Siemens ADVIA: 0,0 (−25,2 a 25,2) mg/dL3) HemoCue 201 DM vs. Siemens ADVIA: 0,0 (−21,6 a 19,8) mg/dL4) Radiometer 700 vs. Siemens ADVIA: −3,6 (−16,2 a 10,8) mg/dL | Los medidores de glucosa en el punto de atención estiman de forma fiable la glucosa en pacientes críticos |
| Garingarao et al.32/2014/Filipinas | Observacional transversal | 180 pacientes (89 normotensos y 91 hipotensos) | 186 (92 en normotensos y 94 en hipotensos) | Accu-Chek® Active | NP | I-Lab 300 Plus | Capilar (glucómetro), venosa (laboratorio) | BA: sesgo (límites de acuerdo 95%):Normotenso: −12,4 (−86,0 a 61,2) mg/dLHipotensos: −34,9 (−207,1 a 137,4) mg/dL | En pacientes críticos e hipotensos con apoyo vasopresor, los valores del medidor de glucosa POC tenían menor precisión que en los pacientes normotensos |
| Pereira et al.23/2015/EE. UU. | Prospectivo transversal | 145 pacientes | 145 | 1) Precision PCx®2) Accu-Chek Advantage II® | NP | Vitros® | Arterial (Precision® PCx), arterial, capilar y venosa (Accu-Chek® Advantage II),arterial (laboratorio) | BA: sesgo (límites de acuerdo 95%):1) Arterial laboratorio vs. arterial Precision: 18,6 (−12,4 a 49,5) mg/dL2a) Arterial laboratorio vs. arterial Accu-Chek®: 10,7 (−21,3 a 42,7) mg/dL2b) Arterial laboratorio vs. capilar Accu-Chek®: 10 (−31,8 a 51,8) mg/dL2c) Arterial laboratorio vs. venosa Accu-Chek®: 15,1 (−51,7 a 81,9) mg/dL | No se debe realizar un control glucémico con muestras de catéteres venosos centrales por su alta variabilidad. La fiabilidad de estos glucómetros es insuficiente en condiciones críticas. Las muestras arteriales parecen ser lo suficientemente precisas para ser utilizadas con glucómetros similares |
| Allardet Servent et al.48/2017/Francia | Observacional prospectivo | 51 pacientes | 306 | NP | Siemens RAPIDPoint® 500 | AU 5800 | Arterial | BA: sesgo (±1,96 DE): −10,7 (−30 a 8,6) mg/dL | El gasómetro es una alternativa fiable. Aunque los valores de glucosa fueron bastante cercanos en promedio, observaron discrepancias clínicamente relevantes en el rango de hipoglucemia |
| Prakash et al.49/2018/EE. UU. | Observacional retrospectivo | 1.765 pacientes | 9.192 | NP | ABL800 Flex | Roche | Arterial o venosa | BA: sesgo (límites de acuerdo 95%): 1,8 (−12,8 a 16,61) mg/dLCCI (IC95%): 0,98 (0,980 a 0,982) | Existe concordancia de moderada a sustancial entre laboratorio central y gasómetro. Sin embargo, los 2 métodos pueden utilizarse indistintamente. Para la práctica clínica es importante utilizar el mismo método de prueba |
| Pilackas et al.34/2020/EE. UU. | Prospectivo de cohorte | 46 pacientes | 85 | Precision Xceed Pro® | NP | ND | Capilar (glucómetro), venosa (laboratorio) | BA: sesgo (límites de acuerdo 95%): 5,23 (−32,2 a 42,7) mg/dL | Existe una pequeña diferencia media entre las mediciones. La prueba de glucosa capilar POC en pacientes críticos similares es probablemente segura y efectiva |
| Deng et al.38/2021/China | Observacional prospectivo | 73 pacientes | ND | CONTOUR® TS | GEM® Premier™ 3000 | NP | Capilar (glucómetro), arterial (gasómetro) | BA: sesgo (IC95%): 14,58 (−13,86 a 43,02) mg/dL | Se obtuvieron diferencias estadísticamente significativas pero aceptables en el entorno clínico |
| He et al.52/2021/China | Observacional retrospectivo, serie de casos | 82 pacientes | ND | Medisafe® | NP | Beckman Coulter AU5800 | ND | BA: sesgo (límites de acuerdo 95%): −43,83 (−177,97 a 90,32) mg/dL | Las imprecisiones de las lecturas de glucosa en el punto de atención no representan un riesgo clínico significativo. Los valores fueron significativamente más bajos con el glucómetro |
| Howell et al.36/2021/EE. UU. | Observacional retrospectivo, serie de casos (cohorte) | 14 pacientes | 46 | Accu-Chek® Inform II | NP | Cobas® c702 | Capilar (glucómetro), venosa (laboratorio) | BA: sesgo (IC95%): 0,33 (−57,7 a 58,1) mg/dL | Muchos pacientes con sepsis y terapia de vitamina C intravenosa pueden ser controlados con la monitorización de glucosa POC utilizando el Accu-Chek® Inform II POC BGM sin un impacto clínico significativo |
| Rodríguez-Delgado et al.40/2022/España | Observacional transversal | 54 pacientes | 297 | FreeStyle® Optium Neo | NP | NP | Capilar, venosa y arterial | BA: sesgo (±2 DE):Arterial vs. capilar:5,01 (±41,32) mg/dLArterial vs. venosa:−11,80 (±61,13) mg/dLVenosa vs. capilar:16,81 (±71,26) mg/dL | La concordancia de las muestras arteriales, capilares y venosas son bajas con glucómetro. El control de la glucemia con glucómetros, en pacientes críticos, deben utilizar muestras arteriales y en caso de hipoglucemia deben comprobarse con un analizador de gases |
BA: Bland y Altman; CCI: coeficiente de correlación intraclase; DE: desviación estándar; IC95%: intervalo de confianza del 95%; ND: no describe; NP: no precisa; POC: point of care; RIC: rango intercuartílico; UCI: Unidad de Cuidado Intensivos.
Los glucómetros evaluados en esta revisión son muy heterogéneos y se utilizaron diferentes métodos de análisis (Material Suplementario. Tabla S2).
Fiabilidad de las determinaciones capilares con glucómetroSon 19 los estudios que utilizan muestras capilares medidas con glucómetro y las comparan con los valores del laboratorio central o con un gasómetro POC. De los 17 estudios que comparan la glucemia medida con glucómetro vs. laboratorio, 11 autores21–31 contraindican su uso y 2 autores32,33 no lo recomiendan si los pacientes están sometidos a tratamiento intravenoso con catecolaminas. Solo 3 estudios34–36 consideran que las diferencias halladas entre ambas mediciones no limita el uso de los glucómetros en la monitorización de la glucemia, al igual que los 2 estudios37,38 que comparan las muestras capilares medidas con glucómetro vs. gasómetro POC. Cordero Saucedo et al.39 consideran que son necesarios más estudios para evaluar la eficacia; sus resultados no son concluyentes. Rodríguez-Delgado et al.40 comparan muestras capilares, arteriales y venosas con un mismo glucómetro y desaconsejan la utilización de muestras capilares, especialmente cuando los pacientes tienen perfusión de fármacos vasoactivos.
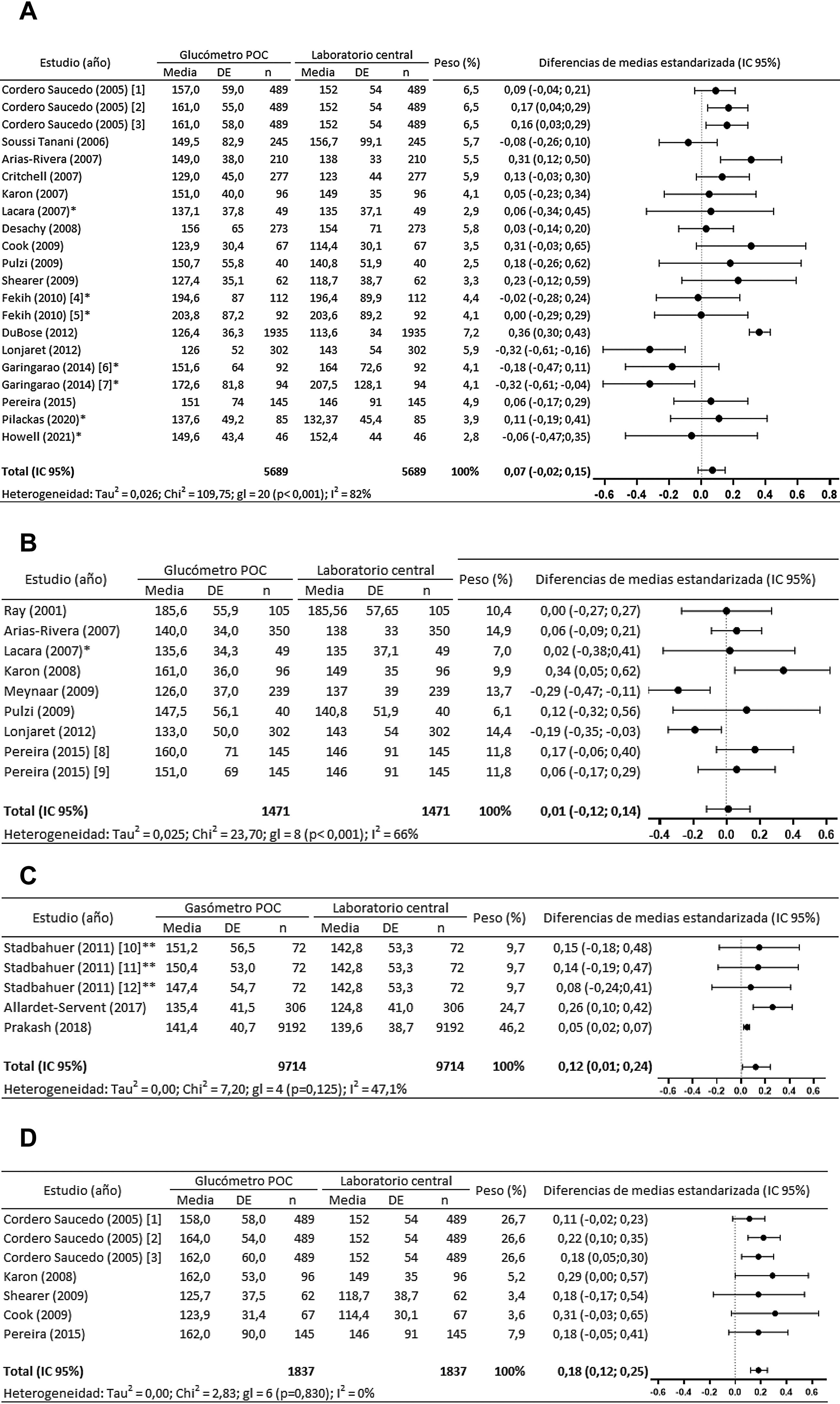
En el metanálisis de los 17 estudios (21 comparaciones) que analizaron las muestras capilares con glucómetro vs. laboratorio, se observa que en 4 comparaciones de 3 estudios22,26,39 se sobreestiman de forma significativa las mediciones del glucómetro y en 2 comparaciones30,32 se infraestiman significativamente. Globalmente se observa una sobreestimación de las determinaciones medidas con el glucómetro, aunque las diferencias de las medias (IC95%) no son significativas (0,07 [−0,02 a 0,15] mg/dL) (fig. 2a).
Metanálisis. 2a. Metanálisis de muestras capilares con glucómetro POC vs. laboratorio central. 2b. Metanálisis de muestras arteriales con glucómetro POC vs. laboratorio central. 2c. Metanálisis de muestras arteriales con gasómetro POC vs. laboratorio central. 2d. Metanálisis de muestras venosas con glucómetro POC vs. laboratorio central.
IC95%: intervalo de confianza del 95%; gl: grados de libertad; [1]: Ascensia EliteTM; [2]: Precision Q.I.D®; [3]: SureStepTM Plus; [4]: pacientes estables; [5]: pacientes con catecolaminas; [6]: pacientes normotensos; [7]: pacientes hipotensos; [8]: Precision PCX®; [9]: Accu-check Advantage II®; [10]: Cobas B 221; [11]: ABL800 Flex; [12]: GEM Premier; *: datos estimados; **: datos proporcionados por la autora.
Las muestras arteriales son analizadas por 11 autores, 9 comparando la determinación en glucómetro vs. valores de laboratorio21–23,29,30,35,41–43 y 2 comparando el glucómetro con un gasómetro POC44,45. De los 9 estudios que comparan las determinaciones de glucemia entre glucómetro y laboratorio, 7 recomiendan su uso21–23,29,41–43 y 230,35 consideran que no hay buena concordancia entre glucómetro y laboratorio, desaconsejando su uso, al igual que los 2 estudios que comparan glucómetro con gasómetro POC44,45. Los 2 estudios40,46 que comparan muestras de diferente procedencia con un mismo glucómetro se muestran a favor de su utilización con muestras arteriales.
En el metanálisis de 8 estudios (9 comparaciones) donde se evalúan las diferencias entre las glucemias medidas con el glucómetro vs. laboratorio central se observan diferencias significativas en 3 estudios: Karon et al.35 sobreestiman el valor de la glucemia en el glucómetro, mientras que Lonjaret et al.30 y Meynaar et al.42 la infraestiman, pero globalmente observamos que la diferencia de las medias (IC95%) es muy pequeña y no significativa (0,01 [−0,12 a 0,14] mg/dL) (fig. 2b).
Los 4 estudios43,47–49 que comparan las glucemias medidas entre los gasómetros POC y el laboratorio consideran las mediciones en el gasómetro como fiables. En el metanálisis (fig. 2c) observamos cómo el gasómetro siempre sobreestima y que las diferencias entre la valoración, medidas con el gasómetro POC y el laboratorio, son significativas en 2 comparaciones48,49. La valoración global de la diferencia de las medias (IC95%) también es significativa (0,12 [0,01 a 0,24] mg/dL).
Fiabilidad de las determinaciones venosas con glucómetroLos 5 estudios localizados que comparan las glucemias venosas medidas con glucómetro vs. laboratorio23–25,35,39 desaconsejan el uso del glucómetro. En el metanálisis de estos 5 estudios (7 comparaciones) podemos observar cómo el valor global muestra una sobreestimación significativa en la diferencia de las medias (IC95%) entre la medición del glucómetro vs. laboratorio (0,18 [0,12 a 0,25] mg/dL) (fig. 2c).
Fiabilidad de las determinaciones de muestras sin origen especificadoAlgunos autores analizaron la fiabilidad de las glucemias sin especificar el origen de la muestra. Tanto Castaño López et al.50 como Lacara et al.21 recomiendan el glucómetro si la muestra de sangre es arterial o venosa y lo desaconsejan si es capilar. Finkielman et al. y He et al.51,52 consideran que las mediciones del glucómetro son poco fiables.
Análisis de los factores de influencia sobre la imprecisión de la medición de glucosa mediante dispositivos POCDe los 32 artículos incluidos en esta revisión, 15 (46,87%) analizan la influencia de determinadas variables sobre la imprecisión de los dispositivos POC frente a laboratorio. Se evalúa la influencia de un total de 18 variables que podrían justificar la falta de concordancia entre los valores medidos con distintos dispositivos (tabla 2).
Influencia de las variables confusoras sobre la diferencia de valores de glucemia entre métodos y/o muestras
| Estudio | Variable confusora | Resultados | Conclusiones |
|---|---|---|---|
| Finkielman et al.51, 2005, EE. UU. | Hipotensión arterial (PAM<60mmHg):Glucómetro (NDM) y laboratorio (NDM) | BA: sesgo (límites de acuerdo del 95%):No hipotensión: sesgo 8 (−27,2 a 43,7) mg/dLHipotensión: sesgo 8,9 (−19,8 a 37,6) mg/dL | La presencia de hipotensión no parece afectar a la diferencia entre el valor del glucómetro y laboratorio |
| Vasopresores:Glucómetro (NDM) y laboratorio (NDM) | BA: sesgo (límites de acuerdo del 95%):No vasopresores: 7,8 (−31,2 a 46,7) mg/dLVasopresores: 9 (−12,2 a 30,2) mg/dL | La presencia de vasopresores no parece afectar a la diferencia entre el valor del glucómetro y laboratorio. No repercusión | |
| Kulkarni et al.37, 2005, Australia | Hipoperfusión sistémica (PAS<90mmHg o necesidad NAD o adrenalina):Gasómetro POC-arterial y glucómetro-capilar | BA: sesgo (límites de acuerdo del 95%):Hipoperfusión sistémica: 4 (−36,8 a 28,4) mg/dL | En pacientes con hipoperfusión sistémica, la hipoglucemia puede pasar desapercibida si se usan ambas técnicas indistintamente. Se aconseja precaución con el uso intercambiable de estas |
| Arias-Rivera et al.22, 2007, España | Hemoglobina:Glucómetro-arterial y laboratorio-arterial | BA: sesgo (límites de acuerdo del 95%):<10g/dL: 8 (−9 a 26) mg/dL;>12g/dL: −13 (−50 a 24) mg/dL | Las mediciones con sangre capilar pueden tener mayor imprecisión en relación con la concentración de hemoglobina. Existe una sobreestimación con niveles<10 mg/dL y una infraestimación si es>12 mg/dL |
| HTA:Glucómetro-arterial y laboratorio-arterial | BA: sesgo (límites de acuerdo del 95%):HTA: 0,4 (−27 a 27) mg/dLNo HTA: 4 (−25 a 34) mg/dL | La HTA no influye en la diferencia de valores entre métodos con sangre arterial, aunque se observa una mayor diferencia en pacientes normotensos | |
| Terapia con insulina IV:Glucómetro-arterial y laboratorio-arterial | BA: sesgo (límites de acuerdo del 95%):Insulina IV: 5 (−23 a 33) mg/dL | Las mediciones pueden tener un mayor error en aquellos que están recibiendo perfusión de insulina. El dispositivo POC puede sobreestimar los valores de glucemia obtenidos en laboratorio | |
| DM:Glucómetro-arterial y laboratorio-arterial | BA: sesgo (límites de acuerdo del 95%):DM: 5 (−27 a 37) mg/dLNo DM: 1 (−26 a 29) mg/dL | Las mediciones pueden tener un mayor error y dispersión en pacientes con diabetes previa frente los que no la padecen, observándose una tendencia a la sobreestimación | |
| Enfermedad de ingreso:Glucómetro-arterial y laboratorio-arterial | BA: sesgo (límites de acuerdo del 95%):Médica: 2 (−27 a 31) mg/dLQuirúrgica: 1 (−27 a 29) mg/dLPolitraumatizados: 7 (−17 a 31) mg/dL | Las mediciones pueden tener un mayor error y dispersión en pacientes politraumatizados frente a aquellos que ingresaron por una enfermedad médica o quirúrgica. El dispositivo POC sobreestimó la glucemia frente al laboratorio | |
| Critchell et al.28, 2007, EE. UU. | Vasopresores:Glucómetro-capilar y laboratorio-venosa | AR: OR (intervalo de confianza 95%):OR: 2,81 (1,5-5,4) | El uso de agentes vasopresores se asocia con mayor riesgo de resultados discordantes, sobreestimando los valores de glucosa del laboratorio |
| Edema en miembro superior (0: no; 1: ligero; 2: moderado; 3: grave):Glucómetro-capilar y laboratorio-venosa | AR: OR (intervalo de confianza 95%):OR edema grado 2-3: 2,1 (1,05-4,19) | El edema en miembro superior de grado moderado y grave se asocia a un incremento en la probabilidad de resultados discordantes de glucemia entre laboratorio y glucómetro | |
| Lacara et al.21, 2007, EE. UU. | Hematocrito:Glucómetro-arterial/capilar y laboratorio-arterial/venosa | AR (p):Punción capilar todos los pacientes, p=0,10POC catéter arterial o venoso central todos los pacientes, p=0,04POC punción capilar en pacientes con catéter arterial, p=0,24POC catéter arterial todos los pacientes con catéter arterial, p=0,02 | Los niveles de hematocrito por debajo de rangos normales mediante glucómetro y sangre arterial tienden a sobreestimar los valores de glucosa del laboratorio. En situaciones individuales con niveles anormales de hematocrito, se debe verificar la exactitud del POC comparándolos con el laboratorio con muestras obtenidas al mismo tiempo |
| Niveles de pCO2:Glucómetro-arterial/capilar y laboratorio-arterial/venosa | AR (p):Punción capilar todos los pacientes, p=0,09POC catéter arterial o venoso central todos los pacientes, p=0,004POC punción capilar en pacientes con catéter arterial, p=0,04POC catéter arterial todos los pacientes con catéter arterial, p=0,002 | Los niveles de pCO2 influyen sobre la diferencia de valores de glucemia entre métodos y muestras | |
| PAM:Glucómetro-arterial/capilar y laboratorio-arterial/venosa | AR (p):Punción capilar todos los pacientes, p=0,43POC catéter arterial o venoso central todos los pacientes, p=0,77POC punción capilar pacientes con catéter arterial, p=0,40POC catéter arterial todos los pacientes con catéter arterial, p=0,55 | Los valores de PAM no influyen en la diferencia de valores entre métodos y muestras | |
| Desachy et al.27, 2008, Francia | PAM<70mmHg y necesidad de NAD o adrenalina:Glucómetro-capilar y laboratorio (NDM) | AR: OR (intervalo de confianza del 95%), p:OR de 0,96 por 1mmHg (0,93-0,99 por 1mmHg), p=0,007 | La PAM se asoció a valores en conflicto entre la diferencia de valores entre POC-capilar y laboratorio, sobreestimando los valores de este |
| Índice de perfusión (bajo: <0,3; aceptable: 0,3 y 1; óptimo:> 1)Glucómetro-capilar y laboratorio (NDM) | AR: OR (intervalo de confianza del 95%), p:OR de 1 punto de unidad, 0,80 (0,65 a 0,99), p=0,04 | Valores bajos en el índice de perfusión reflejan una hipoperfusión periférica y se asocian a un mayor riesgo de valores erróneos de glucemia capilar, por lo que, en estos casos, puede que no esté justificada la realización de pruebas capilares | |
| Moteado generalizado (acrocianosis y vasoconstricción cutánea subjetiva en dedo)Glucómetro-capilar y laboratorio (NDM) | AR: OR (intervalo de confianza del 95%), p:OR de 3,58 (1,09 a 11,84), p=0,04 | La presencia de moteado generalizado se asoció a un mayor número de valores en conflicto entre la diferencia de valores POC-capilar y laboratorio, sobreestimando los valores de este | |
| Meynaar et al.42, 2009, Países Bajos | Hematocrito:Glucómetro (corregido hematocrito 1,086mg/dL)-arterial y laboratorio-arterial | BA: sesgo (CV [%]):Hematocrito 15-19%: 9mg/dL (CV 6%)Hematocrito 20-24%: −2mg/dL (CV 2%)Hematocrito 25-29%: −3mg/dL (CV −2%)Hematocrito 30-34%: 3mg/dL (CV 1%)Hematocrito 35-39%: −2mg/dL (CV −2%)Hematocrito 39-44%: 2mg/dL (CV 1%)Hematocrito 45-49%: 30mg/dL (CV 25%) | La precisión de AccuChek® es independiente del hematocrito.El hematocrito no influyó sistemáticamente en el resultado AccuChek® corregido en el rango de 0,20 a 0,45. Fuera de este rango, no hubo datos suficientes |
| Fekih et al.33, 2010, Túnez | Shock (PAS≤90mm Hg) y terapia vasopresora:Glucómetro-capilar y laboratorio-venosa | BA: sesgo (límites de acuerdo 95%):No shock ni catecolaminas: 0,9 (−74,34 a 72,54) mg/dLShock y catecolaminas: 5,22 (−90,9 a 101,34) mg/dL | La medición de glucosa en sangre por punción capilar no refleja con precisión el nivel de glucosa sérica en pacientes en estado crítico que reciben infusión de catecolaminas, sobreestimando los valores de laboratorio |
| Juneja et al.46, 2011, India | Shock y vasopresores (≥0,1μg/kg/min NAD para mantener PAM>70mmHg):GlucómetroMuestra arterial y capilar | BA: sesgo (límites de acuerdo 95%):Shock: 7,28mg/dL (−49,1 a 63,7) mg/dLNo shock: −0,43 (−26,1 a 25,2) mg/dL | La monitorización de la glucemia capilar solo es fiable en un grupo de pacientes de UCI. Se debe tener precaución en pacientes con shock y fármacos vasoactivos, siendo preferible la sangre arterial. La muestra capilar infraestimó los valores de glucosa arterial |
| DuBose et al.26, 2012, EE. UU. | Shock (PAS≤90mmHg o PAM<70 mHg):Glucómetro-capilar y laboratorio-arterial/venosa (NDM)Acuerdo definido como diferencia de valores de glucosa entre instrumentos<15% | BA: sesgo (límites de acuerdo 95%):Todas las muestras: 12,4 (−22,4 a 47,2) mg/dLShock: 13,4 (−27,1 a 53,9) mg/dLNo shock: 12,6 (−20,6 a 45,8) mg/dLGrado de acuerdo según el estado glucémico y situación de shock:Población general: acuerdo total 59,9% (hipoglucemia 34,0%; normoglucemia 62,9%; hiperglucemia 68,4%)Shock: acuerdo total 62,9% (hipoglucemia 41,5%; normoglucemia 69,1%; hiperglucemia 56,8%)No shock: acuerdo total 59,2% (hipoglucemia 30,3%; normoglucemia 61,4%; hiperglucemia: 78,5%) | Existe una pobre correlación entre los valores de glucosa capilar y de laboratorio en estados de shock y sin shock tras un traumatismo. En rangos cercanos a los umbrales hipoglucémicos o que los excedan, se deben usar mediciones de laboratorio tradicionales para confirmar los valores registrados usando metodología de muestreo de glucosa capilar antes del inicio del tratamiento.La glucemia capilar sobreestimó los valores de glucosa determinados en laboratorio |
| Garingarao et al.32, 2014, Filipinas | Shock (PAM<70mmHg o necesidad de soporte vasopresor):Glucómetro-capilar y laboratorio-venosa (NDM) | BA: sesgo (límites de acuerdo 95%):Normotensión: −12,4 (−86,0 a 61,2) mg/dLHipotensión: −34,9 (−207,1 a 137,4) mg/dL | Las mediciones de glucosa mediante el dispositivo POC en sangre capilar en pacientes críticamente enfermos pero normotensos brindan una precisión aceptable (al menos para la tecnología de medición utilizada) siempre que no estén presentes factores de confusión conocidos y se sigan técnicas de recogida estandarizadas |
| Pereira et al.23, 2015, EE. UU. | Hematocrito:Glucómetro 1 (GDH-NAD)-arterialGlucómetro 2 (GDH-PQQ)-arterial/capilar/venosaLaboratorio-arterial | BA: sesgo (límites de acuerdo 95%), p:Glucómetro 1-arterial: −0,89 (−1,38 a −0,40) mg/dL, p<0,001Glucómetro 2-arterial: −0,74 (−1,29 a −0,19) mg/dL, p=0,009Glucómetro 2-capilar: −1,04 (−1,75 a −0,32) mg/dL, p=0,005 | Los niveles de hematocrito influyen en la imprecisión de los valores de glucemia con el dispositivo POC, sobreestimando los valores de glucosa de laboratorio |
| pH:Glucómetro 1-arterialGlucómetro 2-arterial/capilar/venosaLaboratorio-arterial | BA: sesgo (límites de acuerdo 95%), p:Glucómetro 2-venosa: −77,4 (−135,7 a −19,1) mg/dL, p=0,010Glucómetro 2-arterial: −34,8 (−62,8 a −6,7) mg/dL, p=0,009 | El error con el glucómetro Accu-Chek® Advantage II (GDH-PQQ) aumenta con niveles de pH más bajos. La glucemia capilar sobreestima los valores de laboratorio | |
| Vasopresores:Glucómetro 1 (GDH-NAD)-arterialGlucómetro 2 (GDH-PQQ)-arterial/capilar/venosaLaboratorio-arterial | BA: sesgo (límites de acuerdo 95%), p:Glucómetro 2-capilar: −25,8 (−40,1 a −11,5) mg/dL, p=0,001Además de estar asociado con el sesgo medio, el aumento de los valores de glucosa en sangre también se asoció con límites de concordancia del más grande, lo que implica que la precisión disminuye durante la hiperglucemia | El error mediante el dispositivo POC Accu-Chek® Advantage II (GDH-PQQ) y sangre capilar se ve aumentado con el uso de noradrenalina. La glucemia capilar infraestima la glucemia de laboratorio | |
| He et al.52, 2021, China | Ácido ascórbicoGlucómetro-capilar y laboratorio (NDM) | BA: sesgo (límites de acuerdo 95%):Terapia ácido ascórbico: −43,83 (−177,97 a 90,32) mg/dLCumplimiento según dosis administrada de vitamina C (%):Dosis bajas 38,30%Dosis altas 34,29%Precisión según la presencia de fracaso renal (%):No deterioro 45,24%Deterioro renal: 37,50%CRRT 22,22%Aclaramiento renal aumentado 20% | Altas dosis de vitamina C en infusión IV pueden interferir en las mediciones del dispositivo POC respecto al laboratorio, infraestimando los valores de glucemia. Los pacientes que reciben altas dosis de vitamina C deberían ajustar los resultados del glucómetro con los de laboratorio. Además, la función renal puede representar otro factor importante de imprecisión del dispositivo POC |
| Howell et al.36, 2021, EE. UU. | Ácido ascórbicoGlucómetro-capilar y laboratorio-venosa | BA: sesgo (límites de acuerdo 95%):Terapia ácido ascórbico: 0,33 (−57,7 a 58,1) mg/dLCumplimiento de criterios ISO según función renal:No IR 82,4%IR 45,55%CRRT 83,3% | El tratamiento con vitamina C aumenta la disconformidad entre las mediciones del dispositivo POC y el laboratorio. Nuestro estudio evidencia que la función renal tiene un impacto en el riesgo de imprecisiones en el dispositivo POC, sobreestimando los valores de laboratorio |
| Rodríguez-Delgado et al.40, 2022, España | Hematocrito:GlucómetroMuestra arterial, capilar y venosa | Análisis de desacuerdo-supervivencia (p):Niveles de hematocrito (≤25% o>25%): test Log Rank, p=0,1 | Los niveles de hematocrito no influyeron en la concordancia de valores de glucosa arterial, capilar y venosa central, determinados por un dispositivo POC (GDH-NAD) |
| pH:GlucómetroMuestra arterial, capilar y venosa | Análisis de desacuerdo-supervivencia (p):pH (<7,35; 7,35-7,45;>7,45): test Log Rank, p=0,7 | Los trastornos en el equilibrio ácido-base no influyen en la concordancia de valores de glucosa arterial, capilar y venosa central | |
| Lactato:Glucómetromuestra arterial, capilar y venosa | Análisis de desacuerdo-supervivencia (p):Nivel sérico de ácido láctico (≤2 o>2 mmol/L): test Log Rank, p=0,002 | Las muestras de sangre capilar infraestiman la glucemia en pacientes con acidosis láctica, mientras que las venosas la sobreestiman por contaminación de la muestra | |
| Fallo hemodinámico:GlucómetroMuestra arterial, capilar y venosa | Análisis de desacuerdo-supervivencia (p):Fallo hemodinámico (puntuación SOFA≥4): test Log Rank, p=0,02Subpoblación sin fallo hemodinámico (puntuación SOFA<4): se mejora el grado de concordancia en el conjunto de pacientes. Los valores de corte para el 10% de desacuerdo es una diferencia absoluta de 16mg/dL | Las muestras con sangre venosa sobreestiman la glucemia (por contaminación de la muestra), mientras que las capilares la infraestiman | |
| Vasopresores:GlucómetroMuestra arterial, capilar y venosa | Análisis de desacuerdo-supervivencia (p):Tratamiento con noradrenalina (capilar y arterial). Análisis de los valores atípicos (diferencia>40mg/dL): el tratamiento de apoyo con noradrenalina fue significativamente mayor (dosis de 0,27μg/kg/min frente a 0,69μg/kg/min, p=0,003) para los valores atípicos | Las muestras de sangre capilar subestiman la glucemia en pacientes con fármacos vasoactivos (noradrenalina a una dosis>0,1μg/kg/min) | |
| Relleno capilar:GlucómetroMuestra arterial, capilar y venosa | Análisis de desacuerdo-supervivencia (p):Relleno capilar disminuido (>2s): test Log Rank (arterial y capilar), p<0,001) | El relleno capilar disminuido afecta a la concordancia arterial y capilar determinadas por glucometría, infraestimando los valores cuando se realiza con sangre capilar | |
| Insulina IV:GlucómetroMuestra arterial, capilar y venosa | Análisis de desacuerdo-supervivencia (p):Terapia insulina IV: test Log Rank (capilar y arterial), p=0,03 | Las muestras de sangre capilar subestiman la glucemia en pacientes con terapia de insulina IV |
AR: análisis de regresión; BA: Bland y Altman; CRRT: terapias de reemplazo renal; CV: coeficiente de variación; DM: diabetes mellitus; GDH-NAD: glucosa deshidrogenasa con nicotinamida-adenina-nucleótido; GDH-PQQ: glucosa-deshidrogenasa-pirrolquinolinaquinona; HTA: hipertensión arterial; IR: insuficiencia renal; IV: intravenosa; NAD: noradrenalina; NDM: no describe muestra; OR: odds ratio; PAM: presión arterial media; PAS: presión arterial sistólica; POC: point of care; UCI: Unidad de Cuidados Intensivos.
Entre los 4 estudios21,23,40,42 que analizan la influencia del hematocrito sobre la falta de precisión del dispositivo POC, encontramos conclusiones discrepantes. Dos autores40,42 constatan que el hematocrito no influye sistemáticamente sobre la precisión del dispositivo POC, mientras que otros 221,23 concluyen que el hematocrito sí afecta en la precisión. Pereira et al.23 consideran que esta imprecisión se incrementa con el uso de muestras capilares en glucómetros que utilizan para su análisis la glucosa deshidrogenasa pirroloquinolina quinona (GDH-PQQ). Lacara et al.21 observan que, ante niveles de hematocrito por debajo de rangos normales, el glucómetro con muestras arteriales tiende a sobreestimar los valores de la glucosa.
HemoglobinaSolo un estudio22 analizó la hemoglobina como factor de influencia sobre la disconformidad de la glucemia entre los distintos dispositivos. En este estudio se observa que las mediciones POC de glucosa con sangre arterial tienen una mayor imprecisión en relación con la concentración de hemoglobina del paciente; ante valores de hemoglobina>12mg/dL, el dispositivo POC tiende a infraestimar la glucemia, mientras que con niveles de hemoglobina<10mg/dL la sobreestima.
Equilibrio ácido-base: concentración de iones de hidrógeno y presión parcial de dióxido de carbonoLa influencia del equilibrio ácido-base sobre la falta de concordancia entre valores de glucemia medida con diferentes métodos es analizada en 3 estudios, a través de la concentración de iones de hidrógeno (pH)23,40 y de los niveles de presión parcial de dióxido de carbono (pCO2)21.
Se observa disparidad de resultados. Mientras Rodríguez-Delgado et al.40 determinan que los trastornos del equilibro ácido-base no influyen en la concordancia de valores de glucosa arterial y capilar en el paciente crítico, Pereira et al.23 determinan que el pH sobreestima los valores de la glucosa y que este error se ve incrementado cuanto más bajos son los valores del pH.
Lacara et al.21 concluyen que la pCO2 debe ser considerada un factor de influencia sobre la imprecisión, aunque no especifican cómo repercute.
Situación hemodinámicaNueve artículos analizan la influencia de la situación hemodinámica sobre la disconformidad de resultados entre instrumentos y muestras a través de diferentes parámetros: a través del ácido láctico y la puntuación SOFA40, del estado de shock26,32,33,46, de la hipotensión arterial51, la presión arterial media21,27 y la hipertensión arterial22.
De forma general, 6 de estos estudios observan que la situación hemodinámica influye en la imprecisión del dispositivo POC, 3 infraestimando la glucemia32,40,46 y otros 3 sobreestimándola26,27,33. Tres de las investigaciones realizadas21,22,51 no observaron que la situación hemodinámica afectase a la concordancia entre valores del dispositivo POC y el laboratorio.
Rodríguez-Delgado et al.40 observan que en pacientes con hiperlactacidemia (>2mmol/L), retraso en el relleno capilar (>2s) y situación de fallo hemodinámico (SOFA>4), la concordancia entre valores de glucosa capilar y arterial se ve afectada, observándose que las muestras de sangre capilar infraestiman la glucemia frente a las determinadas en sangre arterial, y que las muestras venosas, por el contrario, la sobreestiman. La única explicación posible es la contaminación de la muestra, por lo que desaconsejan utilizar este tipo de muestra sanguínea para tal fin.
Por otro lado, 4 de los estudios evalúan el shock como variable de confusión para la imprecisión del dispositivo POC, aunque también observamos disparidad de resultados. En 2 de estos estudios26,33 evidencian una sobreestimación sistemática de la glucemia en el dispositivo POC en pacientes en situación de shock frente a pacientes normotensos. DuBose et al.26, además, constatan que esta diferencia de valores de glucemia entre métodos se ve incrementada en el rango de la hipoglucemia. En el caso de los estudios realizados por Juneja et al.46 y Garingarao et al.32, se observa la influencia del shock sobre la falta de precisión de dispositivos POC, con una clara tendencia a la sobreestimación de la glucemia capilar, por lo que desaconsejan el uso de estas en pacientes con inestabilidad hemodinámica, recomendando utilizar muestras arteriales para la monitorización de la glucosa. Sin embargo, Finkielman et al.51 concluyen que la presencia de hipotensión en el paciente crítico no parece afectar a la diferencia de valores de glucosa entre dispositivos.
En relación con la presión arterial media como posible factor de confusión, Lacara et al.21 no constatan que exista una asociación entre esta y las diferencias de glucemias entre métodos, mientras que Desachy et al.27 sí que la asocian con un mayor número de valores en conflicto, observando una sobreestimación sistemática de la glucemia capilar con el dispositivo POC.
Para pacientes con hipertensión arterial, la investigación realizada por Arias-Rivera et al.22 concluye que no existe afectación de la precisión del dispositivo cuando la medición es realizada con muestras de sangre arterial.
Perfusión tisularCuatro estudios analizan la perfusión tisular como variable confusora sobre la precisión del dispositivo POC y la mayoría observan que puede ser considerada un factor de influencia sobre la imprecisión de este dispositivo.
Critchell et al.28 manifiestan que el edema en los dedos de grado ii-iii afecta a la precisión del glucómetro cuando se utilizan muestras capilares, observándose una tendencia a la sobreestimación. Por el contrario, Desachy et al.27 evalúan el estado de perfusión tisular mediante el índice de perfusión y la presencia de alteraciones vasculares cutáneas (moteado generalizado), observando que valores bajos en el índice de perfusión y la existencia de un moteado generalizado como indicador de hipoperfusión periférica están asociados a un mayor riesgo de valores erróneos en la glucemia capilar, tanto sobreestimando como infraestimando. Rodríguez-Delgado et al.40 constatan que la presencia de relleno capilar disminuido puede afectar a la concordancia entre muestras arteriales y capilares determinadas mediante glucometría, aunque no especifican cómo afecta.
Los resultados obtenidos por Kulkarni et al.37 no consiguen demostrar que exista una asociación entre la imprecisión de las muestras capilares con glucómetro y la situación de hipoperfusión sistémica.
Terapia vasopresoraSeis investigaciones analizan la influencia de fármacos vasopresores sobre la precisión de los dispositivos POC en el paciente crítico. Cinco de las investigaciones realizadas23,28,33,40,46 demuestran que existe un mayor riesgo de resultados discordantes cuando se realiza la medición con sangre capilar en pacientes críticos con soporte vasopresor, observándose una infraestimación sistemática de esta, especialmente con dosis de noradrenalina superior a 0,1μg/kg/min.
Finkielman et al.51, por el contrario, no observan que los fármacos vasopresores influyan en las determinaciones de glucosa medidas con glucómetro, basado en el método de análisis de la glucosa-oxidasa, aunque en su estudio no se detalla el tipo de muestra utilizada.
Otra terapia farmacológica: insulina intravenosa y vitamina CCuatro investigaciones analizan la influencia de la farmacoterapia sobre la discordancia de valores de glucosa.
Los estudios realizados por Arias-Rivera et al.22 y Rodríguez-Delgado et al.40 coinciden en que la terapia con insulina intravenosa debe ser considerada un factor de imprecisión de las determinaciones glucémicas medidas mediante glucometría, aunque existe discordancia en cuanto al modo de afectación, ya que para los primeros se produce una sobreestimación de estos valores, mientras que para los segundos sería por infraestimación.
Otras 2 investigaciones36,52 analizan la influencia del tratamiento con ácido ascórbico como factor de confusión en pacientes sépticos, coincidiendo en que esta terapia incrementa el riesgo de imprecisión del dispositivo POC. Mientras que Howell et al.36 observan una tendencia a la sobreestimación, He et al.52 determinan que se origina una infraestimación en las muestras capilares, especialmente en pacientes en situación de deterioro renal, requerimiento de terapia de reemplazo o aclaramiento renal alterado.
Antecedentes personales de diabetes mellitus y motivo de ingreso en cuidados intensivosSolo encontramos un estudio que analiza la influencia de alteraciones metabólicas previas y el tipo de enfermedad que origina el ingreso en UCI. Arias-Rivera et al.22 determinan que los pacientes con diabetes mellitus presentan un mayor riesgo de imprecisión en la determinación de glucemia en muestras arteriales mediante dispositivo POC, mientras que la enfermedad que mayor discordancia presenta es la traumatológica frente a la quirúrgica y médica.
Rendimiento analítico del dispositivo POC según criterios de intercambiabilidadDe los 32 artículos seleccionados en la revisión, 17 (53,12%) analizan el rendimiento del dispositivo POC (glucómetro/gasómetro) según diferentes criterios de intercambiabilidad (Material Suplementario. Tabla S3).
La mayoría de las investigaciones realizadas24,27–30,32,36,42–46,50,52 consideran que la monitorización de la glucemia en el paciente crítico mediante glucometría tiene una menor precisión en términos de concordancia en comparación con el método de referencia (laboratorio), principalmente cuando esta se determina con muestras capilares, en presencia de shock y soporte vasopresor, en situación de fallo renal o durante el tratamiento con vitamina C.
Tan solo 2 autores38,50 concluyen que el uso del glucómetro es preciso y fiable en términos de calidad y rendimiento del dispositivo para llevar a cabo la medición de glucosa en el ámbito de los cuidados intensivos, sobre todo con muestras arteriales.
Por el contrario, son 5 las investigaciones38,43,45,48,49 que se posicionan a favor de la determinación de la glucemia en UCI mediante gasómetro POC, presentando un buen nivel de cumplimiento respecto a los criterios de intercambiabilidad cuando es comparado con el método de referencia (laboratorio). Ningún estudio considera que el gasómetro POC es un dispositivo de baja precisión.
Calidad metodológica de los estudios incluidosLa mayoría de los estudios presentan una calidad aceptable a pesar del diseño observacional de los mismos, con una baja probabilidad de sesgo y bajo riesgo en la aplicabilidad de los resultados. El mayor riesgo de sesgo lo encontramos en la selección de pacientes, donde el 53% de los estudios presentan riesgo incierto o elevado (Material Suplementario tabla S4 y Figura S1).
DiscusiónTras esta revisión sistemática de 32 artículos, consideramos que las determinaciones con muestras arteriales y glucómetros POC son fiables para la monitorización de la glucemia en el paciente crítico adulto a pie de cama, aunque esta fiabilidad está supeditada a muchos factores, que podrían ser subsanados, en parte, con instrumentos de última generación. Las determinaciones realizadas con gasómetros POC también son fiables y su precisión no se ve afectada por factores de confusión.
Los estudios analizados en esta revisión, que comparan las glucemias medidas con muestras arteriales frente al laboratorio, tienen un sesgo que oscila entre −0,1 y 18,6mg/dL cuando se mide con glucómetro y entre −3,6 y 10,7mg/dL al medirlo con un gasómetro POC. Estos sesgos son inferiores a los reportados por Inoue et al.6 (entre −10 y 23mg/dL con glucómetro y entre −2,7 y 25,2 al medirlo con gasómetro POC). Las muestras arteriales son las que ofrecen mayor concordancia en el metanálisis y son las recomendadas por Finfer et al.3.
Si bien, ante la ausencia de un catéter arterial, se recomienda extraer las muestras de un catéter venoso3, en el metanálisis de esta revisión hemos observado que las diferencias de los valores con respecto al laboratorio son significativamente elevadas y todos los autores en esta revisión23–25,35,39 desaconsejan su uso.
La mayoría de los estudios localizados analizan la glucosa medida con muestras capilares en glucómetro frente al laboratorio. En estos estudios se han observado sesgos entre −9,87 y 12,4mg/dL, y este sesgo aumenta (−34,9 a 13,4mg/dL) en pacientes inestables o con catecolaminas. Estos datos son similares a los reportados en la revisión de Inoue et al.6, con sesgos entre −16 y 9,9mg/dL y un incremento de la inexactitud en pacientes con vasopresores. Por otro lado, y además de constatar que la glucemia medida con glucómetros es sobreestimada, observamos que con glucemias más elevadas el sesgo también se incrementa31,35. En las recomendaciones de consenso publicadas por Finfer et al.3 se considera que las muestras de sangre capilar en pacientes de UCI, particularmente en aquellos hemodinámicamente inestables o con catecolaminas, pueden inducir grandes errores en comparación con el método de referencia. La muestra capilar es la más accesible y menos invasiva, pero sin duda es la más desaconsejada en la monitorización de la glucemia de los pacientes críticos. Solo estaría recomendado el uso de muestras capilares en pacientes estables, sin catéter arterial y que no precisen un control estricto de la glucemia. Por lo tanto, tal y como se incluye en estas recomendaciones3, la monitorización intermitente de la glucemia, en el paciente crítico y hemodinámicamente inestable, debería realizarse mediante un gasómetro POC en lugar de un glucómetro, debido al mayor cumplimiento de los criterios de precisión y calidad de este dispositivo.
Los valores de glucosa, determinados mediante un gasómetro POC, difieren entre un 0,5 y un 8%43,48,49 respecto al método de referencia, acompañado de un menor porcentaje de variabilidad (2%)43 y una diferencia media de los valores de la glucemia de −10,7mg/dL48, lo que parece un sesgo asumible en el paciente crítico y que difícilmente puede conducir a un error terapéutico clínicamente relevante. Por el contrario, la práctica habitual de utilizar la glucometría debería ser descartada, debido a que el rendimiento del dispositivo se ve afectado por numerosas variables, incrementándose esta inexactitud en condiciones de inestabilidad clínica y necesidad de soporte vasopresor29,32,46, fallo renal36,52, hipoglucemia42,44,50, administración de dosis elevadas de ácido ascórbico52, mayor puntuación en escalas de gravedad y predictoras de mortalidad en el paciente crítico45 y también cuando es realizado con muestras capilares24,28,30.
Aunque se ha estudiado la influencia de numerosas variables sobre la diferencia de valores del dispositivo POC y el método de referencia, ninguno de los estudios ha analizado el impacto que supone el sesgo introducido por la suma de todas aquellas variables confusoras sobre la imprecisión del dispositivo y el riesgo clínico y morbimortalidad asociada a esta.
Hemos tenido algunas limitaciones en esta revisión. En primer lugar, hay una gran heterogeneidad entre los instrumentos utilizados y los métodos de análisis, lo que dificulta la comparación de estudios. Todos los estudios seleccionados son observacionales y algunos de ellos retrospectivos, por lo que las conclusiones deben tomarse con precaución. No hay estudios que reporten el comportamiento de los diferentes instrumentos con pacientes en hipoglucemia, por lo que desconocemos la fiabilidad en estas situaciones críticas; solo hemos localizado estudios que modificaron la muestra en laboratorio, motivo por el cual no han sido incluidos en la revisión. Algunos autores no especifican el origen de la muestra sanguínea, por lo que no podemos comparar estos estudios con otros y evaluar la fiabilidad de los instrumentos utilizados.
Hay que reseñar que la mayoría de las investigaciones que han constatado un adecuado rendimiento del glucómetro han sido realizadas basándose en normativas internacionales de precisión e intercambiabilidad más permisivas, diseñadas todas ellas para pacientes no críticos. Además, los instrumentos se han evaluado con diferentes normativas, por lo que los resultados podrían estar sesgados. Por último, no existe un criterio de consenso que delimite el sesgo aceptable para que un instrumento pueda considerarse fiable; cada autor tiene su propio criterio y no podemos concretar qué instrumentos son fiables, solo si son más fiables que otros, por presentar menor sesgo.
ConclusionesA pesar de la heterogeneidad de los instrumentos y muestras utilizados en los estudios analizados, consideramos que la monitorización de la glucemia en el paciente crítico, hemodinámicamente inestable y con necesidad de monitorización intensiva de la glucemia debería llevarse a cabo con muestras arteriales y gasómetros POC, por presentar mayor fiabilidad y no verse afectada por la variabilidad de los diferentes factores de confusión. La determinación de la glucemia en sangre capilar mediante glucometría puede ser adecuada en pacientes en situación de estabilidad o cuando no sea necesaria una vigilancia estrecha de la glucemia.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún tipo de conflicto de intereses.
A Juan Medino Muñoz, bibliotecario del Hospital Universitario de Fuenlabrada, Madrid, por la revisión de pares de la estrategia de búsqueda en bases de datos.







![Metanálisis. 2a. Metanálisis de muestras capilares con glucómetro POC vs. laboratorio central. 2b. Metanálisis de muestras arteriales con glucómetro POC vs. laboratorio central. 2c. Metanálisis de muestras arteriales con gasómetro POC vs. laboratorio central. 2d. Metanálisis de muestras venosas con glucómetro POC vs. laboratorio central. IC95%: intervalo de confianza del 95%; gl: grados de libertad; [1]: Ascensia EliteTM; [2]: Precision Q.I.D®; [3]: SureStepTM Plus; [4]: pacientes estables; [5]: pacientes con catecolaminas; [6]: pacientes normotensos; [7]: pacientes hipotensos; [8]: Precision PCX®; [9]: Accu-check Advantage II®; [10]: Cobas B 221; [11]: ABL800 Flex; [12]: GEM Premier; *: datos estimados; **: datos proporcionados por la autora. Metanálisis. 2a. Metanálisis de muestras capilares con glucómetro POC vs. laboratorio central. 2b. Metanálisis de muestras arteriales con glucómetro POC vs. laboratorio central. 2c. Metanálisis de muestras arteriales con gasómetro POC vs. laboratorio central. 2d. Metanálisis de muestras venosas con glucómetro POC vs. laboratorio central. IC95%: intervalo de confianza del 95%; gl: grados de libertad; [1]: Ascensia EliteTM; [2]: Precision Q.I.D®; [3]: SureStepTM Plus; [4]: pacientes estables; [5]: pacientes con catecolaminas; [6]: pacientes normotensos; [7]: pacientes hipotensos; [8]: Precision PCX®; [9]: Accu-check Advantage II®; [10]: Cobas B 221; [11]: ABL800 Flex; [12]: GEM Premier; *: datos estimados; **: datos proporcionados por la autora.](https://static.elsevier.es/multimedia/11302399/0000003500000001/v1_202401240454/S1130239923000238/v1_202401240454/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)

