Introducción
El tratamiento antirretroviral de gran actividad (TARGA) ha supuesto una revolución en el tratamiento de los pacientes con infección por virus de la inmunodeficiencia humana (VIH), con una importante disminución de la mortalidad y de la incidencia de enfermedades oportunistas1. Sin embargo, esta combinación de fármacos se ha mostrado incapaz de erradicar la infección por el VIH2-5, y el tratamiento antirretroviral (TARV) con al menos tres de los fármacos disponibles en la actualidad debe utilizarse de forma indefinida para conseguir una supresión mantenida de la replicación viral6. Aún estamos lejos de haber conseguido el tratamiento ideal. La complejidad de algunas pautas, la frecuente aparición de efectos adversos con la mayoría de ellas y el requerimiento de un tratamiento indefinido son obstáculos importantes para el cumplimiento correcto del tratamiento por parte de un elevado número de pacientes7-9.
Uno de los problemas que más preocupan en la actualidad en el campo de la infección por VIH es conseguir una adherencia óptima al TARV, indispensable para alcanzar una buena eficacia terapéutica a largo plazo10. El problema del cumplimiento terapéutico es multifactorial, y resultan fundamentales la simplicidad y la ausencia de toxicidad del tratamiento10-12. Sin ninguna duda, estos aspectos se relacionan directamente con la calidad de vida del sujeto con infección por VIH que requiere TARV. Colaborar en mejorar la calidad de vida del paciente es per se un objetivo de todas las actuaciones médicas. En la infección por VIH este objetivo adquiere una relevancia especial por su estrecha relación con la adherencia al tratamiento, que a su vez determinará en gran medida la eficacia y, en definitiva, la morbilidad y mortalidad a largo plazo.
Concepto
Entendemos por simplificación del TARV el cambio de un régimen con el que se ha conseguido una adecuada respuesta virológica e inmunológica por otro que mantenga esta eficacia y permita reducir la complejidad del tratamiento, proporcionando así un beneficio en la calidad de vida del paciente que puede traducirse en una mayor adherencia terapéutica.
Objetivos
Los objetivos de la simplificación del TARV pueden agruparse en dos aspectos.
Mantener la eficacia del tratamiento antirretroviral previo
1. Mantener el control virológico de la infección.
2. Mantener la respuesta inmunológica.
Al plantearse la posibilidad de una simplificación del TARV es indispensable no renunciar a la eficacia del tratamiento previo. Debe haberse demostrado que la nueva pauta terapéutica conseguirá mantener indetectable el ARN viral en plasma y la cifra de linfocitos CD4 como mínimo en la misma proporción de pacientes y como mínimo con la misma duración que el tratamiento que se desea sustituir.
Mejorar la calidad de vida del paciente y la adherencia al tratamiento antirretroviral
Reducir la complejidad
En un sentido literal, simplificar cualquier cosa significa reducir su complejidad. Podremos simplificar el TARV incidiendo en cinco aspectos:
a)Número de fármacos.
b)Número de pastillas.
c)Número de tomas al día.
d)Restricciones alimentarias.
e)Características organolépticas.
En varios estudios se ha demostrado que la adherencia al TARV se relaciona claramente con el número de comprimidos y con el número de tomas al día13. En algunos pacientes, las restricciones alimentarias y las características organolépticas de los comprimidos también pueden dificultar la adherencia al TARV.
Adaptar el tratamiento a la situación personal, social y familiar del paciente
Las características individuales de cada paciente pueden ser muy diferentes. En general, cuanto más simple es el tratamiento, más fácilmente podrá adaptarse a las necesidades del paciente; sin embargo, para algunos será más importante reducir el número de comprimidos que toman, para otros el número de tomas al día. Unos preferirán tomar el tratamiento con las comidas, otros preferirán tomarlo en ayunas. Algunas personas conceden mucha importancia a las características organolépticas de las pastillas, teniendo grandes dificultades en ingerir algunas cápsulas o comprimidos (según el tamaño, consistencia, etc.). En este sentido, es de primordial importancia conocer perfectamente los hábitos y las prioridades del paciente. Deberemos explicarle detalladamente las características de las diferentes posibilidades terapéuticas para poder elegir conjuntamente, médico y paciente, el tratamiento de simplificación más conveniente.
Prevenir, reducir o revertir la toxicidad
Si el tratamiento produce una toxicidad tan importante que obliga inexcusablemente a cambiar el tratamiento, no puede hablarse de simplificar, sino de cambiar el tratamiento por toxicidad. Existen muchos efectos adversos relativamente leves, que el paciente puede tolerar y tolera en aras de la eficacia del TARV. Es importante tener en cuenta esta toxicidad y que la simplificación terapéutica elegida incida de manera positiva sobre ella. De esta manera, además de mejorar la calidad de vida del paciente, probablemente también mejorará la adherencia a largo plazo. Con respecto a la toxicidad, debe tenerse en cuenta que los pacientes ya toleran relativamente bien el tratamiento previo con inhibidores de la proteasa (IP), de manera que los que continúan con dicho tratamiento ya no presentarán muchos de los efectos adversos agudos y algunos de los que se manifiestan a largo plazo, mientras que los que simplifican se exponen a un tratamiento que no habían recibido antes y pueden presentar todos los efectos adversos propios del o de los nuevos fármacos.
Estrategias de simplificación
La mayoría de tratamientos podrían simplificarse, pero antes de decidir el cambio de tratamiento debe valorarse a fondo si las ventajas que espera obtenerse con el nuevo tratamiento compensan los inconvenientes y la posible toxicidad que pueda acarrear.
Reducción del número de fármacos tras un tratamiento de inducción
Siguiendo los principios de tratamiento de algunas neoplasias y de algunas enfermedades infecciosas como la tuberculosis, en los años 1997-1998 se realizaron 3 estudios aleatorizados con una estrategia de simplificación del TARV basada en una primera fase de inducción con 3 o 4 antirretrovirales, seguida de una fase de mantenimiento con menos de 3 fármacos. En el primer estudio (ACTG 343)13 se inició un TARV de inducción con zidovudina (AZT), lamivudina (3TC) e indinavir (IDV) en 378 pacientes. A los 3 meses, 279 casos que habían alcanzado una carga viral inferior a 500 copias/ml iniciaron tratamiento de mantenimiento, estratificándose en 3 grupos: a) continuar el tratamiento inicial; b) AZT e IDV, y c) AZT y 3TC. Tras un seguimiento medio de 6 meses se produjo fracaso virológico en el 7, 17 y 24% de los pacientes, respectivamente. En el segundo estudio (TRILEGE)14 se administró el mismo tratamiento de inducción durante 4 a 6 meses, permitiendo el cambio de AZT por estavudina (d4T) en casos de intolerancia. A continuación, 316 pacientes con carga viral inferior a 200 copias/ml se estratificaron en 3 grupos: a) continuar el tratamiento inicial; b) IDV solo, y c) AZT (o d4T) y 3TC. El estudio se suspendió prematuramente, antes de los 6 meses de su inicio, al observar en un análisis intermedio diferencias muy significativas entre los grupos, con fracaso virológico en el 4, 23 y 23%, respectivamente. En el tercer estudio (ADAM)15 se inició tratamiento de inducción con d4T, 3TC, saquinavir (SQV) y nelfinavir (NFV). A los 6 meses los pacientes con una carga viral inferior a 50 copias/ml se aleatorizaron a: a) continuar el tratamiento inicial; b) d4T y NFV, o c) SQV y NFV. Tras conocer los resultados de los dos anteriores estudios, presentados en un congreso, los autores realizaron un análisis intermedio y suspendieron el estudio al observar diferencias muy significativas entre los grupos. Se habían aleatorizado tan sólo 31 pacientes, 25 de los cuales alcanzaron 9 meses de seguimiento. Presentaron fracaso virológico el 9, el 57 y el 71% de pacientes, respectivamente.
Los resultados de estos estudios inducen a pensar que la estrategia de inducción-mantenimiento no es útil en el tratamiento de la infección por VIH, aunque algunas de las razones que pueden contribuir al fracaso de las pautas de mantenimiento utilizadas podrían ser un tiempo de inducción demasiado corto (de 3 a 6 meses), un límite de carga viral excesivamente elevado para iniciar tratamiento de mantenimiento (de 200 o 500 copias/ml) o la inclusión de pacientes con posible resistencia a alguno de los fármacos16. En algún estudio no controlado más reciente se demuestra que prolongar el período de tratamiento de inducción hasta un año no mejora la eficacia del tratamiento de mantenimiento17,18. Se desconoce si una pauta de mantenimiento con fármacos más potentes que los utilizados en los estudios realizados, iniciada tras un período de inducción prolongado, en pacientes con carga viral indetectable determinada mediante alguna de las técnicas ultrasensibles actualmente disponibles, podría tener una eficacia suficiente como para recomendarla en un tratamiento de simplificación.
Actualmente debe considerarse contraindicada una simplificación del TARV con una pauta que incluya menos de 3 fármacos.
Sustitución de una pauta con inhibidores de la proteasa por otra más simple también con inhibidores de la proteasa
Podría considerarse dentro de las estrategias de simplificación la coadministración de pequeñas dosis de ritonavir (RTV) a regímenes con SQV, IDV o amprenavir (APV). El RTV mejora extaordinariamente la farmacocinética de otros IP, produciéndose un aumento de su concentración plasmática y una mayor eficacia terapéutica. Esta mejoría farmacocinética permite una reducción de las dosis necesarias de IP, que puede suponer una disminución del número total de comprimidos (SQV y APV), una disminución del intervalo de dosificación (pueden tomarse cada 12 h, o incluso cada 24 h, aunque en este caso el número de pastillas que deben tomarse juntas es elevado) y una mejoría de los requerimientos dietéticos (IDV).
No contemplaremos más ampliamente esta estrategia terapéutica porque consideramos que la combinación de pequeñas dosis de RTV con otros IP ya es una práctica clínica habitual y que con ella se busca principalmente el incremento de las concentraciones plasmáticas y de la eficacia terapéutica. Queda en un segundo plano la simplificación de tratamiento propiamente dicha, pues si bien pueden simplificarse algunos aspectos, en otros el tratamiento puede ser incluso más complejo, pues se administra un fármaco más y además la toxicidad no mejora.
Tampoco se comenta la posibilidad de simplificación que podría suponer el cambio de un IP potenciado con RTV, que supone la administración de dos preparados comerciales de IP con 10-12 cápsulas al día, por lopinavir/ritonavir (LPV-RTV), que supone la administración de un solo preparado comercial (Kaletra®) con 6 cápsulas al día. No existe ningún estudio en el que se haya realizado este cambio para simplificar el TARV y con el cambio no se conseguirían mejorar los efectos adversos a corto y a largo plazo de los IP.
Sustitución de una pauta con inhibidores de la proteasa por otra sin ellos
Debido a la complejidad de la mayoría de pautas que incluyen IP y a la elevada frecuencia de efectos adversos a largo plazo, su simplificación a regímenes terapéuticos sin IP ha sido y está siendo ampliamente estudiada. Se han evaluado 3 medicamentos en sustitución del o de los IP: efavirenz (EFV), nevirapina (NVP) y abacavir (ABC).
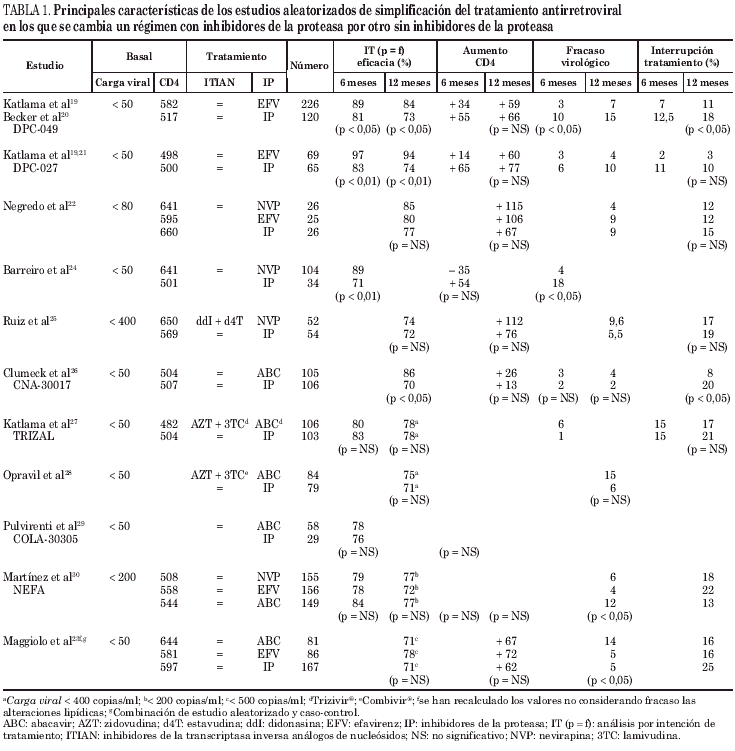
Las principales características de los estudios aleatorizados de simplificación de un régimen con IP a otro si IP puede observarse en la tabla 1.
Simplificación con EFV comparado con continuar con IP (tabla 1)
Se han realizado 3 estudios aleatorizados19-22 y un estudio caso-control prospectivo23 que comparan continuar con el IP o sustituirlo por EFV.
En el estudio DPC-04919-20 se evalúa la sustitución del IP por EFV en 346 pacientes con carga viral inferior a 50 copias/ml. La duración media del tratamiento con el IP había sido de 20 meses, recibiendo la mayoría de pacientes IDV o NFV. Se aleatorizaron 2:1 (226 con EFV y 120 con IP). A las 48 semanas de tratamiento el 11% de pacientes con EFV y el 18% con IP habían suspendido el tratamiento, pero sólo el 5 y el 4%, respectivamente, lo abandonaron por efectos adversos. Presentaron fracaso virológico el 7% de pacientes que recibían EFV y el 15% de los que continuaban con el IP. Por análisis de intención de tratamiento (IT [p = f]) EFV resultó eficaz (carga viral < 50 copias/ml) en el 84% de pacientes y el IP en el 73% (p < 0,05). El cumplimiento fue superior en el grupo de EFV. Las concentraciones de colesterol total y de triglicéridos no se modificaron de manera significativa en ninguno de los 2 grupos, pero aumentó el colesterol HDL (lipoproteínas de alta densidad) en el grupo de EFV.
El estudio DPC-02720,21, de características similares al DPC-049 con un menor número de pacientes incluidos (69 con EFV y 65 continúan el IP), muestra unos resultados muy parecidos. A las 48 semanas, el cambio a EFV fue más eficaz que continuar con el IP, observándose por IT (p = f) una carga viral inferior a 50 copias/ml en el 94 y 74%, respectivamente (p < 0,01). El colesterol total no se modificó, pero aumentó el colesterol HDL en el grupo de EFV.
Negredo et al22 comparan los cambios virológicos, inmunológicos y metabólicos que se producen al simplificar un TARV con IP con el que se ha alcanzado una cifra de linfocitos CD4 superior a 300 cél./μl y una carga viral inferior a 80 copias/ml durante más de 9 meses, por EFV (n = 25), NVP (n = 26) o continuar con el IP (n = 26). Por IT (p = f) el 80% de pacientes tratados con EFV mantenían una carga viral inferior a 80 copias/ml a las 48 semanas, frente al 77% de pacientes que continuaron con el IP (p = NS). Los linfocitos CD4 aumentaron en ambos grupos. Las cifras de colesterol y triglicéridos no se modificaron significativamente. Una limitación importante del estudio es la falta de potencia estadística por el escaso número de pacientes incluidos.
Maggiolo et al23 realizan un estudio en el que se combinan dos diseños: caso-control y aleatorizado. Los casos son 167 pacientes con carga viral inferior a 50 copias/ml en los que se suspende el IP y los controles son 167 pacientes que continúan con el IP. Los casos y los controles son comparables en la visita basal en los principales factores de riesgo de fracaso del tratamiento. Los casos se aleatorizaron a recibir EFV (86) o ABC (81), manteniendo los mismos inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN). Era un criterio de exclusión haber recibido ABC o inhibidores de la transcriptasa inversa no nucleósidos (ITINN) previamente, pero los pacientes podían haber recibido diversos ITIAN o IP. A las 48 semanas, por IT (p = f) el 70% de pacientes tratados con EFV y el 54% de pacientes que continuaron con el IP presentaban una carga viral inferior a 500 copias/ml (p < 0,05). Los autores excluyen por efectos adversos a los pacientes que presentan alteraciones lipídicas. Los pacientes que continuaron con IP presentaron más alteraciones lipídicas que los que simplificaron a EFV. Si no se considerara fracaso terapéutico estas alteraciones metabólicas, como ocurre en la mayoría de estudios, la eficacia sería del 78% para EFV y del 71% para continuar con el IP.
Así pues, en ninguno de los estudios de sustitución del IP por EFV se han modificado los ITIAN que el paciente recibía previamente. En los estudios con mayor número de pacientes la eficacia terapéutica de EFV es superior a la de continuar el IP19-21,23. Globalmente, en todos los estudios donde puede valorarse la eficacia por IT (p = f)19-23 se han incluido un total de 406 pacientes con EFV y 378 con IP. La eficacia global (carga viral < 50 copias/ml en el 80% de casos o < 500 copias/ml en el 20% de casos) a las 48 semanas en pacientes que sustituyen el IP por EFV es del 84%, oscilando entre el 78 y el 94%, y en los que continúan con el IP, la eficacia global media es del 73%, oscilando entre el 71 y el 77%. Las cifras de colesterol total y triglicéridos no suelen mejorar al simplificar el tratamiento con EFV, pero hay un aumento de colesterol HDL, lo cual representa una disminución del riesgo cardiovascular.
Simplificación con NVP comparado con continuar IP (v. tabla 1)
Se han realizado 3 estudios aleatorizados22,24,25 en los que se compara sustituir el IP por NVP o continuar con el IP.
El que incluye un mayor número de pacientes es el de Barreiro et al24: 104 simplifican a NVP, continuando con los mismos ITIAN, y 34 continúan con el tratamiento previo con IP. Sólo se dispone de resultados a las 24 semanas, con una mayor eficacia terapéutica en el grupo de simplificación (89% frente a 71%, p < 0,01). No hay diferencias significativas en la evolución del perfil lipídico.
En el estudio de Ruiz et al25 54 pacientes continúan con el tratamiento previo, con el que habían alcanzado una carga viral inferior a 400 copias/ml y 52 cambian a d4T, didanosina (ddI) y NVP. Por IT (p = f) la eficacia terapéutica a las 48 semanas fue similar en ambos grupos, tanto considerando una carga viral inferior a 400 copias/ml (79% frente a 77%; p = NS) como inferior a 50 copias/ml (74% frente a 72%; p = NS). Las concentraciones de colesterol total y triglicéridos disminuyeron de manera significativa en el grupo de NVP y no en el de IP, pero al comparar las diferencias entre los descensos de ambos grupos las diferencias no fueron significativas. En el estudio de Negredo et al22 la eficacia es similar en los pacientes que simplifican a NVP (n = 26), continuando con los mismos IP, y en los que continúan con el tratamiento previo (n = 26) (85% frente a 80%; p = NS). En el grupo de NVP se produjo una mejoría significativa del perfil lipídico.
Globalmente se dispone de resultados al año de tratamiento de un número de pacientes relativamente reducido como para obtener conclusiones válidas. Parece ser que la eficacia terapéutica se mantiene al simplificar el tratamiento. El perfil lipídico mejora con la simplificación22,25, aunque hay algunos resultados discordantes24.
Simplificación con ABC frente a continuar con IP (v. tabla 1)
Se han realizado 4 estudios aleatorizados26-29 y un estudio caso-control prospectivo23 en los que se compara continuar con el IP o sustituirlo por ABC.
Clumeck et al26 analizaron la simplificación de tratamiento sustituyendo el IP por ABC en pacientes con carga viral inferior a 50 copias/ml, continuando con los mismos ITIAN. Un criterio de inclusión en el estudio fue que el paciente no hubiera presentado fracaso virológico a tratamientos previos. Se aleatorizaron 211 pacientes, cambiando 105 a ABC y continuando 106 con el IP. Por IT (p = f), la eficacia terapéutica a las 48 semanas fue mayor en el grupo de ABC que en el del IP, tanto considerando una carga viral inferior a 400 copias/ml (88% frente a 77%; p < 0,05) como inferior a 50 copias/ml (86% frente a 70%; p < 0,05). Cuatro pacientes del grupo de ABC y dos del grupo de IP presentaron carga viral superior a 400 copias/ml. El incremento de linfocitos CD4 fue similar en ambos grupos. En el grupo de IP el perfil lipídico medio no se modificó, mientras que en el grupo de ABC disminuyeron de manera significativa los valores medios de colesterol (0,51 mmol/l) y triglicéridos (0,11 mmol/l). La proporción de pacientes con colesterol elevado (> 5,2 mmol/l) descendió más en el grupo de ABC que en el de IP (del 61 al 30% con ABC y del 66 al 48% con IP; p < 0,01). Los subtipos de colesterol no se estudiaron y cabe destacar que el perfil lipídico no se determinó en ayunas. La adherencia a las 48 semanas mejoró con ABC y empeoró con el IP con respecto a la adherencia basal.
Katlama et al27 comunicaron los resultados a las 48 semanas del estudio TRIZAL (sustitución del tratamiento con IP en pacientes con carga viral inferior a 50 copias/ml por AZT + 3TC + ABC [Trizivir®]). Se aleatorizan 209 pacientes (106 simplificaron y 103 continuaron el IP). Antes de iniciar el TARGA, el 15% de los pacientes del grupo Trizivir® y el 21% del grupo IP habían recibido tratamientos subóptimos con 1 o 2 ITIAN. Analizando por IT (p = f), el 78% de pacientes de cada grupo presentaban carga viral inferior a 400 copias/ml. Se suspendió prematuramente el tratamiento en el 17% de pacientes con ABC y en el 21% de pacientes con IP. Comparando la evolución del perfil lipídico en ambos grupos, se produjo una disminución significativamente más importante de colesterol total (0,80 frente a 0,44 mmol/l; p > 0,01) y de triglicéridos (0,17 frente a + 0,01 mmol/l; p < 0,001) en el grupo de ABC.
Opravil et al28 aleatorizan 163 pacientes con carga viral inferior a 50 copias/ml a continuar el tratamiento previo (n = 79) o a simplificarlo por AZT, 3TC (Combivir®) y ABC (n = 84). El 46 y el 36% de pacientes, respectivamente, habían recibido tratamiento previo con monoterapia o biterapia que incluía AZT. Por IT (p = f) la eficacia terapéutica (carga viral < 400 copias/ml) tras un seguimiento mediano de 68 semanas (no se realizó un corte a las 48 semanas) fue del 71% en el grupo de IP y del 75% en el grupo de ABC (p = NS). Se produjo elevación de la carga viral (> 400 copias/ml) en el 6% (IP) y en el 15% (ABC) (p = 0,06). El fracaso virológico se produjo fundamentalmente en los pacientes con monoterapia o biterapia previa con AZT. Se observó un descenso significativo del colesterol total (1,2 mmol/l) y los triglicéridos (1,0 mmol/l) en el grupo de ABC.
Pulvirenti et al29 comunican los resultados del estudio de simplificación con ABC COL-30305 a las 24 semanas de tratamiento. Se aleatorizan 87 pacientes (2:1) a cambiar el IP por ABC (58) o continuar con el IP (29). Los pacientes aleatorizados a ABC continuaron tomando además el IP durante las primeras 4 semanas. Por IT (p = f), un número similar de pacientes en cada grupo presentaba una carga viral inferior a 50 copias/ml (78% frente a 76%, respectivamente; p = NS). El aumento de linfocitos fue algo superior en el grupo de IP, pero las diferencias no fueron significativas. La adherencia fue mejor en el grupo de ABC. Las cifras de colesterol total y triglicéridos disminuyeron más en el grupo de ABC.
En el estudio de Maggiolo et al23, comentado anteriormente con la simplificación con EFV, el 65% de pacientes tratados con ABC y el 54% de pacientes que continuaron con el IP presentaban una carga viral inferior a 500 copias/ml (p < 0,05) a las 48 semanas por IT (p = f). Los pacientes que continuaron con IP presentaron más alteraciones lipídicas que los que simplificaron a ABC. Si las alteraciones lipídicas no se hubieran considerado fracaso terapéutico, la eficacia habría sido del 71% para ABC y del 71% para continuar con el IP.
Así pues, en dos de los estudios27,28 los pacientes que sustituyen el IP por ABC también cambian los ITIAN, pasando a tomar AZT, 3TC y ABC. En uno de ellos toman comprimidos de Combivir® y de ABC28 y en el otro lo toman en comprimidos de Trizivir®27. En los otros 3 estudios26,29,30 los pacientes continúan con los mismos ITIAN que recibían antes. Se dispone de resultados a las 48 semanas de 376 pacientes que simplificaron a ABC y de 455 que continuaron con IP. La eficacia global por IT (p = f) fue del 78% para ABC, oscilando entre el 71 y el 86%, y del 72% para continuar con el IP, oscilando entre el 70 y el 78%. El factor fundamental que se relaciona con fracaso virológico a ABC es la administración de pautas terapéuticas subóptimas previas, con monoterapia o biterapia23,27-29. En el estudio donde estas son un criterio de exclusión27, la simplificación con ABC es significativamente más eficaz que continuar con el IP, mientras que en los otros las diferencias no son significativas. Además, en aquel estudio27 la eficacia de ABC (carga viral < 50 en 86%) es más elevada que en los otros (carga viral < 400 o 500 en 75% de media).
Comparación directa de EFV, NVP y ABC en simplificación de TARV (v. tabla 1)
Se han realizado 3 estudios aleatorizados22,23,29 en los que se comparan directamente 2 o los 3 fármacos utilizados en sustitución de IP en pautas de simplificación de tratamiento.
El más importante de ellos y definitivo por el número de pacientes incluido es el estudio NEFA. Martínez et al30 comparan NVP (n = 155), EFV (n = 156) y ABC (n = 149) en sustitución de IP en pacientes con carga viral inferior a 200 copias/ml. El 50, 58 y 46% de los pacientes, respectivamente, habían recibido tratamientos subóptimos con 1 o 2 ITIAN antes de iniciar el TARGA con el IP. Por IT (p = f) la eficacia terapéutica a las 48 semanas (carga viral < 200 copias/ml) fue similar en los 3 grupos (77, 72 y 77%, respectivamente; p = NS). El número de pacientes que presentaron fracaso virológico fue significativamente más elevado en el grupo de ABC (6, 4 y 12%, respectivamente; p < 0,05), fracasando fundamentalmente los pacientes que habían recibido tratamientos subóptimos previos. El número de pacientes que suspendió el tratamiento debido a efectos adversos fue significativamente menor en el grupo de ABC (17, 17 y 6%, respectivamente; p < 0,01). En los 3 grupos se produjo una marcada mejoría del perfil lipídico tras la suspensión del IP31. El colesterol total descendió más en el grupo de ABC, pero el colesterol HDL aumentó en los grupos de NVP y EFV y no en el de ABC31. Los triglicéridos descendieron más en el grupo de NVP31.
En el estudio de Negredo et al22 se compara la simplificación con NVP (n = 26) y EFV (n = 25). No existieron diferencias significativas a las 48 semanas en la eficacia, ni en la recuperación inmunológica, ni en los efectos adversos que obligaron a suspender el tratamiento, aunque la potencia estadística es muy baja. Se observó un descenso significativo del colesterol total en el grupo de NVP y no significativo en el de EFV.
En el estudio de Maggiolo et al23 se distribuye aleatoriamente la sustitución de IP por ABC (81) o por EFV (n = 86). Las diferencias no llegan a ser significativas en la eficacia global (71% frente a 78%, respectivamente), pero los pacientes tratados con ABC presentan un mayor número de fracasos virológicos que los tratados con EFV (15% frente a 5%, p < 0,05).
Así pues, en los estudios en los que se han comparado directamente EFV, NVP y ABC no se han demostrado globalmente diferencias significativas en la eficacia al año del cambio de tratamiento. Se desconoce si a más largo plazo diferencias en la potencia de los fármacos o en el grupo terapéutico al que corresponden pueden repercutir en la eficacia.
Estudios de simplificación observacionales y estudios no comparativos
Se han realizado algunos estudios comparativos observacionales32-36 y muchos estudios de simplificación no comparativos37-49.
Únicamente se comentarán los dos estudios observacionales que parecen más significativos. Hirschel et al32 estudian la evolución de los pacientes de una cohorte suiza que cambian el tratamiento con IP por EFV para simplificarlo, presentando una carga viral inferior a 400 copias/ml, y lo comparan con un grupo control que no simplifica el tratamiento, apareado por las principales variables relacionadas con fracaso terapéutico. La probabilidad de presentar un fracaso virológico (carga viral superior a 1.000 copias/ml) entre los pacientes que están recibiendo el tratamiento es mayor en el grupo que continua el IP que en el grupo que ha simplificado a EFV (9% frente a 27%; p < 0,01). Por el tipo de estudio el número de pacientes que cambian el tratamiento es elevado. Globalmente, la probabilidad de cambio de tratamiento es más elevada en los pacientes que continúan con el IP (40% frente a 60%; p < 0,001). La probabilidad de cambiar EFV es mucho más elevada en los pacientes usuarios de drogas por vía parenteral que en los pacientes que han adquirido la infección a través de otras prácticas de riesgo.
Casado et al33 realizan un estudio observacional en 103 pacientes que presentaban algunos efectos adversos por el IP y los simplifican a NVP (n = 70) o EFV (n = 33). Basalmente, el 86% presentaban carga viral inferior a 50 copias/ml y el 14% inferior a 400 copias/ml. Por IT (p = f) la eficacia terapéutica a las 24 semanas fue del 75% con NVP y 78% con EFV (p = NS). Presentaron fracaso virológico el 13 y el 7% de los pacientes, respectivamente. Los factores relacionados con el fracaso terapéutico fueron: carga viral al simplificar tratamiento, mala adherencia y tiempo de tratamiento previo con ITIAN. En los otros 3 estudios observacionales comparativos se incluyen un escaso número de pacientes en cada grupo34-36.
Los numerosos estudios en los que se sustituye el IP por un ITINN suelen incluir un escaso número de pacientes (desde 15-20 hasta superar excepcionalmente los 50 o 60 casos), que presentaban algunos efectos adversos atribuidos al IP, por lo habitual alteraciones metabólicas o lipodistrofia. Aunque pueden aparecer algunos datos discordantes, en general, los resultados son superponibles a los de los estudios aleatorizados, manteniéndose la carga viral indetectable en una elevada proporción de pacientes y mejorando por lo general el perfil lipídico. En algunos casos mejora la acumulación de grasa subcutánea abdominal. Puede observarse un aumento de peso debido probablemente a la desaparición de algunas alteraciones digestivas o de algunas restricciones dietéticas asociadas a los IP, de manera que puede mejorar la apariencia subjetiva de lipoatrofia por parte del paciente, pero cuando se mide por métodos objetivos la lipoatrofia raramente se modifica al suspender los IP.
Reducción del número de comprimidos al día al simplificar el TARV con IP a un régimen sin IP
En todos los casos comentados de sustitución del IP por EFV, NVP o ABC se reduce el número de pastillas que el paciente debe tomar cada día. Este aspecto es considerado muy importante, tanto por el médico como por el paciente, para simplificar el TARV y mejorar la adherencia50.
El número diario de pastillas de EFV, NVP y ABC es de 3, 2 y 2, respectivamente. Están muy avanzados los estudios con una nueva formulación de EFV, que supondrá un comprimido al día de 600 mg, de una tamaño similar a las cápsulas actuales de 200 mg, y que probablemente estará disponible a finales de 2002. Cabe recordar que con los IP el número de pastillas al día que deben tomarse oscila entre de 6 (IDV/RTV y LPV/RTV) y 10-12 (NFV, APV/RTV, SQV/RTV). Los IP que requieren más comprimidos al día (SQV o APV no asociados a RTV) ya prácticamente no se usan.
Por el momento un solo laboratorio farmacéutico (Glaxo-Smith-Kline) ha optado por unir varios de sus fármacos antirretrovirales en un preparado comercial. Así, se dispone de la combinación de AZT y 3TC en comprimidos de Combivir® y de AZT, 3TC y ABC en comprimidos de Trizivir®. Esta estrategia comercial puede reducir el número de pastillas que deben tomarse y simplificar el tratamiento, aunque por toxicidad o por resistencias previas, no todos los pacientes pueden recibir estas combinaciones fijas de fármacos.
El número total de comprimidos al día que deben tomar los pacientes que simplifican el tratamiento en cada grupo, tomando el fármaco de simplificación y 2 ITIAN, será de:
1. EFV: 5 comprimidos (con Combivir®), 6 (con ddI y otro ITIAN) o 7 (con las restantes combinaciones). En un futuro próximo (comprimidos de 600 mg de EFV) será de 3, 4 o 5 comprimidos/día. Se excluye zalcitabina (ddC) que se utiliza muy poco y no se ha estudiado su uso en simplificación de tratamiento.
2. NVP: 4 comprimidos (con Combivir®), 5 (con ddI y otro ITIAN, excluyendo ddC) o 6 (con las restantes combinaciones, excluyendo ddC).
3. ABC: 2 comprimidos (Trizivir®), 5 (con ddI y otro ITIAN, excluyendo ddC) o 6 (con las restantes combinaciones, excluyendo ddC).
Conclusiones de la simplificación del IP por EFV, NVP o ABC
1. La eficacia virológica global del tratamiento simplificado se mantiene o incluso mejora, con respecto a continuar con el IP sin notables diferencias entre los 3 fármacos al año de tratamiento.
2. La eficacia inmunológica se mantiene con los 3 fármacos, respecto a continuar el tratamiento con IP.
3. La principal causa de fracaso virológico propiamente dicho en todos los grupos de simplificación es la acumulación de mutaciones de ITIAN secundaria a fracasos virológicos previos. Los tratamientos con EFV y NVP toleran relativamente bien algún tratamiento subóptimo previo, al menos durante el período de un año al que se refieren los resultados de la mayoría de estudios. Por el contrario, los fracasos virológicos con ABC son inaceptablemente frecuentes en casos de fracasos previos a ITIAN, en particular a AZT y 3TC, por mutaciones que confieren resistencia cruzada al ABC.
4. Al inicio del tratamiento de simplificación pueden manifestarse algunos efectos tóxicos agudos inherentes a los nuevos fármacos (alteraciones del sistema nervioso central [SNC], hipersensibilidad), pero, a largo plazo, tanto EFV, como NVP, como ABC se toleran mejor que los IP. El número de pacientes que deben suspender el tratamiento por toxicidad es similar con EFV y NVP y puede ser algo inferior con ABC.
5. El perfil lipídico mejora con los 3 fármacos, con un mayor descenso de colesterol total y triglicéridos con ABC y NVP.
6. La adherencia, el grado de satisfacción con el tratamiento y la calidad de vida del paciente mejoran al simplificar el tratamiento en los pocos estudios donde se han valorado estos parámetros.
7. Cualquiera de los 3 fármacos constituyen una buena opción para la simplificación de tratamiento y la elección de uno u otro dependerá de las características individuales de cada paciente.
Tratamiento administrado en una única dosis al día
La mayoría de médicos y de pacientes consideran que una manera importante de facilitar la adherencia al TARV es reducir la frecuencia de dosificación, preferentemente a una sola dosis al día50. Recientemente se ha realizado una revisión sistemática de la relación entre la frecuencia de dosificación de los fármacos y el cumplimiento de tratamiento en otras enfermedades crónicas51. La revisión de 85 estudios indica que la adherencia media de los tratamientos 1, 2, 3 y 4 veces al día es del 79, 69, 65 y 51%, respectivamente. Las diferencias entre 1 y 2 veces al día no llegan a ser significativas, aunque sí lo son entre 1 y 3 y entre 1 y 4 veces al día. En todos los casos los niveles de adherencia son inferiores al 95%, o preferiblemente al 100%, que se requiere para el TARV, pero en las aquellas enfermedades la mala adherencia no tiene las repercusiones catastróficas que tiene en la infección por VIH. Además de mejorar el cumplimiento, con una sola dosis diaria también mejora la regularidad horaria en la ingesta del tratamiento, que resultó correcta en el 74, 58, 46 y 40% para 1, 2, 3 y 4 tomas al día, respectivamente51.
En España, únicamente 2 fármacos están comercializados para su administración una vez al día: ddI y EFV. Probablemente otros 2 fármacos, ya comercializados en España para su administración 2 veces al día, podrán ser utilizados muy pronto en monodosis diaria en su actual formulación, pues ya están avalados por estudios clínicos y farmacocinéticos: 3TC (2 comprimidos de 150 mg = 300 mg/día y 1 comprimido de 300 mg disponible en pocos meses)52-55, aprobado por la EMEA, y NVP (2 comprimidos de 200 mg = 400 mg/día)53,56-58. El tenofovir (TNF) ya ha sido aprobado por la EMEA. Ya está disponible en nuestro país, solicitándolo por "medicación extranjera" y será comercializado próximamente (mediados de 2002) para su administración una vez al día (1 comprimido de 300 mg). Por su favorable posología, perfil de resistencias y toxicidad parece tener grandes posibilidades como fármaco para utilizar en numerosas combinaciones para la simplificación del TARV. Ya están avanzados los estudios de equivalencia y eficacia de una nueva formulación de d4T de liberación retardada, con la que se administra una cápsula de 100 mg al día59,60. Posiblemente estará disponible a finales del año 2002 o a principios de 2003. También se han iniciado estudios con ABC administrado una vez al día (600 mg) aunque todavía no tenemos resultados que avalen su utilización61. Otro fármaco con el que ya se han realizado bastantes estudios y que se administra en una sola dosis diaria es la emtricitabina (FTC)62-64. Se trata de un ITIAN, derivado fluorado del 3TC, con el que también comparte las mutaciones de resistencia. Un IP, atazanavir, que probablemente podrá utilizarse a mediados de 2003, parece atractivo por sus posibilidades de simplificar algunas pautas terapéuticas, pues se administran 2 comprimidos una sola vez al día y no parece alterar el perfil lipídico. En una revisión muy reciente se analizan los pros y los contras del TARV administrado una vez al día y las diferentes posibilidades terapéuticas65.
Se están realizando algunos ensayos clínicos donde se analizan pautas de simplificación de tratamiento administrado una vez al día, pero todavía no se dispone de los resultados. Existen ya algunos estudios que demuestran la eficacia de diversos tratamientos administrados una vez al día en pacientes sin TARV previo. Se han utilizado las siguientes combinaciones, que podrían ser muy útiles para simplificar el TARV:
1. ddI/3TC/EFV. Maggiolo et al54 administraron de manera consecutiva este tratamiento (dosis de ddI de 300 mg, con independencia del peso) a 75 pacientes, con una eficacia a las 48 semanas (IT [p = f], carga viral < 50 copias/ml) del 77%. Algo más de la mitad de pacientes tenían una carga viral basal superior a 100.000 copias/ml y la eficacia en pacientes con carga viral superior e inferior a esta cifra fueron iguales (78 y 76%) Landman et al55 trataron a 40 pacientes (dosis de ddI de 200 o 400 mg, según el peso), con una eficacia (IT [p = f], carga viral < 50 copias/ml) a los 15 meses del 69%. Aunque se trata de 2 estudios no comparativos, la eficacia en los 115 pacientes que suman ambos estudios es muy elevada, no inferior a la obtenida por AZT, 3TC y EFV en el estudio DPC-00666.
2. ddI/FTC/EFV. Molina et al64 trataron a 40 pacientes, con una eficacia similar a la de la anterior combinación (IT [p = f], carga viral < 400 copias/ml a las 24 semanas, 95%).
3. ddI/3TC/NVP. Staszewski et al53 tratan a 18 pacientes que requerían un tratamiento directamente observado, más de la mitad de los cuales habían recibido otros TARV previos. Los resultados parecen buenos por la población estudiada, pero no pueden sacarse conclusiones de la eficacia por el escaso número de pacientes.
En los estudios de simplificación de tratamiento suele obtenerse una eficacia superior a la de los de tratamiento de pacientes que no han recibido TARV previo, debido a que se trata de una población seleccionada por su buena respuesta al TARV previo y con una carga viral indetectable. Es necesario disponer de resultados de estudios de simplificación administrados una vez al día, aunque es de suponer que la eficacia de con ddI, 3TC (o FTC) y EFV en simplificación de tratamiento como mínimo será igual a la demostrada en pacientes sin TARV previo.
En todo caso la simplificación del TARV siempre debe individualizarse cuidadosamente, teniendo en cuenta la posibilidad de resistencias a algún o algunos fármacos por tratamientos previos y también las preferencias y el estilo de vida del paciente. Parece claro que la necesidad de tomar la medicación una sola vez al día tendrá menos impacto negativo en la calidad de vida que si es preciso tomarla varias veces, pero, por ejemplo, un paciente puede preferir tomar un comprimido cada 12 h, si es posible, que tomar cinco una vez al día.