El tratamiento antirretroviral de gran actividad (TARGA) ha permitido un buen control de la infección por VIH, y por lo tanto la población afectada envejece progresivamente y la esperanza de vida va siendo parecida a la de la población general. Por otro lado, se sabe que la infección por VIH predispone, incluso en pacientes con TARGA efectivo, a un mayor riesgo cardiovascular y a una mayor incidencia de algunas neoplasias. Por todo ello, la mayor parte de pacientes infectados por el VIH reciben diversos medicamentos (pautados por el facultativo o autoadministrados) además de los antirretrovirales. Este artículo revisa las interacciones que pueden provocar daños importantes o incluso poner en peligro la vida de los pacientes y que los clínicos —sobre todo los que no manejan directamente pacientes infectados por el VIH— tendrían que conocer. También se revisan las implicaciones de las interacciones entre antirretrovirales y otros fármacos en situaciones especiales, como la administración concomitante de citostáticos, inmunosupresores utilizados en el trasplante de órganos sólidos o pacientes que reciben los nuevos tratamientos para el virus de la hepatitisC. En general, las pautas con 2 inhibidores nucleós(t)idos de la transcriptasa inversa con raltegravir o dolutegravir son las que tienen menos potencial de interacciones clínicamente significativas.
Highly active antiretroviral therapy has helped to improved control of the HIV infection, and has led to a progressively older population with the infection having a life expectancy quite similar to that of the general population. On the other hand, it is also known that HIV infection, even in patients with undetectable viral loads and good immunity, carries an increased cardiovascular risk, as well as an increased incidence of certain cancers. Therefore, the majority of HIV-infected patients receive several drugs (either prescribed by the physician or self-administered) combined with antiretrovirals. This article reviews the interactions between antiretrovirals and other drugs that can cause significant damage to patients, or even be life-threatening and of whom clinicians, especially those not directly treating HIV-infected patients, should be aware. A review is also presented on the implications of interactions between antiretrovirals and other drugs in special situations, such as the co-administration with cytostatics, immunesuppressants used in solid organ transplantation, or patients receiving new treatments for hepatitisC. Generally, combinations with two nucleos(t)ide reverse transcriptase inhibitors and raltegravir (or in the near future, dolutegravir) are those with less potential for clinically significant interactions.
Gracias a la introducción del tratamiento antirretroviral de gran actividad (TARGA) en 1996-1997 hemos asistido a una progresiva reducción de la morbimortalidad asociada al virus de la inmunodeficiencia humana (VIH)1,2. En pacientes con buena adherencia y que mantienen una supresión virológica, la infección por el VIH se ha convertido en una enfermedad crónica en una población que progresivamente irá envejeciendo. Las personas infectadas por el VIH, a causa de la toxicidad de los antirretrovirales a largo plazo, el aumento de la edad y el estado proinflamatorio y de inmunoactivación provocados por el VIH, incluso en pacientes en TARGA efectivo, padecen un número cada vez mayor de comorbilidades, como enfermedad cardiovascular, dislipidemia, hipertensión, diabetes, osteoporosis o enfermedades renales3,4. Algunos pacientes pueden necesitar también tratamientos concomitantes por coinfección con virus hepatotropos5, enfermedad psiquiátrica6, neoplasias7-10 o trasplantes de órgano sólido11-13. Finalmente, no es infrecuente que estos pacientes tomen suplementos alimentarios, productos «naturales» o sustancias de abuso al margen de la prescripción médica.
Se estima que las interacciones clínicamente relevantes entre fármacos antirretrovirales y medicación concomitante pueden alcanzar una proporción del 27 al 40%14, siendo los factores de riesgo más importantes el uso de inhibidores de la proteasa (IP) potenciados con ritonavir, el número de medicaciones concomitantes, la coinfección con el virus de la hepatitisC y el abuso de sustancias15,16. Marzolini et al.17 recopilaron de forma prospectiva la información de las posibles interacciones entre los tratamientos de los participantes en el Swiss HIV Cohort Study durante 10meses para determinar el efecto del uso de los fármacos y la edad en la aparición de posibles interacciones farmacológicas. Se recogieron las prescripciones de 1.497 participantes HIV: 477 de edad igual o superior a 50años y 1.020 de edad menor a 50años. Se observó que los pacientes mayores tenían más probabilidad de recibir uno o más fármacos concomitantemente comparado con los pacientes más jóvenes (82% versus 61%; p<0,001) y, por tanto, interacciones potenciales más frecuentes (51% versus 35%; p<0,001). Además, los pacientes de edad más avanzada tendían a utilizar un mayor número de medicación concomitante y de clases terapéuticas concretas más a menudo, como los fármacos cardiovasculares (53% versus 19%; p<0,001), gastrointestinales (10% versus 6%; p=0,004) y agentes hormonales (6% versus 3%; p=0,04). Las interacciones potenciales detectadas con los antirretrovirales ocurrieron principalmente con los fármacos cardiovasculares (27%), fármacos para el SNC (22%) y con la metadona (6%) en los pacientes mayores, mientras que para los pacientes jóvenes ocurrían más con fármacos del SNC (27%), metadona (15%) y agentes cardiovasculares (11%). La respuesta y la tolerancia al tratamiento antirretroviral (TARV) no fueron diferentes entre los 2 grupos de edad. Yiu et al.18 registraron retrospectivamente las interacciones farmacológicas clínicamente significativas ocurridas en 110 pacientes jóvenes (<50años) y mayores (>50años) que recibieron TARV durante el año 2007 para analizar las posibles diferencias relativas a la edad. Dentro de las interacciones relacionadas con el TARV, los IP fueron los agentes que presentaron más interacciones tanto en pacientes jóvenes (44%) como en pacientes mayores (42%), seguidos por los inhibidores de la transcriptasa inversa análogos de nucleós(t)idos (ITIAN) (18,1 y 15,4%) y los inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINN) (12,0 y 15,7%).
Este artículo revisa las bases enzimáticas de las interacciones entre antirretrovirales y otros fármacos, los cuadros clínicos derivados de interacciones que pueden acarrear graves consecuencias para los pacientes o que pueden llegar a ser fatales, el manejo de las interacciones en el contexto de situaciones especiales y las pautas alternativas de antirretrovirales y medicación concomitantes en estos casos.
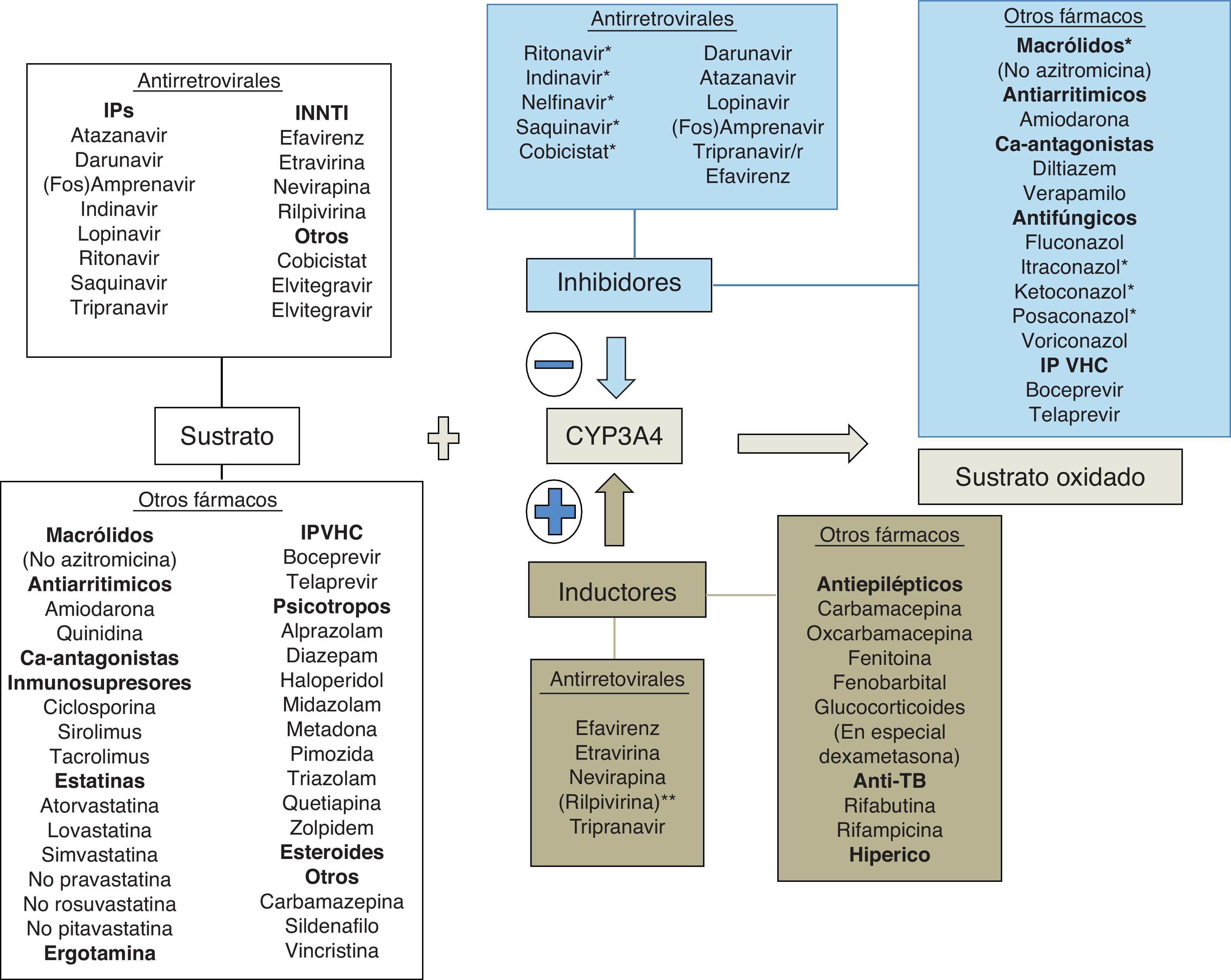
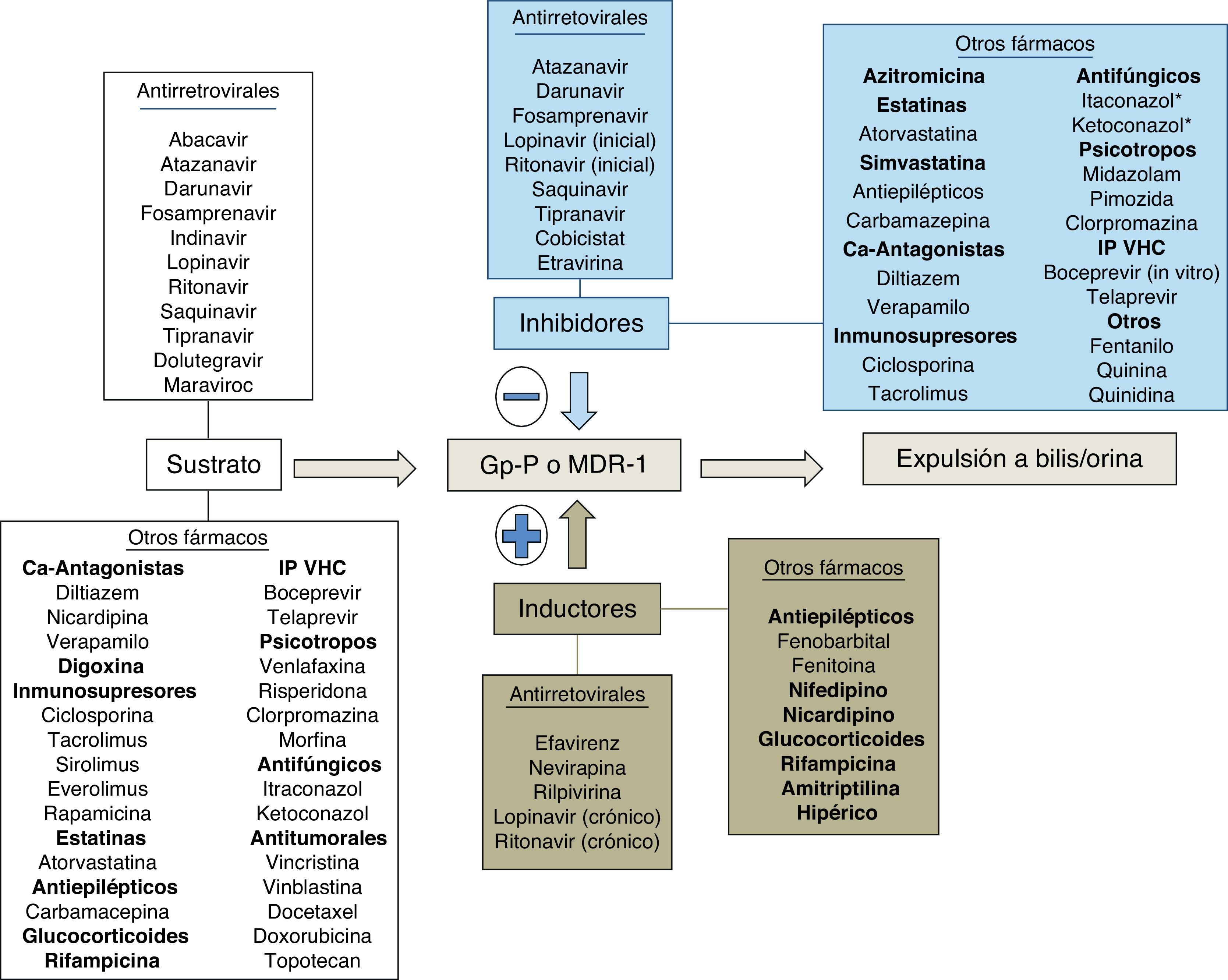
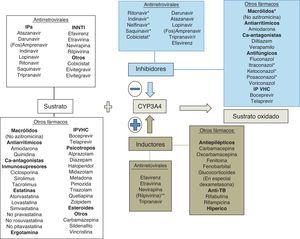
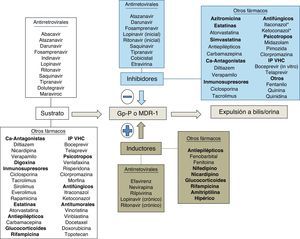
Bases enzimáticas de las interacciones farmacológicasUna interacción farmacológica se acepta como clínicamente relevante cuando la eficacia o la toxicidad de un fármaco se alteran de forma significativa tras la administración de otras sustancias. El mecanismo de la interacción entre fármacos puede ser farmacocinético o farmacodinámico. Las interacciones farmacocinéticas son las más comunes y pueden implicar cambios en la tasa de absorción, distribución (por desplazamiento de proteínas plasmáticas), metabolismo o excreción (biliar, renal o pulmonar). Los citocromos P450 (CYP) son una familia de enzimas responsables de la mayoría de los procesos oxidativos de las sustancias exógenas (medicamentos, alimentos, etc.) y endógenas. Aunque se hayan identificado más de 30 subtipos, el CYP3A4 es uno de los más importantes, siendo por lo menos en parte responsable de la biotransformación del 60% de los fármacos19. Aunque su actividad metabólica tenga diferencias interindividuales, no parece sujeto a polimorfismos genéticos como otras isoformas del CYP20. La variabilidad interindividual parece relacionada con la dieta, la raza, la edad y la presencia de enfermedades hepáticas o del intestino delgado. El CYP3A4 se sitúa principalmente en el hígado y, en menor cantidad, en el intestino delgado, siendo importante en el metabolismo de la los fármacos y otras sustancias exógenas. Un gran número de fármacos de varias categorías terapéuticas son sustratos del CYP3A4. Hay que subrayar que algunas sustancias que son sustratos del CYP3A4 son también sustratos de la glucoproteínaP, una proteína de transporte activo transmembrana dependiente del ATP presente en varios órganos, entre ellos hígado, encéfalo, intestino y riñón21. La glucoproteínaP actúa como un transportador que expulsa las sustancias de los enterocitos, reduciendo la llegada a la circulación portal, y aumenta la excreción de los fármacos en la bilis y la orina, disminuyendo de esta forma la cantidad de fármaco que llega a la circulación sistémica y que actúa en los órganos diana. El CYP3A4 y la glucoproteínaP parecen actuar conjuntamente en el intestino y el hígado para disminuir las concentraciones plasmáticas de los fármacos. Algunas sustancias son sustratos de ambos y son capaces de inhibir (o inducir) ambos mecanismos de eliminación. Algunas interacciones que se creían solo consecuencia de la inhibición del CYP3A4 son en realidad mediadas también por la inhibición de la glucoproteínaP.
El espectro del metabolismo de los fármacos antirretrovirales es complejo, ya que cada fármaco se metaboliza a través de diferentes isoenzimas y es difícil realizar generalizaciones basadas en diferentes clases de fármacos. El potencial de interacciones de los ITIAN es bajo, aunque puede ocurrir con la coadministración de sustancias que alteren el aclaramiento renal del fármaco o la fosforilación intracelular. Los IP son por lo general sustratos e inhibidores del CYP3A4; su coadministración con fármacos metabolizados a través del CYP3A4 por lo general puede acarrear toxicidad debida a un aumento de los niveles plasmáticos de los fármacos implicados. Los inhibidores no nucleósidos de la transcriptasa inversa son por lo general sustratos e inductores del CYP3A4 (pero efavirenz y etravirina pueden ser también inhibidores); por lo general la coadministración de esta clase de fármacos puede disminuir la eficacia de algunas sustancias, como por ejemplo en el caso de los fármacos antineoplásicos22. A diferencia de estas clases de fármacos, el inhibidor de la integrasa raltegravir se metaboliza por glucuronoconjugación principalmente a través de la enzima UGT1A1, con consecuente menor potencial de interacciones respecto a los IP y a los ITINN23-25. Cobicistat es un nuevo potente inhibidor del CYP3A4 que ha sido aprobado como potenciador del elvitegravir (inhibidor de la integrasa sustrato del CYP3A4) y que será utilizado en el futuro como potenciador de algunos IP. Cobicistat es sustrato del CYP3A4 y minoritariamente del 2D6. Asimismo, es inhibidor de CYP3A y CYP2D6 y de los transportadores: glucoproteínaP (P-gp), BCRP, OATP1B1 y OATP1B3. La asociación de cobicistat con fármacos que sean sustratos de las anteriores enzimas y transportadores puede dar lugar a un aumento de sus concentraciones plasmáticas26. Dolutegravir es un inhibidor de la integrasa de segunda generación recientemente aprobado por la FDA. Dolutegravir se metaboliza extensivamente por la UGT1A1 y solo minoritariamente por el CYP3A4. A las concentraciones alcanzadas habitualmente no ha demostrado no ser inductor ni inhibidor de las isoenzimas del CYP ni de la UGT1A1/2B7. Dolutegravir es sustrato de la glucoproteínaP, pero no es ni inductor ni inhibidor de este transportador27. En general, las interacciones entre dolutegravir y sustratos del CYP3A4 son poco probables desde un punto de vista teórico28. Otro fármaco, el inhibidor del correceptor CCR5 maraviroc, es sustrato (pero no inhibidor ni inductor) del CYP3A4 y de la glucoproteínaP y es susceptible a múltiples interacciones farmacológicas que implican ajuste de dosis.
En cualquier caso, las interacciones de los antirretrovirales con otros fármacos son complejas y muchas veces sujetas a variaciones interindividuales dependientes también del background genético y de la alimentación. Por este motivo están disponibles diferentes bases de datos de acceso público que ayudan al clínico a la hora de administrar medicación concomitante en pacientes con infección por VIH que reciben antirretrovirales. Las interacciones entre ITIAN utilizados en la actualidad no son en la mayoría de los casos clínicamente relevantes, por lo cual no se tratarán de forma específica. En esta revisión solo se tratan las interacciones clínicamente relevantes entre antirretrovirales (ITINN, IP potenciados con ritonavir e inhibidores de la integrasa [II]) y otros fármacos que pueden poner en peligro la vida o la salud del paciente. En la tabla 1 se describen algunos de los principales fármacos que se metabolizan por el CYP3A4 y la potencia del metabolismo presistémico. Cuanto más dependiente es el metabolismo presistémico de estos fármacos del CYP3A4, más altas serán las concentraciones plasmáticas alcanzadas por estos fármacos en caso de inhibición de la enzima y más alto el potencial tóxico de las interacciones con fármacos inhibidores del CYP3A4. A pesar de que la isoenzima implicada en la mayoría de interacciones importantes es CYP3A4, en algunas ocasiones pueden producirse interacciones mediadas por CYP2C9 o 2C19. Curiosamente, ritonavir se comporta como inductor de esa isoenzima, y efavirenz y etravirina se comportan como inhibidores (justo al contrario del efecto que ejercen sobre el CYP3A4). De esta forma, podemos entender que ritonavir pueda reducir la eficacia terapéutica de voriconazol, fenitoína o de los anticoagulantes orales, cuyo metabolismo es mediado principalmente por CYP2C9 y 2C19.
Ejemplos de sustratos del CYP3A4 con potencial de interacciones con los antirretrovirales. Cuanto más intensa es la actividad metabólica por parte del CYP3A4 a nivel intestinal y hepático (metabolismo «presistémico»), menor es la cantidad de fármaco que llega a la circulación sistémica. Una inhibición del CYP3A4, por ejemplo por parte de ritonavir o cobicistat, implica por lo tanto que una mayor cantidad de fármaco llegue a la circulación sistémica y pueda, como consecuencia, alcanzar concentraciones tóxicas para el individuo. Los fármacos cuyas interacciones con los antirretrovirales se tratan detenidamente en el texto están marcados en negrita
| Cuantía del metabolismo presistémico (CYP y gp-P) | Biodisponibilidad oral (%) | Fármacos |
|---|---|---|
| Muy alto | < 10 | Buspirona, ergotamina, lovastatina, nimodipino, simvastatina y terfenadina |
| Alto | 10-30 | Estradiol, felodipino, propafenona, tacrolimus |
| Intermedio | 30-70 | Amiodarona, carbamazepina, carvedilol, ciclosporina, diltiazem, etopósido, midazolam, nifedipino, pimozida, sildenafilo, verapamilo |
| Bajo | > 70 | Alprazolam, amlodipino, dapsona, dexametasona, temazepam |
Adaptada de Dresser et al.20.
Las figuras 1 y 2 resumen las principales vías metabólicas de los fármacos implicados en las interacciones con los antirretrovirales.
Los alcaloides ergóticos son una familia de xenobiotas vasoconstrictores utilizados sobre todo en el tratamiento de la migraña refractaria a analgésicos de primera línea29. La ergotamina y la dihidroergotamina, los fármacos más utilizados de esta familia, son sustratos del CYP3A4 con una baja biodisponibilidad oral30,31. El ergotismo es un síndrome asociado a isquemia vascular grave y compromiso neurológico asociado a niveles plasmáticos elevados de ergotamina. Las manifestaciones neurológicas incluyen convulsiones y alucinaciones. Las manifestaciones vasculares debidas a vasoconstricción pueden llevar a necrosis, sobre todo de las extremidades, que en los casos más graves puede producir gangrena. También se puede dar vasoconstricción de las arterias coronarias. Los IP potenciados con ritonavir o cobicistat (pero también otros fármacos como los antibióticos macrólidos, antifúngicos imidazólicos o IP del VHC) inhiben el metabolismo de la ergotamina vía CYP3A4 y provocan aumento considerable de los niveles plasmáticos del fármaco. La coadministración de ergotamina e IP del VIH o cobicistat está contraindicada por este motivo. Se han descrito casos mortales con esta asociación32. El efavirenz también presenta interacciones relevantes con la ergotamina, compitiendo con esta a la hora de metabolizarse en el CYP3A4, por lo que podría inhibir el metabolismo de dihidroergotamina, pudiendo incrementarse las concentraciones plasmáticas de este fármaco produciendo ergotismo33. Una alternativa terapéutica para pacientes con migraña que reciben IP o efavirenz es el sumatriptán o rizatriptán (ambos son eliminados mediante las monoaminooxidasas, no interviniendo el citocromo P450). Debería evitarse el eletriptán, dado que también se elimina por el CYP3A4, como los ergotamínicos. No se conocen interacciones relevantes entre alcaloides ergóticos y los otros fármacos antirretrovirales aunque los ITINN podrían reducir su eficacia por aumento de su metabolismo.
RabdomiólisisLas estatinas son fármacos inhibidores de la HMG-CoA reductasa utilizados de forma extensa para tratar la hipercolesterolemia. Uno de los efectos secundarios descritos en asociación a su uso es la elevación de la creatincinasa sérica y mialgia. Se han descrito casos de rabdomiólisis grave asociada a fracaso renal agudo por mioglobinuria34. Se considera que las estatinas son sustrato de OATP1B1 y OATP1B3, transportadores de membrana que permiten que estas entren en el hepatocito, donde realizan su acción. Estudios in vitro indican que los IP inhiben estos transportadores, con lo que podría empeorar la relación beneficio/riesgo de las estatinas, disminuyendo su efecto y aumentando el riesgo de miotoxicidad por un aumento de sus concentraciones plasmáticas35. La interacción entre estatinas y antirretrovirales debe considerarse como un mecanismo multifactorial donde no solamente interviene la inhibición del CYP3A4, sino también los transportadores transmembrana celular, y el mecanismo de interacción con los antirretrovirales depende de la vía metabólica de la estatina36. Hare et al.37 describieron un caso mortal de rabdomiólisis debido a la interacción entre nelfinavir y simvastatina. Schmidt et al.38 describieron un caso de rabdomiólisis e insuficiencia renal aguda en un paciente en tratamiento con atazanavir (400mg/día durante 2años), simvastatina (80mg/día durante 27días) y amiodarona (200mg/día durante 19días). Al suspender los tratamientos y someter el paciente a diálisis durante un mes, el cuadro clínico mejoró. Lovastatina, simvastatina y atorvastatina se metabolizan por el CYP3A4; las 2 primeras están contraindicadas en su uso con los inhibidores del CYP3A4, mientras que se puede asociar atorvastatina a la mayoría de IP (menos tipranavir/ritonavir), empezando con dosis bajas hasta un máximo de 20mg/día. Rosuvastatina no es sustrato del CYP3A4; el mecanismo de interacción en este caso implica la inhibición de los transportadores OATP1B1 o BCRP39. Se han descrito casos de interacciones relevantes a nivel farmacocinético, sobre todo con atazanavir40, y casos de rabdomiólisis con lopinavir41. En general su coadministración parece más segura con otros IP potenciados o con cobicistat42, aunque su uso implica cautela y su administración debe empezarse con dosis bajas (5mg/día), con ajuste sucesivo según la respuesta clínica. Pravastatina y pitavastatina se eliminan prácticamente sin ser metabolizadas, y los IP y cobicistat tienen un efecto clínicamente no relevante sobre sus niveles plasmáticos42. Fluvastatina se metaboliza principalmente a través del CYP2C9, por lo cual es improbable una interacción clínicamente relevante con los IP y el cobicistat; sin embargo, efavirenz actúa como inhibidor de esta isoenzima, por lo cual la coadministración de fluvastatina y efavirenz no se recomienda por existir otras opciones más seguras. No se han descrito interacciones relevantes entre estatinas y otros fármacos antirretrovirales (ITIAN, raltegravir, maraviroc, rilpivirina o etravirina). El potencial de interacciones con dolutegravir también es bajo.
«Torsades de pointes» y otras arritmias cardiacasLas torsades de pointes son una arritmia ventricular potencialmente mortal que ocurre en el contexto de una prolongación excesiva del intervalo QT en el electrocardiograma. Esta grave arritmia se ha descrito como efecto secundario con los antihistamínicos astemizol43 (no comercializado en España) y terfenadina44, el procinético intestinal cisaprida45 (no comercializado en España) y el antipsicótico pimozida46, entre otros. Estos sustratos del CYP3A4 parecen actuar de manera dosis-dependiente bloqueando la corriente repolarizadora dependiente del potasio en las vías de conducción cardiaca, que es la base de la prolongación del intervalo QT. En otras palabras, concentraciones elevadas de estas sustancias ralentizan la repolarización cardiaca, alargando el QT y pudiendo dar origen a arritmias mortales. Efectos graves se pueden dar en asociación con IP, cobicistat y efavirenz, los primeros 2 por un mecanismo de inhibición enzimática y el efavirenz por mecanismo de competición con la pimozida a la hora de metabolizarse en el CYP3A4, lo que podría inhibir el metabolismo del fármaco e incrementar las concentraciones plasmáticas con riesgo de cardiotoxicidad. Como alternativa, se pueden utilizar los antihistamínicos cetirizina y loratadina, que parecen no prolongar el intervalo QT47. Como procinéticos, desde el punto de vista de las interacciones, se pueden utilizar de forma relativamente segura metoclopramida o domperidona. Sin embargo, e independientemente de las posibles interacciones, recientemente la relación beneficio-riesgo de metoclopramida ha sido reevaluada por las agencias reguladoras, que han emitido recomendaciones limitando sus indicaciones, su dosificación y su duración (máximo 5días) y domperidona se ha asociado a arritmias ventriculares graves48,49. La prescripción de procinéticos es compleja, especialmente en pacientes con riesgo cardíaco de base. En pacientes en tratamiento con pimozida habría que plantear un tratamiento basado en fármacos antirretrovirales que no inhiban el CYP3A4, como por ejemplo el raltegravir.
Otros casos en los cuales la coadministración de IP puede potencialmente provocar aumento del QT es el uso de la quinina o la mefloquina en el contexto del tratamiento de la malaria50. Los resultados de un estudio publicado por Soyinka et al.51 indican que en presencia de ritonavir (200mg/12h) el área bajo la curva (AUC) de quinina es 4 veces mayor, por lo que se requiere ajustar la dosis. Quinina aumentó de forma leve (21%) el AUC de ritonavir. Se trata de un estudio abierto, no aleatorizado y de diseño secuencial en voluntarios sanos (n=10) que recibieron una dosis única de 600mg de quinina (periodo1), ritonavir 200mg/12h durante 7 días tras un periodo de blanqueo (período 2), y ambos fármacos a la vez en el día 8 (periodo 3). La semivida de eliminación de quinina aumentó de 11,15 a 13,37h, indicando una reducción de su metabolismo, que también se evidenció por una reducción de la concentración de su metabolito 3-hidroxiquinina. Aunque no existan guías clínicas para la coadministración de antirretrovirales y antimaláricos, lo más plausible es que haya que reducir un 50% la dosis de quinina cuando el paciente recibe un IP potenciado con ritonavir14. El uso de metadona es también habitual entre los ex adictos a drogas por vía parenteral que reciben TARV. Metadona se ha relacionado con la aparición de torsades de pointes en un amplio margen de dosis en asociación a TARV52,53. Cabe considerar que algunos IP del VIH, como atazanavir, lopinavir/ritonavir y saquinavir, se han relacionado con prolongación del intervalo PR y/o QT, tal como se indica en sus fichas técnicas. Cuando se administran en asociación con medicamentos que tienen potencial para incrementar el intervalo QT y/o en pacientes con factores de riesgo preexistentes (bradicardia, alargamiento congénito de QT, desequilibrios electrolíticos), se deben tomar precauciones especiales. Sin embargo, Hunt et al.54, en una revisión de la literatura publicada en MEDLINE y EMBASE hasta agosto 2011, concluyen que el uso de IP no parece un factor predictor independiente de prolongación del intervalo QT.
Sedación excesiva, coma y otros trastornos neurológicosVarios fármacos psicotropos se metabolizan por el CYP3A4. Se han descrito interacciones farmacológicas clínicamente relevantes entre ritonavir y diferentes psicofármacos, incluyendo midazolam55, triazolam56, alprazolam20,57, diazepam58, zopiclona59 y buspirona60. Midazolam (oral) y triazolam están contraindicados con todos los IP potenciados con ritonavir y el cobicistat. También están contraindicados con efavirenz (por mecanismo competitivo pueden aumentar las concentraciones plasmáticas). Diazepam es metabolizado por el CYP3A4 y el 2C19. Sus posibles interacciones teóricas son difíciles de establecer, dado que tiene diversos metabolitos activos; sin embargo, podría aumentar la sedación en presencia de inhibidores del CYP3A4, como los IP, o del CYP2C19, como efavirenz o etravirina (este efecto se ha observado con otros inhibidores del CYP3A4, como ketoconazol, o del CYP2C19, como omeprazol). Alprazolam se puede administrar con cautela conjuntamente a los inhibidores e inductores del CYP3A4. Los ITIAN, rilpivirina, raltegravir y maraviroc se pueden administrar de forma segura con las benzodiacepinas. En general, la benzodiacepina que presenta menor riesgo de interacción con los antirretrovirales por su metabolismo (glucuronidación) es lorazepam.
El midazolam es una benzodiacepina de acción corta con significativas propiedades amnésicas. Su biodisponibilidad oral es del 25-40% y se metaboliza extensivamente por el CYP3A4 a nivel entérico y hepático. La inhibición del CYP3A4 por parte del ritonavir puede incrementar de forma importante las concentraciones plasmáticas del midazolam administrado por vía oral con riesgo de toxicidad grave: sedación excesiva o prolongada, confusión, ataxia, debilidad, alteración cognitiva o motora. La administración concomitante de ritonavir y midazolam oral está por lo tanto contraindicada. Respecto a la administración de midazolam parenteral, teniendo en cuenta que su administración con otros IP sugiere un posible incremento de 3-4 veces en los niveles plasmáticos de midazolam, se debe realizar en una unidad de cuidados intensivos (UCI) o centro similar que asegure una estrecha monitorización clínica y la actuación médica adecuada en caso de depresión respiratoria y/o sedación prolongada. En un estudio que no se llegó a publicar61, la administración de una dosis única de 7,5mg de midazolam a 73 pacientes tratados con IP a los que se les practicó una broncoscopia no alteró el índice de saturación de oxígeno ni la duración del procedimiento, comparado con pacientes no tratados con IP o VIH negativos. Está sin embargo contraindicado en dosis múltiples. En otro estudio caso-control más reciente, realizado en el Johns Hopkins Hospital de Baltimore en pacientes a los cuales se les realizaba una broncoscopia, se vio que en pacientes que recibían IP (n=51) comparados con pacientes que no los recibían (n=190) el riesgo de sedación grave era más de 6 veces superior y que la estancia hospitalaria era aproximadamente 3días más larga62. Los autores concluyen que el uso de midazolam por vía parenteral en pacientes que reciben IP se tendría que monitorizar estrictamente o utilizar sedantes alternativos, como el lorazepam o el propofol.
La interacción farmacocinética entre los IP y los antipsicóticos a nivel de algunas isoenzimas del CYP450, como la inhibición de CYP3A4 y CYP2D6, implicadas en el metabolismo de la mayoría de ellos, puede producir aumentos importantes de sus niveles plasmáticos. La quetiapina y la risperidona son antipsicóticos ampliamente utilizados en psiquiatría. Quetiapina se metaboliza mayoritariamente por el CYP3A4, y risperidona, por el CYP2D6. Hay descritos 2 casos de una posible interacción entre quetiapina y atazanavir potenciado con ritonavir: en un caso una ganancia rápida e importante de peso, y en el otro, una sedación excesiva y confusión63. Hay otro caso descrito de coma profundo, hipotensión refractaria y un aumento importante de la semivida de la quetiapina (de 22 a 64h) en un paciente que ingirió de forma voluntaria 8g de quetiapina durante un tratamiento con atazanavir potenciado con ritonavir64. Otros autores han descrito un caso de priapismo grave en un paciente que recibía perfenazina (sustrato del CYP2D6), quetiapina 900mg y lopinavir/ritonavir 400/100mg BID65. Existen diversos casos de toxicidad neurológica con la asociación de risperidona con IP. En general, con los antipsicóticos eliminados mediante el citocromo P-450 se recomienda empezar con dosis bajas en pacientes tratados con IP y aumentar las dosis progresivamente. Los autores hacen hincapié en que son necesarios estudios farmacocinéticos. También se han descrito casos de vértigo, somnolencia, desorientación, ataxia, vómitos y sedación excesiva en pacientes que recibían fármacos antiepilépticos como la carbamazepina en concomitancia con la administración de IP66. La coadministración requiere por lo tanto monitorización clínica y una bajada de la dosis de carbamazepina. Hay que tener en cuenta que carbamazepina, fenitoína y fenobarbital, potentes inductores del CYP3A4, pueden reducir las concentraciones plasmáticas de IP potenciados, ITINN y maraviroc por inducción de su metabolismo, con mayor riesgo de fracaso virológico. En 2012 la American Academy of Neurology y la International League Against Epilepsy publicaron en la revista Epilepsia una guía para el uso conjunto de fármacos anticomiciales y antirretrovirales. La guía aconseja utilizar con cautela fármacos inductores del CYP3A4 (carbamazepina, fenitoína, fenobarbital) con fármacos antirretrovirales que induzcan, inhiban o sean sustrato del citocromo, ya que por un lado hay riesgo de toxicidad aumentada por aumento de las concentraciones plasmáticas de los anticomiciales (como en el caso de la coadministración de carbamazepina y ritonavir) y, por otro lado, mayor riesgo de fracaso virológico por reducción de los niveles plasmáticos de los antirretrovirales67. Estas guías aconsejan monitorizar estrictamente los niveles de anticomiciales y antirretrovirales y evitar algunas asociaciones. Carbamazepina está contraindicada con efavirenz, etravirina y rilpivirina, y se tiene que utilizar con precaución con nevirapina por inducción por parte del antiepiléptico y los ITINN del CYP3A4 y reducción de los niveles plasmáticos del anticomicial y del antirretroviral. Fenobarbital y fenitoína están contraindicados con etravirina y rilpivirina por posible fracaso virológico debido a la reducción de los niveles plasmáticos de los antirretrovirales. Maraviroc se puede utilizar, pero a dosis aumentadas, con potentes inductores del CYP3A4 como carbamazepina y fenitoína o fenobarbital (es necesario recordar que este aumento de dosis de maraviroc solo debe realizarse en ausencia de IP en el TARV). En muchos casos es necesario buscar alternativas terapéuticas, como utilizar fármacos anticomiciales no inductores enzimáticos (levetiracetam, pregabalina, gabapentina, lamotrigina) o fármacos antirretrovirales que no inhiban ni induzcan ni sean sustrato del CYP3A4 (ITIAN, raltegravir, dolutegravir). Pacientes que reciban estas pautas no requieren una monitorización más estricta respecto a pacientes que no reciben antirretrovirales.
Hipotensión grave e infarto de miocardioLa hipotensión es un efecto adverso que depende de la dosis de muchos fármacos antihipertensivos, incluidos los antagonistas del calcio dihidropiridínicos que son sustrato del CYP3A4. Aunque por lo general no se han descrito efectos secundarios graves en la coadministración de antirretrovirales, cuando se administran con IP potenciados con ritonavir es prudente empezar con dosis bajas e ir incrementando progresivamente la dosis según la respuesta clínica. Solo se ha descrito un caso de hipotensión ortostática y bloqueo cardíaco por asociación de nifedipino de liberación retardada y nelfinavir68. La sintomatología se solucionó tras el cambio del IP por efavirenz.
El sildenafilo es un inhibidor de la fosfodiesterasa de tipo 5 (PDE5) y está indicado para el tratamiento de la disfunción eréctil (Viagra®) y la hipertensión pulmonar (Revatio®). La administración simultánea de IP aumenta de 2 a 11 veces la exposición a sildenafilo; en estas circunstancias, los niveles de sildenafilo alcanzados podrían provocar hipotensión sistémica e incluso infarto de miocardio69. También se ha descrito un caso de muerte en un paciente de 47años en tratamiento con saquinavir/ritonavir que recibió Viagra®70. Por este motivo, el uso de sildenafilo con IP requiere ajuste de dosis si es utilizado para disfunción eréctil (25mg cada 48h), y está por lo general contraindicado para su uso para el tratamiento de la hipertensión pulmonar14, aunque hay estudios que defienden su uso con IP si se monitoriza estrictamente la evolución clínica del paciente y los niveles plasmáticos de sildenafilo71. Las alternativas terapéuticas para pacientes con hipertensión pulmonar que reciben IP incluyen bosentán o tadalafilo ajustando la dosis adecuadamente. En pacientes tratados con IP se puede iniciar bosentán a la dosis de 62,5mg una vez al día o cada 48h, en función de la tolerabilidad del paciente. En pacientes tratados con bosentán que deban iniciar IP, debe suspenderse el bosentán por lo menos 36h antes del inicio del IP y no reiniciarlo hasta que hayan transcurrido como mínimo 10días de tratamiento con el IP. En pacientes tratados con IP se puede iniciar tadalafilo a la dosis de 20mg una vez al día y aumentar a 40mg una vez al día basado en la tolerabilidad del paciente. En pacientes tratados con tadalafilo que deban iniciar IP debe suspenderse el tadalafilo por lo menos 24h antes del inicio del IP y no reiniciarlo hasta que hayan transcurrido como mínimo 7días de tratamiento. Teóricamente, no debería emplearse bosentán en pacientes tratados con rilpivirina o atazanavir no potenciado, dado que podría comprometerse la eficacia del antirretroviral debido al efecto inductor enzimático de bosentan. El uso de sildenafilo con inductores del CYP3A4 como efavirenz, nevirapina o etravirina puede requerir aumento de dosis y monitorización clínica72. Aunque no haya estudios controlados, una alternativa terapéutica para los pacientes VIH con hipertensión pulmonar que no presenten mutaciones de resistencias es una pauta basada en 2 ITIAN más raltegravir o dolutegravir, ya que, sin influir en el metabolismo del CYP3A4, permiten utilizar los fármacos para la hipertensión pulmonar a las dosis estándar sin necesidad de monitorización clínica y farmacológica adicional respecto a los pacientes no infectados por el VIH.
Síndrome de Cushing y otros trastornos hormonalesLa mayoría de corticosteroides utilizados en la práctica clínica son sustratos del CYP3A4. Se han descrito varios casos de acumulación de esteroides y síndrome de Cushing en pacientes que recibían ritonavir73-82. La fluticasona, por sus características farmacocinéticas (alta lipofilia, gran volumen de distribución, larga semivida y alta afinidad para el receptor de los corticosteroides) es probablemente el corticosteroide que más es afectado por la coadministración de ritonavir83. Sin embargo, se han publicado casos de supresión adrenal con triamcinolona inyectable73,78,80,81,83, budesonida inhalada u oral76,77,82,83, e incluso con corticoides utilizados en colirio79. En este último caso, una mujer de 51años en tratamiento con emtricitabina/tenofovir y atazanavir/ritonavir recibió colirio de dexametasona 0,1% 6veces al día y una aplicación nocturna de pomada de betametasona 0,1% en ambos ojos durante varios meses. Aunque en los últimos 5años recibió ciclos de prednisolona oral e intravenosa, no había recibido corticoides sistémicos durante los últimos 8meses. La paciente desarrolló características cushingoides, necrosis aséptica de cadera y supresión del eje suprarrenal con niveles bajos de ACTH. El cuadro se solucionó de forma progresiva tras la sustitución de atazanavir/ritonavir por efavirenz.
Estos casos nos indican que hay que utilizar con extrema cautela los corticoides inyectados, inhalados e incluso tópicos en pacientes en tratamiento con ritonavir. La fluticasona está contraindicada en pacientes en tratamiento con IP potenciados con ritonavir. Otros corticoides no están contraindicados, pero hay que utilizarlos con mucha precaución. En pacientes tratados con IP que deban recibir corticoides inhalados, una alternativa es la beclometasona. Como alternativa terapéutica oral se puede considerar el montelukast o cambiar el TARGA a una pauta que contenga ITIAN, ITINN (utilizar con precaución conjuntamente a dexametasona; rilpivirina está contraindicada con dexametasona en dosis múltiples), inhibidores del CCR5 (si disponemos de tropismo viral) o inhibidores de la integrasa (raltegravir, dolutegravir).
Los anticonceptivos hormonales se metabolizan principalmente por las isoenzimas del citocromo P450 y por conjugación con sulfato y glucurónico a nivel hepático. Como tal, la farmacocinética de los anticonceptivos hormonales puede ser afectada por la terapia antirretroviral con un potencial impacto clínico importante en el sentido de posibles embarazos indeseados en mujeres con infección por VIH84. Los IP potenciados con ritonavir inducen la glucuroniltransferasa reduciendo de forma significativa los niveles de algunos anticonceptivos como el etinilestradiol. Efavirenz y nevirapina reducen los niveles de anticonceptivos por la inducción del CYP3A4. Con los datos de los que disponemos en la actualidad, los fármacos que más probablemente pueden interferir con el metabolismo de los contraceptivos orales, los parches transdérmicos y los implantes son los IP potenciados con ritonavir85, efavirenz, nevirapina86, y elvitegravir potenciado con cobicistat84. Pacientes que reciben estos fármacos tendrían que asociar un método de barrera para evitar embarazos indeseados. Etravirina87, rilpivirina88, maraviroc89 y raltegravir90 se pueden utilizar de forma segura con los anticonceptivos orales. Para la anticoncepción de urgencia en pacientes que reciban fármacos que puedan reducir la eficacia de los anticonceptivos (o que los hayan suspendido recientemente, en los últimos 28días), en Inglaterra, el Faculty of Family Planning and Reproductive Health Care (FFPRHC) recomienda: colocar un DIU de cobre (método más efectivo) o tomar 3mg de levonorgestrel en una toma única lo antes posible y dentro de las 120h después de la relación sin protección. Esta recomendación se basa en el juicio clínico, basándose en las consecuencias que podría tener un embarazo no deseado, sin que existan estudios de eficacia/toxicidad que apoyen este ajuste de dosis (esta pauta no se encuentra recogida en la ficha técnica del producto, que no contempla el uso de levonorgestrel a estas dosis ni más allá de las primeras 72h)91.
Interacciones farmacológicas en situaciones especialesTratamiento de la infección por VHC con los nuevos inhibidores de la proteasa NS3/4A en pacientes coinfectados por el VIHSe estima que en el mundo entre 4 y 5 millones de personas están coinfectadas con el VIH y el virus de la hepatitis C (VHC)92. La enfermedad hepática por VHC se acelera en el contexto de la coinfección por el VIH, con una probabilidad de progresión a cirrosis 3 veces mayor comparada con los pacientes monoinfectados por el VHC93,94. Hasta hace unos años el tratamiento estándar del VHC era la combinación de interferónpegilado (PEG-INF) y ribavirina, siendo la tasa de respuesta virológica sostenida global de solo el 33% en pacientes coinfectados, y aún más baja si se consideran los genotipos1 y 495. Boceprevir y telaprevir son 2 IP NS3/4A del VHC que, en combinación con PEG-INF y ribavirina, alcanzan tasas considerablemente mayores de respuesta virológica sostenida en pacientes monoinfectados96,97 y coinfectados98-100. Telaprevir es oxidado principalmente vía CYP3A4, mientras que boceprevir es metabolizado principalmente por vías no dependientes del citocromo101-103, siendo ambos potentes inhibidores del CYP3A4; por otro lado, telaprevir puede también inhibir o saturar la glucoproteínaP, reduciendo la excreción a bilis y orina y aumentando de esta forma los niveles plasmáticos de muchos sustratos de este transportador104. En general, los ITIAN no presentan interacciones relevantes, aunque hay que evitar la zidovudina, ya que puede empeorar la anemia provocada por ribavirina y los IP del VHC. Debe evitarse el uso de didanosina junto con ribavirina por aumento del riesgo de toxicidad mitocondrial. Boceprevir y telaprevir presentan interacciones potenciales con todos los antirretrovirales que sean inhibidores (IP), inductores (ITINN) o sustratos (maraviroc) del CYP3A4. Por este motivo, y porque muchas interacciones teóricas son imprevisibles in vivo, se han realizado una serie de estudios farmacocinéticos en voluntarios sanos105-108 para valorar las posibles interacciones entre antirretrovirales e IP del VHC.
Las recomendaciones del grupo de expertos de la Agencia Española del Medicamento «Criterios y recomendaciones generales para el tratamiento con boceprevir y telaprevir de la hepatitis crónicaC en pacientes infectados por el VIH, en trasplantados de hígado y en población pediátrica» indican que con la información disponible en el momento de su elaboración (26 de julio de 2012) no se recomienda la asociación de boceprevir con ninguno de los siguientes fármacos: IP del VIH, ITINN, maraviroc o enfuvirtida. Se permite su asociación con abacavir, emtricitabina, lamivudina, tenofovir y raltegravir109.
Los investigadores de Merck Sharp & Dohme evaluaron la interacción entre boceprevir y los IP potenciados con ritonavir, atazanavir, lopinavir y darunavir en voluntarios sanos106. Los autores concluyen que la administración concomitante de boceprevir junto a los IP para el VIH ATV/r, LPV/r y DRV/r resulta en una disminución de la exposición de estos fármacos, por lo que no se recomienda la combinación.
Sin embargo, existen dudas acerca de la repercusión clínica real de las interacciones farmacocinéticas observadas. Sulkowski et al.100 concluyeron en su estudio que el uso de IP del VIH (IP) en pacientes coinfectados por VIH y VHC en tratamiento con boceprevir no afectaba negativamente a la eficacia del tratamiento del VHC ni del TARV, a pesar de la interacción farmacocinética negativa que existe entre ellos. Estudios posteriores han evaluado en voluntarios sanos la interacción de boceprevir con etravirina, observándose un aumento del 10% en el AUC de boceprevir y una reducción del 23% en el AUC de etravirina (y del 29% en su Cmin). Se requieren estudios clínicos que evalúen la posible repercusión sobre la eficacia antirretroviral con esta asociación105, por lo cual por el momento no se recomienda. Por lo que concierne a la rilpivirina, datos preliminares en voluntarios sanos avalan su uso concomitante con boceprevir110. Las características farmacocinéticas de cobicistat contraindican su coadministración con boceprevir111. Respecto a dolutegravir, en voluntarios sanos boceprevir no modificó los niveles de dolutegravir; aunque no se evaluó el posible efecto sobre boceprevir, una alteración parece poco probable basándose en las características farmacocinéticas de dolutegravir112. La coadministración de boceprevir y maraviroc es posible a partir de datos farmacocinéticos recabados en voluntarios sanos, siendo necesario un ajuste de dosis de maraviroc a 150mg BID113.
También hay importantes interacciones entre antirretrovirales y telaprevir. Las recomendaciones del grupo de expertos de la Agencia Española del Medicamento indican que con la información disponible en el momento de su elaboración no se recomienda la asociación de telaprevir con ninguno de los siguientes fármacos: IP del VIH (a excepción de atazanavir/ritonavir), nevirapina, maraviroc o enfuvirtida. Se permite su asociación con abacavir, emtricitabina, lamivudina, tenofovir (con necesidad de monitorizar la función renal por aumento del 30% de la exposición a tenofovir), atazanavir/ritonavir108, efavirenz (aumentando la dosis de telaprevir a 1.125mg/8h), etravirina (200mg cada 12h junto con telaprevir a la dosis habitual) y raltegravir109. En ese momento no había un nivel de evidencia suficiente para recomendar la asociación con rilpivirina; sin embargo, datos preliminares de estudios farmacocinéticos en voluntarios sanos no han detectado interacciones relevantes entre rilpivirina y telaprevir108, y es probable que las indicaciones de la Agencia Española del Medicamento cambien en un futuro para incluir nuevas combinaciones. Estudios en voluntarios sanos indican que telaprevir puede emplearse en combinación con elvitegravir/cobicistat y con dolutegravir sin que se requiera ajuste de dosis112. Estudios en voluntarios sanos113 también avalan la coadministración de maraviroc (ajuste de dosis a 150mg BID) y telaprevir.
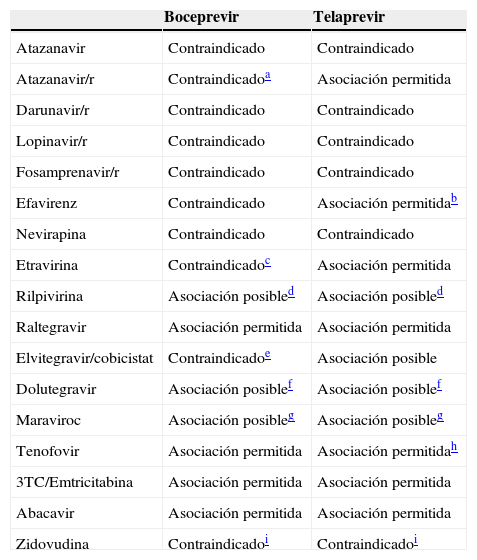
La tabla 2 resume las indicaciones para la coadministración y las interacciones entre los principales antirretrovirales e IP del VHC según las indicaciones vigentes de la Agencia Española del Medicamento, además de las asociaciones posibles basadas en estudios en voluntarios sanos y/o contenidos en ficha técnica114,115.
Asociaciones entre boceprevir y telaprevir y fármacos antirretrovirales según las recomendaciones de la Agencia Española del Medicamento en pacientes con infección por VIH-1 (asociación permitida), e incluidos en ficha técnica y/o basados en estudios farmacocinéticos en voluntarios sanos (asociación posible)
| Boceprevir | Telaprevir | |
|---|---|---|
| Atazanavir | Contraindicado | Contraindicado |
| Atazanavir/r | Contraindicadoa | Asociación permitida |
| Darunavir/r | Contraindicado | Contraindicado |
| Lopinavir/r | Contraindicado | Contraindicado |
| Fosamprenavir/r | Contraindicado | Contraindicado |
| Efavirenz | Contraindicado | Asociación permitidab |
| Nevirapina | Contraindicado | Contraindicado |
| Etravirina | Contraindicadoc | Asociación permitida |
| Rilpivirina | Asociación posibled | Asociación posibled |
| Raltegravir | Asociación permitida | Asociación permitida |
| Elvitegravir/cobicistat | Contraindicadoe | Asociación posible |
| Dolutegravir | Asociación posiblef | Asociación posiblef |
| Maraviroc | Asociación posibleg | Asociación posibleg |
| Tenofovir | Asociación permitida | Asociación permitidah |
| 3TC/Emtricitabina | Asociación permitida | Asociación permitida |
| Abacavir | Asociación permitida | Asociación permitida |
| Zidovudina | Contraindicadoi | Contraindicadoi |
3TC: lamivudina.
De http://www.aemps.gob.es/medicamentosUsoHumano/medSituacionesEspeciales/docs/criterios-VHC-off-label.pdf109.
Reducción significativa de AUC, Cmin y Cmax de atazanavir en voluntarios sanos (Hulskotte et al.106); se desconoce el impacto clínico de estas alteraciones farmacocinéticas, por lo cual recomendamos evitar esta asociación hasta obtener más datos.
Efavirenz induce el metabolismo de telaprevir, disminuyendo sus concentraciones plasmáticas, por lo que es necesario aumentar la dosis de TVR de 750mg (2 comprimidos de 375mg)/8h o 1.125 mg (3 comprimidos de 375 mg)/12 h a 1.125mg (3 comprimidos de 375mg)/8h (50%) durante la coadministración con efavirenz.
Reducción del 23, del 24 y del 29% de la AUC, Cmax y Cmin de etravirina en voluntarios sanos en el estudio de Hammond et al.105; se desconoce el impacto clínico de estas variaciones farmacocinéticas, por lo cual recomendamos evitar esta asociación hasta obtener más datos.
Las indicaciones de la Agencia Española del Medicamento contraindican el uso de todos los NNRTI en asociación con boceprevir y de rilpivirina con telaprevir por falta de datos en el momento de la publicación del documento; sin embargo, datos preliminares en voluntarios sanos no han detectado interacciones relevantes entre boceprevir (Rhee et al.110) o telaprevir (Van Heeswijk et al.108) y rilpivirina; es probable que las indicaciones de la Agencia Española del Medicamento cambien en un futuro. Esta asociación se indica como posible sin necesidad de ajuste de dosis en la ficha técnica de boceprevir114 y telaprevir115.
Potencial interacción basada en datos farmacocinéticos111,114,115, aunque no hay estudios específicos; asociación contraindicada hasta obtener más datos.
Asociación posible basada en datos farmacocinéticos y estudios en voluntarios sanos (Johnson et al.112).
Asociación posible basada en datos farmacocinéticos y estudios en voluntarios sanos (Vourvahis et al.113). Es necesario ajustar la dosis de maraviroc a 150mg BID.
Telaprevir aumenta un 30% la exposición (AUC) a tenofovir (Van Heeswijk et al.108); vigilar efectos adversos, sobre todo la función renal.
Aunque en la era pre-TARGA los resultados de los trasplantes de órganos sólidos (TOS) en pacientes infectados por el VIH eran peores en comparación con los sujetos trasplantados sin infección por el VIH, la evidencia más reciente ha demostrado resultados comparables en ambas poblaciones116-118. En la actualidad, el TOS puede realizarse con seguridad en pacientes infectados por el VIH-1 seleccionados12,13,119.
Sin embargo, una serie de problemas persisten con respecto a la selección de pacientes, el manejo postoperatorio y las interacciones entre medicamentos antirretrovirales y agentes inmunosupresores. Uno de los principales problemas en el período posterior al trasplante son las interacciones farmacocinéticas entre los fármacos inmunosupresores y antirretrovirales. El manejo combinado de la terapia antirretroviral e inmunosupresora puede ser extremadamente difícil debido a las interacciones entre inmunosupresores y TARGA, con un mayor riesgo de rechazo del injerto y de toxicidad farmacológica120. Tacrolimus, sirolimus y ciclosporinaA son sustratos de CYP3A4 e inhibidores de la glucoproteínaP. Los IP pueden aumentar de forma significativa los niveles de los inmunosupresores, aumentando la toxicidad. Los ITINN pueden afectar la eficacia de los inmunosupresores disminuyendo sus niveles plasmáticos por inducción enzimática, aunque la intensidad de la interacción es menor comparada con los IP. Otro fármaco muy utilizado como inmunosupresor, el ácido micofenólico (el metabolito activo del micofenolato de mofetilo [MPA]) es sustrato de la glucuroniltransferasa por lo que su riesgo de interacción es menor. Además, la farmacocinética de los glucocorticoides y de los inhibidores de mTOR puede verse también afectada por IP.
Muchos expertos, basándose en estudios farmacocinéticos y clínicos con decenas de pacientes con infección por VIH receptores de TOS, prefieren utilizar una pauta basada en raltegravir más emtricitabina/tenofovir o abacavir/lamivudina en pacientes que reciben inhibidores calcineurínicos (ciclosporina y tacrolimus), ya que se ha demostrado una buena evolución clínica sin necesidad de ajustar las dosis de inmunosupresores y sin aumento de la tasa de rechazo ni de toxicidad13,121-123. El ácido micofenólico comparte vías metabólicas con raltegravir. La glucuronidación de raltegravir es catalizada en el hígado, principalmente por UGT1A1 con menor contribución de UGF1A9 y UGT1A325, mientras que la MPA se glucuroniza en el tracto gastrointestinal por UGT1A8 y UGT1A10, en el hígado por UGT1A9 y en el riñón por UGT2B7. En el hígado, el MPA se metaboliza por UGT1A9 a ácido micofenólico glucurónido (MPAG), el metabolito inactivo de MPA. A pesar de una posible interacción entre micofenolato y raltegravir a nivel de la UGT1A9 hepática, datos preliminares de un estudio farmacocinético en 6 pacientes trasplantados no han visto modificaciones clínicamente significativas de los niveles de micofenólico y raltegravir en los pacientes estudiados; además, los pacientes mantuvieron una carga viral del VIH indetectable y no presentaron rechazo celular124. Sin embargo, hasta obtener datos más sólidos es aconsejable monitorizar los niveles de MPA en pacientes en tratamiento con raltegravir.
Los datos disponibles hasta la actualidad indican, por lo tanto, que una pauta basada en raltegravir más tenofovir/emtricitabina o abacavir/lamivudina tendría que ser de elección en pacientes sometidos a TOS que no presenten mutaciones de resistencia13,14. Una pauta basada en 2 ITIAN más dolutegravir también es prometedora en este tipo de pacientes, aunque se necesitan datos específicos de interacciones entre dolutegravir e inmunosupresores para aconsejarla de forma generalizada.
Uso concomitante de antirretrovirales y fármacos antineoplásicosA pesar de que el TARGA haya consentido un aumento considerable de la supervivencia en pacientes infectados por el VIH2,125, las enfermedades neoplásicas siguen siendo un problema prevalente en los pacientes infectados por el VIH22,126. La incidencia de los cánceres definitorios de sida (sarcoma de Kaposi, linfoma noHodking y cáncer invasivo de cérvix) ha ido progresivamente disminuyendo en la era del TARGA; sin embargo, aún hay una proporción considerable de pacientes que se presentan tardíamente a los cuidados médicos, y a veces el diagnóstico de infección por VIH se hace a raíz del diagnóstico de una enfermedad definitoria de sida127. Por otro lado, con la mayor supervivencia de los pacientes infectados por el VIH se ha observado un aumento de neoplasias que, sin ser definitorias de sida, parecen más prevalentes en la población infectada por el VIH; entre ellas hay que señalar el linfoma de Hodking, la enfermedad de Castelman, el carcinoma del canal anal, el adenocarcinoma de pulmón y el hepatocarcinoma (este último en los pacientes coinfectados con el VHB y/o el VHC)128-132. Aunque el espectro de las enfermedades neoplásicas diagnosticadas en los pacientes con infección por VIH vaya cambiando, la coadministración de fármacos antirretrovirales y citostáticos es una necesidad creciente, y más con la evidencia científica que el TARV mejora el pronóstico de las enfermedades malignas133-135. El potencial de interacciones entre antirretrovirales y fármacos citostáticos está bien documentado22,136. A pesar de ello, no hay estudios sistemáticos que estudien las interacciones entre ambos. Además, es posible una superposición de efectos tóxicos entre antirretrovirales y fármacos citostáticos. La zidovudina, por ejemplo, provoca neutropenia en hasta el 8% de pacientes con sida; didanosina y estavudina, ya no recomendados en países desarrollados, pueden provocar neurotoxicidad periférica que se puede solapar con la neuropatía asociada a quimioterápicos. Debe evitarse la asociación de tenofovir con citostáticos nefrotóxicos como los derivados del platino.Algunos autores además desaconsejan la coadministración de antirretrovirales que potencialmente provoquen aumento del intervalo QT (entre ellos atazanavir137,138, lopinavir/ritonavir139 y saquinavir54,140) con fármacos citostáticos que también se asocian a prolongación de intervalos QT (antraciclinas, dasatinib, sunitinib, lapatinib, nilotinib, trióxido de arsénico, y tamoxifeno, entre otros)141. La asociación de estos fármacos debería evitarse por el potencial de desarrollo de arritmias mortales y muerte súbita22.
Por lo que concierne más específicamente a las interacciones farmacocinéticas, hay que tener en cuenta que muchos agentes quimioterápicos se metabolizan vía CYP450, entre ellos ciclofosfamida, doxorubicina, alcaloides de la vinca, etopósido, tamoxifeno, bortezomib y los inhibidores de la tirosincinasa como imatinib, erlotinib, gefitinib, dasatinib, lapatinib, nilotinib, sunitinib y sorafenib. Todos ellos verán modificadas sus concentraciones en presencia de antirretrovirales inductores (reducción de eficacia del citostático) o inhibidores (aumento de la toxicidad del citostático). En un estudio en 11 pacientes tratados un mínimo de 2meses con imatinib, la administración de ritonavir 600mg diarios durante 3días no modificó la eliminación ni las concentraciones plasmáticas de imatinib. Ello podría ser debido a la multiplicidad de enzimas que intervienen en el metabolismo de imatinib, de forma que al bloquear una vía se emplearían las vías alternativas. Sin embargo, para asegurar la ausencia de interacción, deberían realizarse estudios con ritonavir administrado de forma más prolongada, ya que los estudios con pocas dosis en ocasiones no reflejan los hallazgos obtenidos tras la administración continuada cuando los fármacos presentan vías de eliminación complejas142. Datos recabados de reporte de casos individuales, pequeñas series de casos y ensayos clínicos han sugerido el potencial de interacciones graves entre IP y vinblastina (toxicidad digestiva y hematológica143), vincristina (íleo paralítico144), docetaxel (toxicidad hematológica y cutánea145,146), paclitaxel147 y ciclofosfamida148,149. Los ITINN, por otro lado, por su efecto inductor, pueden reducir los niveles plasmáticos y la eficacia de algunos antineoplásicos; por ejemplo, efavirenz y bexaroteno son ambos inductores y sustratos del CYP3A4, y hay casos descritos de fracaso virológico y disminución de la AUC del bexaroteno durante la administración simultánea de los 2 fármacos150.
Por las interacciones potenciales y demostradas entre antineoplásicos y antirretrovirales, muchos expertos aconsejan utilizar antirretrovirales que no afecten el CYP45014, cuando sea posible. Hay creciente evidencia de que el uso de una pauta basada en raltegravir más emtricitabina/tenofovir o abacavir/lamivudina en pacientes con cáncer que se someten a quimioterapia podría ser eficaz y segura151. Una pauta con 2 ITIAN más dolutegravir también tiene un bajo potencial de interacciones, aunque se necesitan datos específicos.
A falta de guías de uso concomitante de antirretrovirales y antineoplásicos, los oncólogos tendrían que consultar con especialistas en VIH para iniciar u optimizar el TARV cuando un paciente infectado por VIH se diagnostica de una enfermedad maligna22.
Interacciones entre antirretrovirales y drogas de abusoAdemás del potencial de interacciones entre antirretrovirales y fármacos prescritos por facultativos, hay que tener en cuenta el potencial de interacciones entre antirretrovirales y fármacos con los cuales el paciente se automedica o drogas ilegales de uso recreacional152,153. Antes ya se han descrito las posibles interacciones entre algunas benzodiacepinas, como midazolam y antirretrovirales. Otro fármaco que muchas veces se usa en un contexto recreacional y frecuentemente en asociación con otras drogas vasodilatadoras, como el nitrato de amilo (popper), que es el sildenafilo; anteriormente ya se ha descrito su potencial interacción con ritonavir, y el clínico tendría que avisar a los pacientes sobre los peligros del abuso de este fármaco por su potencial hipotensor.
Sin embargo, se tiene que prestar particular atención y el paciente tendría que ser consciente del riesgo que acarrea el uso concomitante de algunas drogas de abuso y fármacos antirretrovirales, especialmente los IP. Por ejemplo, se han descrito casos mortales de intoxicación por MDMA («éxtasis») en el contexto de tratamiento con ritonavir. El éxtasis se metaboliza principalmente a través del CYP2D6. Ritonavir es un inhibidor de esta isoenzima. Adicionalmente, del 3 al 10% de individuos de raza blanca son metabolizadores lentos a nivel de CYP2D6. Pueden darse importantes incrementos (de hasta 10 veces) en los niveles plasmáticos de éxtasis, por lo que esta combinación puede ser peligrosa154-156, incluso con dosis muy bajas de ritonavir, como las que se usan en asociación con atazanavir o darunavir. Henry y Hill157 describieron un caso mortal de interacción entre ritonavir y éxtasis. El paciente había tomado previamente éxtasis en varias ocasiones antes de que se añadiera ritonavir a su TARV. Esta última vez estaba tomando ritonavir 600mg c/12h e ingirió 180mg de éxtasis junto con alcohol. La muerte se produjo como consecuencia de una reacción serotoninérgica grave. Las concentraciones plasmáticas de éxtasis halladas fueron 10 veces superiores a las esperadas en función de la dosis ingerida. Goorney y Scholes158 describen un caso de anemia hemolítica transitoria en un paciente en TARV que consumió éxtasis. Papaseit et al.159 describieron un caso de intoxicación por éxtasis en un paciente en tratamiento con atazanavir/ritonavir 300/100mg QD (asociado a tenofovir/emtricitabina) que requirió ingreso en una unidad de cuidados intensivos. Se trata de un hombre de 27años que ingirió 2 comprimidos de éxtasis separados por un intervalo de 3h. Ingresó en la UCI 7h después de ingerir la primera tableta tras presentar hipertermia, convulsiones y deterioro del nivel de conciencia. Estos síntomas se asociaron a rabdomiólisis, insuficiencia renal aguda, alteración de las enzimas hepáticas y coagulación intravascular diseminada. Las concentraciones de MDMA fueron 9 veces superiores a las que obtienen tras una dosis «recreacional» de MDMA. El efecto de esta interacción es imprevisible, ya que la farmacocinética del MDMA no es lineal y puede variar de persona a persona dependiendo de la variabilidad genética del CYP2D6160,161 y su posible efecto sobre la glucoproteínaP, por lo cual un paciente que toma ritonavir debería evitar el uso de MDMA y otras anfetaminas.
La cocaína es otra droga de abuso muy utilizada. Es metabolizada principalmente por esterasas plasmáticas, con una vía minoritaria en la que interviene el CYP3A4, formándose norcocaína162, en porcentaje mayor en sujetos con déficit de colinesterasa. La administración simultánea de cocaína y ritonavir (pero también otros IP) puede reducir el metabolismo provocando aumento de la concentración plasmática y la toxicidad. Por otro lado, los inductores del CYP3A4 como efavirenz o nevirapina podrían aumentar la producción de norcocaína, metabolito de cocaína que contribuye a su toxicidad.
Aunque su metabolismo no esté del todo estudiado, es posible el aumento de efectos tóxicos por parte de los IP sobre otras drogas de abuso como ketamina, LSD y gamma hidroxibutirato (GHB)152.
Mientras no se han descrito interacciones relevantes entre heroína y antirretrovirales163, notables son las interacciones entre ITINN e IP y la metadona, un agonista opiáceo ampliamente utilizado en los tratamientos de deshabituación de heroína. La metadona se metaboliza primariamente por el CYP3A4 con contribuciones del CYP2D6, CYP2C9, CYP2E1 y en parte por glucuronidación164. El CYP2B6 juega un papel en el metabolismo estereoselectivo de metadona, y ello podría justificar la importante interacción que presenta con nevirapina y efavirenz, pues ambos son inductores del CYP2B6 además del CYP3A4. También es sustrato de la glucoproteínaP153. En pacientes en tratamiento estable con metadona que inicien nevirapina y efavirenz (inductores del CYP3A4) los niveles pueden bajar considerablemente, provocando síntomas de abstinencia. En estos pacientes en general es necesario aumentar un 45% la dosis diaria de metadona165–168. Datos preliminares sobre ITINN de última generación (etravirina y rilpivirina) parecen indicar que pacientes en tratamiento con estos fármacos no necesitan ajuste de dosis de metadona cuando se añade uno de estos fármacos en pacientes en tratamiento con metadona72,169,170. La administración de IP, especialmente si están potenciados con ritonavir, pueden también provocar síntomas de abstinencia por inducción de la glucuronidación de la metadona a nivel hepático, aunque el riesgo es menor con dosis bajas de ritonavir171. También hay que tener en cuenta la reducción de la dosis de metadona a la hora de interrumpir el TARV, ya que su retirada puede reducir el metabolismo hepático por parte de la glucuroniltransferasa o el CYP3A4 y la expulsión por parte de la glucoproteínaP, aumentando de forma peligrosa los niveles plasmáticos. Como se ha mencionado antes, Lüthi et al.52 describen un caso clínico en el que se produjo arritmia en forma de torsades de pointes.
Las tablas 3 y 4 resumen el manejo de las interacciones entre antirretrovirales y otros fármacos.
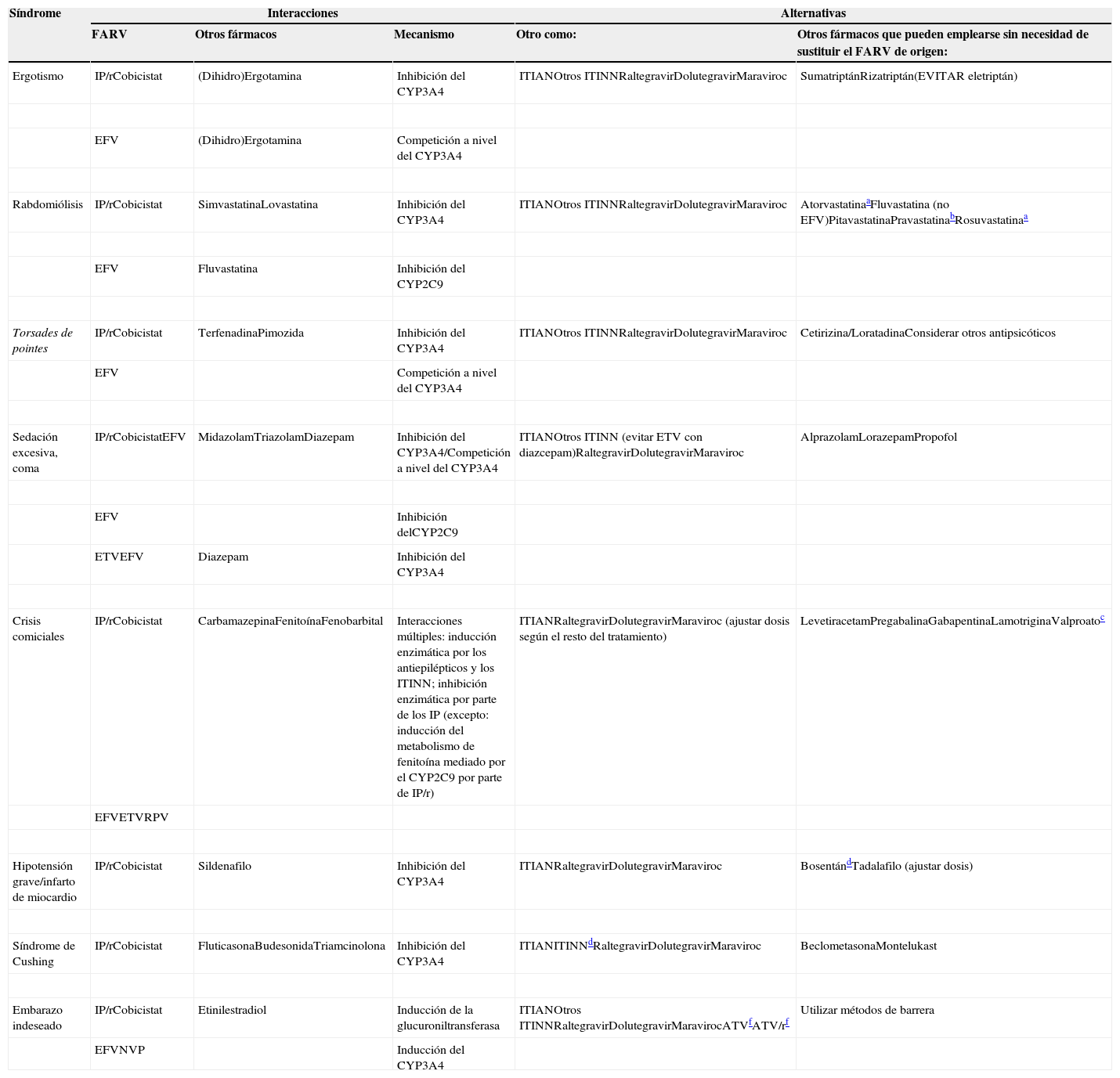
Principales síndromes clínicos consecuencia de interacciones graves entre antirretrovirales y otros fármacos y posibles alternativas terapéuticas, ya sea empleando otro TARV o cambiando el fármaco motivo de la interacción por otro que sea más seguro (manteniento el TARV de origen) (ver texto para los detalles)
| Síndrome | Interacciones | Alternativas | |||
|---|---|---|---|---|---|
| FARV | Otros fármacos | Mecanismo | Otro como: | Otros fármacos que pueden emplearse sin necesidad de sustituir el FARV de origen: | |
| Ergotismo | IP/rCobicistat | (Dihidro)Ergotamina | Inhibición del CYP3A4 | ITIANOtros ITINNRaltegravirDolutegravirMaraviroc | SumatriptánRizatriptán(EVITAR eletriptán) |
| EFV | (Dihidro)Ergotamina | Competición a nivel del CYP3A4 | |||
| Rabdomiólisis | IP/rCobicistat | SimvastatinaLovastatina | Inhibición del CYP3A4 | ITIANOtros ITINNRaltegravirDolutegravirMaraviroc | AtorvastatinaaFluvastatina (no EFV)PitavastatinaPravastatinabRosuvastatinaa |
| EFV | Fluvastatina | Inhibición del CYP2C9 | |||
| Torsades de pointes | IP/rCobicistat | TerfenadinaPimozida | Inhibición del CYP3A4 | ITIANOtros ITINNRaltegravirDolutegravirMaraviroc | Cetirizina/LoratadinaConsiderar otros antipsicóticos |
| EFV | Competición a nivel del CYP3A4 | ||||
| Sedación excesiva, coma | IP/rCobicistatEFV | MidazolamTriazolamDiazepam | Inhibición del CYP3A4/Competición a nivel del CYP3A4 | ITIANOtros ITINN (evitar ETV con diazcepam)RaltegravirDolutegravirMaraviroc | AlprazolamLorazepamPropofol |
| EFV | Inhibición delCYP2C9 | ||||
| ETVEFV | Diazepam | Inhibición del CYP3A4 | |||
| Crisis comiciales | IP/rCobicistat | CarbamazepinaFenitoínaFenobarbital | Interacciones múltiples: inducción enzimática por los antiepilépticos y los ITINN; inhibición enzimática por parte de los IP (excepto: inducción del metabolismo de fenitoína mediado por el CYP2C9 por parte de IP/r) | ITIANRaltegravirDolutegravirMaraviroc (ajustar dosis según el resto del tratamiento) | LevetiracetamPregabalinaGabapentinaLamotriginaValproatoc |
| EFVETVRPV | |||||
| Hipotensión grave/infarto de miocardio | IP/rCobicistat | Sildenafilo | Inhibición del CYP3A4 | ITIANRaltegravirDolutegravirMaraviroc | BosentándTadalafilo (ajustar dosis) |
| Síndrome de Cushing | IP/rCobicistat | FluticasonaBudesonidaTriamcinolona | Inhibición del CYP3A4 | ITIANITINNdRaltegravirDolutegravirMaraviroc | BeclometasonaMontelukast |
| Embarazo indeseado | IP/rCobicistat | Etinilestradiol | Inducción de la glucuroniltransferasa | ITIANOtros ITINNRaltegravirDolutegravirMaravirocATVfATV/rf | Utilizar métodos de barrera |
| EFVNVP | Inducción del CYP3A4 | ||||
CYP: citocromo P450; EFV: efavirenz; ETV: etravirina; FARV: fármacos antirretrovirales; IP/r: inhibidores de la proteasa del VIH potenciados con ritonavir; ITIAN: inhibidores nucleós(t)idos de la transcriptasa inversa; ITINN: inhibidores no nucleósidos de la transcriptasa inversa; NVP: nevirapina; RPV: rilpivirina.
Empezar con dosis bajas (10mg para atorvastatina y 5mg con rosuvastatina; aumentar dosis según respuesta clínica).
Potencial riesgo de aumento del área bajo la curva de pravastatina cuando se administra conjuntamente con darunavir. En tratamientos que contienen darunavir, según ficha técnica, empezar con dosis bajas de pravastatina (5mg/24h) y subir hasta dosis plenas (40mg/24h) según tolerancia. Ver ficha técnica de darunavir: http://ec.europa.eu/health/documents/community-register/2007/2007021219209/anx_19209_es.pdf
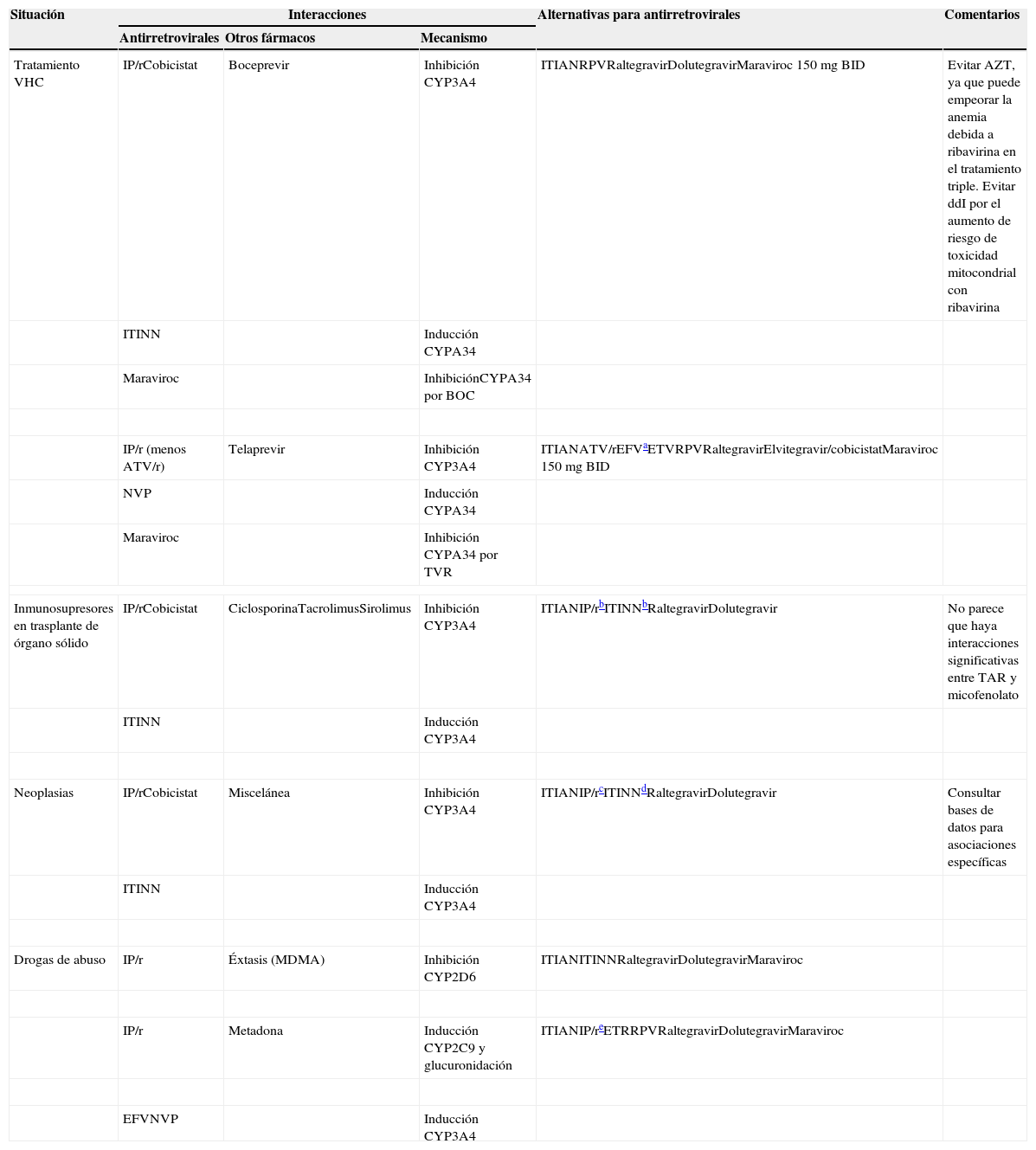
Sugerencias de manejo de las interacciones entre antirretrovirales y otros fármacos en situaciones especiales (ver texto para detalles)
| Situación | Interacciones | Alternativas para antirretrovirales | Comentarios | ||
|---|---|---|---|---|---|
| Antirretrovirales | Otros fármacos | Mecanismo | |||
| Tratamiento VHC | IP/rCobicistat | Boceprevir | Inhibición CYP3A4 | ITIANRPVRaltegravirDolutegravirMaraviroc 150mg BID | Evitar AZT, ya que puede empeorar la anemia debida a ribavirina en el tratamiento triple. Evitar ddI por el aumento de riesgo de toxicidad mitocondrial con ribavirina |
| ITINN | Inducción CYPA34 | ||||
| Maraviroc | InhibiciónCYPA34 por BOC | ||||
| IP/r (menos ATV/r) | Telaprevir | Inhibición CYP3A4 | ITIANATV/rEFVaETVRPVRaltegravirElvitegravir/cobicistatMaraviroc 150 mg BID | ||
| NVP | Inducción CYPA34 | ||||
| Maraviroc | Inhibición CYPA34 por TVR | ||||
| Inmunosupresores en trasplante de órgano sólido | IP/rCobicistat | CiclosporinaTacrolimusSirolimus | Inhibición CYP3A4 | ITIANIP/rbITINNbRaltegravirDolutegravir | No parece que haya interacciones significativas entre TAR y micofenolato |
| ITINN | Inducción CYP3A4 | ||||
| Neoplasias | IP/rCobicistat | Miscelánea | Inhibición CYP3A4 | ITIANIP/rcITINNdRaltegravirDolutegravir | Consultar bases de datos para asociaciones específicas |
| ITINN | Inducción CYP3A4 | ||||
| Drogas de abuso | IP/r | Éxtasis (MDMA) | Inhibición CYP2D6 | ITIANITINNRaltegravirDolutegravirMaraviroc | |
| IP/r | Metadona | Inducción CYP2C9 y glucuronidación | ITIANIP/reETRRPVRaltegravirDolutegravirMaraviroc | ||
| EFVNVP | Inducción CYP3A4 | ||||
ATV/r: atazanavir potenciado con ritonavir; BID: dos veces al día; BOC: boceprevir; CYP: citocromo P450; EFV: efavirenz; ETV: etravirina; IP/r: inhibidores de la proteasa del VIH potenciados con ritonavir; ITIAN: inhibidores de la transcriptasa inversa análogos de nucleósidos; ITINN: inhibidores de la transcriptasa inversa no análogos de nucleós(t)idos; NVP: nevirapina; RPV: rilpivirina; TVR: telaprevir.
Gracias a la introducción del TARGA en la segunda mitad de los años noventa, la morbimortalidad relacionada a la infección por VIH se ha reducido considerablemente. Los pacientes con infección por VIH viven más y están sujetos al diagnóstico de enfermedades concomitantes que necesitan su tratamiento específico. Un conocimiento de las potenciales interacciones entre fármacos antirretrovirales y otros medicamentos es fundamental no solo para los especialistas en el campo sino también para otros profesionales que tratan a estos pacientes, desde los médicos de familia a los especialistas hospitalarios, ya que, como se ha demostrado en esta revisión, fármacos de la mayoría de las categorías terapéuticas pueden tener interacciones incluso mortales con la medicación antirretroviral. La mayoría de interacciones tienen lugar mediante el efecto inductor o inhibidor sobre el CYP450 a nivel hepático y/o la glucoproteínaP. Los IP, especialmente los potenciados con ritonavir, como potentes inhibidores del CYP3A4, son los fármacos a los cuales más frecuentemente se ha relacionado con reacciones graves como consecuencia de interacciones farmacológicas. Los ITINN nevirapina, efavirenz y etravirina también presentan interacciones importantes que hay que tener en cuenta a la hora de la prescripción. En cambio, rilpivirina no modifica los niveles de otros fármacos, dado que no es inductor ni inhibidor del citocromo P450; sin embargo, por ser sustrato del CYP3A4, otros fármacos pueden modificar sus concentraciones. Rilpivirina no debe asociarse con inductores del CYP3A4 o inhibidores de la bomba de protones que podrían poner en peligro su eficacia. Raltegravir (que se metaboliza por glucuronoconjugación, mecanismo independiente del CYP3A4), en combinación con emtricitabina/tenofovir o abacavir/lamivudina es una alternativa terapéutica válida en las ocasiones en las cuales es deseable evitar interacciones que a veces son difíciles de prever y manejar, como es el caso de los tratamientos antineoplásicos o en los pacientes trasplantados que reciben inmunosupresores. Es previsible que el cobicistat, asociado a elvitegravir o a IP, presente un espectro de interacciones muy parecido al ritonavir a nivel de CYP3A4. A pesar del bajo potencial de interacciones de dolutegravir con los sustratos del CYP3A4, serán necesarios estudios farmacocinéticos específicos para confirmar el favorable perfil de este fármaco. Datos preliminares en voluntarios sanos han sido muy positivos.
Dado que el manejo de los pacientes infectados por el VIH es complejo, es imprescindible la colaboración y la comunicación entre los diferentes especialistas implicados en el cuidado de un paciente y el acceso de los mismos a todos los fármacos prescritos al paciente en los diferentes ámbitos (atención primaria y especializada). Aunque las interacciones son muchas y pueden llegar a ser muy graves, pueden manejarse adecuadamente con un adecuado conocimiento y prevención de las mismas, mediante el registro y la evaluación de la medicación que recibe el paciente, tanto de las especialidades farmacéuticas, como de productos de herbolario u otras medicinas alternativas que pudiera estar tomando.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses relativo al presente artículo.