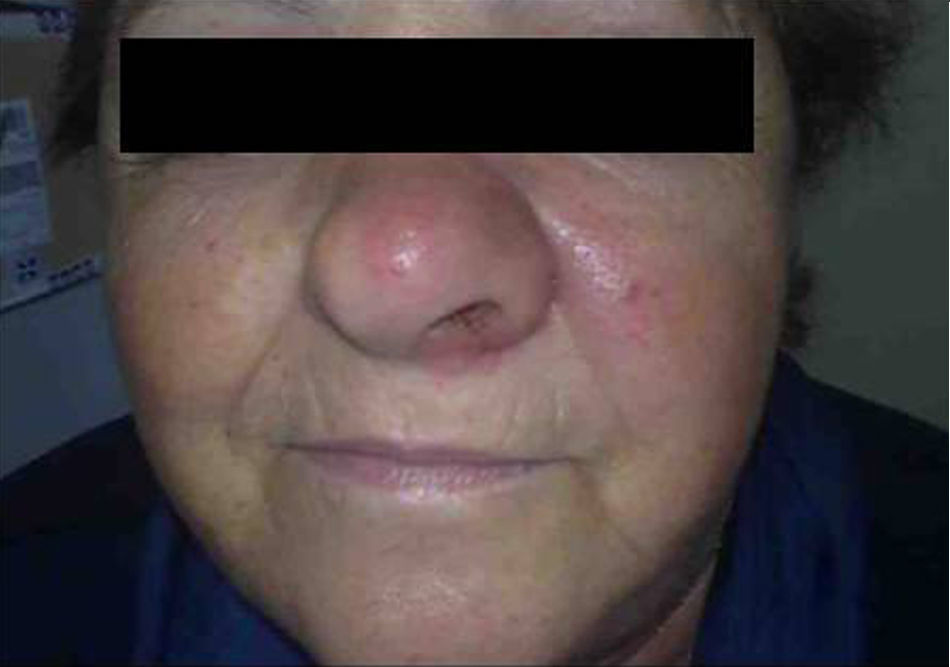
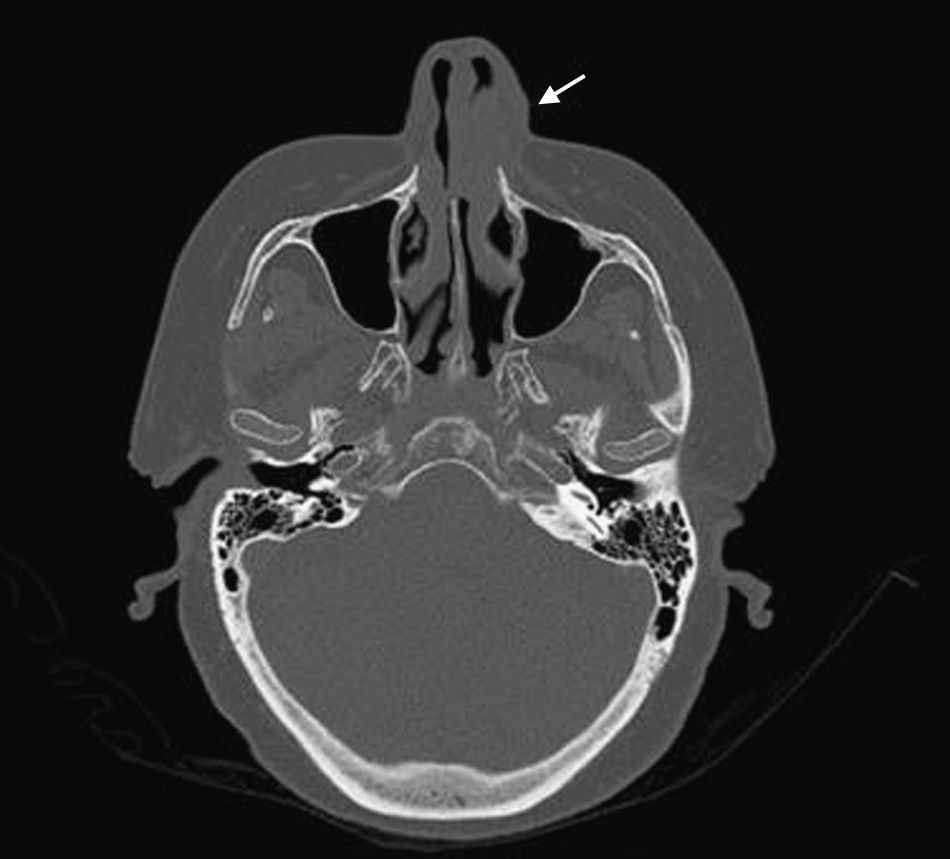
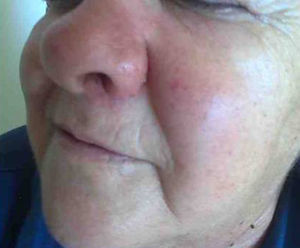
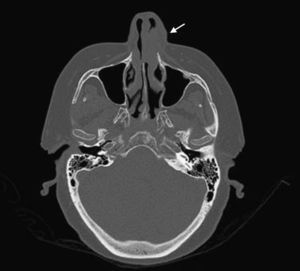
Mujer de 66 años de edad con artritis reumatoide de 7 años de evolución en tratamiento, desde el diagnóstico, con prednisona (2,5mg diarios), metotrexato subcutáneo (15mg semanales) y ácido fólico (10mg semanales), a los que se había añadido infliximab (3mg/kg intravenosos cada 6 semanas, 17 dosis administradas) por respuesta inadecuada. Consulta por presentar un cuadro, de 7 meses de evolución, consistente en inflamación cutánea progresiva en el dorso del ala nasal izquierda, a la que se asocia dolor local intenso, obstrucción del orificio nasal y epistaxis intermitente, sin referir fiebre ni síntomas sistémicos. En la exploración destacaba tumefacción e induración dolorosa del ala nasal y surco nasogeniano izquierdos, con eritema, aumento de temperatura local y rinorrea anterior purulenta teñida de restos hemáticos sin otras anomalías en el examen físico general (figs. 1 y 2). La analítica no mostró alteraciones, con proteína C reactiva de 1,5mg/dl y en una TC craneofacial se identificó una tumoración sólida (17 x 30mm), de contornos irregulares y aspecto infiltrante, originada en ala nasal izquierda y que se realzaba de forma homogénea tras la administración de contraste (fig. 3).
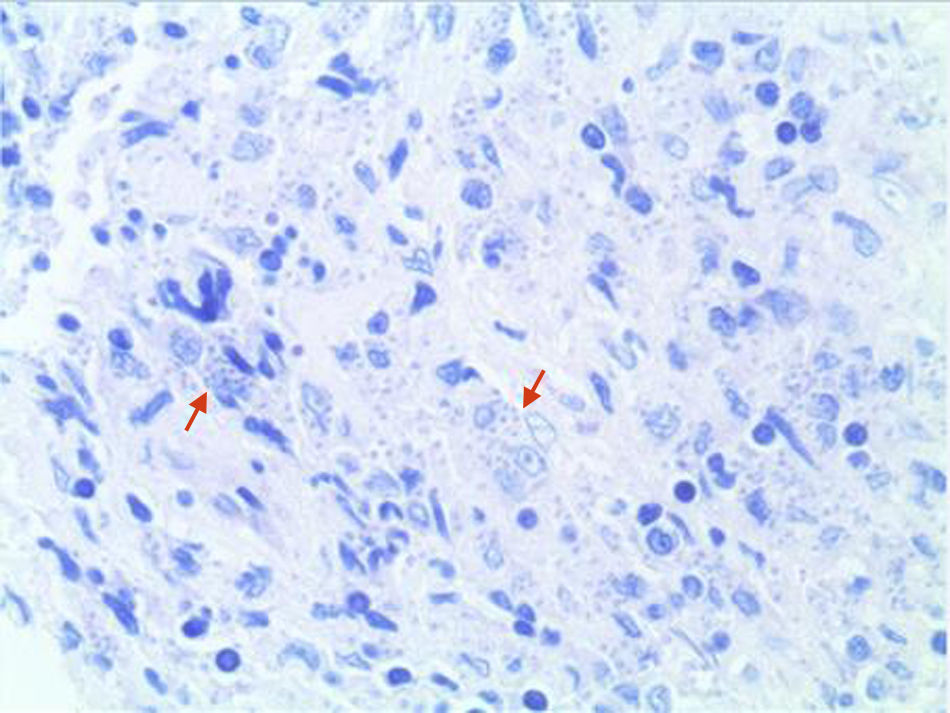
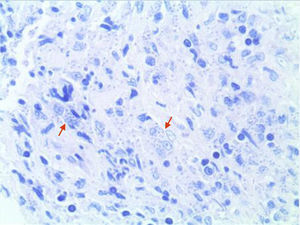
EvoluciónAnte la progresión de la lesión se realizaron biopsias locales seriadas. El estudio anatomopatológico inicial reveló la presencia de un tejido fibroso con algunas áreas de necrosis y con un infiltrado inflamatorio granulomatoso inespecífico de predominio linfoplasmocitario. La revisión de las muestras utilizando la tinción de Giemsa puso de manifiesto la presencia de elementos intracelulares redondeados compatibles con amastigotes de Leishmania (fig. 4). El cultivo posterior en medio NNN (Novy, Nicolle, McNeal) mostró crecimiento de Leishmania spp. y las técnicas de secuenciación genómica (PCR-ELISA) identificaron Leishmania infantum (zimodema MON-183). Se estableció así el diagnóstico definitivo de leishmaniasis mucocutánea. Los inmunosupresores fueron retirados y se inició tratamiento con anfotericina B liposomal en dosis de 4mg/kg/día, que fue necesario suspender por la aparición de una crisis hipertensiva durante la perfusión intravenosa y sustituir por antimoniato de meglumina intravenoso (Glucantime®), en dosis de 20mg/kg/día de antimonio pentavalente, durante 28 días. La tolerancia y respuesta al tratamiento fueron adecuadas con resolución progresiva y completa de la lesión y mejoría de los síntomas, sin presentar recidivas en el seguimiento posterior. En la actualidad el tratamiento antifactor de necrosis tumoral alfa (TNFα) se ha reiniciado, 3 meses después, sustituyendo infliximab por etanercept (25mg subcutáneos, dos veces a la semana) ante el mal control del proceso articular.
ComentarioLas leishmaniasis son un conjunto heterogéneo de enfermedades, producidas por distintas especies de un protozoo intracelular estricto perteneciente a la familia Leishmania, que parasita las células del sistema mononuclear fagocítico. Son zoonosis transmitidas por mosquitos flebótomos y su reservorio natural está constituido por mamíferos, especialmente cánidos y roedores. La enfermedad es endémica en áreas focales de casi 90 países y se calcula una incidencia global de 2 millones de nuevos casos anuales. Existen 3 formas clínicas básicas, cutánea, mucocutánea y visceral, dependientes de la especie implicada y del tipo de respuesta inmunitaria establecida. Aunque puede afectar a la población general, la leishmaniasis ha destacado en los últimos años como infección oportunista en enfermos neoplásicos, trasplantados o con sida. En este sentido, se han publicado varios casos de leishmaniasis visceral y cutánea en pacientes con artropatías inflamatorias tratados con inmunosupresores, especialmente con fármacos anti-TNFα (infliximab1–5, etanercept6 y adalimumab7–9), aunque también con metotrexato y corticoides. En modelos animales se ha demostrado el papel crucial del TNFα, una citocina proinflamatoria, en la protección frente a diversos organismos intracelulares, en particular a través de la activación de los macrófagos y la formación de granulomas, lo que explicaría la vulnerabilidad de los pacientes que reciben estas terapias biológicas a sufrir la reactivación de enfermedades granulomatosas e infecciones oportunistas como tuberculosis, aspergilosis, toxoplasmosis, criptococosis, listeriosis o leishmaniasis3,5,7,9.
En la literatura especializada solo se han comunicado 3 casos de leishmaniasis cutánea2,4,9, y ninguno de leishmaniasis mucocutánea, en pacientes previamente tratados con fármacos anti-TNFα. Esta presentación oportunista ocurre por reactivación de una infección latente, previamente inadvertida o por primoinfección durante el tratamiento y el agente causal más frecuente en nuestro medio es L. infantum. Las lesiones suelen aparecer en áreas expuestas y se inician como pequeñas pápulas induradas, eritemato-violáceas, que posteriormente dan paso al desarrollo de una ulceración indolora de bordes sobreelevados y costra central con frecuentes linfadenopatías locales. La tendencia natural, aun en ausencia de tratamiento, es la curación espontánea, dando lugar a una cicatriz atrófica, aunque el 15% de los casos evolucionan a leishmaniasis mucocutánea, destacando la progresión nasal donde puede producir destrucción de cartílagos nasales y paladar blando con mutilaciones extensas.
Nuestro caso refuerza la importancia de vigilar estrechamente a los pacientes tratados con anti-TNFα en áreas endémicas, para detectar precozmente manifestaciones de leishmaniasis cutánea o sistémica, que además suelen tener un comportamiento atípico y agresivo en estos pacientes3–5. También en estas áreas podría ser útil identificar, de forma previa al tratamiento, a los individuos con mayor riesgo, realizando estudios serológicos7 e investigando el antecedente de una posible infección previa por leishmania5,9. Por otra parte, la mayoría de los autores recomiendan reiniciar el tratamiento biológico tras la curación de la infección intercurrente, siendo más seguro etanercept que los anticuerpos monoclonales10.