El coste incremental que comportan las bacteriemias nosocomiales (BN) se utiliza como medida del impacto de estas infecciones. Los métodos tradicionales de cálculo de coste sobrestiman este incremento al no contemplar variables confusoras. El objetivo de este trabajo es comparar 3 metodologías de cálculo del coste incremental de la BN para corregir los sesgos presentes en análisis previos.
MétodosSe compararon los pacientes que presentaron algún episodio de BN entre 2005 y 2007, con los pacientes con la misma patología sin BN. Los microorganismos causantes se agruparon según la tinción Gram y según si la bacteriemia era monomicrobiana o polimicrobiana, o producida por un hongo. Se compararon 3 métodos de cálculo: 1)estratificación por patología; 2)ajuste econométrico multivariante mediante un modelo lineal generalizado (MLG), y 3)un propensity score matching (PSM) antes del análisis multivariante para controlar los sesgos.
ResultadosSe analizaron 640 hospitalizaciones con BN y 28.459 sin BN; el coste medio observado fue de 24.515€ y 4.851,6€, respectivamente. En la estratificación por patología, el coste incremental medio estimado fue de 14.735€; el grupo de microorganismos que ocasionó menor coste incremental fue el de grampositivos, con 10.051€. En el MLG el coste incremental medio estimado fue de 20.922€, mientras que utilizando PSM se estimó un coste incremental medio de 11.916€. En las 3 estimaciones hay diferencias importantes según el grupo de microorganismos.
ConclusionesUtilizar metodologías más elaboradas mejora el ajuste en este tipo de estudios e incrementa el valor de los resultados obtenidos.
The excess cost associated with nosocomial bacteraemia (NB) is used as a measurement of the impact of these infections. However, some authors have suggested that traditional methods overestimate the incremental cost due to the presence of various types of bias. The aim of this study was to compare three assessment methods of NB incremental cost to correct biases in previous analyses.
MethodsPatients who experienced an episode of NB between 2005 and 2007 were compared with patients grouped within the same All Patient Refined-Diagnosis-Related Group (APR-DRG) without NB. The causative organisms were grouped according to the Gram stain, and whether bacteraemia was caused by a single or multiple microorganisms, or by a fungus. Three assessment methods are compared: stratification by disease; econometric multivariate adjustment using a generalised linear model (GLM); and propensity score matching (PSM) was performed to control for biases in the econometric model.
ResultsThe analysis included 640 admissions with NB and 28,459 without NB. The observed mean cost was €24,515 for admissions with NB and €4,851.6 for controls (without NB). Mean incremental cost was estimated at €14,735 in stratified analysis. Gram positive microorganism had the lowest mean incremental cost, €10,051. In the GLM, mean incremental cost was estimated as €20,922, and adjusting with PSM, the mean incremental cost was €11,916. The three estimates showed important differences between groups of microorganisms.
ConclusionsUsing enhanced methodologies improves the adjustment in this type of study and increases the value of the results.
Las infecciones asociadas al sistema sanitario son uno de los efectos adversos de la asistencia con más posibilidades de prevención. Un trabajo reciente que analiza la tendencia en efectos adversos relacionados con la atención sanitaria considera que sería prevenible el 74,5% de las infecciones hospitalarias, y que incluso llegaría al 88,9% en el caso de las bacteriemias asociadas a catéter vascular1. Por otra parte, las infecciones hospitalarias representan un coste económico muy importante. Según un estudio llevado a cabo en 12 hospitales españoles que evalúa los costes de los eventos adversos, estas infecciones fueron el evento adverso que presentó mayor coste (el 64,2% del total), a pesar de ser uno de los menos frecuentes2.
Entre las infecciones asociadas al sistema sanitario, las bacteriemias nosocomiales tienen un gran impacto en la morbimortalidad de la población general, ya que se encuentran entre las 7 principales causas de mortalidad3. Se ha estimado que en Europa se producen entre 1,2 y 1,4 millones de episodios de bacteriemias al año3.
El exceso de coste que llevan asociado se utiliza como medida del impacto de estas infecciones. Tradicionalmente estos análisis se han llevado a cabo con diseños de tipo caso-control; sin embargo, se han descrito diversos problemas ligados al apareamiento. Por un lado, las características de los enfermos son muy diversas y, si se quiere aparear por todas las posibles variables confusoras, se requiere un número muy grande de controles, lo que resulta muy costoso e ineficiente. Debido a ello, en ocasiones se excluye del análisis una parte de los enfermos infectados, por falta de pareja, pero entonces se puede provocar un sesgo de selección, ya que no todos los casos tendrán la misma oportunidad de ser incluidos en el análisis. También existe la posibilidad de emparejar por un número menor de variables, pero en este caso se puede provocar un sesgo por omisión de variables4-6.
Por otro lado, es conocido que la posibilidad de adquirir una infección está, en parte, ligada al tiempo de exposición. Es decir, a más días de hospitalización, más posibilidad de adquirir una infección hospitalaria. Pero también es sabido que esta infección alarga los días de estancia hospitalaria. Al mismo tiempo, los enfermos más graves —y por tanto con estancias más largas— tienen más riesgo de adquirir una infección. Este problema puede provocar un sesgo en los análisis que se conoce como endogeneity, survivor-treatment selection bias o time-dependent bias5,6.
En una reciente revisión que estudia la calidad de los estudios sobre costes de los efectos adversos de la hospitalización7 se incluyen 10 trabajos sobre el coste de las bacteriemias nosocomiales. En ellos se utilizan diversos métodos de cálculo de costes: apareamiento, modelo lineal generalizado, regresión lineal, regresión lineal múltiple, análisis de regresión, regresión múltiple y uno sin definir. La fuente del coste utilizada en estos análisis incluye microcosting, reembolso, factura, datos recogidos por el equipo de control de infecciones, centros de coste médicos, base de datos de cálculo del coste, base de datos de contabilidad o sistema de contabilidad. Según los autores de la revisión, el 61% de los trabajos analizados no describen de forma clara la metodología de cálculo de coste, y entre los que sí la describen hay disparidad de métodos que dificulta la comparación. El coste atribuible en los diferentes estudios va desde 2.421€ a 67.439$, un rango muy amplio, como es de esperar puesto que los estudios incluidos no son comparables.
Para superar los problemas de los sesgos se ha trabajado con la técnica propensity score matching (PSM). Esta se define como la probabilidad condicionada que tiene cada individuo de sufrir un evento, en este caso una bacteriemia, teniendo en cuenta el resto de covariables8. Al PSM se le atribuye la propiedad de reducir los efectos confusores de las covariables y, de esta forma, asegurar que las diferencias se pueden atribuir a la presencia de la bacteriemia nosocomial.
En un trabajo previo del mismo equipo, se estimó el coste incremental de la bacteriemia nosocomial en una media de 14.735€ en el análisis estratificado por patología, y un incremento de 2,3 veces el coste de los enfermos sin bacteriemia9. En el presente trabajo comparamos los resultados publicados anteriormente con los obtenidos aplicando técnicas de PSM con el fin de identificar el método que mejor solucione el problema de los distintos tipos de sesgo.
MétodosEstudio descriptivo, retrospectivo realizado en el Hospital del Mar de Barcelona. Este es un hospital universitario que atiende un área de referencia de 350.000 habitantes.
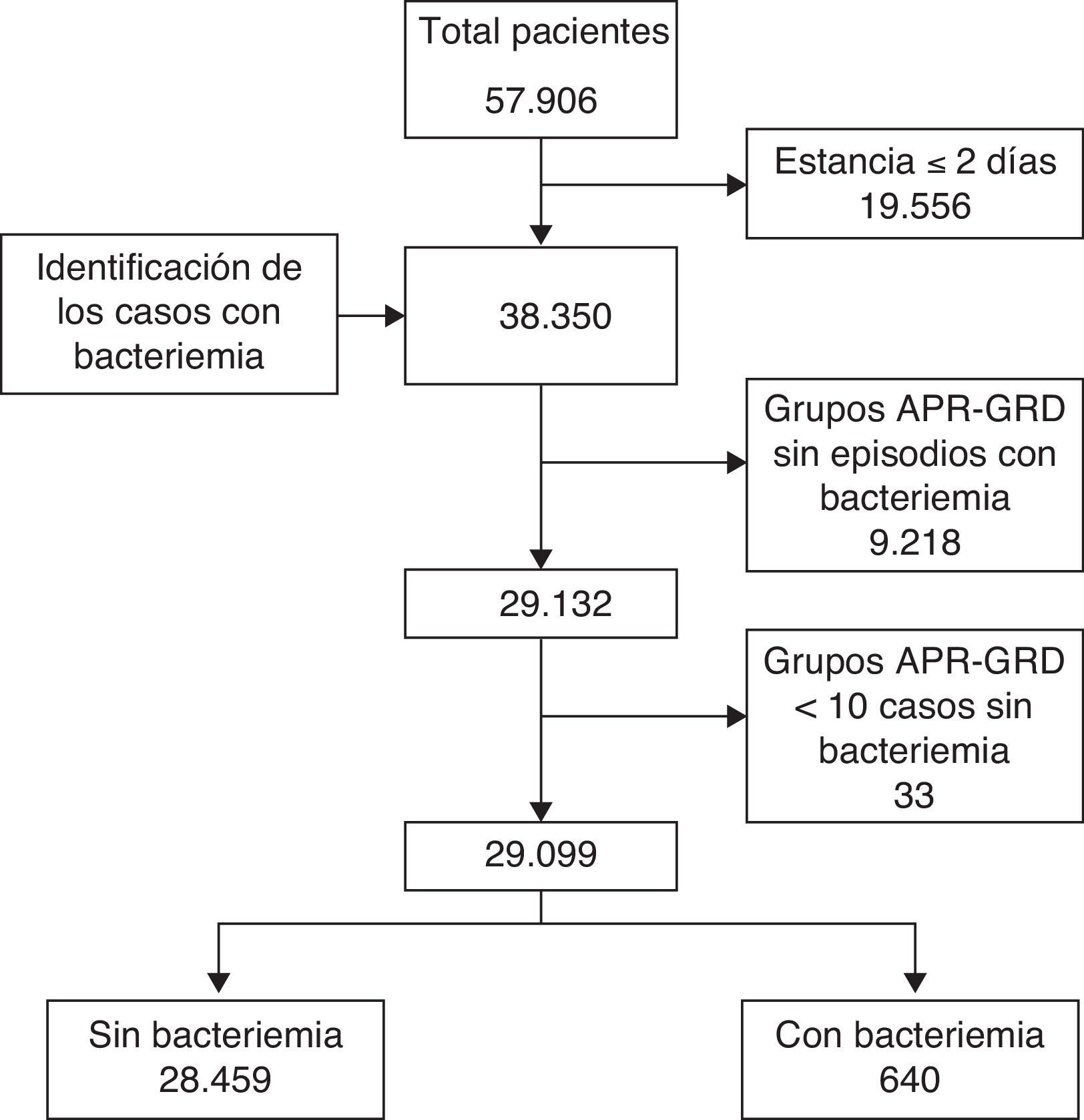
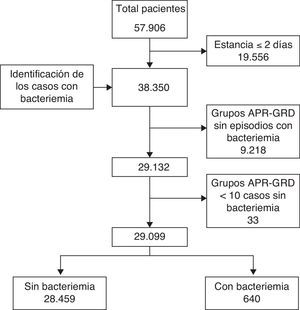
La población del estudio la formaban todos los episodios de hospitalización entre enero de 2005 y diciembre de 2007, agrupados utilizando grupos relacionados con el diagnóstico All Patient Refined Diagnosis Related Groups (APR-DRG) versión 2410. Se excluyeron los pacientes agrupados en el APR-DRG «no agrupable» por falta de información clínica del proceso, así como los APR-DRG con menos de 10 casos sin bacteriemia nosocomial, con el fin de tener un estándar más robusto.
La información se obtuvo del conjunto mínimo básico de datos al alta hospitalaria. La identificación de los enfermos con bacteriemia se realizó utilizando información recogida por el equipo de control de infecciones del hospital, que realiza un seguimiento prospectivo de las bacteriemias. Se definió como bacteriemia nosocomial aquella que sucedió a partir del tercer día después del ingreso y cuya causa no estaba presente en el momento del ingreso, utilizando las definiciones del Centers for Disease Control and Prevention (CDC) adaptadas11.
Para la realización de los análisis, los microorganismos identificados se agruparon en 4 grupos, en función de la tinción de Gram y según la bacteriemia fuera monomicrobiana o polimicrobiana, o causada por un hongo. Los grupos utilizados fueron: a)bacteriemias por microorganismos grampositivos; b)bacteriemias por microorganismos gramnegativos; c)bacteriemias polimicrobianas por grampositivos y gramnegativos, y d)funguemias; en este último caso no se distinguió si se identificaba uno o más microorganismos. Aunque habitualmente los microorganismos anaerobios se identifican como un grupo propio, debido al escaso número de ellos identificados en los cultivos se incluyeron en los grupos de grampositivo o gramnegativo.
La información de los costes se obtuvo del sistema de información del hospital, que dispone de un sistema de contabilidad analítica de costes completos que incorpora la valoración de las actividades que han intervenido en la atención a cada paciente, según criterio Activity Based Costing (ABC)12. El coste evaluado fue el coste total del hospital, que incluye coste fijo y coste variable. Los costes corrientes de cada año se convirtieron en costes constantes 2006, utilizando el índice de precios de consumo, índices nacionales, publicado por el Instituto Nacional de Estadística13.
La variable dependiente fue el coste del episodio de hospitalización. La variable explicativa principal fue la presencia de bacteriemia nosocomial.
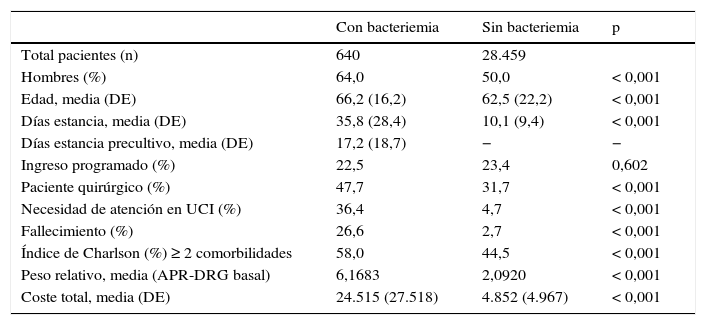
Se realizó un análisis descriptivo de todas las variables de los enfermos con y sin bacteriemia. Se utilizó el test de Chi-cuadrado para comparar las variables categóricas. La comparación de medias se realizó mediante las pruebas no paramétricas U de Mann-Whitney y el test de Kruskal-Wallis (tabla 1).
Pacientes analizados con y sin bacteriemia nosocomial, características y coste medio del proceso
| Con bacteriemia | Sin bacteriemia | p | |
|---|---|---|---|
| Total pacientes (n) | 640 | 28.459 | |
| Hombres (%) | 64,0 | 50,0 | < 0,001 |
| Edad, media (DE) | 66,2 (16,2) | 62,5 (22,2) | < 0,001 |
| Días estancia, media (DE) | 35,8 (28,4) | 10,1 (9,4) | < 0,001 |
| Días estancia precultivo, media (DE) | 17,2 (18,7) | − | − |
| Ingreso programado (%) | 22,5 | 23,4 | 0,602 |
| Paciente quirúrgico (%) | 47,7 | 31,7 | < 0,001 |
| Necesidad de atención en UCI (%) | 36,4 | 4,7 | < 0,001 |
| Fallecimiento (%) | 26,6 | 2,7 | < 0,001 |
| Índice de Charlson (%) ≥ 2 comorbilidades | 58,0 | 44,5 | < 0,001 |
| Peso relativo, media (APR-DRG basal) | 6,1683 | 2,0920 | < 0,001 |
| Coste total, media (DE) | 24.515 (27.518) | 4.852 (4.967) | < 0,001 |
DE: desviación estándar; UCI: unidad de cuidados intensivos.
Se compararon 3 métodos de cálculo del coste incremental que comparten la misma metodología de cálculo, la estratificación por patología: la población agrupada en APR-DRG se dividió en 2 grupos según que el enfermo presentara, o no, algún episodio de bacteriemia nosocomial durante el ingreso (fig. 1). Se compararon los pacientes que presentaron algún episodio de bacteriemia nosocomial con los pacientes agrupados en el mismo APR-DRG que no la presentaron.
1. La primera configuración consistió en aplicar la estratificación por patología al coste observado sin ningún tipo de ajuste. Se calculó el coste medio por APR-DRG de los enfermos que no presentaron bacteriemia. Estos costes medios se utilizaron como estándar para comparar los costes de los enfermos que habían presentado bacteriemia. Así el coste incremental se definió como: Coste del enfermoicon bacteriemia en APR-DRGj−Media de costes de todos los enfermos sin bacteriemia agrupados en el APR-DRGj. Este método fue utilizado en Riu et al.9.
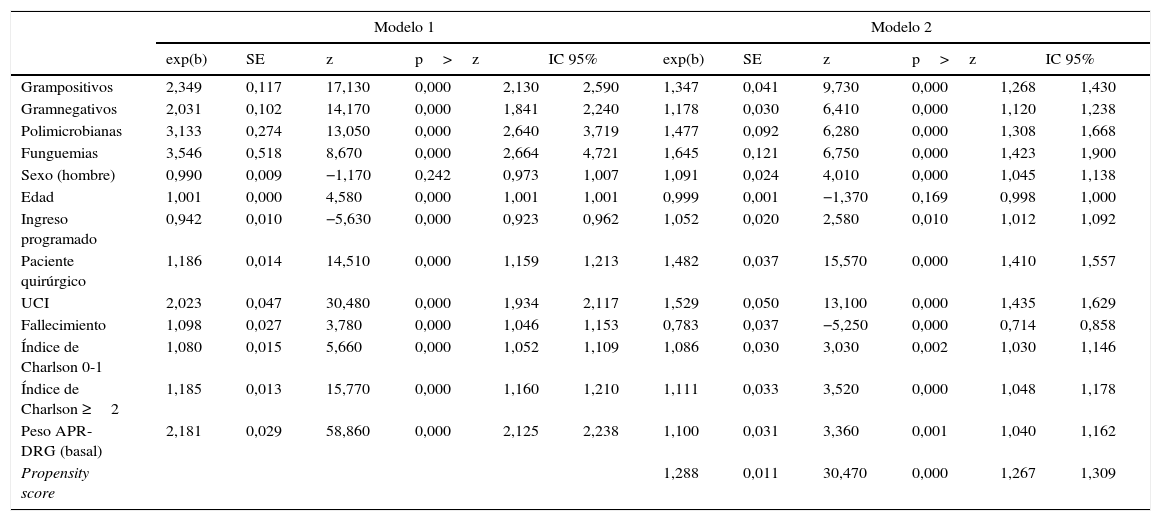
2. Para la segunda modalidad de análisis se utilizó un ajuste econométrico multivariante (modelo1): se ajustó un modelo lineal generalizado (MLG) con distribución Gamma y función de link logaritmo, debido a que la distribución de los costes no es una normal14. En este modelo se explicó el coste total en función del grupo de microorganismos causantes de la bacteriemia. Como variables de ajuste se utilizaron el tipo de ingreso, el motivo de hospitalización, la necesidad de atención en unidades de cuidados intensivos (UCI), la presencia de comorbilidades utilizando el índice de Charlson15 y el estado al alta, definido como vivo o muerto. Se calculó el coste total medio de todos los enfermos sin bacteriemia, y posteriormente se indexaron los costes de cada grupo de APR-DRG con relación a dicho coste medio global; esta variable permitió incorporar la complejidad de la patología en los análisis. Se muestra como resultado la exponencial del coeficiente de cada valor (tabla 2). Se estimó el coste incremental (tabla 3) mediante la estratificación por patología del agrupador APR-DRG, del coste ajustado según el modelo1.
Modelos multivariantes para explicar el incremento del coste, según el tipo de microorganismo causante
| Modelo 1 | Modelo 2 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| exp(b) | SE | z | p>z | IC 95% | exp(b) | SE | z | p>z | IC 95% | |||
| Grampositivos | 2,349 | 0,117 | 17,130 | 0,000 | 2,130 | 2,590 | 1,347 | 0,041 | 9,730 | 0,000 | 1,268 | 1,430 |
| Gramnegativos | 2,031 | 0,102 | 14,170 | 0,000 | 1,841 | 2,240 | 1,178 | 0,030 | 6,410 | 0,000 | 1,120 | 1,238 |
| Polimicrobianas | 3,133 | 0,274 | 13,050 | 0,000 | 2,640 | 3,719 | 1,477 | 0,092 | 6,280 | 0,000 | 1,308 | 1,668 |
| Funguemias | 3,546 | 0,518 | 8,670 | 0,000 | 2,664 | 4,721 | 1,645 | 0,121 | 6,750 | 0,000 | 1,423 | 1,900 |
| Sexo (hombre) | 0,990 | 0,009 | −1,170 | 0,242 | 0,973 | 1,007 | 1,091 | 0,024 | 4,010 | 0,000 | 1,045 | 1,138 |
| Edad | 1,001 | 0,000 | 4,580 | 0,000 | 1,001 | 1,001 | 0,999 | 0,001 | −1,370 | 0,169 | 0,998 | 1,000 |
| Ingreso programado | 0,942 | 0,010 | −5,630 | 0,000 | 0,923 | 0,962 | 1,052 | 0,020 | 2,580 | 0,010 | 1,012 | 1,092 |
| Paciente quirúrgico | 1,186 | 0,014 | 14,510 | 0,000 | 1,159 | 1,213 | 1,482 | 0,037 | 15,570 | 0,000 | 1,410 | 1,557 |
| UCI | 2,023 | 0,047 | 30,480 | 0,000 | 1,934 | 2,117 | 1,529 | 0,050 | 13,100 | 0,000 | 1,435 | 1,629 |
| Fallecimiento | 1,098 | 0,027 | 3,780 | 0,000 | 1,046 | 1,153 | 0,783 | 0,037 | −5,250 | 0,000 | 0,714 | 0,858 |
| Índice de Charlson 0-1 | 1,080 | 0,015 | 5,660 | 0,000 | 1,052 | 1,109 | 1,086 | 0,030 | 3,030 | 0,002 | 1,030 | 1,146 |
| Índice de Charlson ≥2 | 1,185 | 0,013 | 15,770 | 0,000 | 1,160 | 1,210 | 1,111 | 0,033 | 3,520 | 0,000 | 1,048 | 1,178 |
| Peso APR-DRG (basal) | 2,181 | 0,029 | 58,860 | 0,000 | 2,125 | 2,238 | 1,100 | 0,031 | 3,360 | 0,001 | 1,040 | 1,162 |
| Propensity score | 1,288 | 0,011 | 30,470 | 0,000 | 1,267 | 1,309 | ||||||
exp(b): coeficiente exponenciado; IC 95%: intervalo de confianza al 95%; p>z: valor p; SE: standard error, desviación típica; z: valor z.
Modelo 1: modelo lineal generalizado.
Modelo 2: integra la metodología de ajuste propensity score matching.
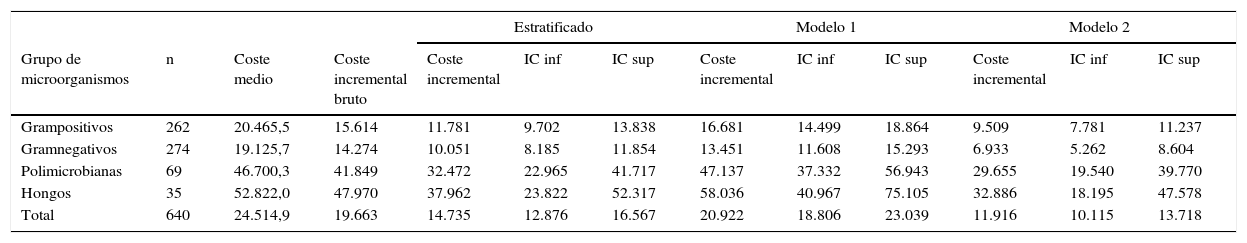
Coste medio y coste incremental, en euros, según grupo de microorganismo y con los 3 métodos de cálculo
| Estratificado | Modelo 1 | Modelo 2 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grupo de microorganismos | n | Coste medio | Coste incremental bruto | Coste incremental | IC inf | IC sup | Coste incremental | IC inf | IC sup | Coste incremental | IC inf | IC sup |
| Grampositivos | 262 | 20.465,5 | 15.614 | 11.781 | 9.702 | 13.838 | 16.681 | 14.499 | 18.864 | 9.509 | 7.781 | 11.237 |
| Gramnegativos | 274 | 19.125,7 | 14.274 | 10.051 | 8.185 | 11.854 | 13.451 | 11.608 | 15.293 | 6.933 | 5.262 | 8.604 |
| Polimicrobianas | 69 | 46.700,3 | 41.849 | 32.472 | 22.965 | 41.717 | 47.137 | 37.332 | 56.943 | 29.655 | 19.540 | 39.770 |
| Hongos | 35 | 52.822,0 | 47.970 | 37.962 | 23.822 | 52.317 | 58.036 | 40.967 | 75.105 | 32.886 | 18.195 | 47.578 |
| Total | 640 | 24.514,9 | 19.663 | 14.735 | 12.876 | 16.567 | 20.922 | 18.806 | 23.039 | 11.916 | 10.115 | 13.718 |
Modelo 1: modelo lineal generalizado.
Modelo 2: integra la metodología de ajuste propensity score matching.
3. La tercera opción (modelo2) integró la metodología de ajuste utilizando el PSM para controlar los sesgos analíticos previamente identificados: mediante un modelo de regresión logística se calculó, para cada paciente, la probabilidad de desarrollar una bacteriemia (propensity score) y se utilizó para realizar un PSM16,17. Posteriormente, el propensity score, ajustado por los días de estancia hospitalaria previos al evento (bacteriemia), se incluyó en los modelos econométricos para ajustar el coste incremental de los enfermos que han desarrollado una bacteriemia, además de las variables descritas en el punto2.
Para ambos modelos de ajuste se validaron las condiciones de no colinealidad y de correlación entre las variables explicativas; se realizaron las validaciones de las familias de distribución de los modelos MLG utilizados y, para el modelo con PSM, se comprobó la estabilidad del ajuste del riesgo de desarrollar una bacteriemia (propensity score), mediante el cual se redujeron los sesgos de selección para las variables explicativas y el time dependent bias.
ResultadosEn el periodo analizado se realizaron 57.906 ingresos hospitalarios, de los que 646 presentaron algún episodio de bacteriemia nosocomial (1,1%). Después de aplicar los criterios de exclusión quedaron 29.099 hospitalizaciones, 28.459 (97,8%) sin y 640 (2,2%) con bacteriemia nosocomial (fig. 1). Los microorganismos predominantes en el grupo de grampositivos fueron Staphylococcus epidermidis (41,8%), Staphylococcus aureus (24,1%) y Enterococcus faecalis (9%); en el grupo de gramnegativos los más frecuentes fueron Escherichia coli (35,8%), Pseudomonas aeruginosa (18,5%) y Klebsiella pneumoniae (12,7%). El 98% de hongos fueron Candida sp., con predominancia de C.albicans (37,5%) y C.glabrata (25%).
Las características y el coste medio de las hospitalizaciones analizadas se muestran en la tabla 1. Se observa que los pacientes con bacteriemia presentaron diferencias estadísticamente significativas en todas las variables de interés, excepto en el porcentaje de ingreso programado.
En la tabla 2 se muestran los resultados de los modelos1 y 2. Después de ajustar por las variables descritas se puede observar que el paciente con una bacteriemia producida por un microorganismo grampositivo tuvo un coste 2,349 (IC: 2,130-2,590) veces superior al mismo enfermo sin bacteriemia en el modelo1, y 1,347 (IC: 1,268-1,430) veces en el modelo2. Si el microorganismo era gramnegativo, el coste fue 2,031 y 1,178 veces superior, respectivamente. En el caso de las bacteriemias nosocomiales polimicrobianas el coste fue 3,133 y 2,640 veces superior en cada modelo, mientras que las funguemias nosocomiales presentaron un coste 3,546 y 1,645 veces superior, respectivamente.
El grupo de microorganismos que ocasionó bacteriemia nosocomial con mayor frecuencia fue el de gramnegativos, con 272 casos, seguido del grupo de grampositivos, de polimicrobianas y, en último lugar, el de los hongos (tabla 3). En la misma tabla se presenta el coste medio bruto, el coste incremental bruto y el estimado con los 3 modelos de ajuste, según grupo de microorganismos y total. El coste medio bruto para todos los microorganismos fue de 24.515€, con un coste incremental medio bruto de 19.663€. El coste incremental bruto inferior corresponde a los microorganismos gramnegativos (14.274€), y el más elevado, a las funguemias (47.970€).
En el modelo estratificado por patología, el coste incremental medio global fue de 14.735€, con un intervalo de confianza de 12.876-16.567. También en este modelo los microorganismos que ocasionaron menor coste fueron los gramnegativos y los que lo ocasionaron superior fueron los hongos, aunque en todos los grupos los costes incrementales estimados fueron inferiores a los observados.
En el modelo 1 el coste incremental medio estimado fue de 20.922€ (IC: 18.806-23.039); en este caso la mayor parte de costes estimados son superiores a los observados, excepto en el grupo de gramnegativos, que fue de 13.451€. El modelo2 es el que estimó un coste incremental medio inferior tanto para el total de pacientes (11.916€; IC: 10.115-13.718) como para todos los grupos de microorganismos.
DiscusiónLos modelos previos al cálculo del propensity score comparan el coste de los pacientes que han tenido una bacteriemia con el de los pacientes que no la tuvieron, sin tener en cuenta que el riesgo de desarrollar una bacteriemia es directamente proporcional al periodo de exposición, en este caso la estancia hospitalaria. Esta limitación deja evidente que los costes incrementales podrían resultar sobrestimados. Si observamos la tabla 2 vemos que casi todos los coeficientes del modelo2 son bastante inferiores a los del modelo1. Ello muestra que incorporar esta probabilidad a todos los pacientes disminuye las diferencias en el resto de variables y nos permite acercarnos a una valoración menos sesgada y no sobrestimada del coste incremental de una bacteriemia, teniendo en cuenta que el modelo2 controla por el efecto de los días de estancia. En el modelo1 el hecho de desarrollar una bacteriemia incrementa entre 2,03 y 3,55 veces el coste del paciente, según el grupo de microorganismos causantes. Esta cifra es similar a la encontrada en un estudio de las mismas características donde el incremento para el total de bacteriemias es de 2,9 veces18.
En cuanto a la estimación del coste incremental, vemos que solamente estratificando por patología el coste observado de los pacientes del estudio, se produce una reducción importante del coste incremental, de una diferencia bruta de 19.663€ a un coste incremental estratificado de 14.735€ de forma global. Ello se debe a que la agrupación con APR-DRG, que tiene en cuenta la patología, las comorbilidades y algunas características del paciente y del episodio, permite aproximar un primer ajuste de riesgo del coste observado, lo que confirma la elevada capacidad explicativa del agrupador APR-DRG para captar diferencias en consumo de recursos. Además, el hecho de excluir los grupos de APR-DRG con menos de 10 casos sin bacteriemia proporciona un grupo de comparación más robusto. El coste incremental estimado mediante este método resulta considerablemente válido y consistente; sin embargo, no deja de mantener incorporados los puntos débiles de un análisis que no incluye todos los niveles de ajuste. En un trabajo que utilizaba este mismo método19, el coste incremental de las bacteriemias nosocomiales fue de 12.853€, muy similar al descrito en el presente trabajo.
En relación con el coste incremental estimado mediante el modelo1, llama la atención que en casi todos los grupos de microorganismos los costes incrementales estimados son superiores a los costes incrementales brutos. Seguramente los coeficientes calculados con este modelo pueden dar una idea del incremento de coste, pero es evidente que no es posible hacer estimaciones con ellos. Por tanto, aunque en algún momento se recomendaba como el mejor método para realizar este tipo de cálculos6,18, en realidad sobrestima el coste incremental. Cuando, en el modelo de ajuste por riesgo del coste por paciente, se incorpora la probabilidad de sufrir una bacteriemia (modelo2), el coste incremental estimado desciende hasta una media de 11.856€, cifra inferior a la descrita por Roberts et al.20, que describen un coste atribuible a la bacteriemia de 15.275$.
Park et al.21 evalúan el coste de las bacteriemias causadas por MRSA respecto a las causadas por MSSA, también mediante técnicas de PSM, e incluye también bacteriemias adquiridas en la comunidad; su coste estimado es de 8.355$ vs 9.369$. Aunque nosotros no podemos diferenciar las bacteriemias ocasionadas por Staphylococcus aureus del resto de microorganismos grampositivos, el coste incremental estimado para las bacteriemias causadas por este grupo de microorganismos es muy similar (9.509€).
El hecho de realizar este análisis en un único hospital no permite extrapolar los resultados a otros centros, pero asegura una correcta identificación de las bacteriemias. Permite asimismo disponer de unos costes muy precisos, puesto que son pocos los hospitales de nuestro entorno que actualmente disponen de un sistema de contabilidad analítica tan desarrollado.
El objeto del presente estudio es comparar diferentes metodologías de análisis. Por ello, los datos que utiliza son los mismos que se publicaron en esta revista hace 4 años9. Esto podría considerarse una limitación; sin embargo, no se actualizaron con el propósito de establecer una comparación directa que se centre en la metodología de ajuste y su impacto en el resultado final.
Es importante evidenciar el impacto para acotar el problema y orientar la implantación de acciones de mejora. En el presente estudio se observa una disminución del coste incremental ocasionado por la presencia de bacteriemia, y estos resultados están corroborados por un análisis metodológicamente más robusto. En cualquier caso, los valores globales de impacto económico siguen teniendo una magnitud relevante.
El uso de una metodología más elaborada añade consistencia al perfil analítico de este tipo de estudios y refuerza el alcance de los resultados obtenidos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Queremos dar las gracias a los miembros del equipo de control de infecciones y del laboratorio de microbiología, así como a todos los profesionales del hospital. Su trabajo diario nos ha permitido disponer de la información necesaria para realizar este análisis. Asimismo, agradecemos a la Dra. E. Cañete la revisión del manuscrito.