Cada vez más pacientes con cardiopatía congénita alcanzan la edad adulta. Una complicación que pueden presentar es la endocarditis infecciosa (EI). Nuestro objetivo es describir las características de la EI en esta población en un centro de referencia.
MétodosEstudio retrospectivo de una cohorte de pacientes mayores de 16 años afectos de una cardiopatía congénita diagnosticados de EI (definida por los criterios modificados de Duke) entre 1996 y 2014. Para el análisis descriptivo se consideró el primer episodio de cada paciente.
ResultadosDurante el periodo de estudio se incluyeron 27 pacientes con EI. Presentaban una edad mediana al diagnóstico de 27,7 años, predominio masculino (63%) y baja comorbilidad (índice de Charlson 0 de mediana). La adquisición fue mayoritariamente comunitaria (78%). La comunicación interventricular fue la cardiopatía subyacente más frecuente (33%). El 48% de los pacientes estaban reparados y el 19% paliados. El 41% de los pacientes eran portadores de material protésico. El 81% presentaban algún tipo de defecto residual. El 44% fueron endocarditis sobre cavidades derechas. Los microorganismos más frecuentes fueron estreptococos del grupo viridans (41%) y Staphylococcus epidermidis (30%). Un 37% requirió tratamiento quirúrgico. Hubo 5 reinfecciones y 3 recidivas. Dos pacientes fallecieron, ambos a consecuencia de una recidiva.
ConclusionesLa EI en adultos con cardiopatía congénita ocurrió en pacientes jóvenes, casi siempre con material protésico o lesiones residuales y con frecuencia en cavidades derechas. Aunque en muchos casos requirió tratamiento quirúrgico la mortalidad fue baja, excepto en el caso de las recidivas.
A growing number of patients with congenital heart disease (CHD) will reach adulthood. Infective endocarditis (IE) is a major complication in this population. The aim of this study was to describe the features of IE in adults with CHD treated in a reference centre.
MethodsA retrospective review was performed on a cohort of patients over 16 years of age with CHD who presented with IE (defined by the modified Duke criteria) between 1996 and 2014. Only the first episode from each patient was considered for the descriptive analysis.
ResultsIE was observed in 27 patients. The median age at diagnosis of IE was 27.7 years, and 63% were male. Comorbidity was low (median Charlson index was 0). IE was mostly community-acquired (78%). The most frequent CHD were ventricular septal defect (33%). A repair was performed in 48% of patients, and 19% received palliative treatment. Forty-one percent of patients had some type of prosthesis. A residual defect was observed in 81%. The IE was detected in the right side of 44% of the patients. The most frequent aetiological agents were viridans group streptococci (41%) and Staphylococcus epidermidis (30%). Surgery was required to treat IE in 37% of patients. There were five re-infections and three relapses. Two patients died, both as a result of recurrence.
ConclusionsIE in adults with CHD occurred in young patients, and almost all of them carried some prosthetic material or a residual defect. The IE is frequently right-sided. Although surgical treatment was required in many cases, mortality was low, except in the case of relapses.
Los avances en el manejo de las cardiopatías congénitas hacen que un número creciente de individuos con una cardiopatía congénita alcance la edad adulta llevando una vida comparable con la población normal. Se calcula que en España hay unos 120.000 adultos con cardiopatía congénita1 (ACC). Una de las complicaciones que pueden presentar estos pacientes es la endocarditis infecciosa (EI), con un riesgo entre 15 y 140 veces superior al de la población general2–4. Se trata de una complicación bien conocida en la población pediátrica, pero sobre la que no existe tanta información en la población adulta. La mayoría de los estudios sobre EI en estos pacientes se han realizado en población pediátrica3 o sin diferenciar entre adultos y niños5–8, y existe un número muy limitado de trabajos sobre la EI en ACC9,10.
El objetivo de este trabajo es describir las características de la EI en los ACC en un centro de referencia.
MétodosDiseño y población de estudioSe realizó un estudio retrospectivo observacional en el que se revisaron todos los casos de EI en ACC (mayores de 16 años) que realizaban seguimiento en la Unidad Integrada de Cardiopatías Congénitas del Adolescente y del Adulto Vall d’Hebron-Sant Pau (centro de referencia de Cataluña para esta enfermedad, con una población activa estimada de unos 3.500 pacientes) o que fueron tratados en el Hospital Universitario Vall d’Hebron (un hospital terciario de Cataluña), en el período comprendido entre 1996 y 2014.
Se incluyeron los casos con un diagnóstico definitivo o posible según los criterios de Duke modificados11. Se excluyeron los pacientes cuyo único defecto cardíaco congénito era una válvula aórtica bicúspide, ya que estos pacientes no requieren un seguimiento en una unidad específica de cardiopatías congénitas, y las EI que pueden sufrir presentan una complejidad comparable a la de la población general.
Para preservar el supuesto de independencia de observaciones se incluyó únicamente el primer episodio de EI de cada paciente en el análisis descriptivo.
Adquisición de datosDesde el año 1996 todos los pacientes atendidos en la Unidad Integrada de Cardiopatías Congénitas del Adolescente y del Adulto Vall d’Hebron-Sant Pau quedan registrados en una base de datos interna. Los ACC que presentaron alguna EI fueron identificados a partir de esta fuente. Además, desde el año 2000 el Hospital Vall d’Hebron mantiene una base de datos de EI en la que se recogen de forma prospectiva todos los episodios de EI en pacientes adultos que han sido tratados en el centro. Los pacientes son identificados a partir del registro diario de bacteriemias del servicio de microbiología, de los pacientes atendidos por enfermedades infecciosas, medicina interna, cardiología, neurología y por el gabinete de ecocardiografía12.
Los datos epidemiológicos, clínicos y evolutivos se obtuvieron revisando detalladamente las historias clínicas de los pacientes.
El estudio fue aprobado por el Comité Ético de Investigación Clínica del Hospital Universitario Vall d’Hebron.
Diagnóstico microbiológicoEn todos los pacientes del estudio se realizaron hemocultivos seriados conforme a la metodología vigente en el centro. En aquellos con hemocultivos negativos y evidencia de endocarditis se realizaron serologías de Bartonella spp., Brucella spp., Coxiella burnetii, Legionella spp., Mycoplasma spp. En todos los pacientes sometidos a cirugía se cultivaron los tejidos explantados. A partir de 2010 se realizó detección directa e identificación de bacterias a través de la amplificación y secuenciación del gen rRNA 16S. Una vez finalizado el tratamiento se practicaron nuevos hemocultivos al cabo de 30 días y al cabo de 90 días en todos los pacientes.
Definiciones y variables de estudioLa comorbilidad se evaluó calculando el índice de Charlson13 en el momento del inicio de los síntomas de la EI.
Se consideran cardiopatías congénitas complejas aquellas que requieren un seguimiento en centros especializados14. Se entiende por cirugías reparadoras aquellas que corrigen la alteración estructural del corazón y dejan a los pacientes con una anatomía y/o fisiología normal (por ejemplo, el procedimiento de Rastelli, la cirugía reparadora de la tetralogía de Fallot o el cierre de defectos septales), a diferencia de las paliativas, en las que no se elimina la cianosis, sino que únicamente se aumenta el flujo de sangre a la circulación pulmonar (por ejemplo la fístula de Blalock-Taussig).
Hemos considerado como cianóticos a los pacientes con cardiopatía congénita cianótica (con cortocircuito derecha-izquierda) que no estaban reparados (nativos o paliados).
Se definió la presencia de defecto residual previo como la existencia de una comunicación interventricular (CIV) residual, una insuficiencia o estenosis valvular en grado moderado o grave o una disfunción protésica moderada o grave, previamente al episodio de EI.
Se definió la EI relacionada con la atención sanitaria (tanto la nosocomial como la nosohusial) de acuerdo con publicaciones previas15. Se ha considerado como material protésico cualquier material extraño (biológico, metálico o de material sintético) implantado en los pacientes y en contacto permanente con el torrente sanguíneo (incluyendo válvulas, conductos, parches, electrodos de marcapasos, etc.).
La EI sobre válvula protésica se definió como aquella EI que afecta a una válvula o a un conducto valvulado. En los pacientes portadores de válvulas o conductos valvulados en los que no se documentó infección del material protésico ni en la ecocardiografía (identificando la infección en otra localización) ni en las muestras quirúrgicas disponibles, la EI no se clasificó como protésica. La EI relacionada con dispositivos cardíacos se definió de acuerdo con las guías de endocarditis infecciosa de la Sociedad Europea de Cardiología publicadas en 200916.
La insuficiencia cardíaca durante los episodios de EI se definió como aquella condición clínica que requirió la utilización de tratamiento diurético o el incremento del mismo.
El retraso diagnóstico se definió como los días transcurridos entre el inicio de la sintomatología hasta el inicio del tratamiento antibiótico dirigido.
Se agruparon las indicaciones quirúrgicas, en concordancia con las guías europeas de EI de 2009, en 3 grupos: 1) insuficiencia cardíaca; 2) infección no controlada; y 3) prevención de embolias16. Se consideró como fecha de la indicación quirúrgica la fecha en que aparece registrada en la historia clínica del paciente que el equipo tratante cree indicada la realización de un tratamiento quirúrgico para resolver el episodio de EI. Se consideró como cirugía durante el seguimiento aquella que se indicó más de un mes después de la finalización del tratamiento antibiótico.
La muerte no relacionada con la EI se consideró como aquella que ocurrió una vez finalizada el tratamiento antibiótico y en un paciente sin evidencia clínica ni microbiológica de EI.
Se consideró como recidiva la ocurrencia de un nuevo episodio de EI producido por el mismo microorganismo en los 12 meses siguientes a la finalización del tratamiento antibiótico, o más tiempo si se pudo comprobar por técnicas de biología molecular que el microorganismo causal era el mismo. Se consideró como reinfección cualquier nuevo episodio de EI que no cumplía la definición de recidiva16.
El tiempo de seguimiento se contabilizó a partir de la fecha de diagnóstico de la EI (entendida como la fecha de inicio del tratamiento antibiótico).
Análisis estadísticoLos datos recogidos se almacenaron en una base de datos Microsoft® Access 2013 (Microsoft, Redmond, Washington, EE. UU.) creada específicamente para este trabajo. Para el análisis estadístico se utilizó el programa estadístico SPSS Statistics 21.0 (IBM, Chigago, Illinois, EE. UU.).
Salvo que se especifique lo contrario, las variables cualitativas se expresan como número y porcentaje y las variables cuantitativas se expresan como mediana y rango intercuartílico.
ResultadosDurante el período de estudio se registraron 27 ACC que presentaron uno o más episodios de EI. El 70% cumplía criterios de EI definitiva11. El 30% restante eran EI posibles según los criterios modificados de Duke, pero en todos los casos presentaban hemocultivos positivos para microorganismos frecuentemente causantes de EI.
La tabla 1 muestra las principales características demográficas de los pacientes. Siete pacientes presentaron más de un episodio de EI (3 recidivas y 5 reinfecciones). En 3 pacientes no se conocía la cardiopatía congénita en el momento del diagnóstico de la EI, y se diagnosticó concomitantemente con la EI una CIV en un paciente y una fístula del seno de Valsalva coronario derecho al tracto de salida del ventrículo derecho en otro.
Características de los 27 pacientes adultos con endocarditis infecciosa sobre cardiopatía congénita
| Características basales | |
| N.° de pacientes, total Un episodio, n/total Dos episodios, n/total Tres episodios, n/total | 27 20/27 6/27 1/27 |
| Edad en años al diagnóstico de la EI, mediana (RIC) | 27,7 (21,9-42,9) |
| Género masculino | 63% |
| Usuarios de drogas por vía parenteral | 0 (0%) |
| Índice de Charlson al diagnóstico de la EI, mediana (RIC) | 0 (0-1) |
| Cardiopatía no conocida antes del diagnóstico de la EI | 3 (11%) |
| Endocarditis infecciosa previa (≤16 años) | 1 (4%) |
| Tiempo de seguimiento desde la EI, en años, mediana (RIC) | 4,5 (2-9,5) |
La tabla 2 muestra las principales características cardiológicas de los pacientes en el momento del diagnóstico de la EI. La CIV fue la cardiopatía subyacente más frecuente en esta serie (33%). El 67% de los pacientes estaban intervenidos previamente al episodio de EI, ya reparados (48%) o paliados (19%).
Características de las cardiopatías congénitas en los 27 pacientes con endocarditis infecciosa
| Característica | N (%) |
|---|---|
| Cardiopatía principal | |
| Comunicación interventricular | 9 (33) |
| Ventrículo funcionalmente único | 4 (15) |
| Transposición compleja de grandes arterias | 3 (11) |
| Estenosis aórtica subvalvular | 3 (11) |
| Coartación aórticaa | 2 (7) |
| Tetralogía de Fallot | 2 (7) |
| Atresia pulmonar con comunicación interventricular | 1 (4) |
| Canal auriculoventricular común | 1 (4) |
| Doble salida del ventrículo derecho | 1 (4) |
| Fístula del seno de Valsalva coronario derecho al tracto de salida del ventrículo derecho | 1 (4) |
| Cardiopatía congénita compleja | 13 (48) |
| Estado de la cardiopatía | |
| Reparada | 13 (48) |
| Sin lesión residual | 3/13 (23) |
| Con lesión residual | 10/13 (77) |
| Paliada | 5 (19) |
| Con material protésico | 1/5 (20) |
| Sin material protésico | 4/5 (80) |
| No intervenida | 9 (33) |
| Cianóticosb | 6 (22) |
| Material protésico | 11 (41) |
| Válvula protésica | 6 (22) |
| Metálica | 4/6 (67) |
| Biológica | 1/6 (17) |
| Dispositivo Melody® | 1/6 (17) |
| Parchesc | 6 (22) |
| Pericardio heterólogo | 3/6 (50) |
| Pericardio autógeno | 1/6 (17) |
| Dacron® | 3/6 (50) |
| Conductosd | 5 (19) |
| Cortocircuitos izquierda-derechae | 3/5 (60) |
| Conductos derechosf | 4/5 (80) |
| Marcapasos | 2 (7) |
| N.° de intervenciones previas a la EI, mediana (rango) | 2 (1-6) |
| Defecto residual previog | 22 (81) |
| Comunicación interventricular | 13 (48) |
| Estenosis pulmonar | 9 (33) |
| Insuficiencia mitral | 5 (19) |
| Insuficiencia aórtica | 5 (19) |
| Estenosis aórtica | 4 (16) |
| Insuficiencia pulmonar | 2 (7) |
La tabla 3 recoge las características clínicas de la EI. Hubo 6 EI relacionadas con la atención sanitaria; 3 nosocomiales (en relación con el ingreso hospitalario en 2 casos y tras cirugía cardíaca en otro) y 3 nosohusiales (una EI sobre el electrodo de marcapasos y 2 EI tras la realización de un cateterismo cardíaco). En 6 pacientes no se pudo determinar la localización de la infección, ya que en 3 casos no se visualizó vegetación ni otros signos de EI en el ecocardiograma, y en 3 casos no se pudo recuperar esta información (el ecocardiograma previo al inicio de tratamiento se realizó en otro centro). En 6 pacientes no se visualizó ninguna vegetación ni otros signos de EI en la ecocardiografía (22%). Dos pacientes presentaron una EI relacionada con dispositivos intracardíacos (marcapasos), uno de ellos 5 semanas después del recambio del generador y otro 3 años y medio después.
Características clínicas de los 27 episodios de endocarditis infecciosa
| Variable | N (%) |
|---|---|
| Adquisición de la infección | |
| Comunitaria | 21 (78) |
| Relacionada con la atención sanitaria | 6 (22) |
| Nosohusial | 3/6 (50) |
| Nosocomial | 3/6 (50) |
| Localización de la infección | |
| Cavidades derechas | 12 (44) |
| Cavidades izquierdas | 9 (33) |
| Desconocida | 6 (22) |
| EI sobre válvula protésica | 7 (26) |
| Precoz (≤un año) | 2 (7) |
| Tardía (>un año) | 5 (19) |
| Tiempo desde la cirugía valvular en años, mediana (RIC) | 3,7 (0,9-9,7) |
| EI relacionada con marcapasos | 2 (7) |
| Clínica | |
| Fiebre (temperatura ≥38°C) | 27 (100) |
| Insuficiencia cardíaca | 4 (15) |
| Embolias | 8 (30) |
| Cutáneas | 1/8 (12) |
| Renales | 2/8 (25) |
| Pulmonares | 3/8 (38) |
| Sistema nervioso central | 2/8 (25) |
| Shock séptico | 0 (0) |
| Fracaso renal agudo | 0 (0) |
| Alteraciones de la conducción | 0 (0) |
| Retraso diagnóstico en días, mediana (RIC) | 21 (7-33) |
| Complicaciones cardíacasa | 3 (11) |
| Pseudoaneurismas paravalvulares | 2/3 (66) |
| Absceso paravalvular | 2/3 (66) |
| Perforación valvular | 1/3 (66) |
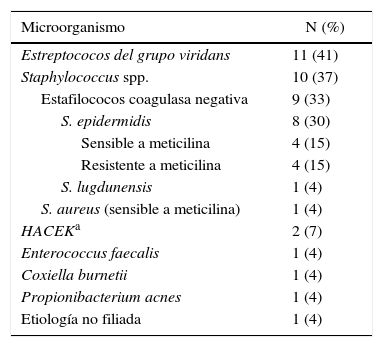
En la tabla 4 se describe la etiología. Ocho EI fueron causadas por S. epidermidis, 7 de ellas en cavidades derechas. En 3 pacientes se relacionó con la atención sanitaria. Tres casos fueron EI protésicas y 2 casos fueron EI relacionadas con dispositivos intracardíacos. Tres pacientes requirieron tratamiento quirúrgico.
Etiología de los 27 episodios de endocarditis infecciosa
| Microorganismo | N (%) |
|---|---|
| Estreptococos del grupo viridans | 11 (41) |
| Staphylococcus spp. | 10 (37) |
| Estafilococos coagulasa negativa | 9 (33) |
| S. epidermidis | 8 (30) |
| Sensible a meticilina | 4 (15) |
| Resistente a meticilina | 4 (15) |
| S. lugdunensis | 1 (4) |
| S. aureus (sensible a meticilina) | 1 (4) |
| HACEKa | 2 (7) |
| Enterococcus faecalis | 1 (4) |
| Coxiella burnetii | 1 (4) |
| Propionibacterium acnes | 1 (4) |
| Etiología no filiada | 1 (4) |
Hubo 2 episodios de EI por bacilos gramnegativos (BGN). Un paciente con doble salida del ventrículo derecho reparado presentó una EI por Haemophilus parainfluenzae sin vegetación visible, que recidivó tras tratamiento antibiótico; dado que presentaba un xenoinjerto tipo Contegra® (Medtronic, Dublín, Irlanda) con estenosis severa se asumió que este era el foco de la infección y fue intervenido, observándose durante la cirugía signos macroscópicos de infección. En otro paciente no pudo identificarse con precisión (los hemocultivos se realizaron en otro centro y el cultivo de la válvula fue negativo) y se tipificó como un probable BGN del grupo HACEK.
Destaca una EI protésica (casi 4 años tras el recambio valvular) por Propionibacterium acnes, complicada con un absceso periprotésico aórtico, bacteriemia mantenida e insuficiencia cardíaca. A pesar de ello, dado que la reparación era de alta complejidad y dada la poca agresividad del microorganismo, se optó por realizar tratamiento antibiótico (ceftriaxona 2g al día por vía intravenosa) durante 4 meses, con buena evolución y sin evidencia de recidiva a los 9 meses de finalizar el tratamiento. Hubo una EI sobre válvula aórtica por Coxiella burnetii, diagnosticada mediante serología (IgG frente a antígeno de fase i, 1/20480 e IgG frente a antígeno de fase ii 1/5120) y tratada con doxiciclina 100mg cada 12h y rifampicina 300mg cada 12h (paciente con síndrome de QT largo), y mediante sustitución valvular aórtica tras 5 meses de tratamiento antibiótico. La paciente continúa en tratamiento antibiótico en el momento de finalizar el estudio.
En uno de los pacientes no se pudo identificar el microorganismo causante, ya que recibió tratamiento antibiótico en otro centro antes de extraer los hemocultivos.
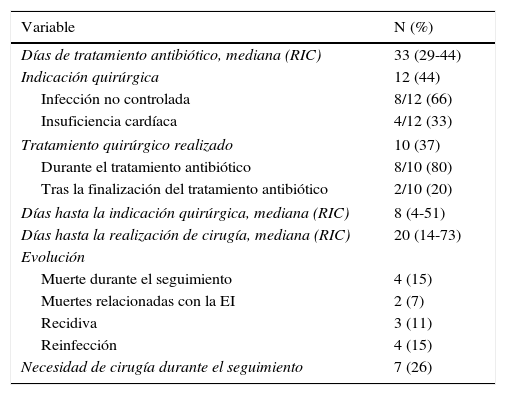
En la tabla 5 se resumen el tratamiento y la evolución de los pacientes. La indicación quirúrgica más frecuente en nuestra serie fue la infección no controlada. Se intervinieron por este motivo 3 pacientes con EI por S. epidermidis que presentaban infección de dispositivos (el electrodo de marcapasos en 2 pacientes y una prótesis Melody® (Medtronic, Dublín, Irlanda) en otro paciente, 2 pacientes con estreptococos del grupo viridans y un paciente con EI por Coxiella burnetii. Excepto en el caso de la infección de la prótesis Melody®, que se sustituyó por un homoinjerto un mes después de finalizar el tratamiento antibiótico, los otros 5 pacientes fueron intervenidos durante la fase activa de la EI. Los 4 pacientes que requirieron cirugía por insuficiencia cardíaca presentaban infección por estreptococos del grupo viridans en 2 casos, por S. lugdunensis en otro caso y por BGN (probable HACEK) en otro. Ningún paciente requirió cirugía para prevención de embolias.
Tratamiento y evolución de la endocarditis aguda en los 27 pacientes adultos con cardiopatía congénita
| Variable | N (%) |
|---|---|
| Días de tratamiento antibiótico, mediana (RIC) | 33 (29-44) |
| Indicación quirúrgica | 12 (44) |
| Infección no controlada | 8/12 (66) |
| Insuficiencia cardíaca | 4/12 (33) |
| Tratamiento quirúrgico realizado | 10 (37) |
| Durante el tratamiento antibiótico | 8/10 (80) |
| Tras la finalización del tratamiento antibiótico | 2/10 (20) |
| Días hasta la indicación quirúrgica, mediana (RIC) | 8 (4-51) |
| Días hasta la realización de cirugía, mediana (RIC) | 20 (14-73) |
| Evolución | |
| Muerte durante el seguimiento | 4 (15) |
| Muertes relacionadas con la EI | 2 (7) |
| Recidiva | 3 (11) |
| Reinfección | 4 (15) |
| Necesidad de cirugía durante el seguimiento | 7 (26) |
Dos pacientes fallecieron a consecuencia de la EI. Ambos presentaron una recidiva de la EI sobre materiales protésicos localizados en cavidades derechas, el microorganismo responsable fue S. epidermidis resistente a meticilina, y la causa de la muerte fue una complicación quirúrgica durante la sustitución de los materiales protésicos infectados (encefalopatía anóxica en un paciente y rotura aórtica en el otro). Dos pacientes fallecieron por causas no relacionadas con el episodio de EI, uno de ellos por una neumonía comunitaria casi 5 años después y otro por una muerte súbita 15 años después de la EI. Siete pacientes requirieron cirugía durante el seguimiento, en 3 casos por recidiva de la EI, en 2 casos para realizar una paliación de su cardiopatía subyacente, en un caso para realizar una corrección de la cardiopatía subyacente, y en un caso para corregir una insuficiencia tricuspídea secuela de la EI.
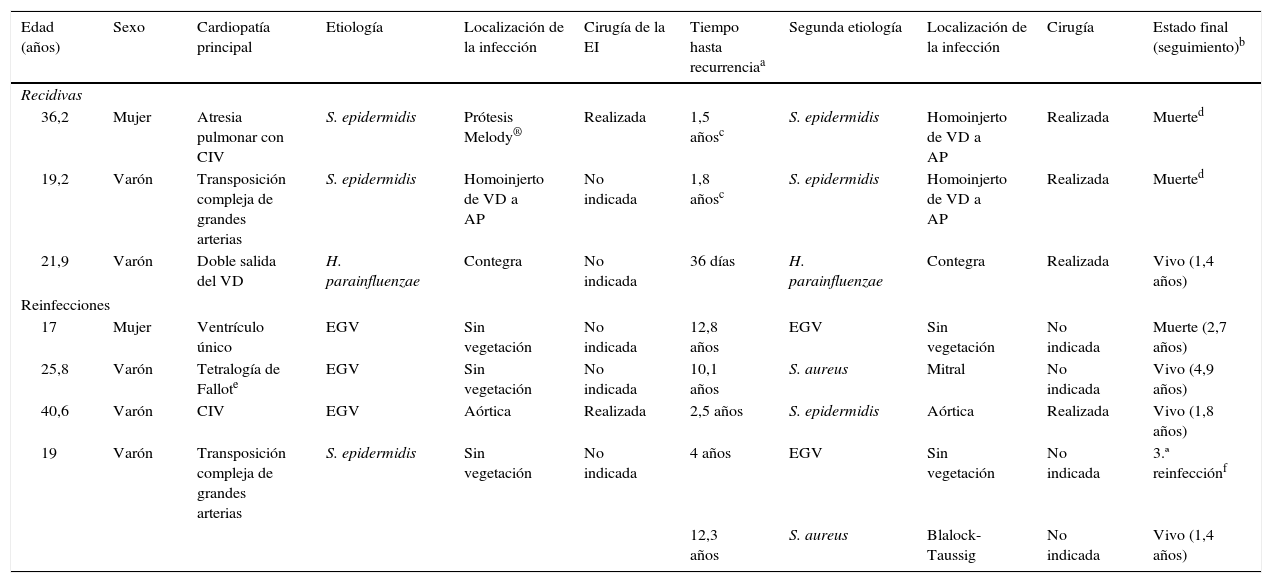
La tabla 6 resume las principales características clínicas y evolutivas de los 7 pacientes con recurrencias.
Descripción resumen de los siete pacientes con recidiva o reinfección
| Edad (años) | Sexo | Cardiopatía principal | Etiología | Localización de la infección | Cirugía de la EI | Tiempo hasta recurrenciaa | Segunda etiología | Localización de la infección | Cirugía | Estado final (seguimiento)b |
|---|---|---|---|---|---|---|---|---|---|---|
| Recidivas | ||||||||||
| 36,2 | Mujer | Atresia pulmonar con CIV | S. epidermidis | Prótesis Melody® | Realizada | 1,5 añosc | S. epidermidis | Homoinjerto de VD a AP | Realizada | Muerted |
| 19,2 | Varón | Transposición compleja de grandes arterias | S. epidermidis | Homoinjerto de VD a AP | No indicada | 1,8 añosc | S. epidermidis | Homoinjerto de VD a AP | Realizada | Muerted |
| 21,9 | Varón | Doble salida del VD | H. parainfluenzae | Contegra | No indicada | 36 días | H. parainfluenzae | Contegra | Realizada | Vivo (1,4 años) |
| Reinfecciones | ||||||||||
| 17 | Mujer | Ventrículo único | EGV | Sin vegetación | No indicada | 12,8 años | EGV | Sin vegetación | No indicada | Muerte (2,7 años) |
| 25,8 | Varón | Tetralogía de Fallote | EGV | Sin vegetación | No indicada | 10,1 años | S. aureus | Mitral | No indicada | Vivo (4,9 años) |
| 40,6 | Varón | CIV | EGV | Aórtica | Realizada | 2,5 años | S. epidermidis | Aórtica | Realizada | Vivo (1,8 años) |
| 19 | Varón | Transposición compleja de grandes arterias | S. epidermidis | Sin vegetación | No indicada | 4 años | EGV | Sin vegetación | No indicada | 3.ª reinfecciónf |
| 12,3 años | S. aureus | Blalock-Taussig | No indicada | Vivo (1,4 años) | ||||||
AP: arteria pulmonar; CIV: comunicación interventricular; EGV: estreptococo del grupo viridans; VD: ventrículo derecho.
En esta serie de EI en ACC los pacientes fueron jóvenes y con poca comorbilidad, y presentaron mayoritariamente EI de adquisición comunitaria, con una baja morbimortalidad, salvo en las recidivas.
Esta serie de EI en ACC incluye población adulta española de forma exclusiva, a diferencia de otras series recientes de nuestro entorno7, que incluyen también población pediátrica. La EI en ACC ocurre en pacientes más jóvenes que la EI en población general17. A pesar de su cardiopatía los pacientes presentan poca comorbilidad debido precisamente a su juventud. Aunque las características de nuestro trabajo impiden conocer datos de incidencia, la serie prospectiva más reciente estima una tasa de incidencia de EI en ACC de 1,1 casos por 1.000 pacientes-año, con la máxima tasa de incidencia en pacientes con atresia pulmonar y CIV (5,8 casos por 1.000 pacientes-año)10. En nuestra serie el defecto más frecuente fue la CIV, que es el tercer defecto congénito más frecuente en adultos18. Algunos trabajos han estimado que entre los pacientes con EI del 2% al 18% pueden presentar alguna cardiopatía congénita19–21. En consonancia con este dato 3 pacientes (11%) de nuestra serie desconocían su cardiopatía congénita.
Resulta llamativo que la demora diagnóstica mediana fue de 21 días y superior a los 33 días en una cuarta parte, principalmente debido a que los pacientes no consultaron de forma precoz, a pesar de que los ACC saben que deben solicitar atención médica ante la presencia de fiebre. Este dato resalta la necesidad de continuar realizando educación sanitaria en la población de ACC para que conozcan las medidas generales de prevención de la endocarditis infecciosa1 y sean conscientes de la necesidad de consultar rápidamente ante cuadros de fiebre.
La proporción de EI relacionada con la atención sanitaria fue baja en esta serie, teniendo en cuenta la complejidad de estos pacientes, su frecuente necesidad de atención sanitaria y que en un 30% de los casos la etiología fue S. epidermidis. Este hallazgo probablemente responde a una limitación de la definición utilizada para la EI relacionada con la atención sanitaria16, que no contempla las EI protésicas precoces. A diferencia de otras series no se pudo documentar un origen de la bacteriemia en los 2 meses previos más que en 4 casos, si bien probablemente esto responda a una limitación en la recogida de datos.
En contraste con lo que ocurre en la población general, donde solo un 5-10% de las EI ocurren en las cavidades derechas del corazón, casi la mitad de los pacientes presentaron una EI de localización derecha. Este hallazgo coincide con otras series similares6 y se debe a que los ACC presentan frecuentemente lesión estructural en la válvula tricúspide o pulmonar, o si están reparados presentan material protésico en el tracto de salida del ventrículo derecho y/o defectos residuales a dicho nivel. En este sentido hay varios trabajos recientes sobre el riesgo de infección de determinados dispositivos protésicos utilizados en el tracto de salida del ventrículo derecho22–25, especialmente los xenoinjertos Contegra® y las prótesis percutáneas Melody®. De los 2 pacientes que fallecieron en nuestra serie uno presentaba infección sobre un xenoinjerto Contegra® y el otro sobre una prótesis Melody®.
El espectro etiológico de esta serie difiere del de la población general por el bajo número de casos producidos por S. aureus, el microorganismo más frecuente en las series actuales de EI12, y porque S. epidermidis fue el segundo microorganismo en frecuencia después de los estreptococos del grupo viridans. Nuestro espectro etiológico difiere también de la serie de Li9 y de la cohorte japonesa26, donde también predominan los estreptococos del grupo viridans, pero la proporción de S. aureus es más elevada y la de estafilococos coagulasa negativa muy inferior a la de nuestra serie. También encontramos diferencias con la serie de Fortún7, que encuentra un 16% de EI por S. aureus y un 16% por estafilococos coagulasa negativa.
En un estudio se objetivó un aumento del riesgo relativo de desarrollar EI en los niños con cardiopatía congénita que portaban material protésico con respecto a los que no lo portaban (odds ratio 21), sin objetivar ninguna EI en 1.669 niños con cardiopatía congénita corregida sin material protésico27. Sin embargo, en nuestra serie 7 pacientes sin material protésico presentaron EI. De estos 6 tenían algún defecto residual y solamente uno presentaba una CIV reparada sin lesión residual. Por tanto, aunque los pacientes portadores de material protésico tienen más riesgo de desarrollar EI, el otro factor crucial es la presencia de lesiones residuales, ya que la presencia de flujos turbulentos provoca un daño endocárdico que facilita la instauración de una endocarditis28,29. Así, en nuestra serie el 81% de los pacientes tenía una o más lesiones cardíacas previas al diagnóstico de la EI. Únicamente 3 pacientes de nuestra serie presentaron EI sin ser portadores de material protésico ni presentar defecto residual.
En el 22% de los pacientes no se pudieron identificar signos ecocardiográficos de EI. Los ACC suponen un reto para el ecocardiografista, ya que presentan una anatomía cardíaca compleja o son portadores de conductos y/o materiales protésicos, por lo que las vegetaciones pueden ser muy difíciles de visualizar. En algunos casos de nuestra serie la tomografía por emisión de positrones ha demostrado ser una técnica útil, sobre todo en las complicaciones periprotésicas30 (permitió por ejemplo el diagnóstico de un absceso periprotésico en 2 pacientes portadores de válvula protésica) y en pacientes con material protésico en posición pulmonar, en los que la ecocardiografía tiene baja resolución.
La necesidad de tratamiento quirúrgico en nuestra serie (44%) está en consonancia con lo descrito en las últimas series de EI en población general12. En nuestra serie hubo 2 pacientes que a pesar de tener indicación quirúrgica (una EI por Propionibacterium acnes y otra por S. epidermidis complicada con un absceso periprotésico) no se intervinieron debido a que la cirugía presentaba elevada complejidad técnica y alto riesgo, ya que se trataba de pacientes con 3 intervenciones previas. En ambos casos los pacientes se curaron con el tratamiento médico y están libres de recurrencia tras 18 y 13 meses de seguimiento respectivamente.
La mortalidad en nuestra serie fue baja (7%), acorde con otras series6,9,16, y mucho menor que la que ocurre en población general12,16. Sin embargo, en nuestra serie las recidivas, las recurrencias y la necesidad de cirugía durante el seguimiento fueron mayores que en la población general12. Los 2 casos fatales de nuestra serie ocurrieron a consecuencia de recidivas de EI con necesidad de tratamiento quirúrgico en pacientes de elevada complejidad técnica; la cirugía que condicionó la muerte era la quinta intervención cardíaca en uno de los pacientes y la sexta en el otro. Así, la recidiva fue un factor de mal pronóstico en nuestra serie, ya que 2 de los 3 pacientes que presentaron una recidiva fallecieron.
LimitacionesNuestro estudio presenta 2 limitaciones principales. La más importante es su carácter retrospectivo, lo que ha limitado la recopilación de datos y ha impedido generar información relativa a incidencia y factores de riesgo. Para paliar al máximo esta limitación metodológica la recogida de datos se realizó de forma prospectiva a partir de bases de datos que el centro mantiene desde hace años, y a través de múltiples sistemas, lo que minimizó la pérdida de información. La otra limitación del estudio es que ha sido realizado en uno de los centros de referencia de cardiopatía congénita de Cataluña e Islas Baleares, por lo que la epidemiología no se corresponderá necesariamente con la de otras áreas geográficas o centros, si bien probablemente la información sea útil y comparable a la de otros centros de referencia de nuestro entorno.
ConclusionesEn conclusión, podemos decir que la EI en ACC ocurre en pacientes relativamente jóvenes y con poca comorbilidad, aunque casi todos tienen algún defecto cardiológico residual que favorece la instauración de la endocarditis, y que a pesar de que muchos casos requieren tratamiento quirúrgico la mortalidad es baja y ocurre fundamentalmente en las recidivas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.