El objetivo primario fue determinar si la traqueobronquitis asociada a ventilación mecánica (TAV) está asociada con un aumento de estancia en UCI. Los objetivos secundarios incluyeron prolongación de estancia hospitalaria, así como mortalidad en UCI y hospitalaria.
DiseñoEstudio retrospectivo caso-control. Apareamos cada caso con un control en base a los siguientes criterios: periodo de VM al menos tan extenso, como el tiempo en que el caso desarrolla la TAV ± 2 días, gravedad evaluada por la escala APACHE II al ingreso en UCI, igual ± 3, igual motivo de ingreso del paciente, igual edad ± 10 años.
PacientesPacientes adultos ingresados en una UCI polivalente de 30 camas, con el diagnóstico de TAV en el periodo 2013-2016.
ResultadosIdentificamos 76 pacientes con TAV que ingresaron en UCI en el periodo de estudio. No se encontraron controles adecuados para 3 pacientes con TAV. No se encontraron diferencias significativas entre ambos grupos en cuanto a características demográficas, motivo de ingreso y comorbilidades. La estancia media en UCI de los pacientes con traqueobronquitis asociada a ventilación mecánica fue más prolongada en los casos que en los controles, mediana 22d (14-35), comparada con los controles mediana 15d (8-27), p=0,02. Los casos presentaron mayor número de días de VM respecto a los controles, mediana 18 días (9-28) vs. 9 días (5-16) p = 0,03. No encontramos diferencias significativas respecto a la estancia hospitalaria 40d (28-61) vs. 35d (23-54), p= 0,32; mortalidad en UCI (20,5 vs. 31,5% p=0,13) y mortalidad hospitalaria (30,1 vs. 43,8% p= 0,09). Realizamos un análisis del subgrupo de pacientes con TAV con documentación microbiológica y tratamiento empírico adecuado sin encontrar diferencias significativas en ninguno de los aspectos analizados.
ConclusionesLa TAV, prolonga los días de estancia en UCI y de ventilación mecánica. Este efecto desaparece cuando los pacientes reciben tratamiento empírico adecuado.
The main objective was to determine whether ventilator-associated tracheobronchitis (VAT) is related to increased length of ICU stay. Secondary endpoints included prolongation of hospital stay, as well as, ICU and hospital mortality.
DesignA retrospective matched case-control study. Each case was matched with a control for duration of ventilation (± 2 days until development of ventilator-associated tracheobronchitis), disease severity (Acute Physiology and Chronic Health Evaluation II) at admission ± 3, diagnostic category and age ±10 years.
PatientsCritically ill adults admitted to a polyvalent 30-beds ICU with the diagnosis of VAT in the period 2013-2016.
Main resultsWe identified 76 cases of VAT admitted to our ICU during the study period. No adequate controls were found for 3 patients with VAT. There were no significant differences in demographic characteristics, reasons for admission and comorbidities. Patients with VAT had a longer ICU length of stay, median 22 days (14-35), compared to controls, median 15 days (8-27), p=.02. Ventilator days were also significantly increased in VAT patients, median 18 (9-28) versus 9 days (5-16), p=.03. There was no significant difference in total hospital length of stay 40 (28-61) vs. 35days (23-54), p=.32; ICU mortality (20.5 vs. 31.5% p=.13) and hospital mortality (30.1 vs. 43.8% p=.09). We performed a subanalysis of patients with microbiologically proven VAT receiving adequate antimicrobial treatment and did not observe significant differences between cases and the corresponding controls.
ConclusionsVAT is associated with increased length of intensive care unit stay and longer duration of mechanical ventilation. This effect disappears when patients receive appropriate empirical treatment.
La ventilación mecánica (VM) está asociada con infecciones del tracto respiratorio inferior que son causa de importante morbimortalidad en el paciente crítico1. Durante los últimos años, la traqueobronquitis asociada a ventilación mecánica (TAV) ha despertado el interés de clínicos e investigadores al tratarse de una entidad relativamente frecuente afectando a uno de cada diez pacientes con VM2.
Sin embargo, aunque la neumonía asociada a ventilación (NAV) es una infección nosocomial que ha sido objeto de múltiples estudios que han analizado su impacto en la morbilidad y la mortalidad3 de los pacientes críticos (mortalidad atribuible del 13% según un metaanálisis), existen pocos estudios y con resultados controvertidos en relación con el impacto de la TAV en el pronóstico de este tipo de pacientes4–6. Dos de estos estudios fueron realizados en pacientes adultos5,6 y el otro en población pediátrica4, teniendo en cuenta solo uno de ellos el impacto del tratamiento antibiótico adecuado6. Los dos estudios realizados en adultos uno con diseño de casos y controles y otro un estudio prospectivo de cohorte, mostraron un incremento en la estancia en UCI y ventilación mecánica de los pacientes que desarrollaban una TAV, sin mostrar diferencias significativas entre los pacientes que recibían tratamiento adecuado en el estudio analizado6. Ninguno de estos dos estudios halló un incremento de mortalidad atribuible a la TAV. Sin embargo en el estudio llevado a cabo en la población pediátrica no fueron capaces de mostrar que los pacientes que desarrollaban TAV presentaban diferencias significativas en cuanto a mortalidad y estancia media, pero sí demostraron un incremento en la duración de la ventilación mecánica4. Una mejora en la compresión de la TAV puede ayudarnos a la prevención, diagnóstico precoz y a un adecuado tratamiento, aunque existen controversias respecto a la necesidad de este último, no existiendo una recomendación uniforme en todas las guías de práctica clínica7,8.
La mortalidad cruda de la TAV o la estancia hospitalaria que genera pueden verse influenciada por diversos factores tales como las enfermedades previas o la gravedad subyacente. Por ello, es necesario emplear una aproximación metodológica que nos permita discernir el efecto sobre la mortalidad y la estancia que tiene en sí la TAV. Un mejor conocimiento del impacto sobre el pronóstico de esta infección nos permitirá definir los objetivos óptimos y el cálculo del tamaño muestral a la hora de diseñar estudios sobre la prevención o tratamiento de la TAV9.
Por todo ello, nos planteamos realizar este estudio con el objetivo primario de determinar si la TAV origina un aumento de estancia en UCI atribuible a dicha infección. Los objetivos secundarios incluyeron conocer si la TAV prolonga los días de VM, la estancia hospitalaria, así como si existe mortalidad atribuible a esta infección.
Material y métodosDiseño: el estudio se llevó a cabo en una UCI de adultos polivalente de 30 camas sin ingresos coronarios, de un hospital universitario. Realizamos un estudio retrospectivo casos – controles (un caso - un control), para ello utilizamos una base de datos donde se introducen todos los pacientes que ingresan en nuestra unidad de forma prospectiva. Por ello todas las variables analizadas en este estudio han sido recogidas prospectivamente. El estudio cuenta con dictamen favorable del Comité Ético de Investigación Clínica del Hospital Universitario Virgen Macarena que le eximió de la obtención de consentimiento informado (Código 1132-N-17).
Todos los pacientes diagnosticados de TAV desde enero de 2013 a diciembre de 2016 fueron potencialmente elegibles. El diagnóstico fue realizado por el clínico que se ocupaba de forma habitual del paciente. Dos clínicos independientes (MLCB y AAS) revisan todos los casos de infección nosocomial antes de la introducción de los mismos en la base de datos ENVIN-HELICS, introducidos según las definiciones descritas en el manual del usuario10.
Todos los casos fueron apareados por un único investigador ciego a los resultados (MLCB), con otro paciente de UCI sin diagnóstico de TAV y con las siguientes características:
- •
Periodo de ventilación mecánica al menos tan extenso ± 2 días, como el tiempo en que el caso desarrolla la TAV.
- •
Gravedad del paciente al ingreso en UCI, evaluada por la escala APACHE II igual ± 3 puntos.
- •
Igual motivo de ingreso del paciente, diferenciados en pacientes médicos, quirúrgicos programados o quirúrgicos urgentes.
- •
Igual edad de los pacientes con un rango de variabilidad ± 10 años.
Para el cálculo de la escala APACHE II que se realiza en todos los pacientes que ingresan en la unidad, se toma en consideración el peor valor de cada una de las variables analizadas en las primeras 24 h de ingreso.
Las comorbilidades analizadas fueron las recogidas en la base de datos ENVIN-HELICS.
Los pacientes que desarrollaron neumonía nosocomial en UCI, asociada o no a VM, previa o posteriormente a la TAV fueron excluidos como casos. E igualmente de los controles se excluyeron pacientes con neumonía de las mismas características6.
Para la elección de los controles se evaluaron inicialmente los pacientes introducidos en la base de datos en el periodo de selección de los casos. En caso de que no se encontraran controles en el periodo de estudio, se buscaron entre los pacientes incluidos en la base de datos durante el periodo 2009-2012.
DefinicionesCaso: TAV fue definida como aquel paciente con aumento de secreciones purulentas y al menos dos de los siguientes criterios a) Tª > 38,5°C o < 36,5°C no atribuible a otra causa, b) recuento de leucocitos > 12.000 o < 4.000 por mm3 y c) ausencia de un nuevo infiltrado en la RX de tórax. Todos los pacientes estuvieron expuestos al factor de riesgo (VM) durante un mínimo de 48 h11. En todos los pacientes se obtuvo al menos una muestra de broncoaspirado.
Caso confirmado microbiológicamente: aquel que presentaba además un broncoaspirado cuantitativo con 106 cfu/ml6.
Tratamiento antibiótico adecuado: aquel activo in vitro contra el microorganismo aislado y administrado dentro de las primeras 24 h del diagnóstico de TAV. Siempre se empleó la antibioterapia por vía intravenosa, no recibiendo ningún paciente tratamiento nebulizado12.
Este análisis está escrito siguiendo las recomendaciones de la guía STROBE13.
Análisis estadístico: el análisis estadístico descriptivo fue realizado utilizando el programa SPSS versión 22. Las variables continuas son expresadas como medianas (percentil 25-75) y las variables categóricas como porcentajes. La significación estadística se determinó usando el test de t de Student y U de Mann - Withney para comparar variables continuas y el de chi–cuadrado o test exacto de Fisher cuando fue necesario para las variables categóricas. La significación estadística se estableció en p <0,05, y los resultados se expresan con sus intervalos de confianza del 95%.
ResultadosDurante el periodo de estudio ingresaron 5.329 pacientes en UCI, de los cuales el 67,29% (n= 3586) recibieron VM, con una mediana de 2 días (1-5). Se identificaron 76 episodios de TAV, lo cual supone una densidad de incidencia de 5,79 TAV por 1.000 días de VM. Se incluyeron 73 casos en el estudio, al no encontrarse controles compatibles en tres de los episodios. De estos, 67 (91,8%), fueron apareados con controles del periodo en que se llevó a cabo el estudio, mientras que los otros 6 controles fueron apareados con casos procedentes de la misma base de datos pero introducidos previamente al estudio (2009-2012). La mayoría de los pacientes fueron posquirúrgicos.
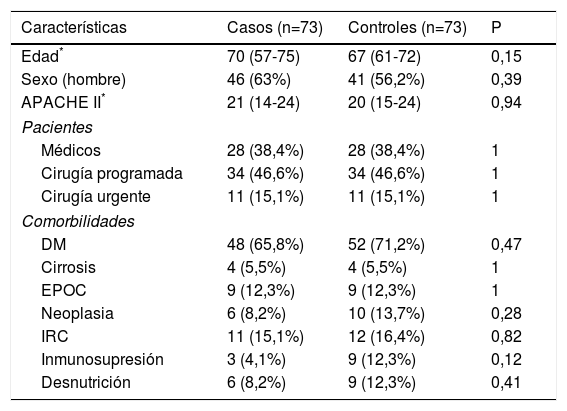
Los datos demográficos de los pacientes casos y controles se muestran en la tabla 1. No se encontraron diferencias significativas entre ambos grupos en cuanto a características demográficas, motivo de ingreso y comorbilidades. Todos los casos recibieron tratamiento antibiótico. La mediana de días de uso de ATB fue 7 días (5-8).
Características demográficas y comorbilidades de pacientes con TAV y sus respectivos controles
| Características | Casos (n=73) | Controles (n=73) | P |
|---|---|---|---|
| Edad* | 70 (57-75) | 67 (61-72) | 0,15 |
| Sexo (hombre) | 46 (63%) | 41 (56,2%) | 0,39 |
| APACHE II* | 21 (14-24) | 20 (15-24) | 0,94 |
| Pacientes | |||
| Médicos | 28 (38,4%) | 28 (38,4%) | 1 |
| Cirugía programada | 34 (46,6%) | 34 (46,6%) | 1 |
| Cirugía urgente | 11 (15,1%) | 11 (15,1%) | 1 |
| Comorbilidades | |||
| DM | 48 (65,8%) | 52 (71,2%) | 0,47 |
| Cirrosis | 4 (5,5%) | 4 (5,5%) | 1 |
| EPOC | 9 (12,3%) | 9 (12,3%) | 1 |
| Neoplasia | 6 (8,2%) | 10 (13,7%) | 0,28 |
| IRC | 11 (15,1%) | 12 (16,4%) | 0,82 |
| Inmunosupresión | 3 (4,1%) | 9 (12,3%) | 0,12 |
| Desnutrición | 6 (8,2%) | 9 (12,3%) | 0,41 |
DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; IRC: insuficiencia renal crónica.
El intervalo entre el ingreso en UCI y desarrollo de TAV fue una mediana de 5 días (3-9).
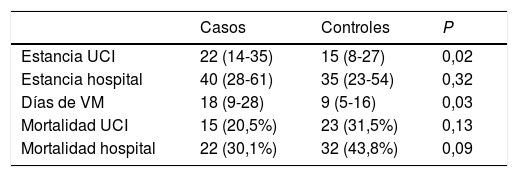
De los 73 casos, 15 fallecieron en la UCI, lo que corresponde a una mortalidad cruda del 20,5% (IC 95% 11-30), mientras que en el caso de los controles fueron 23 los fallecidos, mortalidad cruda del 31,5% (IC 95% 21-42) (p= 0,13). La mortalidad cruda hospitalaria fue de 30,1% (IC 95% 19-41) en los casos y 43,8% (IC95% 32-55) en los controles (p= 0,09). La estancia media en UCI entre los supervivientes fue más prolongada en los casos que en los controles, sin encontrarse diferencias significativas en la estancia hospitalaria (tabla 2). Los casos presentaron mayor número de días de VM respecto a los controles, mediana 18 días (9-28) vs. 9 días (5-16) p = 0,03.
Estancia media, mortalidad cruda y días de VM de pacientes con TAV y sus respectivos controles
| Casos | Controles | P | |
|---|---|---|---|
| Estancia UCI | 22 (14-35) | 15 (8-27) | 0,02 |
| Estancia hospital | 40 (28-61) | 35 (23-54) | 0,32 |
| Días de VM | 18 (9-28) | 9 (5-16) | 0,03 |
| Mortalidad UCI | 15 (20,5%) | 23 (31,5%) | 0,13 |
| Mortalidad hospital | 22 (30,1%) | 32 (43,8%) | 0,09 |
UCI: Unidad de Cuidados Intensivos; VM: ventilación mecánica.
Se obtuvo confirmación microbiológica en 53 de los episodios de TAV. Todas las TAV fueron monomicrobianas, siendo los gérmenes más frecuentemente aislados Pseudomonas aeruginosa –P. aeruginosa– (24,5%) y Haemophilus influenzae (18,9%) como se muestra en la tabla 3. Ninguna de ellas se asoció con bacteriemia y el tratamiento antibiótico fue adecuado en el 69,8% de los episodios.
Gérmenes más frecuentes en TAV
| n (%) | n(%) | ||
|---|---|---|---|
| Pseudomona aeruginosa | 13 (24,5) | Enterobacter cloacae | 2 (3,8) |
| Haemophilus influenzae | 10 (18,9) | Streptococcus pneumoniae | 2 (3,8) |
| Escherichia coli | 5 (9,4) | Moraxella catarrhalis | 2 (3,8) |
| Klebsiella pneumoniae | 4 (7,5) | Morganella morganii | 1 (1,9) |
| Staphylococcus aureus | 4 (7,5) | SAMR | 1 (1,9) |
| Serratia marcescens | 2 (3,8) | Acinetobacter baumannii | 1 (1,9) |
| Citrobacter freundii | 2 (3,8) | Proteus mirabilis | 1 (1,9) |
| Corynebacterium | 2 (3,8) | Stenotrophomonas maltophilia | 1 (1,9) |
SAMR: Staphylococcus aureus meticilín resistente.
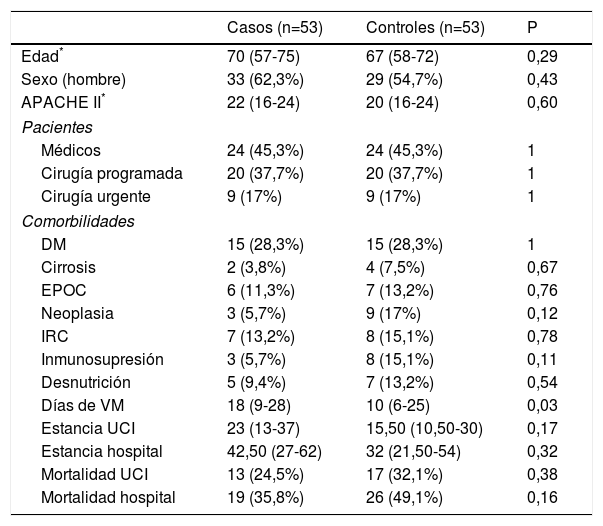
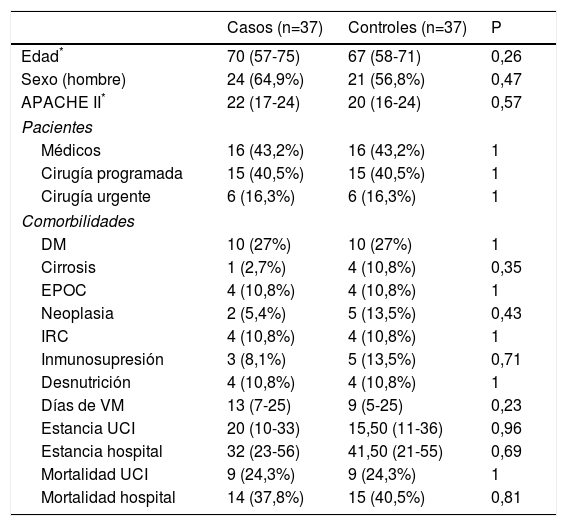
Realizamos un análisis de subgrupos de los pacientes con TAV y documentación microbiológica y de los pacientes con TAV, documentación microbiológica y tratamiento adecuado en las primeras 24 h. Los resultados se muestran en las tablas 4 y 5.
Pacientes con TAV y documentación microbiológica
| Casos (n=53) | Controles (n=53) | P | |
|---|---|---|---|
| Edad* | 70 (57-75) | 67 (58-72) | 0,29 |
| Sexo (hombre) | 33 (62,3%) | 29 (54,7%) | 0,43 |
| APACHE II* | 22 (16-24) | 20 (16-24) | 0,60 |
| Pacientes | |||
| Médicos | 24 (45,3%) | 24 (45,3%) | 1 |
| Cirugía programada | 20 (37,7%) | 20 (37,7%) | 1 |
| Cirugía urgente | 9 (17%) | 9 (17%) | 1 |
| Comorbilidades | |||
| DM | 15 (28,3%) | 15 (28,3%) | 1 |
| Cirrosis | 2 (3,8%) | 4 (7,5%) | 0,67 |
| EPOC | 6 (11,3%) | 7 (13,2%) | 0,76 |
| Neoplasia | 3 (5,7%) | 9 (17%) | 0,12 |
| IRC | 7 (13,2%) | 8 (15,1%) | 0,78 |
| Inmunosupresión | 3 (5,7%) | 8 (15,1%) | 0,11 |
| Desnutrición | 5 (9,4%) | 7 (13,2%) | 0,54 |
| Días de VM | 18 (9-28) | 10 (6-25) | 0,03 |
| Estancia UCI | 23 (13-37) | 15,50 (10,50-30) | 0,17 |
| Estancia hospital | 42,50 (27-62) | 32 (21,50-54) | 0,32 |
| Mortalidad UCI | 13 (24,5%) | 17 (32,1%) | 0,38 |
| Mortalidad hospital | 19 (35,8%) | 26 (49,1%) | 0,16 |
DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; IRC: insuficiencia renal crónica; UCI: Unidad de Cuidados Intensivos; VM: ventilación mecánica.
TAV con documentación microbiológica y tratamiento adecuado
| Casos (n=37) | Controles (n=37) | P | |
|---|---|---|---|
| Edad* | 70 (57-75) | 67 (58-71) | 0,26 |
| Sexo (hombre) | 24 (64,9%) | 21 (56,8%) | 0,47 |
| APACHE II* | 22 (17-24) | 20 (16-24) | 0,57 |
| Pacientes | |||
| Médicos | 16 (43,2%) | 16 (43,2%) | 1 |
| Cirugía programada | 15 (40,5%) | 15 (40,5%) | 1 |
| Cirugía urgente | 6 (16,3%) | 6 (16,3%) | 1 |
| Comorbilidades | |||
| DM | 10 (27%) | 10 (27%) | 1 |
| Cirrosis | 1 (2,7%) | 4 (10,8%) | 0,35 |
| EPOC | 4 (10,8%) | 4 (10,8%) | 1 |
| Neoplasia | 2 (5,4%) | 5 (13,5%) | 0,43 |
| IRC | 4 (10,8%) | 4 (10,8%) | 1 |
| Inmunosupresión | 3 (8,1%) | 5 (13,5%) | 0,71 |
| Desnutrición | 4 (10,8%) | 4 (10,8%) | 1 |
| Días de VM | 13 (7-25) | 9 (5-25) | 0,23 |
| Estancia UCI | 20 (10-33) | 15,50 (11-36) | 0,96 |
| Estancia hospital | 32 (23-56) | 41,50 (21-55) | 0,69 |
| Mortalidad UCI | 9 (24,3%) | 9 (24,3%) | 1 |
| Mortalidad hospital | 14 (37,8%) | 15 (40,5%) | 0,81 |
DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; IRC: insuficiencia renal crónica; UCI: Unidad de Cuidados Intensivos; VM: ventilación mecánica.
En el primero de los subgrupos analizados (tabla 4), se mantiene un mayor número de días de VM de los casos respecto a los controles, mediana 18 días (9-28) vs. 10 días (6-25); p=0,03. Por otro lado, no hallamos diferencias significativas respecto a la estancia en UCI u hospital o la mortalidad.
En el subgrupo de pacientes con documentación microbiológica y tratamiento empírico adecuado (tabla 5), no se encuentran diferencias en ninguno de los objetivos analizados. Es decir, no observamos aumento de la estancia o días de VM así como la mortalidad fue similar en los casos y los controles.
DiscusiónEl objetivo principal de nuestro estudio fue determinar si la TAV origina un aumento de estancia en UCI atribuible a dicha infección, y el principal hallazgo encontrado en el estudio es que la TAV está asociada con un incremento en la estancia en UCI. Sin embargo, hay que destacar que no se encuentran diferencias significativas en cuanto a estancia en aquellos pacientes que reciben tratamiento antibiótico empírico adecuado. Asimismo, también se objetiva que los pacientes que desarrollan un episodio de TAV presentan más días de VM, dato que se mantiene en el subgrupo de pacientes en los que existe documentación microbiológica, pero no en aquellos pacientes con documentación microbiológica y tratamiento antibiótico adecuado. No existe un impacto de la TAV en cuanto a la mortalidad ni en UCI ni hospitalaria.
Nuestros datos sobre la ausencia de mortalidad atribuible de la TAV contrastan con la percepción de los médicos intensivistas. Así, en una encuesta internacional la mitad de los 288 participantes consideran que la TAV incrementa el riesgo de muerte. De igual modo, la práctica totalidad de los que respondieron consideran que la TAV prolonga los días de estancia en UCI y la duración de VM14.
Estos datos ya han sido demostrados en varios estudios previos, Karvouniaris et al.5 en un estudio observacional prospectivo mostró que los pacientes con TAV presentaban una mayor estancia en UCI sin tener impacto en la mortalidad. Nseir et al.6 encontraron en un estudio caso-control que la TAV se asociaba con incremento en la duración de VM y estancia en UCI, sin encontrar no obstante diferencias en los resultados en los pacientes que recibían tratamiento antibiótico adecuado.
No existen diferencias respecto a otros estudios15, en cuanto al microorganismo más frecuentemente aislado, siendo este P. aeruginosa. Pero sí encontramos una mayor proporción de tratamientos adecuados siendo en nuestro caso de un 69,8% frente al 47% descrito por Nseir et al.16 en un estudio observacional prospectivo multicéntrico en el que evaluaban el impacto del tratamiento antibiótico apropiado sobre la transición de TAV a NAV.
Otros de los datos hallados en el estudio muestran que la aparición de TAV es algo más precoz, mediana 5 días (3-9) desde el ingreso en UCI, con respecto a lo descrito previamente por Karvouniaris et al.5 y Martín-Loeches et al.15 que muestran que la TAV aparece a partir de los 6-8 días de ingreso en UCI.
Cuando analizamos el subgrupo de pacientes con documentación microbiológica y tratamiento empírico adecuado encontramos que no existen diferencias en ninguno de los objetivos analizados, lo que podría estar en relación con los efectos del tratamiento antibiótico adecuado sobre la estancia y días de VM de estos pacientes. No obstante si realizamos una revisión de la literatura encontramos controversias, por una parte la no recomendación de las guías de la IDSA7 publicadas en el año 2016, de tratamiento antibiótico en las TAV. Los autores se basan en que tras analizar los resultados de un estudio controlado aleatorizado17 y varios estudios observacionales6,18,19, únicamente encuentran como efecto favorable del tratamiento una reducción en los días de VM, frente a la posibilidad de múltiples efectos desfavorables como serían aumento de costes, desarrollo de resistencias e incremento del número de infecciones por Clostridium difficile. Esto queda un poco en contraposición con la realidad de la práctica habitual, donde se pone de manifiesto en diversas publicaciones, la elevada frecuencia del tratamiento con antibióticos en esta entidad 50-100% según las series14,15,16. Nuestros datos apuntan a que debemos tratar de forma precoz y adecuada a los episodios de TAV pues esto conlleva a que el desarrollo de una TAV no prolongue la estancia en UCI ni los días de VM.
Nuestro estudio presenta varias limitaciones: primero, se trata de un estudio retrospectivo durante un periodo relativamente prolongado de años con lo cual no es posible excluir la presencia de sesgos. A pesar de ello, el 8,2% de los controles tuvieron que ser elegidos de años anteriores. Segundo, se trata de una muestra pequeña, lo cual puede afectar la significación estadística de alguna de las variables. Tercero, la TAV evoluciona en un porcentaje elevado a NAV. Como nuestro objetivo era analizar el impacto clínico de la TAV en aquellos pacientes que no desarrollaban NAV, excluimos todos los casos de TAV que evolucionaban a NAV. Ello nos ha permitido evaluar específicamente a la TAV teniendo además en cuenta que la transición entre uno y otro proceso infeccioso es un continuo15,16.
Por el contrario, también queremos resaltar sus fortalezas. Todas las variables se recogieron prospectivamente y los estrictos criterios de apareamiento empleados incluyendo la gravedad al ingreso, principal determinante de la mortalidad, que aseguran que los casos representan a la misma población que los pacientes controles.
Por último, hemos logrado hallar controles adecuados a un elevado número de casos de TAV utilizando criterios estrictos de apareamiento lo que nos posibilita afirmar que ambas poblaciones son similares y determinar el efecto preciso que sobre el pronóstico tiene el desarrollo de una TAV.
La TAV es una complicación infecciosa frecuente, asociada a la ventilación mecánica. Este estudio nos permite mostrar el impacto que posee esta en los pacientes de UCI, relacionándose con un aumento de estancia y de días de ventilación mecánica lo cual lleva implícito un mayor aumento de recursos y costes hospitalarios. Nuestros datos apuntan a que el tratamiento empírico adecuado podría ser beneficioso al no asociarse los episodios tratados adecuadamente en las primeras 24 h a una prolongación significativa de estancia en UCI y del tiempo de VM. Futuros ensayos clínicos bien diseñados están plenamente justificados para confirmar esta hipótesis.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.