La enfermedad de Chagas es endémica de Latinoamérica. Debido a la migración de individuos de esta región a zonas no endémicas, como es el caso de Estados Unidos, Canadá y Europa, esta infección se ha convertido en un problema de salud mundial. Para realizar el diagnóstico existen pruebas parasitológicas y serológicas, pero solo las últimas son útiles durante la fase crónica. Muchas de estas técnicas requieren equipos costosos, lo que limita su uso. En este trabajo se estandarizó la técnica Dot-ELISA para el diagnóstico de la infección con Trypanosoma cruzi por ser una técnica sencilla, de bajo costo y accesible.
MétodosSe evaluaron 360muestras: 96sueros de pacientes chagásicos y 153de individuos sanos; 40muestras de sangre recogidas en papel filtro, así como 71sueros de pacientes con otras infecciones. Se calculó la sensibilidad, la especificidad y el índice kappa de Dot-ELISA en comparación con las pruebas ELISA y Western blot previamente estandarizadas para el diagnóstico de la infección por T.cruzi.
ResultadosDot-ELISA obtuvo una sensibilidad del 97% y una especificidad del 89%, ya que presentó reacción cruzada principalmente con Leishmania spp. El índice kappa calculado fue de 0,79.
ConclusionesDot-ELISA mostró buena correlación con otras pruebas que ya son utilizadas para el diagnóstico de la enfermedad de Chagas. Por tratarse de una técnica sencilla y económica, que puede realizarse sin equipo sofisticado, resulta ser más accesible y puede utilizarse como una prueba para un cribado inicial en el diagnóstico en el laboratorio o en estudios en campo.
Chagas disease is considered endemic of Latin America. Because of migration of people from this region to non-endemic areas, such as the United States, Canada and Europe, it has become a major health problem. There are parasitology and serology tests for its diagnosis, but only the latter are useful during the chronic phase. Most of these tests require expensive equipment, which make them also inaccessible for laboratories in endemic areas. In the present work we standardize Dot-ELISA as a diagnostic test for Trypanosoma cruzi infection, since it is an easy, inexpensive and an accessible test.
MethodsA total of 360samples were tested: 96 sera from Chagas patients and 153 from healthy people; 40blood samples spots collected and eluted from filter paper were also tested, as well as 71serum samples of patients with non-related infections. Sensitivity, specificity and kappa index of Dot-ELISA test were calculated, in order to determine a correlation value of this technique compared to ELISA and Western blot that are already being used for diagnosis.
ResultsDot-ELISA obtained 97% sensitivity and 89% specificity, since it showed cross-reaction mainly with Leishmania spp., and a kappa index of 0,79.
ConclusionsDot-ELISA results correlate well with other tests that are already being used for diagnosis of Chagas disease. As it is easy and inexpensive, it may be useful as an additional diagnostic test or for field studies.
La enfermedad de Chagas o tripanosomiasis americana es una infección producida por el parásito Trypanosoma cruzi. Alrededor de 10millones de personas están infectadas, la mayoría de ellas en Latinoamérica, donde la enfermedad es endémica. Sin embargo, más de 25millones están en riesgo de adquirirla y se estima que causa la muerte de 10.000personas anualmente debido a complicaciones principalmente cardiacas1. En las últimas décadas el flujo de migración de individuos de zonas endémicas de países latinoamericanos hacia otros continentes ha ido en aumento, lo que ha provocado que la enfermedad se haya convertido en un problema importante de salud mundial. La mayoría de estos inmigrantes latinoamericanos se dirigen a Estados Unidos, Canadá, países europeos (principalmente Italia, Portugal y España), Japón y Australia2. El problema es de particular importancia en España por ser uno de los países que reciben a un gran número de inmigrantes latinoamericanos, la mayoría provenientes de Ecuador, Colombia, Bolivia y Argentina3. En 2008, el número de personas que migraron de países de Latinoamérica hacia España fue de 1.808.771, de los cuales 1.678.711 provenían de zonas endémicas para la enfermedad de Chagas. En ese año, el número de migrantes de México fue de 23.673, de los cuales un porcentaje podría estar infectado con el parásito y eventualmente requeriría tratamiento médico2. Según el Instituto Nacional de Estadística de España, para el año 2011 los inmigrantes de América Central, el Caribe y América del Sur correspondían al 30,2% (1,7 millones) del total de la población extranjera que residía en dicho país4. Esta población puede representar un riesgo transfusional, y es por ello que es necesario realizar pruebas para descartar la infección con T.cruzi5.
La enfermedad de Chagas se manifiesta en 2 fases: aguda y crónica. En la primera se suele presentar una reacción inflamatoria con o sin síntomas y una alta parasitemia. Es durante esta fase que se utilizan métodos parasitológicos o moleculares para el diagnóstico. Sin embargo, la gran mayoría de las personas infectadas desarrollan la fase crónica. Debido a la disminución del número de parásitos en circulación, durante esta etapa el diagnóstico únicamente puede realizarse mediante técnicas serológicas. Casi todos los individuos chagásicos crónicos desarrollan anticuerpos anti-T.cruzi6.
Según la Organización Mundial de la Salud (OMS), se considera un diagnóstico positivo definitivo a la infección por T.cruzi cuando se obtiene un resultado positivo en 2 o más pruebas serológicas. Generalmente se utiliza una mezcla de antígenos del parásito o al parásito completo, lo que aumenta la sensibilidad de la prueba, pero así también la probabilidad de un resultado falso positivo, por reacción cruzada con otras enfermedades, sobre todo parasitosis con otros tripanosomátidos como Leishmania spp. Existen algunos casos especiales en los que los resultados de las pruebas divergen y lo más recomendable es comparar con el resultado de una tercera prueba7.
En zonas endémicas, la enfermedad de Chagas está asociada a las áreas rurales, donde los insectos vectores pueden fácilmente introducirse en el domicilio de las personas o tener contacto con animales de granja o animales domésticos8. En muchas de estas zonas se carece de los medios adecuados para realizar un diagnóstico oportuno, ya que la mayoría de las técnicas para el diagnóstico requieren personal calificado y equipos que resultan costosos y poco accesibles. Con la estandarización de una técnica sencilla que no requiera equipo especializado sería posible analizar un número grande de muestras a bajo costo y servir como apoyo para estudios de campo.
La técnica Dot-ELISA o Dot-blot cumple con dichas características, ya que es una técnica sencilla, de fácil desempeño e interpretación de resultados que no requiere instrumentos costosos9. El antígeno es depositado en una matriz sólida (membrana de nitrocelulosa) y se incuba en presencia de anticuerpos específicos, seguido de un anticuerpo secundario acoplado a una enzima. La reacción se revela añadiendo el sustrato de la misma10. Dot-ELISA ya ha sido utilizada como una técnica de diagnóstico para diversas parasitosis11, incluyendo el diagnóstico de la tripanosomiasis americana, ya que permite la detección de anticuerpos séricos contra antígenos del parásito.
Debido a la necesidad de desarrollar métodos sencillos que muestren buena correlación con pruebas convencionales utilizadas para el diagnóstico de la enfermedad de Chagas, en el presente trabajo el objetivo fue estandarizar la técnica Dot-ELISA con antígenos de cepas mexicanas para la detección de anticuerpos contra T.cruzi y evaluar su eficiencia como prueba de diagnóstico utilizando muestras serológicas y sangre depositada directamente en papel filtro, que puede obtenerse por punción digital cuando no sea posible la obtención y la preservación de suero, sobre todo en estudios de campo. También se determinó el tiempo en el que el antígeno se mantiene estable en la membrana a temperatura ambiente. Finalmente se compararon los resultados con los obtenidos mediante otras técnicas que ya se han estandarizado para el diagnóstico de la infección.
MétodosCultivo de parásitos y preparación del extracto antigénicoSe cultivaron epimastigotes de la cepa Querétaro (TBAR/MX/0000/Querétaro) en medio LIT al 10% de suero fetal bovino (SFB) inactivado a 56°C durante 30min y 25μg/ml de hemina. Los cultivos fueron resembrados semanalmente a una densidad de 1×106 parásitos/ml de medio. Para preparar el extracto antigénico se sembró medio fresco con una densidad de 5×106 células/ml y se siguió el protocolo descrito anteriormente12. Brevemente, los parásitos fueron colectados a las 96h de cultivo y centrifugados a 6.000×g. El sedimento celular fue lavado 3veces con buffer fosfato salino (PBS) estéril y centrifugados cada vez. El mismo fue resuspendido en amortiguador de lisis con inhibidores de proteasas (Tris-HCl 10mM pH8,2, EDTA12mM, PMSF1mM, leupeptin 0,1mM, pepstatin 0,001mM). Los parásitos fueron lisados en un sonicador modelo vibracell (Sonic & Materials, EE.UU.) empleando 100watts con intervalos de 1,5s durante 1min, seguido de un minuto de agitación intensa en vórtex. Este procedimiento se repitió 2 veces más, y al final se centrifugó a 10.000×g durante 30min a 4°C para eliminar el detritus celular. El extracto obtenido se mantuvo a −20°C hasta su uso. La concentración de proteína total se determinó mediante el método de Lowry, empleando el sistema DC Protein Assay BIO-RAD, según las instrucciones del proveedor. Las lecturas de absorbancia se realizaron a 655nm.
Sueros y muestras sanguíneas en papel filtroUna parte de los sueros utilizados en el presente estudio fue proporcionada por el Instituto Nacional de Cardiología «Ignacio Chávez» y otra parte son muestras que se han tomado en el Laboratorio de Tripanosomiasis Americana del Departamento de Inmunología, del Instituto de Investigaciones Biomédicas (IIB) de la Universidad Nacional Autónoma de México (UNAM) mediante punción venosa a personas que son canalizadas del Centro Médico Nacional «La Raza» del Instituto Mexicano del Seguro Social (IMSS) con un diagnóstico positivo a T.cruzi y a quienes se les solicitó su consentimiento para dicho estudio. Los sueros fueron evaluados por ELISA y Western blot, de acuerdo con el procedimiento descrito por Sánchez et al. (2001)12, con lo que se caracterizaron como positivos y negativos. El protocolo fue autorizado por los comités de ética de todas las instituciones.
Para la colección de muestras en papel filtro, a partir de un tubo para obtención de suero con la muestra sanguínea recién tomada y antes de la coagulación se colocaron 25μl sobre papel filtro. Se dejó secar la muestra y se mantuvo en un recipiente seco a temperatura ambiente hasta la elución. Se extrajeron porciones del papel con la muestra de 6mm de diámetro y se colocaron en 250μl de PBS, dejando eluir toda la noche a 4°C13. El sobrenadante se recuperó considerando una dilución final de 1:25 por el proceso de elución.
El tamaño total fue de 360muestras: 96sueros positivos por ELISA y Western blot, 153sueros negativos por ambas pruebas, 40muestras sanguíneas colectadas en papel filtro (23muestras positivas y 17negativas), así como 71sueros de pacientes con otras infecciones (39sueros de pacientes con leishmaniasis, 9 con tuberculosis, 15 con neurocisticercosis, 5 con teniasis y 3 con toxoplasmosis), también analizadas por ELISA y Western blot. Todas las muestras se mantuvieron a –20°C diluidas 1:1 en glicerol hasta su uso para asegurar su estabilidad.
Dot-ELISASe sensibilizó una membrana de nitrocelulosa Schleicher & Schuell de poro 0,2μm con el equipo Dot Blotter Schleicher & Schuell SRC 96D Minifold I mediante vacío de acuerdo con el fabricante y colocando en cada pozo extracto antigénico en concentraciones de 0,25, 0,5 y 0,75μg/dot. Se cortó la membrana en porciones de 2pozos y se colocaron en microtubos, procurando que la cara de la membrana sensibilizada se mantuviera hacia la luz del tubo. Se bloqueó con leche descremada al 10% en PBS durante toda la noche a 4°C en agitación suave. Posteriormente se incubó con el suero problema en diluciones de 1:500 en leche descremada al 10% en PBS durante 2h a temperatura ambiente. Se realizaron 3lavados de 10min con PBS-Tween 20 al 0,1%. Se agregó el anticuerpo conjugado anti-IgG humano acoplado a peroxidasa (Zymed) a una dilución de 1:10.000 en PBS-Tween 20 al 0,1% durante 2h a temperatura ambiente. Después de 3lavados se reveló agregando el sustrato 3,3-diaminobenzidina en una concentración de 0,5mg/ml en PBS y 0,02% de peróxido de hidrógeno. Se estableció un tiempo fijo de 90s en presencia de la solución de revelado. La reacción se detuvo realizando 3lavados con agua bidestilada.
La evaluación de las muestras sanguíneas eluidas de papel filtro se realizó de la misma manera, modificando la dilución del anticuerpo primario por 1:250, 1:150 y 1:70. Los resultados de esta determinación se compararon con los resultados de los sueros correspondientes.
Evaluación de la estabilidad del antígeno en la membranaSe sensibilizaron membranas con una concentración de antígeno de 1μg/dot. Las membranas se mantuvieron a temperatura ambiente, protegidas de la luz. Para determinar la estabilidad del antígeno en la membrana se realizaron ensayos Dot-ELISA con sueros control positivo fuerte, positivo débil y un suero control negativo a 1, 2, 3, 5, 7 y 13meses después de la adsorción del antígeno en la membrana.
Cálculo de sensibilidad, especificidad e índice kappaEl valor de sensibilidad se obtuvo considerando las muestras positivas y negativas. La especificidad de la técnica se calculó considerando muestras positivas, negativas y sueros de individuos con otras infecciones concordantes con los resultados de ELISA y Western blot. Ambos mediante el programa EPIDAT versión 3.1 (http://www.sergas.es/MostrarContidos_N3_T01.aspx?IdPaxina=62715).
El cálculo del índice kappa se realizó mediante el programa VassarStats: Website for Statistical Computation (http://faculty.vassar.edu/lowry/kappa.html), para determinar el índice de correlación entre 2 pruebas.
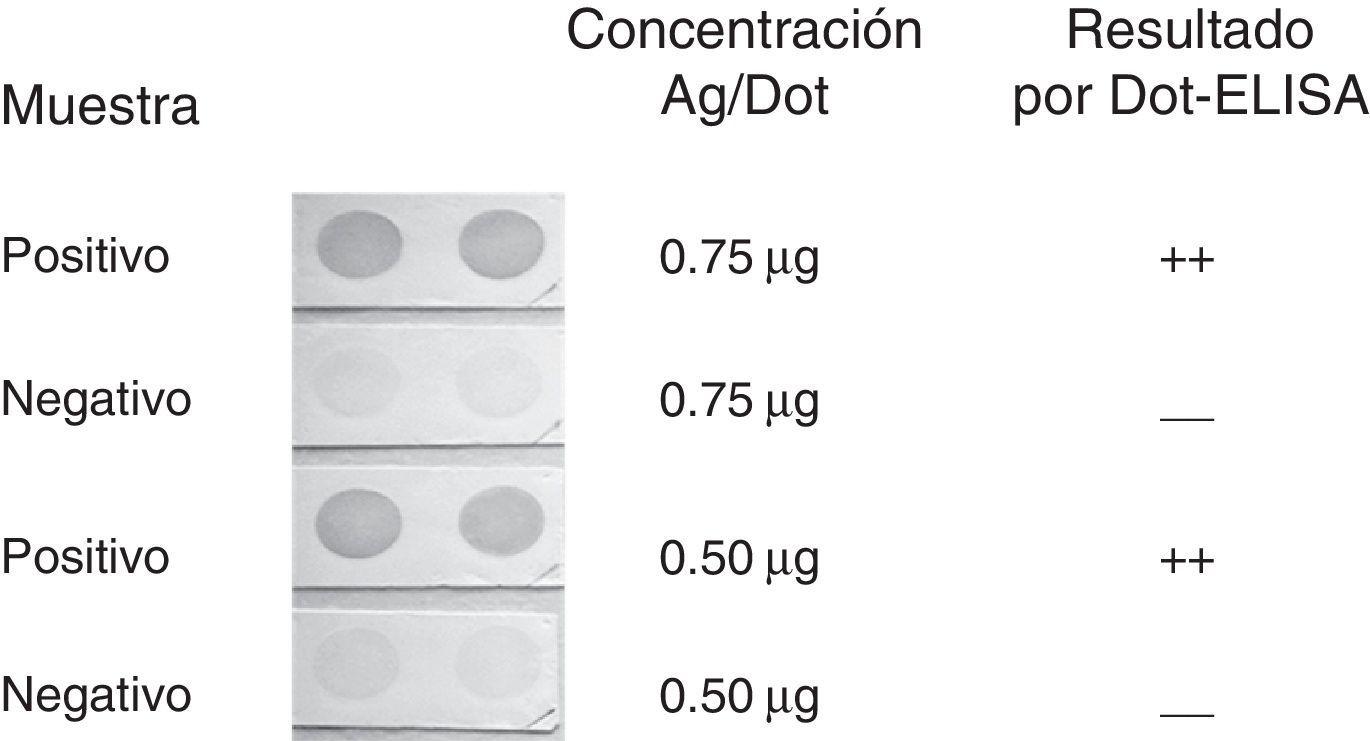
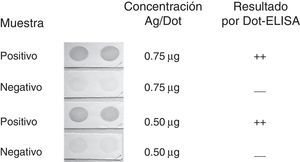
ResultadosEstandarizaciónPara estandarizar la cantidad de antígeno adecuada para sensibilizar la membrana de nitrocelulosa se trabajó con concentraciones de 0,25, 0,50 y 0,75μg/dot (50μl) evaluando una muestra previamente caracterizada como positiva débil (resultado en ELISA: D.O. superior al punto de corte 0,62/0,22; resultado en Western blot: 2-3bandas tenues) y un control negativo (fig. 1), se utilizó una dilución de 1:500 para el suero problema y 1:10.000 para el anticuerpo conjugado a la enzima, por ser estas las diluciones establecidas previamente para un ensayo Western blot diagnóstico12. En los casos en que se observó la formación de una coloración oscura, se consideró un resultado positivo. Se observó un reconocimiento evidente con todas las concentraciones probadas, pero a medida que la concentración de antígeno fue menor, también lo fue la señal. En el caso de la muestra negativa, se estableció que una señal tenue, como la que se muestra en la figura 1, es el máximo que llega a observarse en una muestra de este tipo manteniendo la membrana durante 90s en presencia de la solución de revelado. Se estableció también que una concentración de 0,50μg/dot era suficiente para la formación de una coloración evidente en presencia de anticuerpos anti-T.cruzi y un reconocimiento de tenue a no señal cuando no los hay.
Dot-ELISA con 0,75 y 0,50μg de antígeno. Evaluación de un suero control positivo débil y un suero control negativo a una dilución de 1:500 y 1:10.000 para el anticuerpo conjugado. El número de cruces indica la intensidad de la señal observada: ++=fuerte; —=ausencia de señal o señal muy tenue.
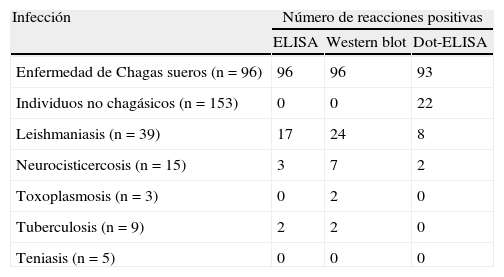
En las condiciones anteriores se evaluaron un total de 96muestras serológicas previamente caracterizadas como positivas por Western blot y ELISA siguiendo el protocolo descrito anteriormente12 y 153muestras negativas, de las cuales se obtuvieron 93positivos y 131negativos por Dot-ELISA, respectivamente (tabla 1). Ambos grupos de sueros, positivos y negativos, se analizaron estadísticamente para la obtención de un índice kappa de 0,79 (de 249muestras totales, 224 obtuvieron un resultado concordante entre pruebas) que corresponde a un buen grado de concordancia entre el resultado obtenido por Dot-ELISA y pruebas previamente estandarizadas (ELISA y Western blot) mediante el programa VassarStats.
Comparación de reactividad observada entre las 3 pruebas
| Infección | Número de reacciones positivas | ||
| ELISA | Western blot | Dot-ELISA | |
| Enfermedad de Chagas sueros (n=96) | 96 | 96 | 93 |
| Individuos no chagásicos (n=153) | 0 | 0 | 22 |
| Leishmaniasis (n=39) | 17 | 24 | 8 |
| Neurocisticercosis (n=15) | 3 | 7 | 2 |
| Toxoplasmosis (n=3) | 0 | 2 | 0 |
| Tuberculosis (n=9) | 2 | 2 | 0 |
| Teniasis (n=5) | 0 | 0 | 0 |
Número de sueros chagásicos, de individuos sanos y de personas con otras infecciones que resultaron positivos mediante técnicas previamente estandarizadas (ELISA y Western blot) y Dot-ELISA.
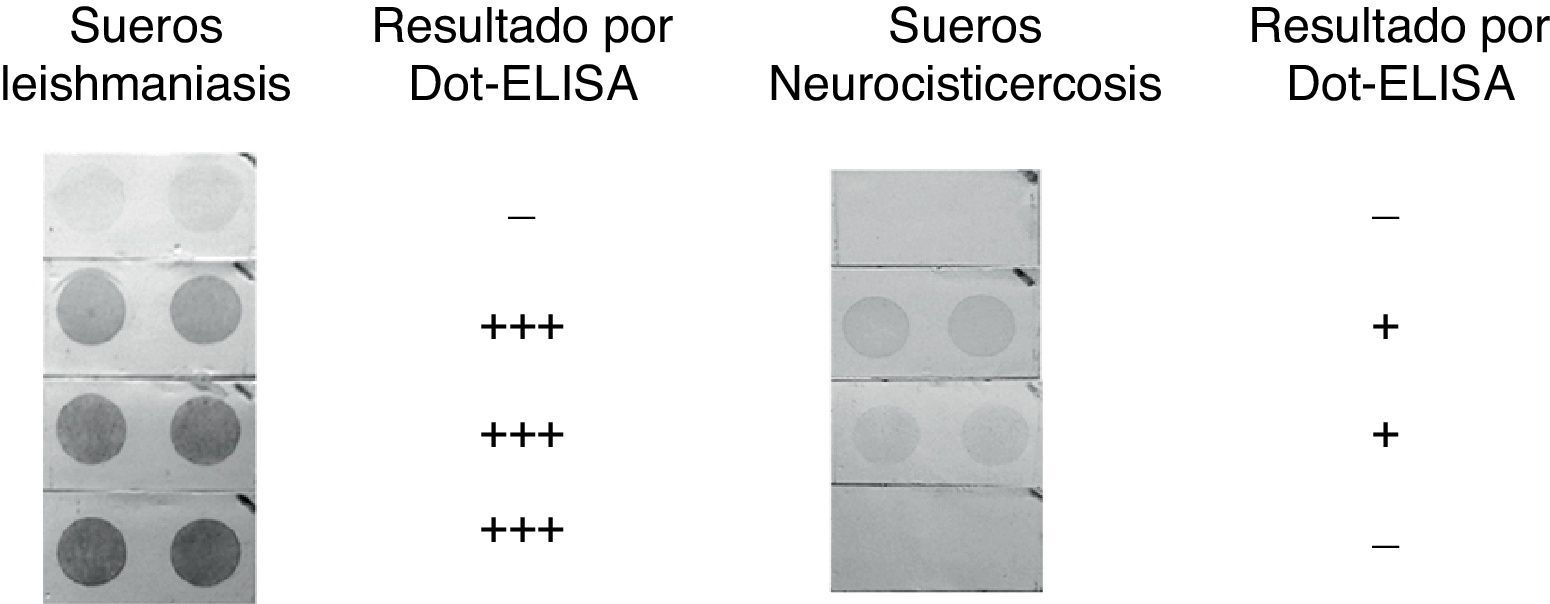
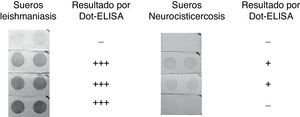
Para determinar la especificidad de la prueba se evaluaron sueros de individuos leishmaniásicos, individuos con tuberculosis, neurocisticercosis, teniasis y toxoplasmosis (fig. 2). Se encontró únicamente un reconocimiento en 8 de 39 (20,5%) sueros de individuos con leishmaniasis y un reconocimiento débil en 2 de 15 (13%) sueros evaluados de individuos con neurocisticercosis. En ambos casos el número de falsos positivos resultó ser menor al que se obtuvo mediante ELISA y Western blot. Sueros de individuos con otras infecciones no demostraron reconocimiento del extracto antigénico en Dot-ELISA (tabla 1).
Reacción cruzada. Evaluación por medio de Dot-ELISA de sueros de individuos con distintas infecciones para la búsqueda de reacción cruzada con extracto antigénico de epimastigotes de Trypanosoma cruzi. Dilución del suero 1:500 y 1:10.000 para el anticuerpo conjugado con una concentración de 0,50μg del antígeno/dot. El número de cruces indica la intensidad de la señal observada: +=débil; +++=muy fuerte; —=ausencia de señal o señal muy tenue.
La sensibilidad de la prueba Dot-ELISA fue del 97% (intervalo de confianza [IC] de 95%: 93-100%) y la especificidad obtenida considerando las muestras negativas evaluadas y sueros de individuos con otras parasitosis fue del 89% (IC95%: 85-94%).
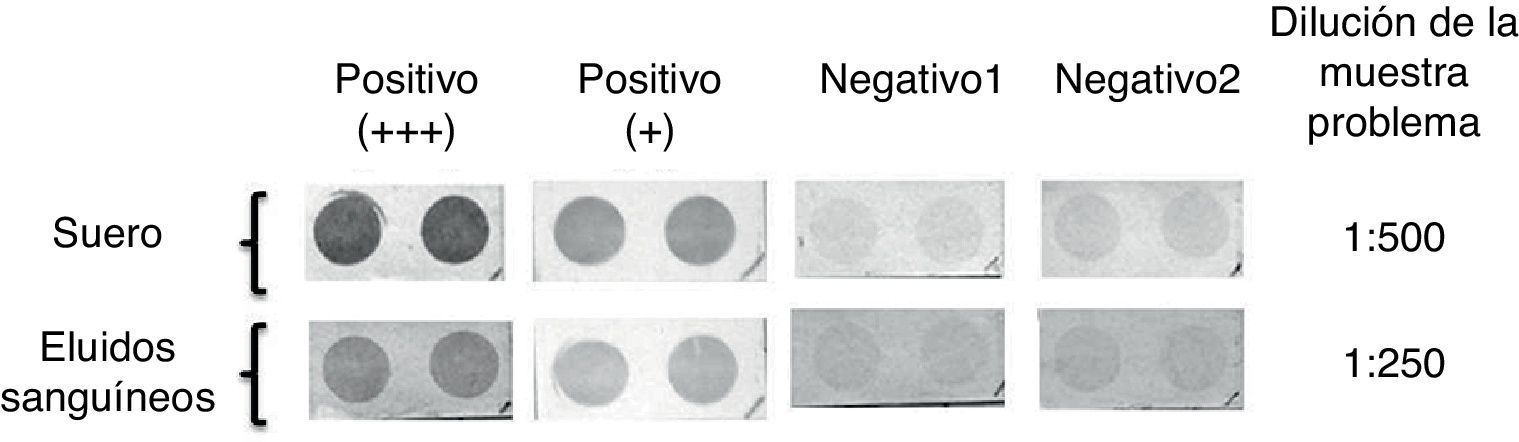
Determinación de anticuerpos anti-Trypanosoma cruzi a partir de muestras sanguíneas eluidas de papel filtroMuestras de sangre depositada y posteriormente eluida de papel filtro fueron analizadas, inicialmente a la misma dilución que los sueros. La intensidad de la coloración obtenida no fue completamente equivalente a la que se observó con el suero correspondiente, por lo que se probaron diluciones menores del eluido sanguíneo (1:250 y 1:150), encontrándose un aumento en la intensidad de la señal producida. Sin embargo, a estas diluciones la señal de las muestras negativas también aumentó, por lo que se estableció que con la dilución 1:250 de sangre eluida se obtiene un resultado similar a la del suero evaluado a 1:500, manteniéndose una señal negativa en sueros control (fig. 3).
Ensayo Dot-ELISA de una muestra positiva fuerte (+++), una muestra positiva débil (+) y 2 controles negativos (Negativo1 y Negativo2) a una dilución de 1:250 de muestras sanguíneas eluidas de papel filtro comparado frente a las muestras serológicas correspondientes diluidas 1:500 y el anticuerpo conjugado diluido 1:10.000 en todos los casos.
Una vez establecidas las condiciones de evaluación para este tipo de muestras, se realizó el análisis de 40eluidos simultáneamente con el suero correspondiente. De los sueros analizados, se obtuvieron 23positivos al evaluarlos por Dot-ELISA y 17negativos. Treinta y cinco eluidos (88%) mostraron un resultado concordante (19positivos y 16negativos) con el resultado obtenido por Dot-ELISA del suero evaluado y un índice kappa de 0,75, que corresponde a un buen grado de concordancia. Con estos resultados también se calculó el valor de sensibilidad, obteniéndose un valor del 83% (IC95%: 63-100%) y especificidad del 94,1% (IC95%: 80-100%).
Estabilidad del antígeno en la membranaMembranas sensibilizadas con 1μg de antígeno/dot fueron mantenidas a temperatura ambiente, protegidas de la luz y evaluadas a 1, 2, 3, 5, 7 y 13meses después de la adsorción del antígeno. Los ensayos para verificar la estabilidad del mismo se realizaron con un suero control positivo fuerte, un suero positivo débil y un control negativo en las condiciones estandarizadas. A partir del mes 7 se observa una disminución en la intensidad de la señal en el caso de sueros positivos (fig. 4).
Estabilidad del antígeno en la membrana. Se evaluó a los 0, 2, 3, 5, 7 y 13meses post-sensibilización de la membrana con el antígeno mediante Dot-ELISA con una concentración de 1μg de antígeno/dot, utilizando un suero control positivo fuerte (+++), un suero control positivo débil (+) y un suero control negativo (Negativo).
En la actualidad no existe un consenso que establezca una técnica de referencia para el diagnóstico de la enfermedad de Chagas. Una de las razones principales por las que no se ha establecido una técnica estándar para el diagnóstico de la infección por T.cruzi es debida a la variedad en sensibilidad y especificidad que presentan las pruebas. Estas variaciones están dadas en muchas ocasiones por el antígeno utilizado que proviene de distintas cepas. También en algunos países convergen diferentes parasitosis que influyen en la especificidad de las pruebas. En países como México, donde en ciertas regiones está presente T.cruzi y Leishmania spp., o España, donde la leishmaniasis causada por Leishmania infantum tiene una amplia distribución14, la respuesta humoral hacia uno u otro parásito puede dar lugar a reactividad cruzada en numerosas técnicas serológicas. Alrededor del 98% de las personas son diagnosticadas durante la fase crónica de la infección, cuando la parasitemia suele ser baja y difícil de detectar, y por ello se emplean técnicas inmunológicas para la búsqueda de anticuerpos anti-T.cruzi generalmente de la clase IgG15.
En Sudamérica, Dot-ELISA se ha sugerido como una técnica adecuada para realizar el diagnóstico de la enfermedad de Chagas y para llevar a cabo encuestas seroepidemiológicas por ser práctica y económica, sobre todo en zonas donde no se tiene acceso a laboratorios especializados16, y por su gran versatilidad ya ha sido utilizada en la detección de infecciones con bacterias, virus y otros parásitos9,17,18.
Anteriormente la técnica se había utilizado ya para el diagnóstico de la tripanosomiasis americana, utilizando 0,8μg/dot y suero diluido desde 1:128 a 1:512, así como el anticuerpo secundario conjugado a la enzima diluido 1:50019. En este trabajo se empleó una concentración similar de antígeno (0,5μg/dot que equivale a 10μg/ml) y altas diluciones tanto de la muestra problema (1:500) como del anticuerpo conjugado a la enzima (1:10.000), lo que permite mantener un bajo costo de la prueba, obteniéndose buenos resultados. Se estableció un tiempo fijo de revelado para evitar problemas de interpretación en cada ensayo realizado y un punto de corte en el que a simple vista se pudiera diferenciar fácilmente una señal positiva de una negativa (fig. 1).
Se han determinado la sensibilidad y la especificidad de las pruebas en las que se utiliza como antígeno el parásito completo o extractos solubles, demostrándose sensibilidades altas del 98-100%, mientras que en las pruebas en las que se utilizan antígenos recombinantes se han encontrado sensibilidades del 92-100%15. Por su parte, la especificidad de las pruebas se ha reportado más variable, ya que se han obtenido valores desde 83 hasta 100%12,15,20,21. El Dot-ELISA estandarizado en este trabajo mostró una sensibilidad alta del 97% para la búsqueda de anticuerpos anti-T.cruzi presentes en muestras serológicas. Únicamente 3muestras evaluadas dieron un resultado falso negativo, que podría deberse a fallos en la interpretación del resultado, ya que esta es una técnica que depende en parte de la apreciación del analista. Aun cuando la técnica ya ha sido empleada para el diagnóstico de la enfermedad de Chagas19 obteniéndose valores altos tanto de sensibilidad como de especificidad, no se analizaron sueros de pacientes con leishmaniasis, que por la alta incidencia de reacción cruzada que se observa deben ser incluidas en esta clase de estudios. La especificidad obtenida en este trabajo fue del 89%, ya que se presentaron 22falsos positivos debido a la alta incidencia de reacción cruzada, principalmente con leishmaniasis.
El análisis de muestras sanguíneas que pueden obtenerse mediante punción digital, depositarse y posteriormente eluirse de papel filtro, implica un gasto menor. Este tipo de muestras no requieren mantenerse en refrigeración o separarse por centrifugación como en el caso de los sueros, y por lo tanto son una buena opción, sobre todo cuando se requiera hacer un diagnóstico en zonas rurales o donde no se cuente con dichos equipos. Además, su obtención causa menos molestias para algunas personas y es útil cuando la toma de sangre venosa no es sencilla o cuando se requiere tomar una muestra de niños pequeños. Según el presente estudio, al evaluar sangre es recomendable disminuir la dilución de la muestra en un rango de 1:150 a 1:250 para obtener una buena correlación haciendo la comparación entre los resultados con estas muestras y con el suero correspondiente. El valor de sensibilidad de la prueba evaluando eluidos fue alto, pero inferior al obtenido al analizar los sueros directamente. Esto se puede atribuir al número reducido de muestras evaluadas (40), por lo que es importante analizar un número mayor de muestras de este tipo.
Como ha sido reportado anteriormente, el método puede mejorar con el uso de fracciones antigénicas, antígenos puros o antígenos recombinantes, como se ha observado en otras técnicas basadas en inmunocromatografía22.
Adicionalmente se evaluó la estabilidad del antígeno en membranas sensibilizadas. Estas se almacenaron a temperatura ambiente y protegidas de la luz, observándose que la membrana en estas condiciones se mantiene estable y funcional durante al menos 5meses, lo que es una mejoría al uso de antígenos que tienen que ser congelados, permitiendo el uso de estas membranas en regiones que carecen de refrigeración. Tras determinarse en este estudio que una concentración adecuada para la detección de anticuerpos es de 0,5μg de antígeno/dot, estudios similares con esta concentración de antígeno se están llevando a cabo actualmente para corroborar su estabilidad.
Finalmente, la técnica Dot-ELISA ha mostrado ser sensible y accesible, ya que no requiere equipo especializado como en el caso de ELISA, de Western blot o de inmunofluorescencia indirecta, entre otras técnicas. La interpretación de resultados es sencilla y se puede utilizar un extracto total de epimastigotes del parásito como antígeno, que según lo reportado en este trabajo puede mantenerse estable sin refrigeración durante meses. Por todas estas ventajas, Dot-ELISA es una buena técnica para un diagnóstico que podría utilizarse como un primer cribado en zonas endémicas o para estudios de campo y posteriormente confirmarse empleando otras técnicas, como ELISA o Western blot.
FinanciaciónEste estudio ha recibido el apoyo del Instituto de Ciencia y Tecnología del Distrito Federal mediante el proyecto N.o PICSA10-130. ACL recibió una beca durante su tesis del proyecto PICSA10-130.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Se agradece a la Dra. Araceli Malagón, al Dr. Ángel Guerra y al Químico Jorge Gómez, del Hospital Centro Médico «La Raza», por la donación de sueros chagásicos utilizados en el estudio. También se agradece a la Dra. Agnes Marie Fleury y a la Dra. Esperanza García, del Instituto Nacional de Inmunología «Manuel Velasco Suárez», por la donación de sueros de pacientes con neurocisticercosis; al Dr. Rafael Saavedra, de la UNAM, por la donación de sueros de pacientes con toxoplasmosis; a la Dra. Luz María López Marín por la donación de sueros de pacientes con tuberculosis, y a la Dra. Ingeborg Becker, de la UNAM, y la Dra. Claude Pirmez, del Instituto Oswaldo Cruz, por la donación de sueros de pacientes con leishmaniasis.