Introducción
El género Enterovirus (familia Picornaviridae) clásicamente comprende 64 serotipos agrupados en cinco especies, Poliovirus (PV) y Enterovirus humanos (EVH) A a D, aunque se ha propuesto que PV se reclasifique dentro de EVH C1. Recientemente se han descrito nuevos serotipos por métodos moleculares, que son enterovirus (EV) 73 a 78, y EV89 a 912-5.
La mayoría de las infecciones por EV son leves o asintomáticas. Su papel etiológico es frecuentemente investigado en procesos neurológicos (meningitis aséptica, parálisis fláccida). No obstante, otros síndromes no neurológicos se han asociado también a infección por EV, como: enfermedad febril aguda, infección respiratoria aguda (IRA), exantema, enfermedad mano-pie-boca, herpangina, y procesos más graves como miocarditis, o infección aguda grave del recién nacido6. La alta morbilidad asociada a las infecciones por EV se traduce también de forma directa o indirecta en un significativo impacto económico7.
En 2004 se propuso EV75 como un nuevo serotipo dentro del género Enterovirus. Su aislamiento a partir de muestras clínicas ha sido excepcional, y casi siempre asociado a procesos no meníngeos5. En España, recientemente se ha comunicado la detección de 8 casos de infección por EV75, cinco de los cuales se dieron en pacientes con meningitis aséptica, repartidos en cuatro áreas geográficas diferentes8. De estos 8 casos, 3 procedían de Granada, uno de cuyos aislados fue obtenido de una muestra de LCR de un paciente con meningitis. En este trabajo se analizan los datos clínicos y epidemiológicos de estos 3 casos de infección por EV75, detectados en la provincia de Granada, y se describen 2 nuevos casos de infección por este serotipo.
Material y métodos
Nuestro laboratorio pertenece a un Hospital Regional que cubre una población de 320.000 habitantes. Desde 1988, se investiga sistemáticamente la presencia de EV en pacientes con meningitis aséptica, IRA, miopericarditis, síndrome febril, exantema y otros cuadros en los que se solicite de modo expreso. Las muestras en las que fundamentalmente se realiza la investigación, en función del síndrome clínico, son: líquido cefalorraquídeo (LCR), aspirado nasofaríngeo, exudado faríngeo y heces. Durante el período de estudio, desde 1988 hasta junio de 2006, dichas muestras fueron procesadas a su vez por procedimientos habituales para descartar la presencia de patógenos no virales.
El aislamiento de EV se realizó por cultivo tradicional en líneas celulares adecuadas. Para ello, 200 μl de la muestra se inocularon en 4 tubos que contenían líneas celulares MRC-5 (fibroblastos de pulmón fetal humano), rabdomiosarcoma (RD), Hep-2 y Vero respectivamente, siguiendo procedimientos descritos previamente9,10. Los tubos se examinaron a diario, durante 14 días, para detectar la aparición de efecto citopático (ECP) característico. La identificación de los aislados a partir de líneas celulares con ECP se realizó por inmunofluorescencia indirecta (IFI) usando un anticuerpo monoclonal frente a la proteína VP1 de EV (clone 5-D8/1; Dako, Glostrup, Dinamarca), o por pruebas físico-químicas (resistencia a cloroformo y a pH ácido). Desde enero de 2005, los aislados de EV fueron confirmados a partir del sobrenadante de los cultivos mediante RT-PCR en tiempo real, usando tecnología SYBR green I y los cebadores desarrollados por Rotbart et al11. Los aislados se almacenaron a 80 °C hasta que se efectuó la determinación del serotipo.
El serotipado de EV se llevó a cabo por tres técnicas diferentes según el período en que se estudiara la muestra. Hasta 1997 se realizó por ensayos de neutralización del ECP12. De 1997 a 2005, la IFI fue el procedimiento fundamentalmente empleado, y las cepas no tipables eran con posterioridad tipadas por neutralización del ECP. Para la IFI, utilizamos anticuerpos monoclonales frente a Echovirus (E) 4, 6, 9, 11 y 30, Coxsackievirus A (CAV) 9 y 24, Coxsackievirus B (CBV) 1-6, y PV 1-3 (Light Diagnostics, Chemicon International, Southampton, UK)13. Desde enero de 2005, los nuevos EV aislados, así como las cepas no tipables congeladas desde 2001 de EV no-polio, fueron tipados por RT-nested-PCR dirigida frente a un fragmento de la región VP1 y posterior secuenciación de los productos de PCR14. Los aislados que no amplificaron la región VP1 pero eran identificados como EV por IFI o RT-PCR se consideraron no tipables (NT).
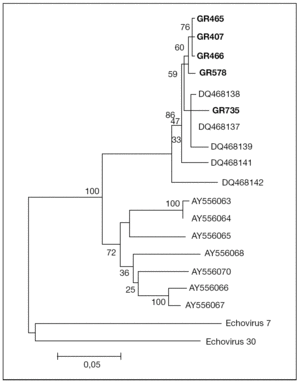
Las secuencias obtenidas de los 5 aislados de EV75 se alinearon y compararon con las correspondientes de otros EV75 incluidos en GenBank, con el programa ClustalW Multiple Sequence Alignment (versión 1.82; European Bioinformatics Institute, Cambridge, Reino Unido). Los números de acceso del GenBank de las secuencias de comparación son: DQ468137, DQ468138, DQ468139, DQ468141, DQ468142, AY556063, AY556064, AY556065, AY556066, AY556067 y AY556068. Se construyó el árbol filogenético de las secuencias de la región VP1 analizadas con el programa MEGA 315 usando el método "neighbour-joining", con un valor de confianza de bootstrap de 1.000 réplicas.
Resultados
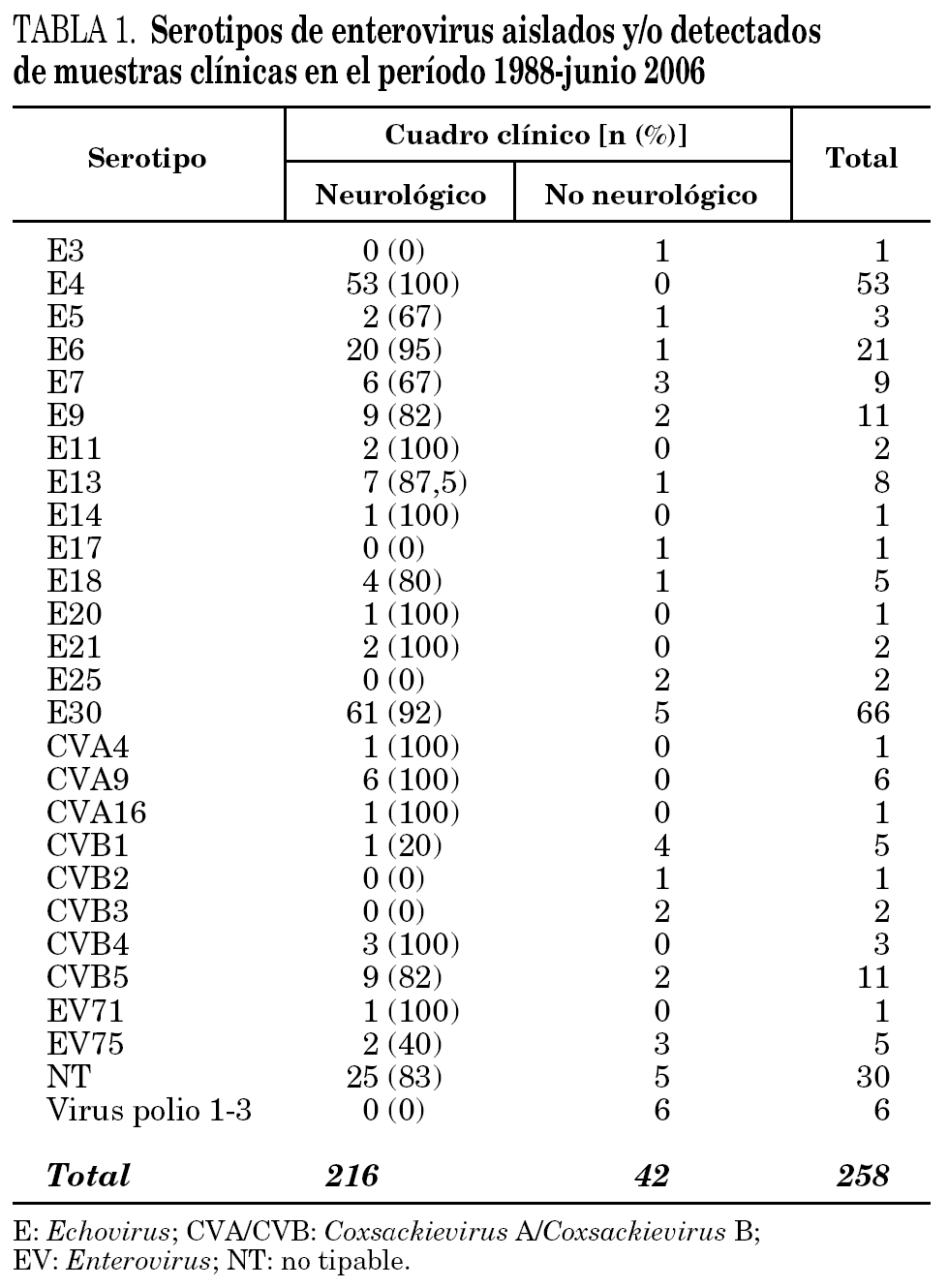
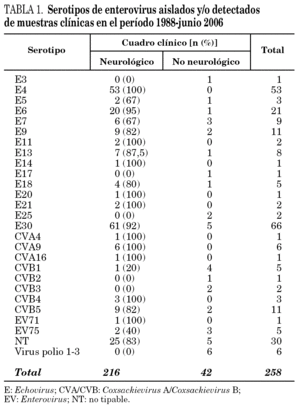
Desde 1988 hasta junio de 2006 se han investigado EV en muestras de 4.507 pacientes. Se han aislado EV en alguna muestra de 362 pacientes (8% de los pacientes investigados). De éstos, se pudo realizar serotipado y tener acceso al diagnóstico clínico de 258 pacientes, correspondiendo 216 (83,7%) a pacientes con meningitis aséptica, y 42 a pacientes con cuadros no neurológicos.
En 228 cepas se identificaron 28 serotipos diferentes y 30 cepas fueron NT. Tanto las cepas tipables como las NT mayoritariamente se asociaron a cuadros neurológicos (tabla 1).
En conjunto, el serotipo dominante a lo largo de estos años ha sido el E30, con el 28,2% (61/216) de los cuadros neurológicos. En España, brotes de meningitis aséptica causados por este serotipo han sido descritos por Trallero et al16. Se detectó E4 en 53 casos, todos ellos neurológicos; por lo que, junto con E30, constituyen el 55% del total de casos neurológicos de la serie.
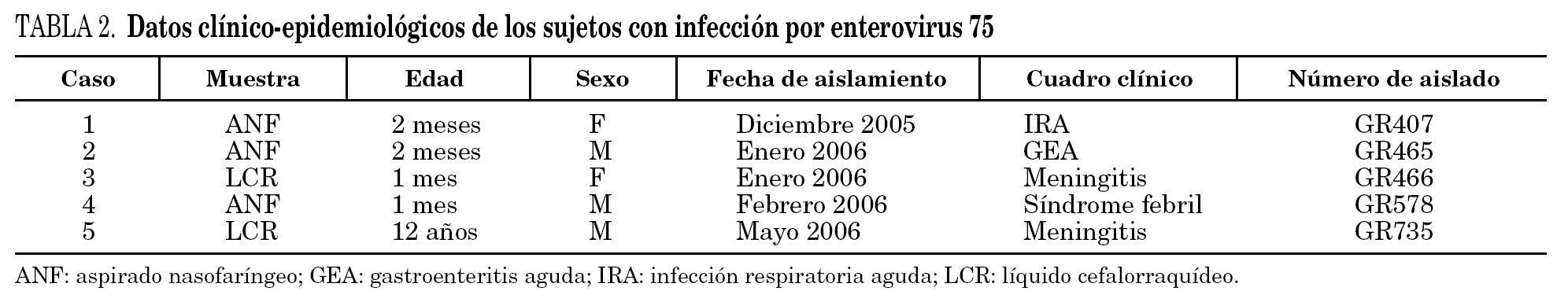
Se detectó EV75 en 5 pacientes (2%). En todos los casos se aisló en cultivo en línea celular RD, mediante la detección de ECP y confirmación mediante IFI y RT-PCR del sobrenadante del cultivo. El tiempo de detección del ECP osciló entre 3 y 7 días. El serotipo se determinó mediante secuenciación de los productos de PCR de la región VP114. En 3 casos (60%) se aisló de pacientes con cuadros no neurológicos, en concreto uno con IRA, otro con síndrome febril y el tercero con gastroenteritis, y en los 2 casos restantes (40%) se aisló de pacientes con meningitis linfocitaria. En ninguno de estos pacientes se detectó otro patógeno que justificara el proceso. El primer aislamiento tuvo lugar en diciembre de 2005 y el último, en mayo de 2006. La edad de 4 de los 5 pacientes fue menor de un año. Todos los casos evolucionaron hacia la curación sin secuelas (tabla 2).
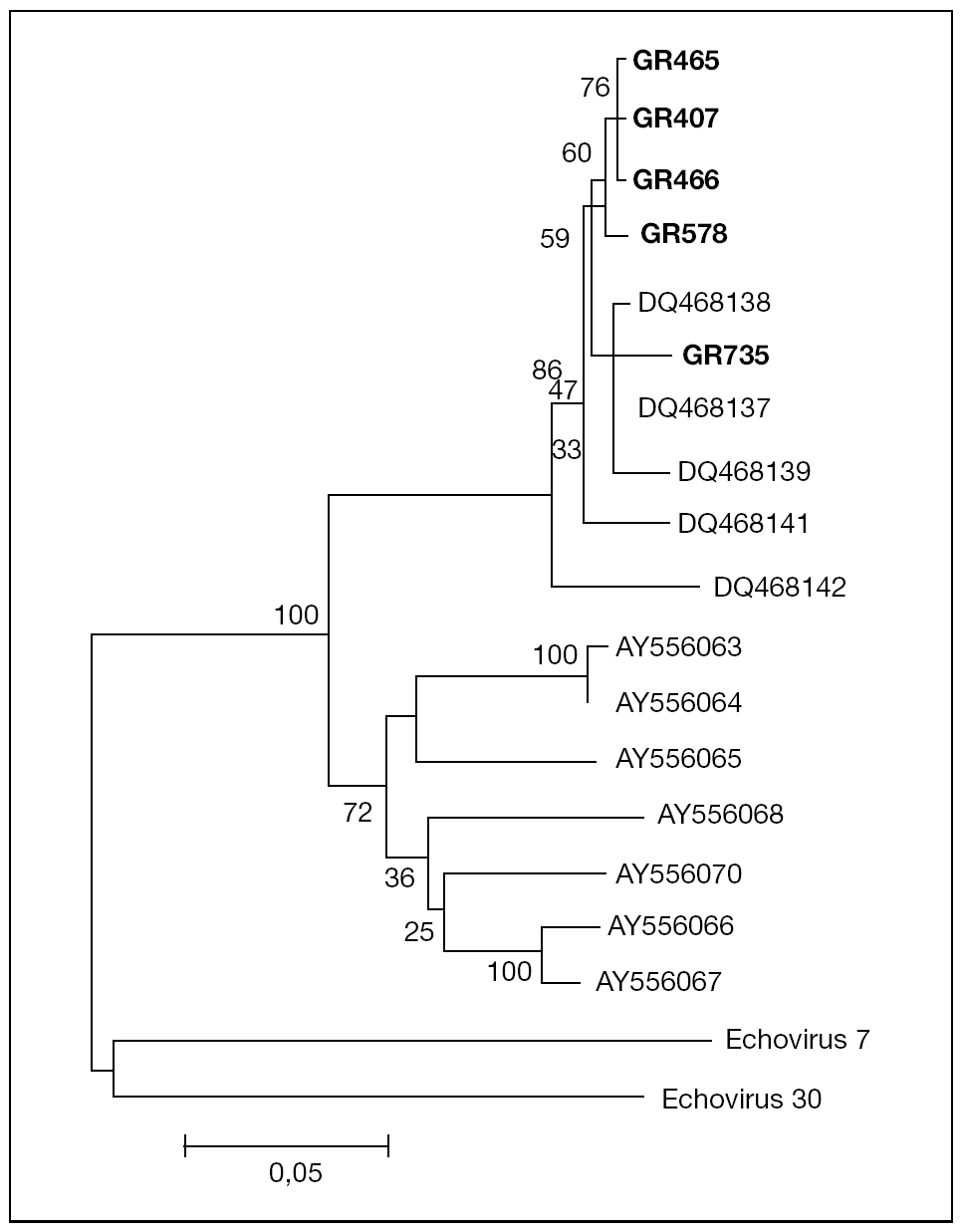
El análisis filogenético de las secuencias amplificadas de la región VP1 de los 5 aislados muestra que éstos se agrupan en un mismo cluster junto con los otros aislados de EV75 descritos previamente en España por Avellón et al8, separado de cepas de EV75 detectadas en otros países (fig. 1). La homología de las secuencias de los aislados de este trabajo con otros EV75 aislados en España fue del 95-100%, frente al 78-81% con respecto a aislados de otros países.
Figura 1. Árbol filogenético de enterovirus 75 aislados en Granada (GR407, GR465, GR466, GR578, GR735), en otras áreas geográficas de España (número de acceso en GenBank: DQ468137-DQ468139, DQ468141, DQ468142) y otros países (número de acceso en GenBank: AY556063-AY556068, AY556070), que muestra la relación a nivel de la región proteica VP1 del genoma viral. La secuencia del aislado GR407 está introducida en el GenBank y tiene número de acceso DQ468140.
Discusión
EV75 fue propuesto como un nuevo subtipo de EV en 20045. Aunque es de distribución mundial, hasta 2005 sólo se había comunicado su aislamiento en 8 ocasiones; el primero se detectó en 1974, y en ningún caso estaba asociado a meningitis. En 2006 se comunicaron 8 casos de infección por EV75 en distintas áreas geográficas de España, 5 de los cuales se detectaron en pacientes con meningitis aséptica8. Tres de los casos correspondían a los primeros 3 casos de este trabajo (GR407, GR465 y GR466), a los que hay que sumar los 2 restantes, uno de los cuales fue un cuadro de meningitis. La serie de 5 pacientes con infección por EV75 de este trabajo constituye la mayor serie local de aislamientos de este serotipo comunicada hasta la fecha.
Cabe destacar dos hechos importantes en este trabajo relacionados con el aislamiento de este serotipo. Por una parte, el hecho de que 2 de los 5 casos correspondieron a pacientes con meningitis aséptica. Junto con los datos publicados previamente8, en España se han comunicado 6 casos de meningitis por EV75 de un total de 10 casos de infección por este serotipo. Estos datos contrastan con lo descrito en otras áreas geográficas, en las que la infección por EV75 se asoció de forma casi exclusiva con cuadros no meníngeos5. La homología de las secuencias de nucleótidos en la región del genoma estudiada entre aislados españoles es del 95-100%; sin embargo, se observan diferencias de más de un 20% con aislados de otros países. Podría especularse que esta variabilidad genética se tradujera en una mayor neurovirulencia de las cepas de EV75 aisladas en nuestro medio.
El otro hecho destacable es que los aislados de EV75 se obtuvieron preferentemente durante los meses fríos, cuando la circulación habitual de la mayoría de EV se produce en los meses cálidos. Esta circunstancia podría justificar en parte el aislamiento de EV75 asociado a cuadros no neurológicos de forma más frecuente que otros EV, ya que estos procesos, sobre todo IRA, son mejor estudiados en los meses de invierno con el fin de descartar otros virus respiratorios, como virus respiratorio sincitial y gripe, sujetos a especial vigilancia para control de brotes nosocomiales y epidemias anuales.
La epidemiología de los EV muestra una gran variabilidad temporal y geográfica. Algunos autores han sugerido que la circulación de un determinado serotipo en un área concreta podría predecir futuros brotes por ese serotipo en áreas geográficas próximas16,17. Por tanto, cabría esperar que en los próximos años se produzca un aumento de casos por EV75 en nuestro país y su aparición en otros países de nuestro entorno.
En conclusión, en la actualidad, EV75 está circulando en nuestro medio, asociado tanto a cuadros neurológicos como no neurológicos, sobre todo en niños de corta edad y preferentemente en los meses fríos del año.
Agradecimientos
Agradecemos a Francisca García, María Ángeles Rivera y María José Ruiz su excelente asistencia técnica para la realización de este trabajo.
Correspondencia: Dr. J.M.ª Navarro-Marí.
Servicio de Microbiología, Hospital Universitario Virgen de las Nieves.
Avda. Fuerzas Armadas, 2. 18014 Granada. España.
Correo electrónico: josem.navarro.sspa@juntadeandalucia.es
Manuscrito recibido el 21-12-2006; aceptado el 7-3-2007.