Varón de 44 años con infección por el virus de la inmunodeficiencia humana tipo 1 (VIH-1) en estadio C3 de 4 años de evolución. Diagnosticado a raíz de una tuberculosis ganglionar tratada de modo irregular durante 6 meses con rifampicina, isoniazida, y pirazinamida, sin otra enfermedad oportunista desde entonces. Inició tratamiento antirretroviral en 2004 con lopinavir+ritonavir (400/100mg dos veces al día), tenofovir (300mg al día) y lamivudina (300mg al día) con mal cumplimiento terapéutico. Consulta por cuadro de 1 mes de evolución de cefalea con debilidad muscular y astenia en contexto de abandono del tratamiento, asociado a sensación distérmica y tos no productiva.
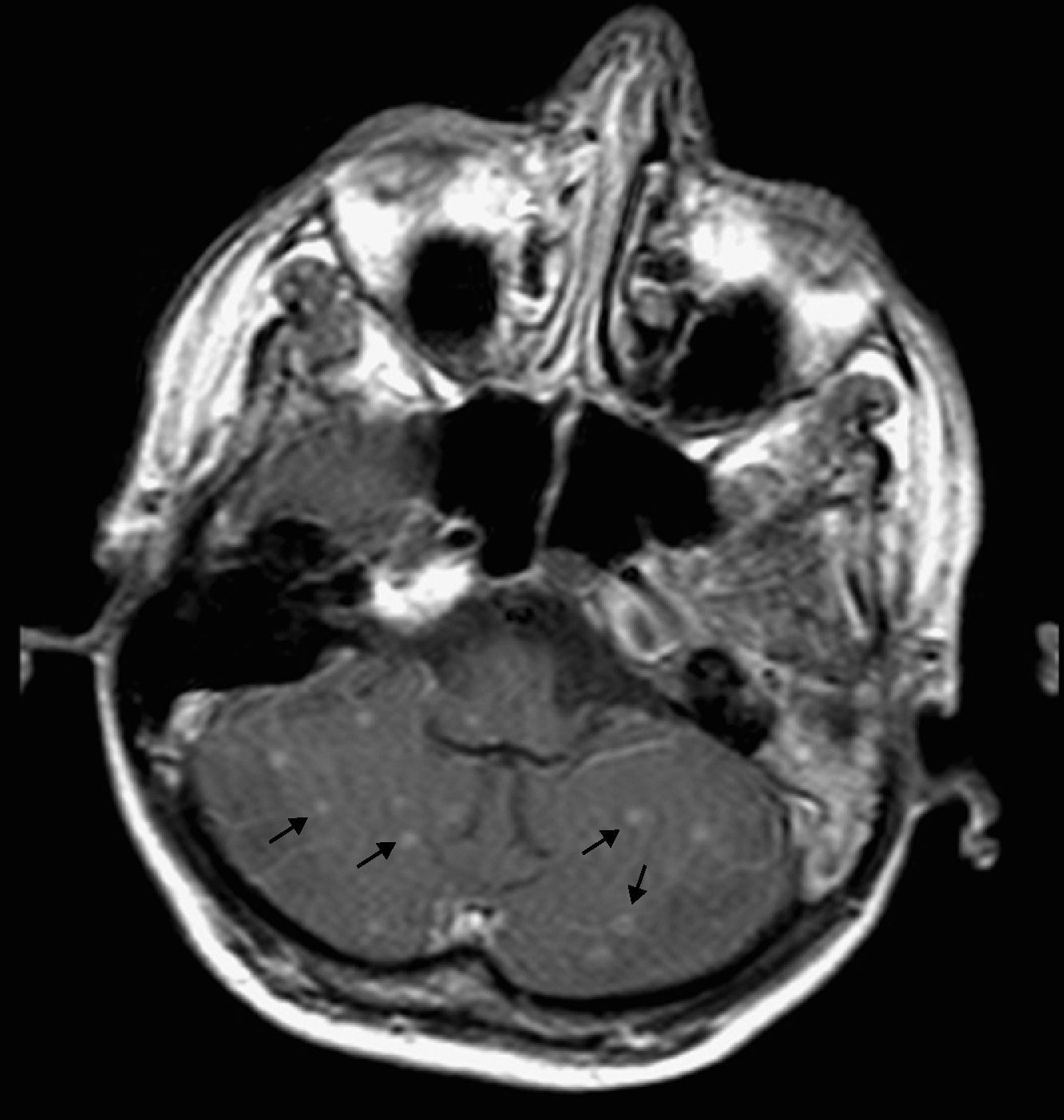
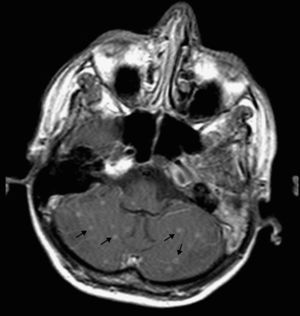
A la exploración física destacaban crepitantes bibasales, sin signos meníngeos. El control analítico mostraba hiponatremia de 126 mEq/l, con un recuento de CD4 de 62 células/μl y una carga viral (CV) plasmática de VIH-1 de 1.800.000 copias/ml. La radiografía de tórax mostraba un patrón alveolointersticial difuso bilateral con engrosamiento hiliar compatible con adenopatías hiliares. Se realizó una TC cerebral que no mostró lesiones ocupantes de espacio. La punción lumbar mostró un LCR cristalino, con 1 leucocito/μl; glucosa, 31mg/dl; proteínas, 0,1g/dl, y ADA, 7,9 U/l. Las tinciones de Gram, Ziehl-Neelsen, tinta china, antígeno criptocócico, los cultivos para bacterias y PCR para virus resultaron negativos. La RM cerebral objetivó múltiples lesiones nodulares infracentrimétricas, supratentoriales e infratentoriales corticales y subcorticales, isointensas y con captación homogénea de contraste sin fondo necrótico central, lo que señalaba lesiones incipientes secundarias a granulomas, sin signos de meningitis (fig. 1). La IgG para Toxoplasma gondii fue positiva (1.400 U/ml), y negativa para cisticercosis. Los hemocultivos, urocultivos y la antigenemia para citomegalovirus también fueron negativos. En la broncoscopia se observó secreción purulenta bronquial difusa, con tinción de Ziehl-Neelsen y auramina negativos. La ecografía abdominal mostró numerosas adenopatías retroperitoneales y en tronco celíaco.
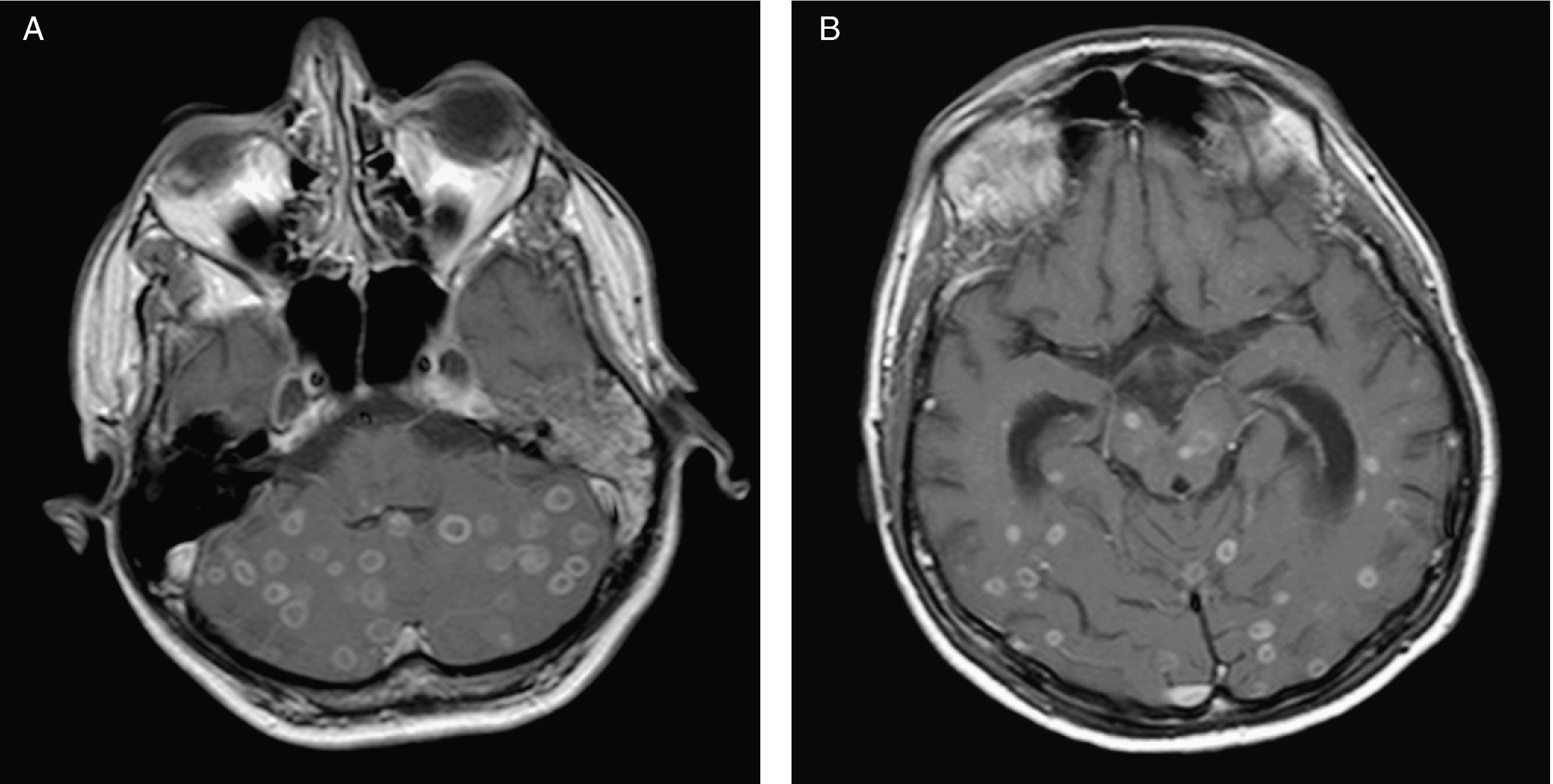
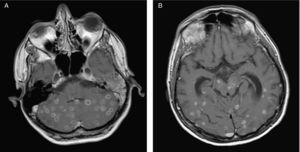
EvoluciónEn el lavado broncoalveolar obtenido por broncoscopia creció Mycobacterium tuberculosis complex (sensible a todos los antituberculosos); el cultivo para Legionella y virus fue negativo. El cultivo en medio de Lowenstein del LCR no resultó valorable debido a un problema técnico. Se inició tratamiento oral con etambutol (20mg/kg/día), pirazinamida (30mg/kg/día), estreptomicina (1g intramuscular/día) e isoniazida (300mg al día), tratamiento antirretroviral (tenofovir, emtricitabina y lopinavir/ritonavir), y profilaxis a días alternos con cotrimoxazol oral (160mg de trimetoprima). Inicialmente se había incluido rifampicina en el régimen, pero debió suspenderse por hepatotoxicidad. Tras un período de mejoría inicial, el paciente presentó a los 2 meses deterioro de la marcha y síndrome cerebeloso izquierdo. Se repitió la RM que mostró un aumento de tamaño de las múltiples lesiones cerebrales respecto al estudio previo, con captación periférica de gadolinio y efecto masa, sin captación central, indicativo de la formación de necrosis central, y compatible con una reacción inflamatoria paradójica de reconstitución inmune (fig. 2). Se inició corticoterapia durante 1 mes (prednisona 1mg/kg/dia por vía oral), con pauta descendiente posterior. La evolución fue favorable con desaparición de toda la sintomatología neurológica y reconstitución de su estado general. Finalizó el tratamiento con antituberculosos a los 18 meses. Actualmente presenta una cifra de CD4 de 403 células/μl y una CV < 50 copias/ml.
Resonancia magnética cerebral de control evolutivo que muestra aumento paradójico de tamaño de las lesiones cerebrales parenquimatosas en cerebelo (a) y hemisferios cerebrales (b) con captación periférica en anillo correspondientes a tuberculomas en el contexto de síndrome inflamatorio de reconstitución inmune.
Encefalitis tuberculosa con múltiples tuberculomas cerebrales y cerebelosos en paciente con infección por VIH y severa depleción linfocitaria. Síndrome inflamatorio de reconstitución inmunológica.
DiscusiónLas infecciones por Mycobacterium tuberculosis y por el VIH están íntimamente relacionadas y la infección por el VIH aumenta el riesgo de desarrollar TBC sintomática en más de 10 veces1,2. Del 5 al 9% de los pacientes con sida desarrollarán TBC y, de estos, de un 2 a un 18% desarrollarán infección tuberculosa en el sistema nervioso central (SNC)3,4. La manifestación más frecuente de TBC en el SNC es la leptomeningitis, cuya localización más habitual es en las cisternas basales, especialmente alrededor del polígono de Willis, aunque no es infrecuente la presencia de encefalitis manifestada como tuberculomas, abscesos o isquemia cerebral e infartos por vasculitis asociada3. Los tuberculomas suelen ser supratentoriales, aunque también pueden ser infratentoriales, o localizarse a nivel subdural, epidural o subaracnoideo. Pueden ser solitarios o múltiples, normalmente con diámetro < 1cm4. Son hiperintensos inicialmente en secuencia T2 de RM cuando están constituidos básicamente por granulomas, pero cuando se produce necrosis caseosa en el interior, presentan una cápsula hiperintensa con captación periférica, con una zona interior isointensa o hipointensa. Los abscesos cerebrales bacterianos, en cambio, suelen captar contraste en anillo, tener diámetro > 3cm y presentarse de forma solitaria y asociados a sepsis o enfermedad otosinusal crónica. Los tuberculomas son 5 veces más frecuentes en coinfectados por VIH-1.
El diagnóstico diferencial se debe realizar con diferentes entidades5. La toxoplasmosis cerebral se presenta en estadios avanzados de infección por VIH (CD4 < 100 cél/ml) y suele comportarse como lesiones ocupantes de espacio (LOE) múltiples en la RM, suelen ser bilaterales y de diámetro > 2-3cm4,5. La localización más frecuente es en núcleos de la base y entre la sustancia blanca y gris, con edema a su alrededor y moderado efecto masa. Es común la presencia de atrofia cerebral asociada por encefalitis por el propio VIH-1. Se produce captación en forma de anillo y suelen ser más irregulares. El linfoma cerebral primario suele manifestarse como una LOE única, con captación heterogénea e irregular del contraste, con signos locales de invasión tisular y evolución tórpida5. La localización más frecuente es en lóbulos frontales y núcleos grises, con cierta predilección por la zona periventricular. La criptococosis es la causa más frecuente de meningitis en pacientes con infección por VIH. Aunque no es frecuente, puede producir asimismo pequeños abscesos cerebrales (criptococomas), habitualmente diagnosticados a través del estudio del LCR debido a la afectación prácticamente universal del LCR por Cryptococcus con clínica meníngea subaguda. La leucoencefalopatía multifocal progresiva (LMP) predomina en la sustancia blanca, aunque en la RM produce lesiones difusas hiperintensas que, a diferencia de la toxoplasmosis y el linfoma, no captan contraste ni producen edema o efecto masa. La encefalitis por citomegalovirus no tiene una imagen radiológica típica, pero no causa LOE. Suele causar cuadros de afectación encefálica difusa, con refuerzo de la capa ependimaria como signo indirecto de presencia de afectación periventricular característica (ventriculitis) o meningitis asociada. Finalmente, los hemocultivos negativos descartan la presencia de émbolos sépticos asociados en el contexto de una sepsis con o sin endocarditis.
El síndrome inflamatorio de reconstitución immunológica (IRIS) suele verse en pacientes infectados por el VIH-1 con severa depleción linfocitaria después del inicio del tratamiento antirretroviral (TAR)6-8. Suele aparecer un empeoramiento clínico de la afección específica inicial a pesar de presentar un aumento de cifras de CD4 y disminución de CV, y recibir un tratamiento antiinfeccioso apropiado. Esto es debido a una respuesta inflamatoria exagerada o desregulación del sistema immunitario ante patógenos subclínicos o ante antígenos biológicos residuales, que tienen como resultado múltiples manifestaciones clínicas8. Las más características incluyen empeoramiento de cualquier lesión tisular producida por micobacterias (tuberculosas o no), como linfadenitis, tuberculomas, derrame pleural, patrón radiológico miliar en tórax (reacciones tuberculosas paradójicas)9,10. También puede producir empeoramiento de la LMP, hipertensión intracraneal grave en criptococosis, desprendimiento retiniano en retinitis por citomegalovirus, y brotes de hepatitis en hepatitis crónica por virus B o C8,11.
Hasta el 25% de los pacientes con VIH+ (33/132) pueden padecer uno o más episodios de IRIS después de haber iniciado TAR. Entre los posibles factores de riesgo están: bajos valores de CD4 antes de iniciar TAR (especialmente < 100 cél/μl), rápida respuesta al TAR (los pacientes con una disminución superior a dos logaritmos en la CV plasmática de VIH-1 después de 90 días de tratamiento tienen mayor riesgo), tener una elevada carga antigénica de alguna infección oportunista y, por último, que exista un intervalo de tiempo muy corto entre el inicio del tratamiento de las infecciones oportunistas y el TAR. Desafortunadamente, no existe un test diagnóstico para el IRIS y el diagnóstico diferencial suele ser complejo y angustioso para el clínico, incluyendo el incumplimiento terapéutico, la aparición de resistencias al TAR, un fallo en el tratamiento contra la infección oportunista, interacciones medicamentosas, toxicidad medicamentosa o incluso la aparición de una nueva infección oportunista. Mycobacterium tuberculosis es el patógeno asociado con más frecuencia a IRIS (hasta el 40% de los pacientes con coinfección tuberculosa-VIH). Las reacciones paradójicas en la afectación del SNC por tuberculosis están bien descritas en VIH negativos e incluyen la expansión de tuberculomas intracraneales, empeoramiento de la meningitis tuberculosa y de las lesiones de canal medular. Asimismo, estos casos también han sido descritos en pacientes con VIH positivo. Esta afectación del SNC presenta una elevada morbimortalidad, especialmente en la criptococosis diseminada11. El tratamiento incluye la utilización de corticosteroides o antiinflamatorios no esteroideos para aliviar los síntomas, especialmente la hipertensión intracraneal, y reducir las secuelas neurológicas. No debe interrumpirse el TAR, puesto que se ha demostrado que su inicio precoz en la tuberculosis reduce la mortalidad global en pacientes con infección por VIH-17.