En este artículo se revisan las infecciones por el virus del herpes simple, herpes zóster y citomegalovirus y se resumen las características más destacadas de los antivirales empleados en su tratamiento. Se indica su dosificación en función de la indicación, el ajuste de dosis en caso de insuficiencia renal o hepática, sus características farmacocinéticas más relevantes, así como sus principales efectos secundarios e interacciones.
This article aims to review herpes simplex, herpes zoster and cytomegalovirus and to summarize the main characteristics of the antiviral drugs available to treat those infections. The review of each drug focuses on dosage according to the treatment indication, dose adjustment in patients with impaired renal or hepatic function, the main pharmacokinetic features, and the most significant adverse effects and drug interactions.
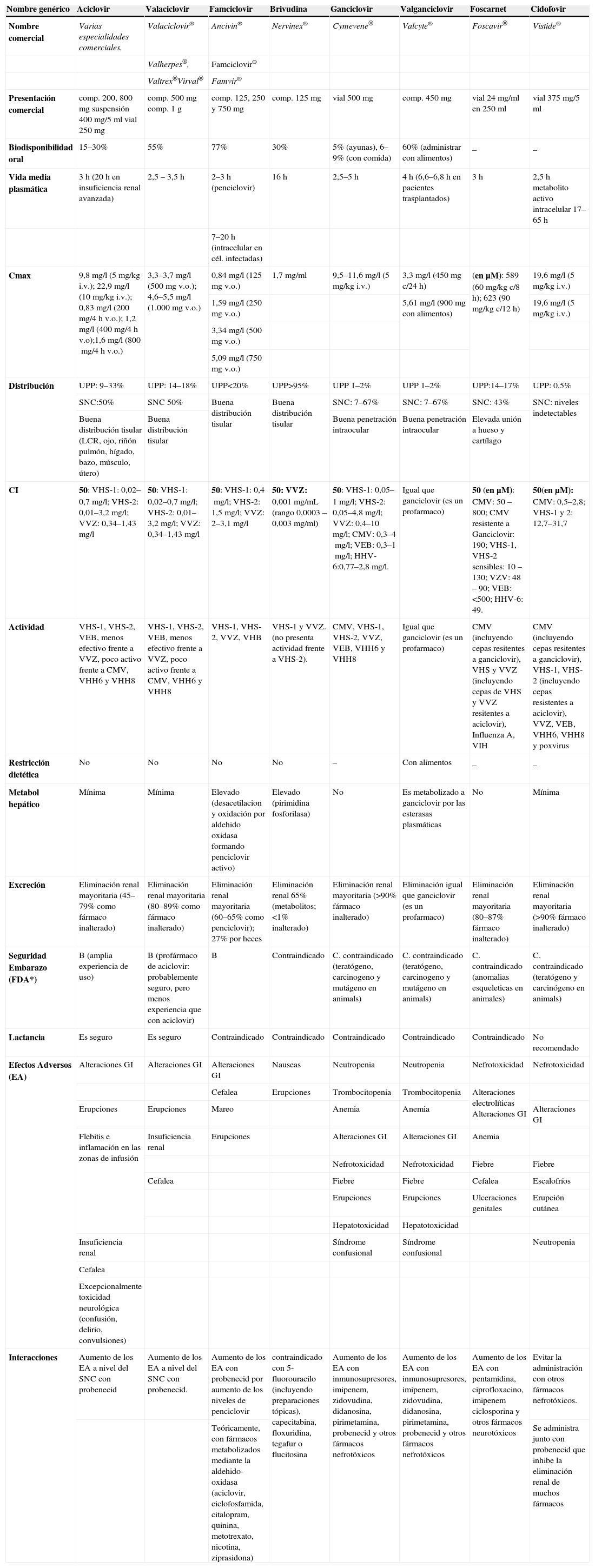
Existe un gran número de enfermedades causadas por virus que pueden afectar en mayor o menor grado a diferentes colectivos dependiendo del estado de su sistema inmunitario. Algunas de ellas pueden ser graves, especialmente en prematuros, ancianos, trasplantados o pacientes con infección por el virus de la inmunodeficiencia humana (VIH). A continuación se revisan las infecciones causadas por el virus del herpes simple, herpes zóster y citomegalovirus, así como antivirales utilizados en su tratamiento en el adulto (tabla 1)1–7. Se describen sus características farmacocinéticas, sus efectos adversos e interacciones, su dosificación en el adulto en sus principales indicaciones (tabla 2)1–23 y los ajustes de dosis en situaciones de insuficiencia renal o hepática (tabla 3)1–6. Se indican asimismo los principales fármacos en investigación.
Características de los antivirales activos frente a herpesvirus y citomegalovirus
| Nombre genérico | Aciclovir | Valaciclovir | Famciclovir | Brivudina | Ganciclovir | Valganciclovir | Foscarnet | Cidofovir |
| Nombre comercial | Varias especialidades comerciales. | Valaciclovir® | Ancivin® | Nervinex® | Cymevene® | Valcyte® | Foscavir® | Vistide® |
| Valherpes®, | Famciclovir® | |||||||
| Valtrex®Virval® | Famvir® | |||||||
| Presentación comercial | comp. 200, 800mg suspensión 400mg/5ml vial 250mg | comp. 500mg comp. 1g | comp. 125, 250 y 750mg | comp. 125mg | vial 500mg | comp. 450mg | vial 24mg/ml en 250 ml | vial 375mg/5 ml |
| Biodisponibilidad oral | 15–30% | 55% | 77% | 30% | 5% (ayunas), 6–9% (con comida) | 60% (administrar con alimentos) | _ | _ |
| Vida media plasmática | 3h (20h en insuficiencia renal avanzada) | 2,5–3,5h | 2–3h (penciclovir) | 16h | 2,5–5h | 4h (6,6–6,8h en pacientes trasplantados) | 3h | 2,5h metabolito activo intracelular 17–65h |
| 7–20h (intracelular en cél. infectadas) | ||||||||
| Cmax | 9,8mg/l (5mg/kg i.v.); 22,9mg/l (10mg/kg i.v.); 0,83mg/l (200mg/4h v.o.); 1,2mg/l (400mg/4h v.o);1,6mg/l (800mg/4h v.o.) | 3,3–3,7mg/l (500mg v.o.); 4,6–5,5mg/l (1.000mg v.o.) | 0,84mg/l (125mg v.o.) | 1,7mg/ml | 9,5–11,6mg/l (5mg/kg i.v.) | 3,3mg/l (450mg c/24h) | (en μM): 589 (60mg/kg c/8h); 623 (90mg/kg c/12h) | 19,6mg/l (5mg/kg i.v.) |
| 1,59mg/l (250mg v.o.) | 5,61mg/l (900mg con alimentos) | 19,6mg/l (5mg/kg i.v.) | ||||||
| 3,34mg/l (500mg v.o.) | ||||||||
| 5,09mg/l (750mg v.o.) | ||||||||
| Distribución | UPP: 9–33% | UPP: 14–18% | UPP<20% | UPP>95% | UPP 1–2% | UPP 1–2% | UPP:14–17% | UPP: 0,5% |
| SNC:50% | SNC 50% | Buena distribución tisular | Buena distribución tisular | SNC: 7–67% | SNC: 7–67% | SNC: 43% | SNC: niveles indetectables | |
| Buena distribución tisular (LCR, ojo, riñón pulmón, hígado, bazo, músculo, útero) | Buena distribución tisular | Buena penetración intraocular | Buena penetración intraocular | Elevada unión a hueso y cartílago | ||||
| CI | 50: VHS-1: 0,02–0,7mg/l; VHS-2: 0,01–3,2mg/l; VVZ: 0,34–1,43mg/l | 50: VHS-1: 0,02–0,7mg/l; VHS-2: 0,01–3,2mg/l; VVZ: 0,34–1,43mg/l | 50: VHS-1: 0,4mg/l; VHS-2: 1,5mg/l; VVZ: 2–3,1mg/l | 50: VVZ: 0,001mg/mL (rango 0,0003 – 0,003mg/ml) | 50: VHS-1: 0,05–1mg/l; VHS-2: 0,05–4,8mg/l; VVZ: 0,4–10mg/l; CMV: 0,3–4mg/l; VEB: 0,3–1mg/l; HHV-6:0,77–2,8mg/l. | Igual que ganciclovir (es un profarmaco) | 50 (en μM): CMV: 50 – 800; CMV resistente a Ganciclovir: 190; VHS-1, VHS-2 sensibles: 10 – 130; VZV: 48 – 90; VEB: <500; HHV-6: 49. | 50(en μM): CMV: 0,5–2,8; VHS-1 y 2: 12,7–31,7 |
| Actividad | VHS-1, VHS-2, VEB, menos efectivo frente a VVZ, poco activo frente a CMV, VHH6 y VHH8 | VHS-1, VHS-2, VEB, menos efectivo frente a VVZ, poco activo frente a CMV, VHH6 y VHH8 | VHS-1, VHS-2, VVZ, VHB | VHS-1 y VVZ. (no presenta actividad frente a VHS-2). | CMV, VHS-1, VHS-2, VVZ, VEB, VHH6 y VHH8 | Igual que ganciclovir (es un profarmaco) | CMV (incluyendo cepas resitentes a ganciclovir), VHS y VVZ (incluyendo cepas de VHS y VVZ resitentes a aciclovir), Influenza A, VIH | CMV (incluyendo cepas resitentes a ganciclovir), VHS-1, VHS-2 (incluyendo cepas resistentes a aciclovir), VVZ, VEB, VHH6, VHH8 y poxvirus |
| Restricción dietética | No | No | No | No | – | Con alimentos | _ | _ |
| Metabol hepático | Mínima | Mínima | Elevado (desacetilacion y oxidación por aldehido oxidasa formando penciclovir activo) | Elevado (pirimidina fosforilasa) | No | Es metabolizado a ganciclovir por las esterasas plasmáticas | No | Mínima |
| Excreción | Eliminación renal mayoritaria (45–79% como fármaco inalterado) | Eliminación renal mayoritaria (80–89% como fármaco inalterado) | Eliminación renal mayoritaria (60–65% como penciclovir); 27% por heces | Eliminación renal 65% (metabolitos;<1% inalterado) | Eliminación renal mayoritaria (>90% fármaco inalterado) | Eliminación igual que ganciclovir (es un profarmaco) | Eliminación renal mayoritaria (80–87% fármaco inalterado) | Eliminación renal mayoritaria (>90% fármaco inalterado) |
| Seguridad Embarazo (FDA*) | B (amplia experiencia de uso) | B (profármaco de aciclovir: probablemente seguro, pero menos experiencia que con aciclovir) | B | Contraindicado | C. contraindicado (teratógeno, carcinogeno y mutágeno en animals) | C. contraindicado (teratógeno, carcinogeno y mutágeno en animals) | C. contraindicado (anomalias esqueleticas en animales) | C. contraindicado (teratógeno y carcinógeno en animals) |
| Lactancia | Es seguro | Es seguro | Contraindicado | Contraindicado | Contraindicado | Contraindicado | Contraindicado | No recomendado |
| Efectos Adversos (EA) | Alteraciones GI | Alteraciones GI | Alteraciones GI | Nauseas | Neutropenia | Neutropenia | Nefrotoxicidad | Nefrotoxicidad |
| Cefalea | Erupciones | Trombocitopenia | Trombocitopenia | Alteraciones electrolíticas Alteraciones GI | ||||
| Erupciones | Erupciones | Mareo | Anemia | Anemia | Alteraciones GI | |||
| Flebitis e inflamación en las zonas de infusión | Insuficiencia renal | Erupciones | Alteraciones GI | Alteraciones GI | Anemia | |||
| Nefrotoxicidad | Nefrotoxicidad | Fiebre | Fiebre | |||||
| Cefalea | Fiebre | Fiebre | Cefalea | Escalofríos | ||||
| Erupciones | Erupciones | Ulceraciones genitales | Erupción cutánea | |||||
| Hepatotoxicidad | Hepatotoxicidad | |||||||
| Insuficiencia renal | Síndrome confusional | Síndrome confusional | Neutropenia | |||||
| Cefalea | ||||||||
| Excepcionalmente toxicidad neurológica (confusión, delirio, convulsiones) | ||||||||
| Interacciones | Aumento de los EA a nivel del SNC con probenecid | Aumento de los EA a nivel del SNC con probenecid. | Aumento de los EA con probenecid por aumento de los niveles de penciclovir | contraindicado con 5-fluorouracilo (incluyendo preparaciones tópicas), capecitabina, floxuridina, tegafur o flucitosina | Aumento de los EA con inmunosupresores, imipenem, zidovudina, didanosina, pirimetamina, probenecid y otros fármacos nefrotóxicos | Aumento de los EA con inmunosupresores, imipenem, zidovudina, didanosina, pirimetamina, probenecid y otros fármacos nefrotóxicos | Aumento de los EA con pentamidina, ciprofloxacino, imipenem ciclosporina y otros fármacos neurotóxicos | Evitar la administración con otros fármacos nefrotóxicos. |
| Teóricamente, con fármacos metabolizados mediante la aldehido-oxidasa (aciclovir, ciclofosfamida, citalopram, quinina, metotrexato, nicotina, ziprasidona) | Se administra junto con probenecid que inhibe la eliminación renal de muchos fármacos |
CI50/90: concentración inhibitoria 50/90%; Cmax: concentracion plasmática máxima; CMV: citomegalovirus; EA: efectos adversos; GI: gastrointestinal; LCR: líquido cefalorraquídeo; SNC: sistema nerviosos central; VHS: virus del herpes simple; VVZ: virus de la varicela-zóster.
*Categorías seguridad embarazo (FDA): A: ausencia de riesgos para el feto; B:no teratogenicidad en animales, falta de estudios en humanos; C: no datos de seguridad en embarazadas y los estudios en animales muestran toxicidad fetal o no se han realizado y no deben utilizarse dichos fármacos, a menos que el beneficio potencial supere el posible riesgo fetal.
Principales enfermedades víricas: dosificación de los antivirales en pacientes adultos con función renal normal (si insuficiencia renal, ver tabla 3).
| Indicación | Grupo de población | Fármaco | Dosis | Vía | Duración | Comentarios |
| Virus del Herpes Simple. | ||||||
| Herpes simple oro-labial primario. Tratamiento | Inmunocompetentes | En general no suele requerir tratamiento. En los casos más leves pueden emplearse los antivirales tópicos y en los más graves, los antivirales orales a las mismas dosis que para el tratamiento de las recurrencias (ver apartado correspondiente) | ||||
| Herpes simple genital primario. Tratamiento | Inmunocompetentes | Aciclovirb,c | 5mg/kg c/8h | i.v. | 5–7 días | Todos los pacientes deben ser tratados y el tratamiento debe ser iniciado de forma temprana para obtener un resultado óptimo (primeras 48h) |
| Aciclovire | 200mg 5 veces al día (cada 4h excepto noche) o 400mg c/8h (si malabsorción 400mg 5 veces al día) | Oral | 5 días, pudiéndose alargar dependiendo de la situación clínica. (en EEUU: 10 dias, pudiéndose alargar si no se ha conseguido la curación) | No se recomiendan los preparados tópicos por su escasa efectividad. | ||
| Valaciclovire | 500mg c/12h (en EE.UU.: 1g c/12h) | Oral | En mujeres embarazadas con herpes genital, cuando se adquiere la infección durante el primer o segundo trimestre es preferible tratar con aciclovir oral o i.v. Si se adquiere después de la semana 34 de gestación y en los casos de herpes recurrente, debe considerarse la cesarea para reducir el riesgo de transmisión materno-fetal | |||
| Famciclovire | 250mg c/8h | Oral | ||||
| Herpes mucocutáneo. Tratamiento | Pacientes inmunodeprimidos o enfermedad grave | Aciclovirb,c | 250mg/m2 c/8h o 5–10mg/kg c/8h (según NCCN hasta 12,5mg/kg c/8h si enfermedad diseminada) | i.v. | 7–14 días, o hasta curación de las lesiones en casos graves. | |
| VIH: 5mg/kg c/8h | ||||||
| Aciclovire | 400mg 5 veces al día | Oral | ||||
| VIH: 400mg c/8h ó 200mg 5 veces al día. | ||||||
| Valaciclovire | 1g c/6–8h VIH:1g c/12h | Oral | ||||
| Famciclovire | 500mg c/12h o 250mg c/8h (VIH: misma dosis) | Oral | ||||
| Encefalitis por VHS. Tratamiento | Aciclovirb,c | 10–15mg/kg c/8h | i.v. | 14–21 días | Duración mínima 14 días (se han descrito recaídas con tratamientos cortos) | |
| Infecciones herpéticas oculares (VHS ó VVZ). Tratamiento | Aciclovir 3% pomada oftálmica | 5 veces al día (cada 4h excepto noche) | Tópica ocular | Hasta 3 días después de la curación | Interconsulta con oftalmólogo | |
| Asociar con corticoides tópicos. La queratitis herpética puede requerir tratamiento sistémico | ||||||
| Sospecha de VHS resistente. Tratamiento | Foscarnetf | 40mg c/8h o 60mg c/12h | i.v. | 2–3 semanas o hasta curación | En algunos casos, puede emplarse tratamiento tópico con foscarnet al 2,4% (fomentos de 20min c/12h) o cidofovir al 1% c/24h (fórmula magistral) | |
| En caso de infección sistémica por un virus resistente a aciclovir y foscarnet, puede considerarse la administración de cidofovir intravenoso (excepto si encefalitis) | ||||||
| VHS labial recurrencias. Tratamiento | Inmunocompetentes | Aciclovire | 200–400mg 5 veces al día (cada 4h excepto noche) | Oral | 5 días (hasta 10 días si episodio primario) | Los preparados tópicos tienen una efectividad modesta y se reservan a las afecciones leves y localizadas: aciclovir 5% cada 4 horas excepto noche durante 5 días o penciclovir 1% cada 2 horas excepto noche durante 4 días |
| Valaciclovire | 500g c/12h Pauta corta: 2g c/12h | Oral | 5 días Pauta corta: 1 día (2 dosis) | Es necesario iniciar el tratamiento de forma precoz, por lo que se recomienda que el paciente disponga de medicación en su domicilio | ||
| Famciclovire | 1500mg | Oral | dosis única | |||
| VHS genital recurrencias. Tratamiento | Inmunocompetentes | Aciclovire | 200mg 5 veces al día (cada 4h excepto noche) o 400mg c/8h o 800mg c/12h | Oral | 5 días | Iniciar tratamiento en fase prodrómica o cuando aparezcan los primeros síntomas, por lo que se recomienda que el paciente disponga de medicación en su domicilio |
| Valaciclovire | 500mg c/12h | Oral | 3–5 días (en un Ensayo Clínico no se observaron diferencias entre 3 y 5 días) | No se recomiendan los preparados tópicos por su escasa efectividad | ||
| Famciclovire | Según ficha técnica, 125mg c/12h (se han empleado dosis de 125 a 500mg c/12h) | Oral | 5 días | |||
| Pauta corta: 1g c/12h×1 dia | Pauta corta: 1 día | |||||
| Herpes mucocutáneo Recurrencias. Tratamiento | Pacientes inmunodeprimidos (en pacientes con infección por el VIH, se prefiere la terapia supresora) | Aciclovire | 200mg 5 veces al día o 400mg c/8h. | Oral | 7–10 días VIH: 14 días | Iniciar las primeras 48h. La duración puede ser mayor en función de la resolución de los síntomas |
| Aciclovirb,c | 5mg/kg c/8h | i.v. | ||||
| Valaciclovire | 1g c/12h | Oral | No hay datos sobre la efectividad y seguridad de las pautas cortas con famciclovir en pacientes inmunodeprimidos | |||
| Famciclovire | 500mg c/12h | Oral | ||||
| Herpes genital recurrente. Terapia supresora. (si aparecen más de 6 episodios/año, las recurrencias son graves o no presentan prodromos claros) | Inmunocompetentes | Aciclovire | 400mg c/12h Reducir dosis a lo largo del tiempo: en algunos pacientes es suficiente con 200mg c/12–8h | Oral | Hasta 6–12 meses | A los 6–12 meses, suspender tratamiento hasta que se produzcan 2 recurrencias en 6–12 meses |
| Valaciclovire | Si recurrencias frecuentes (⩾10 episodios/año): 250mg c/12h (mas eficaz que 500mg c/24h en este subgrupo). (1g c/24h en EEUU) | Oral | Si ⩾10 recurrencias anuales, usar la misma pauta que para inmunodeprimidos | |||
| Si <10 recurrencias/año: 500mg c/24h. | Es importante mantener una adecuada adherencia al tratamiento y que los intervalos entre dosis se mantengan estables (p. ej. en pautas c/12h no dejar transcurrir más de 12h) para que no se produzcan intervalos de tiempo con concentraciones bajas de fármaco | |||||
| Famciclovire | 250mg c/12h | Oral | ||||
| Inmunodeprimidos | Aciclovire | 400mg c/8h o 800mg c/12h | Oral | |||
| VIH: misma pauta | ||||||
| Valaciclovire | 500mg/12h (en VIH se han empleado también pautas de 1000mg/24h) | Oral | ||||
| Famciclovire | 500mg/12h VIH: 250mg c/12h | Oral | ||||
| Herpes labial recurrente. Terapia supresora. | Inmunocompetentes | Aciclovire | 400mg c/12h | Oral | 4 meses | |
| Valaciclovire | 500mg c/24h | Oral | ||||
| Famciclovire | 250mg c/12h | Oral | ||||
| Profilaxis del herpes simple | Inmunodeprimidos: Sida | Profilaxis primaria: según el panel de expertos de GESIDA/PNS, la profilaxis primaria del VHS en pacientes con infección por el VIH no está indicada | ||||
| Ptofilaxis secundaria: en pacientes con recidivas frecuentes (>6/año) o graves ver terapia supresora del herpes recurrente en pacientes inmunodeprimidos | ||||||
| Inmunodeprimidos (TPH, si donante o receptor seropositivos para VHS) (si se requiere profilaxis para CMV, ver apartado correspondiente: La profilaxis para CMV es activa frente a VHS y VVZ) | Aciclovirb,c,e | IV: 250mg/m2/dosis c/12h VO: 400mg c/6h o 800mg/12h | iv/ Oral | Desde el inicio del acondicionamiento hasta el implante o hasta resolución de la mucositis (como mínimo durante 30 días). Debe considerarse una mayor duración en pacientes sometidos a alo-TPH con EICH o reactivaciones frecuentes del VHS antes del trasplante | Estas pautas también podrían emplearse en pacientes con malabsorción intestinal | |
| Valaciclovire | 500mg c/8–12h | Oral | Según el NCCN el riesgo es intermedio para el auto-TPH (se recomienda profilaxis solo en algunos pacientes con elevado riesgo de mucositis) y elevado para el alo-TPH (se recomienda profilaxis). En alo-TPH existe más experiencia con aciclovir y valaciclovir que con famciclovir | |||
| Inmunodeprimidos – TOS (La profilaxis para CMV es activa frente a VHS y VVZ) | Aciclovire | 200–400mg c/8–12h | Oral | Entre 30 y 90 días post-trasplante | ||
| Inmunodeprimidos seropositivos para VHS: QT estándar en tumores sólidos (ver comentarios), leucemias agudas (inducción/consolidación) linfomas, mieloma múltiple, LLC, QT con análogos de purina (fludarabina, 2-Cda.), QT con alemtuzumab | Aciclovire | 400mg c/6h o 800mg/12h | Oral | Durante la neutropenia (ver comentarios) | Según el NCCN, en general en la QT estándar para tumores sólidos el riesgo es bajo y no requieren profilaxis a no ser que hayan presentado episodios previos de infección por el VHS | |
| Valaciclovire | 500mg c/8–12h | Oral | En QT con alemtuzumab: como mínimo hasta 2 meses después de la administración (mantener hasta CD4⩾ 200 cél./mm3) | Según el NCCN el riesgo es intermedio para pacientes sometidos a QT para el tratamiento de linfomas, mieloma múltiple, LLC o que reciban QT con dosis altas de corticoides o análogos de purina. En estos casos, puede considerarse la profilaxis. Si el paciente desarrolla una reactivación de la infección por el VHS que requiera tratamiento, se recomienta profilaxis en los episodios posteriores de neutropenia | ||
| Famciclovire (ver comentarios) | 250mg c/12h | Oral | Según el NCCN el riesgo es elevado para pacientes sometidos a QT para leucemias agudas (inducción/consolidación) y en caso de QT con alemtuzumab, por lo que debe realizarse profilaxis para VHS | |||
| Famciclovir: ausencia de datos en pacientes oncológicos (NCCN) | ||||||
| Varicela y herpes zoster | ||||||
| Tratamiento de la varicela | En pacientes inmunocompetentes si no nuevas vesículas en las 24–48h anteriores ni criterios de gravedad | Sólo tratamiento sintomático y observación por si aparecieran criterios de gravedad. | ||||
| Intravenoso si: a) gestación >36/40 semanas o riesgo de parto prematuro o con criterios de gravedad. b) infección grave c) pacientes inmunodeprimidos | Aciclovirb,c | 10mg/kg c/8h o 500mg/m2 c/8h | i.v. | 7–10 días. Puede requerir tratamiento más prolongado en función de la sintomatología | Varicela durante el embarazo: el fármaco de elección es aciclovir 10–15mg/kg c/8h IV, seguido de aciclovir oral 800mg 5 veces al día x7–10días | |
| En caso de infección grave, se han utilizado hasta 15mg/kg c/8h | Necrosis de la retina: considerar aciclovir 10–15mg/kg c/8h IV x10–14 días, seguido de valaciclovir 1g c/8h oral x4–6 semanas | |||||
| Necrosis retiniana externa rápidamente progresiva en pacientes con infección por el VIH: emplear combinaciones de aciclovir o ganciclovir intravenoso con foscarnet. En algunos casos, puede considerarse también tratamiento intravítreo. | ||||||
| Oral si no se cumplen los criterios para terapia intravenosa y han aparecido nuevas vesículas en las últimas 24–48h. Embarazo: ver comentarios | Aciclovire | 800mg c/4h excepto noche (también se han utilizado pautas de c/6h) | Oral | 5–7 días | Idealmente, iniciar dentro de las primeras 24h de la aparición de la erupción. Dado que es difícil, en general se considera un periodo de 24–48h | |
| Valaciclovire | 1g c/8–12h | Casos graves o pacientes inmunodeprimidos: 7–14 días | ||||
| Casos graves o pacientes inmunodeprimidos: 1g c/8h | En el embarazo, si gestación <36/40 semanas sin riesgo de parto prematuro ni criterios de gravedad es de elección el aciclovir oral | |||||
| Famciclovire | 500mg c/8h | Por vía oral y en ausencia de embarazo se prefieren valaciclovir y famciclovir por su mejor biodisponibilidad en comparación con aciclovir | ||||
| Tratamiento del herpes zóster | Inmunocompetentes | Aciclovirb,c | 5mg/kg c/8h | i.v. | 5–7 días | Se recomienda iniciar el tratamiento en las primeras 72h. Iniciar después de 72h en algunos casos (nuevas vesículas tras 7 días de tratamiento, ⩾ 50 años, dolor intenso o síntomas neurológicos, afectación ocular o visceral-encefalitis, neumonitis) |
| Aciclovire | 800mg 5 veces al día (cada 4 horas excepto noche) (en EE.UU. 500mg c/8h) | Oral | 7 días | Con una duración mayor de 7 días parece que se obtiene un beneficio mínimo. Considerar duración superior en algunos casos (nuevas vesículas tras 7 días de tratamiento, complicaciones cutáneas, motoras, oculares o neurológicas) | ||
| Valaciclovire | 1g c/8h | Oral | 7 días | Por vía oral en pacientes no embarazadas se prefieren valaciclovir y famciclovir por su mejor biodisponibilidad) | ||
| Famciclovire | 250mg c/8h o 750mg c/24h (500mg c/8h en EEUU) | Oral | 7 días | El uso de corticoides (siempre junto con antiviricos) reduce el dolor agudo inicial (prednisona 60mg/día x7 días, seguido de 30mg/día x7 días y 15mg/día x7 días), pero no hay evidencia de que reduzca la neuralgia postherpética. Se puede considerar en caso de parálisis facial, afectación oftálmica o paciente anciano con dolor intenso inicial. No hay datos sobre su empleo en pacientes con infección por el VIH, por lo que no se recomienda su uso en estos pacientes (Gesida no recomienda el uso de corticoides en herpes zoster localizado) | ||
| Brivudina | 125mg/24h | Oral | 7 días (no debe administrarse más de un ciclo de brivudina) | Brivudina no debe administrarse conjuntamente con 5-fluorouracilo (incluyendo preparados tópicos y profármacos) | ||
| Si afectación oftálmica, interconsulta con un oftalmólogo. No se recomienda el uso tópico de antivíricos por falta de efectividad | ||||||
| Tratamiento del herpes zóster | Pacientes inmunodeprimidos (enfermedades linfoproliferativas, trasplantados, VIH, tratamiento con corticoides). Ver comentarios | Aciclovirb,c | 10mg/kg c/8h o 500mg/m2/dosis c/8h (según NCCN hasta 12,5mg/kg c/8h si enfermedad diseminada) | i.v. | 7 días Puede requerir se tratamiento más prolongado (hasta resolución de las lesiones en zoster diseminado o con afectación visceral o VIH con necrosis retiniana) | Utilizar aciclovir intravenoso en caso de inmunodepresión grave (sometidos a TPH dentro de los 4 primeros meses post-TPH, TPH con enfermedad del injerto contra el huésped moderada-grave o pacientes trasplantados sometidos a terapia inmunodepresora agresiva), pacientes con sospecha de diseminación visceral (encefalitis, neumonitis) zoster oftálmico |
| Encefalitis: considerar terapia coadyuvante con corticoides. Como alternativa a aciclovir puede emplearse ganciclovir. No se recomienda el uso de cidofovir debido a su escasa penetración en el SNC. | ||||||
| Necrosis retiniana rápidamente progresiva en VIH: considerar asociación de aciclovir 10mg c/8h I.V.+ foscarnetf 60mg/kg c/8h I.V. Otras opciones: ganciclovirg 5mg/kg c/12h+foscarnetf 60mg/kg c/8h I.V ó cidofovirj (± antivíricos intravítreos). Duración óptima de tratamiento no claramente establecida | ||||||
| Aciclovire | 800mg 5 veces al día VIH: 800mg c/6h | Oral | 7–10 días, o hasta resolución de las lesiones en casos graves | En pacientes menos inmunodeprimidos o los gravemente inmunodeprimidos tras el tratamiento intravenoso, puede valorarse terapia oral | ||
| Valaciclovire | 1g c/8h | Oral | Brivudina, debido al riesgo de interacción grave/mortal con 5-fluorouracilo, no se recomienda en pacientes inmunodeprimidos | |||
| Famciclovire | 500mg c/8h | Oral | En los pacientes con infección por el VIH, debido al riesgo de recaída, debe mantenerse el tratamiento hasta la curación de las lesiones (habitualmente más de los 7–10 días habituales). En estos pacientes no se recomienda el tratamiento con corticoides. | |||
| Sospecha de resistencia VVZ. Tratamiento | Foscarnetf | 40mg c/8h o 60mg c/12h | i.v. | 2–3 semanas o hasta curación | Foscarnetf: evitar en insuf renal moderada a grave. Reducir dosis en caso de IR leve. (Tabla 3) Asegurar hidratación adecuada y monitorizar función renal y electrolitos | |
| Ganciclovirg+Foscarnetf | Ganciclovir: 5mg/kg c/12h | i.v. | ||||
| Foscarnet: 60mg/kg c/8h | ||||||
| Profilaxis VVZ | Pacientes inmunodeprimidos -TPH, si donanto o receptor seropositivos para VVZ) (si se requiere profilaxis para CMV, ver apartado correspondiente) | Aciclovirb,c,e | 250mg/m2 c/12h | i.v. | No existe unanimidad. Algunos grupos realizan profilaxis desde inicio del acondicionamiento y durante 30 días | Ver también profilaxis CMV en TPH |
| 400mg c/6h o 800mg/12h | Oral | Algunos grupos no realizan la profilaxis con aciclovir para el VVZ debido al largo periodo de riesgo. | ||||
| Valaciclovire | 500mg c/8–12h | Oral | En el alo-TPH, el NCCN recomienda mantener la profilaxis hasta el 1.° año post-TPH y considerar un periodo mayor en los pacientes que continúen recibiendo terapia inmunodepresora. Según NCCN la profilaxis puede considerarse en auto-TPH | Algunos grupos emplean la vacunación pre-trasplante. No debe emplearse post-trasplante dado que contiene virus atenuados. | ||
| Profilaxis post-exposición tras contactos de riesgo en pacientes seronegativos: inmunoglobulina específica (Varitect®) 1ml (25 UI)/kg o inmunoglobulina insespecífica IV (Flebogamma® y Endobulin®, entre otras) 100–200mg/kg (en algunos lugares se emplean dosis mayores, hasta 400mg/kg).m Administrar dentro de las 96h (preferiblemente 48h) posteriores al contacto. No es necesario administrarla si el paciente ha recibido inmunoglobulinas inespecíficas IV en las 3 semanas previas a la exposición | ||||||
| Contacto de riesgo: contacto de más de 15 minutos en la misma habitación o 5 minutos en una conversación cara a cara con un paciente afecto de varicela susceptible de transmitir la enfermedad (desde 48h antes de la aparición del exantema cutáneo hasta la formación de costras en las lesiones) o bien el contacto con un paciente afecto de herpes zoster diseminado o con lesiones cutáneas activas (úlceras y vesículas) | ||||||
| Profilaxis VVZ | Inmunodeprimidos-TOS (si se requiere profilaxis para CMV, ver apartado correspondiente: La profilaxis para CMV es activa frente a VHS y VVZ) | Aciclovire | 200–400mg c/8–12h | Oral | Entre 30 y 90 días post-trasplante | Vacunación con la cepa atenuada como mínimo de 4 a 6 semanas antes del trasplante (contraindicada en el postrasplante). Deben vacunarse también las personas que convivan con estos pacientes y sean susceptibles. |
| Profilaxis postexposición tras contactos de riesgo en pacientes seronegativos: inmunoglobulina específica (Varitect®) 1ml (25 UI)/kg o inmunoglobulina insespecífica I.V. (Flebogamma® y Endobulin®, entre otras) 100–200mg/kg (en algunos lugares se emplean dosis mayores, hasta 400mg/kg)m. Administrar dentro de las 96h (preferiblemente 48h) posteriores al contacto. | ||||||
| Contacto de riesgo: contacto de más de 15 minutos en la misma habitación o 5 minutos en una conversación cara a cara con un paciente afecto de varicela susceptible de transmitir la enfermedad (desde 48h antes de la aparición del exantema cutáneo hasta la formación de costras en las lesiones) o bien el contacto con un paciente afecto de herpes zoster diseminado o con lesiones cutáneas activas (úlceras y vesículas). | ||||||
| Inmunodeprimidos seropositivos para VVZ: QT en linfomas, mieloma múltiple, LLC, QT con análogos de purina (fludarabina, 2-Cda.), QT con alemtuzumab | Aciclovirb,c,e | 250mg/m2 c/12h | i.v. | Durante la neutropenia | Según en NCCN el riesgo es elevado para la QT con alemtuzumab y se recomienda realizar profilaxis. | |
| 400mg c/6h o 800mg/12h | Oral | En QT con alemtuzumab, el NCCN recomienda como mínimo hasta 2 meses después de la administración (mantener hasta CD4⩾ 200 cél/mm3) | El riesgo es intermedio para QT en linfomas, mieloma múltiple, LLC, QT con análogos de purina (fludarabina, 2-Cda.), inhibidores de la calcineurina (ciclosporina, tacrolimus) y bortezomib. En estos casos la profilaxis puede considerarse | |||
| Valaciclovire | 500mg c/8–12h | Oral | ||||
| Famciclovire (ver comentarios) | 250mg c/12h | Oral | Famciclovir: ausencia de datos en pacientes oncológicos (NCCN). | |||
| Pacientes inmunodeprimidos -VIH Pacientes susceptibles a VVZ que han tenido un contacto de riesgo (ver comentarios) | 1.a opción: Inmunoglobulina anti-VVZ i.m. dentro de las 96h posteriores al contacto | 1ml (25 UI)/kg | i.v. | Profilaxis post-exposición tras contactos de riesgo en pacientes seronegativos: inmunoglobulina específica (Varitect®) 1ml (25 UI)/kg o inmunoglobulina insespecífica IV (Flebogamma® y Endobulin®, entre otras) 100–200mg/kg (en algunos lugares se emplean dosis mayores, hasta 400mg/kg)m | ||
| Administrar dentro de las 96h (preferiblemente 48h) posteriores al contacto | ||||||
| No debe emplearse la vacuna en pacientes con infección por el VIH muy inmunodeprimidos, dado que contiene virus atenuados. Sí deben vacunarse las personas que convivan con estos pacientes y sean susceptibles | ||||||
| 2.a opción: Aciclovire | 800mg 5 veces al día | Oral | 7 días | Contacto de riesgo: contacto de más de 15 minutos en la misma habitación o 5 minutos en una conversación cara a cara con un paciente afecto de varicela susceptible de transmitir la enfermedad (desde 48h antes de la aparición del exantema cutáneo hasta la formación de costras en las lesiones) o bien el contacto con un paciente afecto de herpes zoster diseminado o con lesiones cutáneas activas (úlceras y vesículas) | ||
| Citomegalovirus | ||||||
| Enfermedad aguda por CMV, incluyendo retinitis, neumonitis, colitis esofagitis, y otras afectaciones viscerales o infecciones sistémicas graves. Tratamiento | De elección: | Ganciclovirg | Inducción: 5mg/kg c/12h | i.v. | Inducción: VIH-retinitis: 2–3 semanas | Monitorizar función renal y electrolitos |
| Mantenimiento: 5mg/kg/día 7 días por semana o 6mg/kg/día 5 días por semana | En retinitis, junto con implantes oculares de ganciclovir | |||||
| Inducción: neumonitis, colitis o esofagitis: 3–6 semanas o hasta resolución de los síntomas Después pauta de mantenimiento (duración variable: 4 semanas en neumonitis; según recuento de CD4 en VIH) | El panel de expertos de GESITRA-SEIMC y RESITRA recomienda en caso de neumonía por CMV en pacientes sometidos a TPH, asociar ganciclovir I.V. a dosis altas de inmunoglobulina inespecífica intravenosa 500mg/kgm a días alternos (en total 7–10 dosis), seguido de 500mg/kg por semana otras 4 semanas (junto con terapia de mantenimiento con ganciclovir). En cambio, no se recomienda para otro tipo de infecciones por CMV | |||||
| En enfermedad gastrointestinal por CMV la utilidad de una pauta de mantenimiento no ha sido establecida. Considerar si enfermedad grave o recaída. | ||||||
| VIH: mantener pauta de mantenimiento hasta CD4>200/μl durante al menos 6 meses y, en algunos casos, puede considerarse la suspensión entre 100 y 200/μl. | ||||||
| Valganciclovirh (en investigación para la indicación de tratamiento en pacientes trasplantados, farmacocinética favorable) | Inducción: 900mg c/12h | Oral | Inducción: | Dado que se considera potencialmente teratógeno y carcinógeno, se recomienda especial precaución para los cuidadores que manipulen los comprimidos: manipular con guantes (evitar el contacto directo de comprimidos rotos o triturados con piel y mucosas. En caso de producirse lavar abundantemente) | ||
| Mantenimiento: 900mg c/24h | Retinitis: 2–3 semanas | En retinitis, junto con implantes oculares de ganciclovir | ||||
| Colitis o esofagitis: 3–6 semanas o hasta resolución de los síntomas | En enfermedad gastrointestinal no emplear si los síntomas son suficientmente graves como para impedir su absorción | |||||
| Después pauta de mantenimiento | En enfermedad gastrointestinal la utilidad de una pauta de mantenimiento no ha sido establecida. Considerar si enfermedad grave o recaída | |||||
| Ganciclovir implantes intravítreos para retinitis por CMV | 1 implante de 4,5mg (asociado a terapia sistémica) | Intravítreo | Un implante dura de 5 a 8 meses. Sustituir cuando se aprecie progresión de la retinitis | Utilizar los implantes intravítreos en combinación con valganciclovirh 900mg c/24h para evitar la infección del ojo contralateral | ||
| Alternativas: | Foscarnetf (activo frente a cepas resistentes a ganciclovir) | Retinitis: Inducción: 60mg/kg c/8h o 90mg/kg c/12h | i.v. | Inducción:Retinitis: 2–3 semanas | Valorar foscarnet en pacientes con clínica o viremia persitentes a pesar de tratamiento con ganciclovir o valganciclovir, aparición de sintomatología en paciente bajo profilaxis de larga duración con ganciclovir o valganciclovir y en pacientes con leucopenia grave que no puedan recibir ganciclovir | |
| Infecciones extraoculares: 90mg/kg c/12h | Neumonitis, colitis o esofagitis: 3–6 semanas o hasta resolución de los síntomas | El panel de expertos de GESITRA-SEIMC y RESITRA recomienda en caso de neumonía por CMV en pacientes sometidos a TPH, asociar ganciclovir I.V. a dosis altas de inmunoglobulina inespecífica intravenosa 500mg/kgm a días alternos (en total 7–10 dosis), seguido de 500mg/kg por semana otras 4 semanas (junto con terapia de mantenimiento). En cambio, no se recomienda para otro tipo de infecciones por CMV | ||||
| Después pauta de mantenimiento: entre 90 y 120mg/kg c/24h (ver también profilaxis secundaria de la retinitis por CMV en pacientes con infección por el VIH) | Cepa resistente: minimo 3 semanas | |||||
| Después pauta de mantenimiento (duración variable: como mínimo 2 semanas; en neumonitis 4 semanas; en VIH según recuento de CD4) | En enfermedad gastrointestinal por CMV la utilidad de una pauta de mantenimiento no ha sido establecida. Considerar si enfermedad grave o recaída. | |||||
| Ganciclovirg+Foscarnetf (en cepas con resistencia a ganciclovir ó pacientes con afectación neurológica) | Ganciclovir: 5mg/kg c/12h | i.v. | En cepas resistentes puede emplearse foscarnet en combinación con ganciclovir. Esta asociación ha demostrado sinergia in vitro y clínicamente ha sido de utilidad en algunos casos de resistencia a ganciclovir. No debe combinarse foscarnet con cidofovir, debido al riesgo de nefrotoxicidad grave | |||
| Foscarnet: 60mg/kg c/8h | VIH: mantener pauta de mantenimiento hasta CD4>200/μL durante al menos 6 meses y, en algunos casos, puede considerarse la suspensión entre 100 y 200/μL. | |||||
| Indicación | Fármaco | Dosis | Vía | Duración | Comentarios | |
| Citomegalovirus Enfermedad aguda por CMV | Alternativas | Cidofovirj (activo frente a cepas resistentes a ganciclovir; alternativa de segunda línea debido a su toxicidad) | Inducción: 5mg/kg una vez por semana (junto con probebecid). | i.v. | Inducción: 2 semanas | Iniciar cidofovir solo si Cr ⩽ 1.5mg/dL (ClCr>55 mL/min) y proteinuria<100mg/dL (< 2 cruces) |
| Mantenimiento: 5mg/kg | Después pauta de mantenimiento cada 2 semanas | Hidratar previamente (>1 L de suero fisiológico; si es posible, 1L antes en 1h y 1L durante o inmediatamente después en 1–3h) y administrar probenecid 2g oral (con alimentos) 3h antes y 1g a las 2h y 8h después de finalizar la infusión. Monitorizar función renal y electrolitos. Si aumento de Cr en 0,3 – 0,4mg/dL por encima del valor basal, reducir dosis a 3mg/kg. Suspender si el aumento Cr es ⩾ 0.5mg/dL o proteinuria ⩾ 3 cruces | ||||
| Cidofovir puede ser útil en CMV resistente a ganciclovir y foscarnet, pero la alta resistencia a ganciclovir por alteraciones en el gen de la polimerasa se asocia a resistencia cruzada a cidofovir | ||||||
| Fomivirsen9 (en retinitis) | Inducción: 330 mcg c/2 semanas | Intravítreo | Un total de 2 administraciones. | Formivirsen es activo frente a CMV resistentes a ganciclovir, foscarnet o cidofovir. | ||
| Mantenimiento: 330 mcg cada mes. | Después pauta de mantenimiento | Monitorizar campos visuales y presión intraocular. | ||||
| Encefalitis ó poliradiculitis por CMV. Tratamiento | De elección: | Ganciclovirg+Foscarnetf | Ganciclovir: 5mg/kg c/12h | i.v. | Hasta mejoría de los síntomas | No se recomienda el uso de cidofovir debido a su escasa penetración en el SNC. |
| Foscarnet: 60mg/kg c/8h | ||||||
| Tratamiento anticipado (“preemptive”) | De elección | Ganciclovirg | Inducción: 5mg/kg c/12h Mantenimiento: 6mg/kg/día 5 días a la semana ó 5mg/kg/día 7 días a la semana | i.v. | TPH: inducción 2 semanas (si antigenemia persistente alargar 2 semanas más); si la antigenemia o PCR no se negativizan durante la inducción, se puede continuar con dosis de mantenimiento hasta negativización o hasta el día +100 post-trasplante (algunos centros no realizan mantenimiento; en su lugar, si aparecen nuevas determinaciones positivas se vuelve a tratar) | Monitorizar función renal y electrolitos |
| En TPH (alo-TPH de bajo riesgo siempre que pueda cumplirse el protocolo de monitorización virológica, si no, emplear profilaxis-; TPH autólogo de elevado riesgo). En el TPH autólogo de bajo riesgo no está indicada la prevención de CMV | Valganciclovirh (en investigación para la indicación de tratamiento en pacientes trasplantados, farmacocinética favorable) | Inducción: 900mg c/12h | Oral | Monitorizar recuento de neutrófilos como mínimo una vez por semana. Si descienden entre 750 y 1000/μL intentar mantener ganciclovir junto con G-CSF. Suspender ganciclovir si recuento de neutrófilos <750/μL 2 días consecutivos. Reiniciar si recuento de neutrófilos >1000/μL 2 días consecutivos. Ganciclovir no debe administrarse si el recuento de plaquetas es <250.000/μL. | ||
| Monitorizar antigenemia en sangre al menos semanalmente desde el postrasplante (días 0–10) hasta al menos el día +100. El NCCN recomienda mantener la vigilancia hasta los 6 meses después de un alo-TPH | Mantenimiento: 900mg c/24h | Empleado en tratamiento anticipado, valganciclovir ha demostrado una buena biodisponibilidad incluso en pacientes con EICH intestinal de grados I y II | ||||
| En algunas situaciones se requiere un tiempo mayor (EICH grave, reactivación de la infección por CMV, alo-TPH de donante no emparentado o HLA no idéntico, y en los mini-alo-TPH). En general, mientras persista la inmunodepresión. (ver protocolos específicos de cada centro) | Un aumento de la antigenemia o PCR durante la primera semana no indican fracaso del tratamiento. Sí pueden indicarlo a partir de la segunda semana. | |||||
| Si la antigenemia/PCR se negativizan durante la inducción, se puede dar el tratamiento por finalizado, aunque algunos centros prolongan el tratamiento 1 o 2 semanas más. Si no se negativizan, se puede indicar la continuación del tratamiento con una dosis de mantenimiento | ||||||
| No se recomienda el tratamiento combinado con ganciclovir y foscarnet a mitad de dosis en el tratamiento anticipado | ||||||
| Alternativa de 1ª línea | Foscarnetf | Inducción: 60mg/kg c/12h Mantenimiento 90mg/kg 5 días por semana | i.v. | TPH: inducción 2 semanas (si antigenemia persistente alargar 2 semanas más); mantenimiento hasta al menos el día +100 (algunos centros no realizan mantenimiento; en su lugar, si aparecen nuevas determinaciones positivas se vuelve a tratar) | Foscarnet ha demostrado una eficacia similar a ganciclovir. Ambos se diferencian en su perfil de toxicidad. Evitar foscarnet en insuf renal moderada a grave. Reducir dosis en caso de IR leve Asegurar hidratación adecuada y monitorizar función renal y electrolitos | |
| Un aumento de la antigenemia o PCR durante la primera semana no indican fracaso del tratamiento. Sí pueden indicarlo a partir de la segunda semana | ||||||
| Si la antigenemia/PCR se negativizan durante la inducción, se puede dar el tratamiento por finalizado, aunque algunos centros prolongan el tratamiento 1 o 2 semanas más. Si no se negativizan, se puede indicar la continuación del tratamiento con una dosis de mantenimiento. | ||||||
| No se recomienda el tratamiento combinado con ganciclovir y foscarnet a mitad de dosis en el tratamiento anticipado | ||||||
| Indicación | Fármaco | Dosis | Vía | Duración | Comentarios | |
| Tratamiento anticipado (“preemptive”) | De segunda línea | Cidofovirj | Inducción: 3mg/kg Mantenimiento: 3mg/kg | Inducción: una vez/semana x 2 dosis en total, seguido de mantenimiento cada 2 semanas | Iniciar solo si Cr ⩽ 1.5mg/dL (ClCr>55 mL/min) y proteinuria<100mg/dL (< 2 cruces) | |
| Hidratar previamente (>1 L SF; si es posible, 1L antes en 1h y 1L durante o inmediatamente después en 1–3h) y administrar probenecid 2g oral (con alimentos) 3h antes y 1g a las 2h y 8h después de finalizar la infusión. Monitorizar función renal y electrolitos. Suspender si el aumento Cr es ⩾ 0.5mg/dL por encima del valor basal o proteinuria ⩾ 3 cruces | ||||||
| Tratamiento anticipado en el trasplante de órgano sólido (TOS) | Ganciclovirg | 5mg/kg c/12h | i.v. | En general 14 días y monitorización posterior | En pacientes sometidos a TOS cardíaco con enfermedad por CMV recidivante, descartar hipogammaglobulinemia. | |
| El panel de expertos de GESITRA-SEIMC y RESITRA recomienda en caso de neumonía por CMV en pacientes sometidos a TPH, asociar ganciclovir I.V. a dosis altas de inmunoglobulina inespecífica intravenosa 500mg/kgm a días alternos (en total 7–10 dosis), seguido de 500mg/kg por semana otras 4 semanas (junto con terapia de mantenimiento con ganciclovir). En cambio, no se recomienda para otro tipo de infecciones por CMV | ||||||
| De riñón, corazón e hígado, si receptor+para CMV | Valganciclovirh (en investigación para la indicación de tratamiento en pacientes trasplantados, farmacocinética favorable) | 900mg c/12h | Oral | El inicio del seguimiento y duración del mismo dependerán del órgano trasplantado | ||
| De pulmón en todos los casos, después de la profilaxis durante los 3 primeros meses | En el TOS de pulmón e intestino la monitorización debería ser semanal al menos hasta el 6.o mes y posteriormente en cada visita hasta el 2.o año postrasplante En QT con alemtuzumab: como mínimo hasta 2 meses después de la administración (mantener hasta CD4⩾ 100 cél./mm3). | Adicionalmente, en TOS intestinal es especialmente importante la monitorización periódica del VEB mediante PCR cuantitativa. Ante evidencia de replicación de CMV o VEB, administrar ganciclovirg IV 5mg/kg c/12h o valganciclovirh oral 900mg c/12h hasta negativización. | ||||
| Empleado en tratamiento anticipado, valganciclovir ha demostrado una buena biodisponibilidad incluso en pacientes con EICH intestinal de grados I y II | ||||||
| Renopancreático después de la profilaxis (a las 3 semanas si R+ o a los 3 meses si D+/R-) | ||||||
| Intestinal, después de la profilaxis (a partir del 3.ºo mes en R+y a partir del 6.o mes en D+/R- o tratamiento con anticuerpos antitimocíticos) | ||||||
| Cada tipo de trasplante tiene un punto de corte para la antigenemia en el cual iniciar tratamiento (ver protocolos específicos de cada centro) | ||||||
| Tratamiento anticipado en la QT con alemtuzumab | ||||||
| Indicación | Grupo de población | Fármaco | Dosis | Vía | Duración | Comentarios |
| Profilaxis CMV (cuando donante o el receptor presenten serología positiva; en caso de donante y receptor seronegativos, evitar la exposición a CMV (medidas higiénicas, uso de preservativo y administración de hemoderivados negativos para CMV o filtros adecuados) | TPH: cuando no sea posible cumplir el protocolo de monitorización virológica que requiere el tratamiento anticipado o cuando se trate de un alo-TPH de alto riesgo. | Ganciclovirg | 5mg/kg c/12h x 5 días, seguido de 5mg/kg c/24h | i.v. | Inciar en el prendimiento del injero y mantener hasta el día +100 (posteriormente se puede continuar con terapia anticipada mientras persista la inmunodepresión).También puede emplearse un curso breve pretrasplante | |
| Valganciclovirh (indicación en investigación) | 900mg c/12h x 5 días, seguido de 900mg c/24h | Oral | Administrar con alimentos | |||
| Dado que se considera potencialmente teratógeno y carcinógeno, se recomienda especial precaución para los cuidadores que manipulen los comprimidos: manipular con guantes (evitar el contacto directo de comprimidos rotos o triturados con piel y mucosas. En caso de producirse lavar abundantemente) | ||||||
| Foscarnetf | 90mg/kg c/12h x 5 días, seguidos de 90mg/kg/día 3 días por semana. (según NCCN: 60mg/kg c/8–12h x 7 días, seguido de 90–120mg/kg c/24h) | i.v. | Iniciar en el prendimiento y mantener hasta el día +100 | |||
| Después de la profilaxis, continuar con terapia anticipada. | ||||||
| Aciclovir b,c,e | 500mg/m2 IV c/8h del día –5 al +30 ± 800mg VO c/5–6h | i.v./Oral | Iniciar en el prendimiento y mantener hasta el día +30 (o hasta +120–180) | Aciclovir y valaciclovir son alternativas aceptables para evitar la toxicidad de ganciclovir, valganciclovir o foscarnet en profilaxis prolongadas. Sin embargo, dado que su eficacia frente a CMV es modesta, han de emplearse siempre bajo elevada supervisión y tratamiento anticipado de la infección por CMV con ganciclovir, valganciclovir o foscarnet | ||
| Valaciclovire | 1g c/6h (2g c/6h según NCCN) | Oral | Iniciar en el prendimiento y mantener hasta el día +30 (o hasta +120–180) | |||
| Profilaxis primaria | Ganciclovirg | 5mg/kg c/24h TOS riñon, corazón e hígado | i.v. | TOS riñon, corazón e hígado: iniciar tan pronto como sea posible después del TOS y mantener habitualmente hasta 3 meses postrasplante (en pacientes de alto riesgo puede ser necesario un tratamiento más prolongado) | En el TOS renal, diferir la profilaxis hasta que el aclaramiento de creatinina sea >10 ml/min, dada la eliminación renal de estos fármacos. Ver ajustes de dosis en tabla 3 | |
| TOS de riñon, corazón e hígado: en situaciones de elevado riesgo: donante +/receptor -; uso de anticuerpos antilinfocitarios (globulinas antilinfocíticas o antitimocíticas o anticuerpos monoclonales OKT3) | Valganciclovirh | 900mg c/24h | Oral | |||
| Valaciclovire (solo hay estudios en TOS renal) | 2g c/6h | Oral | ||||
| Profilaxis CMV | Profilaxis primaria | Ganciclovirg Valganciclovirh | Ganciclovir 5mg/kg c/12h hasta tolerancia oral, seguido de valganciclovir 900mg c/24h | i.v./Oral | Hasta el 3.° mes | El uso de gammaglobulina anti-CMV siempre en asociación con ganciclovir I.V. puede constituir un beneficio en pacientes de elevado riesgo |
| TOS de pulmón: en todos los pacientes | ||||||
| Profilaxis primaria | Ganciclovirg Valganciclovirh | Ganciclovir 5mg/kg c/12h o valganciclovir 900mg c/12h | iv / Oral | Durante las primeras 3 semanas. Después pasar a terapia anticipada si R+ o mantener profilaxis con valganciclovirh 900mg c/24h hasta completar 3 meses en D+/R- o en pacientes que hayan recibido más de 3 días de ATG u OKT3 (después continuar con terapia anticipada) | ||
| TOS renopáncreático: en todos los pacientes | iv / Oral | |||||
| Profilaxis primaria | Ganciclovirg Valganciclovirh | Ganciclovir 5mg/kg c/12h durante las 2–3 primeras semanas, seguido de valganciclovirh 900mg c/24h hasta completar 3 meses | Durante 3 meses. En D+/R- o en pacientes que hayan recibido anticuerpos antitimocíticos, mantener la profilaxis hasta el mes +6 | Asociar gammaglobulina anti-CMV 150mg/kg en las semanas 0, 2, 4, 6 y 8, seguido de 100mg/kg en las semanas 12 y 16 | ||
| TOS intestinal: en todos los pacientes | ||||||
| Indicación | Grupo de población | Fármaco | Dosis | Vía | Duración | Comentarios |
| Profilaxis CMV | VIH-profilaxis primaria Pacientes con CD4⩽ 50/μL y serología positiva a CMV | 1.aopción: TARGA | Panel de expertos de GESIDA y PNS recomiendan como 1.a opción TARGA con revisiones oftalmológicas periódicas –con o sin determinación de CMV en sangre por PCR– para detectar precozmente la enfermedad durante 3–4 meses después del inicio del TARGA (en caso de positividad valorar tratamiento anticipado con valganciclovir) (ver apartado CMV-tratamiento anticipado). Sin embargo, en caso de enfermedad del SNC por CMV, algunos expertos recomiendan demorar el inicio del TARGA hasta mejoría de la sintomatología neurológica por temor a la reacción inflamatoria asociada a la reconstitución inmunológica | |||
| En pacientes con serología negativa, evitar la exposición a CMV (medidas higiénicas, uso de preservativo y administración de hemoderivados negativos para CMV o filtros adecuados) | 2.aopción: valganciclovirh | 900mg c/24h | Oral | |||
| VIH-profilaxis secundaria (terapia de mantenimiento) Pacientes con retinitis por CMV en remisión tras un ciclo de inducción | 1.aopción: Valganciclovirh | 900mg/24h | Oral | VIH: aunque se desconoce la cifra de CD4 a partir de la cual parece seguro suspender la profilaxis, parece razonable hacerlo en pacientes con retinitis por CMV inactiva con CD4>200/μl durante al menos 6 meses y, en algunos casos, puede considerarse entre 100 y 200/μl | Según recomendaciones del panel de expertos de GESIDA/PNS | |
| Ganciclovir: Reducir dosis si IR (tabla 3). Monitorizar función renal y electrolitos | ||||||
| Cidofovir: hidratar previamente (>1 Lsuero fisiológico; si es posible, 1L antes en 1h y 1L durante o o inmediatamente después en 1–3h) y administrar probenecid 2g oral (con alimentos) 3h antes y 1g a las 2h y 8h después de finalizar la infusión. Monitorizar función renal y electrolitos. Si aumento de Cr en 0,3 – 0,4mg/dL por encima del valor basal, reducir dosis a 3mg/kg. Suspender si el aumento Cr es ⩾ 0.5mg/dL o proteinuria ⩾ 3 cruces | ||||||
| Alternativa: Ganciclovirg | 5mg/kg c/24h 7 días por semana o 6mg/kg c/24h 5 días por semana o 10mg/kg 3 días por semana | i.v. | Fomivirsen: monitorizar campos visuales y presión intraocular | |||
| El tratamiento de mantenimiento en pacientes con CMV extraocular no está bien establecido. Considerar si enfermedad grave o recaída | ||||||
| Alternativa: Ganciclovir implantes intravítreos | 1 implante de 4,5mg c/6–9 meses (asociado a valganciclovirh oral) Sustituir el implante cuando se aprecie progresión de la retinitis. | Intravítreo | ||||
| Alternativa: Foscarnetf | 90–120mg/kg 5–7 días por semana | i.v. | ||||
| Alternativa: Cidofovirj | 5mg/kg c/2 semanas. Iniciar 15 días después de finalizar inducción. | i.v. | ||||
| Alternativa: Fomivirsenk intravítreo | 330 mcg cada mes | Intravítreo | ||||
CMV: citomegalovirus; Cr: creatinina; D: donante; EICH: enfermedad del injerto contra el huésped; GeSida: Grupo de Estudio del Sida de la SEIMC; IR: insuficiencia renal, IV: intravenoso; LLC: leucemia linfocítica crónica; NCCN: National Comprehensive Cancer Network, OKT3: muromonab-CD3; PCR: reacción en cadena de la polimarasa; PNS Plan Nacional sobre el Sida, QT: quimioterapia; R: receptor; RESITRA: red de estudio de infección en el trasplante; SEIMC: sociedad Española de Enfermedades Infecciosas y Microbiología Clínica; SF: suero fisiológico; SG5%: suero glucosado al 5%.; SNC: sistema nervioso central; TARGA: tratamiento antirretroviral de gran actividad; TOS: trasplante de órgano sólido; TPH: Trasplante de progenitores hematopoyéticos; VEB: virus de Epstein-Barr; VHS: virus del herpes simple; VIH: virus de la inmunodeficiencia humana; VO: oral: VVZ., L: virus varicela zoster.
aSi no se especifica lo contrario, la dosis indicada es la que debe utilizarse en cada administración (p.ej. 20mg/kg c/8h=60mg/kg diarios).
Aciclovir: dosis máxima IV en el adulto12,5mg/kg c/8h. En pacientes obesos, dosificar aciclovir según peso corporal ideal.
Aciclovir: reconstituir el vial de 250mg con 10mL API ó SF. Diluir dosis total en 50–100mL SF o SG5% (a una conc.<5mg/ml). Administrar en mínimo 60min. Asegurar una adecuada hidratación del paciente para evitar la nefropatía por formación de cristales, que puede aparecer con dosis altas.
Foscarnet: i.v. por vía central sin diluir (24mg/ml) o por vía periférica diluyendo a la mitad (12mg/ml) con SF ó SG5%. Administrar en 1–2h (según dosis). Evitar en IR moderada a grave. Reducir dosis en caso de IR leve (tabla 3). Asegurar hidratación adecuada y monitorizar función renal y electrolitos.
Ganciclovir: reconstituir vial con API. Diluir en SF o SG 5% (conc. máx. 10mg/mL). Administrar en 60min.
Valganciclovir: administrar con alimentos. Dado que se considera potencialmente teratógeno y carcinógeno, se recomienda especial precaución para los cuidadores que manipulen los comprimidos: manipular con guantes (evitar el contacto directo de comprimidos rotos o triturados con piel y mucosas. En caso de producirse lavar abundantemente).
Ajustes de dosis en pacientes adultos con insuficiencia renal
| Farmaco | Insuficiencia renal (Cl Cr expresado en ml/min) | Hemodialisis, Dialisis Peritoneal y otros | Insuficiencia Hepática |
| Aciclovir IV | Administrar la misma dosis (5 o 10mg/kg según indicación) y espaciar intervalos: Cl Cr 25-50: c/12h; Cl Cr 10-25: c/24h | HD: mitad de dosis (2,5 o 5mg/kg según indicación) c/24h Administrar post-HD o suplementar 50% dosis. CAPD: mitad de dosis c/24h; no require suplementos. TCSR: variable en función de la técnica apliada. A modo orientativo, basado en un flujo de dializado de 1L/h: CAVH: 3,5mg/kg c/24h. CVVH/CVVHD/CVVHDF: 5–10mg/kg C/24h (10mg/kg c/24h si VVZ o afectación neurológica) | Debido a su eliminación mayoriatariamente por vía renal probablemente no requiera ajuste de dosis |
| Aciclovir V.O. | VHS: Cl Cr ⩽10: 200mg c/12h | HD: VHS: 200mg c/12h | Debido a su eliminación mayoriatariamente por vía renal probablemente no requiera ajuste de dosis |
| VVZ:Cl Cr 10-25: 800mg c/6–8h | VVZ: 800mg c/12h | ||
| Cl Cr <10: 800mg c/12h | Administrar post-HD o suplementar 50% dosis | ||
| Cidofovir | Cl Cr >55: dosis habitual | No recomendado | Debido a su eliminación mayoriatariamente por vía renal probablemente no requiera ajuste de dosis |
| Contraindicado en pacientes con Cr >133 μM (>1.5mg/dl) o ClCr <55 o proteinuria > 2+ (100mg/dL). Si durante la terapia se produce un aumento de Cr serica de 0,3–0,5mg/dL o proteinuria >2+, reducir la dosis a 3mg/kg. Suspender si el aumento Cr es ⩾ 0.5mg/dL ó proteinuria ⩾ 3 cruces | HD: elimina aprox 50% (HD de flujo elevado). Dosificar post-HD | ||
| CAPD: no lo elimina de forma significativa | |||
| HF: no hay datos | |||
| Famciclovir | (Cl Cr expresado en ml/min/ 1,73m2) | HD: | No requiere ajuste de dosis en pacientes con insuficiencia hepática compensada. No se han realizado estudios en pacientes con insuficiencia hepática grave descompensada |
| herpes genital (primer episodio): | herpes zoster: 250mg c/48h. | ||
| 30–59: 250mg c/24h | Recurrencias del herpes genital: 250mg c/48h | ||
| 10–29: 125mg c/24h | |||
| Recurrencias del herpes genital : | Tratamiento supresor de las recurrencias del herpes genital: 125mg c/48h | ||
| 30–59: 250mg c/24h | |||
| 10–29: 125mg c/24h | |||
| Recurrencias de herpes mucocutáneo en VIH: 250mg c/48h | |||
| Tratamiento supresor de las recurrencias del herpes genital: | |||
| ≥30: No es necesario ajuste de dosis | |||
| Administrar post-HD (una sesión de HD de 4h reduce aprox. un 75% las concentraciones plasmáticas de penciclovir) | |||
| 10–29: 125mg c/12h | |||
| Herpes simplex en pacientes inmunocomprometidos: | |||
| 30–59: 250mg c/12h | |||
| 10–29: 125mg c/12h | |||
| Tratamiento del herpes zoster: | CAPD:no hay datos. | ||
| 30–59: 250mg c/12h | HF: no hay datos | ||
| 10–29: 250mg c/24h | |||
| Foscarnet | (Cl Cr expresado en mL/kg/min): | No recomendado en Cl Cr <20mL/min excepto en caso de insuficiencia renal irreversible en HD: dosis de carga de 60–90mg/kg post-HD, seguido de 45–60mg/kg post-HD tres veces por semana (la HD elimina aprox un 38%) | Debido a su eliminación mayoriatariamente por vía renal probablemente no requiera ajuste de dosis |
| Inducción retinitis CMV en SIDA: | |||
| Equivalente a pauta habitual de 90mg/kg c/12h: Cl Cr >1,4: 90mg/kg c/12h; Cl Cr <1,4–1: 70mg/kg c/12h; Cl Cr <1–0,8: 50mg/kg c/12h; Cl Cr <0,8–0,6: 80mg/kg c/24h; Cl Cr <0,6–0,5: 60mg/kg c/24h; Cl Cr<0,5–0,4: 50mg/kg c/24h; Cl Cr <0,4: no recomendado. | |||
| Equivalente a pauta habitual de 60mg/kg c/8h: Cl Cr >1,4: 60mg/kg c/8h; Cl Cr <1,4–1: 45mg/kg c/8h; Cl Cr <1–0,8: 35mg/kg c/8h; Cl Cr <0,8–0,6: 40mg/kg c/12h; Cl Cr <0,6–0,5: 30mg/kg c/12h; Cl Cr <0,5–0,4: 25mg/kg c/12h; Cl Cr <0,4: no recomendado | |||
| CAPD: misma dosis que para Cl Cr <10mL/min | |||
| CAVHDF/CVVHDF: misma dosis que para Cl Cr 10–50mL/min | |||
| Mantenimiento retinitis CMV en SIDA: | |||
| Equivalente a pauta habitual de 90mg/kg c/24h: Cl Cr >1,4: 90mg/kg c/24h; Cl Cr <1,4–1: 70mg/kg c/24h; Cl Cr <1–0,8: 50mg/kg c/24h; Cl Cr <0,8–0,6: 80mg/kg c/48h; Cl Cr <0,6–0,5: 60mg/kg c/48h; Cl Cr <0,5–0,4: 50mg/kg c/48h; Cl Cr <0,4: no recomendado | |||
| Equivalente a pauta habitual de 120mg/kg c/24h: Cl Cr >1,4: 120mg/kg c/24h; Cl Cr <1,4–1: 90mg/kg c/24h; Cl Cr <1–0,8: 65mg/kg c/24h; Cl Cr <0,8–0,6: 105mg/kg c/48h; Cl Cr <0,6–0,5: 80mg/kg c/48h; Cl Cr <0,5–0,4: 65mg/kg c/48h; Cl Cr <0,4: no recomendado | |||
| Enfermedad gastrointestinal por CMV: | |||
| Equivalente a pauta habitual de 90mg/kg c/12h: Cl Cr >1,4: 90mg/kg c/12h; Cl Cr <1,4–1: 70mg/kg c/12h; Cl Cr <1–0,8: 50mg/kg c/12h; Cl Cr <0,8–0,6: 80mg/kg c/24h; Cl Cr <0,6–0,5: 60mg/kg c/24h; Cl Cr <0,5–0,4: 50mg/kg c/24h; Cl Cr <0,4: no recomendado | |||
| Infecciones mucocutáneas por VHS: | |||
| Equivalente a pauta habitual de 40mg/kg c/8h: Cl Cr >1,4: 40mg/kg c/8h; Cl Cr <1,4–1: 30mg/kg c/8h; Cl Cr <1–0,8: 20mg/kg c/8h; Cl Cr 0,8–0,6: 25mg/kg c/12h; Cl Cr 0,6–0,5: 20mg/kg c/12h; Cl Cr 0,5–0,4: 15mg/kg c/12h; Cl Cr <0,4: no recomendado | |||
| Ganciclovir IV | Inducción: | Puede reducir un 50% los niveles plasmáticos | Debido a su eliminación mayoriatariamente por vía renal probablemente no requiera ajuste de dosis |
| Cl Cr ≥70: 5mg/kg c/12h | En inducción 1,25mg/kg post- | ||
| Cl Cr 50–69: 2,5mg/kg c/12h | HD y mantenimiento 0,625mg/kg post-HD. Máximo tres veces por semana. | ||
| Cl Cr 25–49: 2,5mg/kg c/24h | CAPD: en inducción 1,25mg/kg 3 veces por semana y mantenimiento 0,625mg/kg 3 veces por semana | ||
| Cl Cr 10–24: 1,25mg/kg c/24h | |||
| Mantenimiento: | |||
| Cl Cr ≥70: 5mg/kg c/24h | |||
| Cl Cr 50–69: 2,5mg/kg c/24h | |||
| Cl Cr 25–49: 1,25mg/kg c/24h | |||
| Cl Cr 10–24: 0,625mg/kg c/24h | |||
| CVVHD: 5mg/kg c/48h en inducción y 2,5mg/kg c/48h en mantenimiento (datos limitados) | |||
| CAVH/CVVH: 2,5mg/kg c/24h | |||
| Valaciclovir | Herpes labialis: Cl Cr ≥50: 2g c/12h 2 dosis; Cl Cr 30–49: 1g c/12h 2 dosis; Cl Cr 10–29: 500mg c/12h 2 dosis; Cl Cr <10: 500mg dosis única | HD: 500mg c/24h | No requiere ajuste de dosis |
| Administrar post-HD (Una sesión de diálisis de 4h elimina aprox. 1/3 de la cantidad presente en el organismo) | No se dispone de datos sobre el uso de dosis altas (8g al día) en pacientes con insuficiencia hepática, por lo tanto se recomienda administrarlo con precaución, bajo estrecha monitorización | ||
| Herpes zoster: Cl Cr ≥50: 1g c/8h; Cl Cr 30–49: 1g c/12h; Cl Cr 15–30: 500mg c/12h; Cl Cr <15: 500mg c/24h. | |||
| Herpes genital inicial: Cl Cr ≥30: 1g c/12h; Cl Cr 10–29: 1g c/24h; Cl Cr <10: 500mg c/24h | CAPD: 500mg c/24–48h (no requiere suplementos) | ||
| Herpes genital recurrencias: Cl Cr ≥30: 500mg c/12h; Cl Cr <29: 500mg c/24h. | HF: no se elimina. Considerar 500mg c/24h | ||
| Herpes genital-terapia supresiva (para una dosis con función renal normal de 1000mg c/24h): Cl Cr ≥30: 1g c/24h; Cl Cr <29: 500mg c/24h | |||
| Herpes genital-terapia supresiva (para una dosis con función renal normal de 500mg c/24h): Cl Cr ≥30: 500mg c/24h; Cl Cr <29: 500mg c/48h | |||
| Herpes genital-terapia supresiva en inmunodeprimidos VIH+ (para una dosis con función renal normal de 500mg c/12h): Cl Cr ≥30: 500mg c/12h; Cl Cr <29: 500mg c/24h | |||
| Profilaxis de la infección y enfermedad causada por CMV en pacientes trasplantados (correspondiente a una dosis de 2g c/6h en pacientes con función renal normal): | |||
| Cl Cr 50–75: 1500mg c/6h | |||
| Cl Cr 25–49: 1500mg c/8h | |||
| Cl Cr 10–24: 1500mg c/12h | |||
| Cl Cr <10: 1500mg c/24h | |||
| Valganciclovir | Inducción: | El laboratorio fabricante no lo recomienda | Debido a su eliminación mayoriatariamente por vía renal probablemente no requiera ajuste de dosis |
| Cl Cr ≥60: 900mg dos veces al día | |||
| Cl Cr 40–59: 450mg dos veces al día | Considerar en HD/HF: 900mg c/48h en inducción y 450mg c/48h en mantenimiento. Dosificar post-HD (la HD elimina aprox. un 50%). | ||
| CAPD: no hay datos | |||
| Cl Cr 25–39: 450mg una vez al día | |||
| Cl Cr 10–24: 450mg c/48h. | |||
| Mantenimiento: | |||
| Cl Cr ≥60: 900mg una vez al día | |||
| Cl Cr 40–59: 450mg una vez al día | |||
| Cl Cr 25–39: 450mg c/48h | |||
| Cl Cr 10–24: 450mg dos veces por semana |
CAPD: diálisis peritoneal contínua ambulatoria; CAVH: hemofiltración contínua arterio-venosa; CAVHDF: hemodiafiltración contínua arterio-venosa; Cl Cr: aclaramiento de creatinina; Cr: creatinina sérica; CMV: citomegalovirus; CVVH: hemofiltración contínua veno-venosa; CVVHD: hemodiálisis contínua veno-venosa; CVVHDF: hemodiafiltración contínua veno-venosa; HD: hemodiálisis (estándar); HF: hemofiltración; IV: intravenoso; SIDA: síndrome de inmunodeficiencia adquirida; TCSR: técnicas contínuas de sustitución renal; VHS: virus del herpes simple; VO: oral; VVZ: virus varicela-zoster.
En este artículo se actualiza la revisión publicada en esta revista en el año 200324, por lo que se indican tan solo las citas bibliográficas nuevas. Para la actualización de esta revisión se realizó una búsqueda en PubMed (2003–2009) utilizando los términos «herpes simplex», «herpes zoster», «chickenpox», «cytomegalovirus infections» y «drug therapy (subheading)» y se limitó la búsqueda a «meta-analysis», «randomized controlled trial» o «review» publicados en lengua inglesa o castellana. Adicionalmente, se seleccionaron las revisiones de la Cochrane library relacionadas con el tema, así como la existencia de guías de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) o de la Infectious Diseases Society of America.
Antivirales activos frente al virus del herpesVirus del herpes simpleSe han identificado 2 tipos de virus del herpes simple (VHS): el VHS-1, que habitualmente causa herpes orolabial, y el VHS-2, asociado con mayor frecuencia a herpes genital y neonatal. Después de una infección primaria, el virus permanece en forma latente en los ganglios sensitivos y pueden producirse reactivaciones de forma imprevisible. Los posibles factores desencadenantes serían las situaciones de estrés físico o mental, la menstruación, las radiaciones ultravioletas o el láser, el daño tisular, la fiebre, el uso de corticoides o infecciones del tracto respiratorio superior. El herpes labial primario afecta a 1,6 de cada 1.000 pacientes por año17,25. Habitualmente, el VHS causa infecciones leves y autolimitadas. El episodio primario no suele tratarse, a excepción de casos graves, especialmente en inmunodeprimidos. Las recurrencias se tratan o no en función de su gravedad, su frecuencia y las características del individuo.
En los casos de herpes labial no complicado pueden aplicarse antivirales tópicos (aciclovir crema 5 veces al día o penciclovir crema cada 2h), aunque las pautas son incómodas y la eficacia limitada. En un reciente estudio multicéntrico aleatorizado y ciego para el investigador, en el que se incluyó a 728 individuos, los parches hidrocoloides Compeed® antiherpes presentaron una eficacia clínica similar al aciclovir crema al 5% en individuos con herpes labial recidivante cuando ambos se administraron hasta la curación de las lesiones (como máximo 10 días). Estos parches se sustituyen cada 8h y son transparentes, por lo que suponen una mayor comodidad para el paciente a un coste similar26. Otro estudio aleatorizado abierto en el que se incluyó a 74 pacientes con la misma patología demostró que el silica gel (Silicea® gel labial) 5 veces al día era tan efectivo como el aciclovir crema al 5% cuando ambos eran aplicados durante 10 días27. Tanto Compeed® parches antiherpes como el silica gel son productos bien tolerados y no contienen agentes antivirales. En casos más graves, puede considerarse la administración de antivirales por vía oral. Las nuevas pautas cortas con valaciclovir y famciclovir son más cómodas y han demostrado una mayor eficacia. Se han realizado diversos ensayos clínicos aleatorizados, doble ciego y controlados con placebo para evaluarlas. La administración de valaciclovir (2g/12h en 2 dosis) para el tratamiento de las recurrencias de herpes labial redujo un día la duración de los síntomas28, y la administración de famciclovir (1.500mg en dosis única o 750mg/12h en 2 dosis) redujo 2 días la duración de los síntomas. No se observaron diferencias entre ambas pautas de famciclovir29,30.
Para la prevención de la recurrencias (tratamiento supresor) sólo ha demostrado eficacia la administración de antivirales orales25. Las recurrencias del VHS-1 en pacientes inmunodeprimidos son más agresivas, dolorosas y lentas en su curación. Requieren un tratamiento más prolongado, con mayor riesgo de aparición de resistencias.
El herpes simple ocular es una infección prevalente causada principalmente por el VHS-1. Presenta recurrencias y puede causar blefaroconjuntivitis, queratitis, uveítis y, con menor frecuencia, retinitis. Los episodios reiterados pueden ocasionar lesiones en la córnea con pérdida de la visión. Habitualmente se trata con antivirales por vía tópica en colirio o pomada oftálmica, si bien en algunos casos se requiere tratamiento sistémico22.
La encefalitis herpética es una manifestación grave, causada en más del 90% de los casos por el VHS-1 y en el resto por el VHS-2. Aunque es poco frecuente (1-2,5 casos cada un millón de habitantes por año), su mortalidad se sitúa entre un 6 y un 11%31. Debe tratarse con dosis altas de aciclovir por vía intravenosa de forma precoz16,31.
En el paciente sometidos a trasplante de órgano sólido (TOS), la reactivación del VHS condiciona la aparición de lesiones de la mucosa oral o genital en aproximadamente un tercio de los pacientes en ausencia de profilaxis. Aunque suele ser leve, algunos pacientes pueden presentar lesiones ulcerativas graves que se complican con sobreinfección bacteriana y con afectación esofágica. Excepcionalmente, la reactivación o la infección primaria por VHS pueden causar neumonitis, hepatitis, traqueobronquitis o infección diseminada, cuadros muy graves y con elevada mortalidad32. La profilaxis para el citomegalovirus (CMV) es también activa frente al VHS y al virus de la varicela zóster (VVZ). Se han empleado dosis de aciclovir de entre 200 y 400mg/8–12h los primeros 30–90 días postrasplante33. En pacientes con trasplante de progenitores hematopoyéticos (TPH), la profilaxis con aciclovir está plenamente justificada en los pacientes seropositivos al disminuir la reactivación del VHS de un 80% hasta un 25% dentro de los primeros meses del trasplante. Con ello se consigue disminuir la gravedad de las mucositis y las manifestaciones viscerales de la enfermedad. Sin embargo, actualmente no está clara la conveniencia de mantener la profilaxis oral con aciclovir más allá del mes inicial34.
El VHS-2 es el agente etiológico más frecuente del herpes genital, aunque a éste también puede causarlo el VHS-135. Es una enfermedad de transmisión sexual. La prevalencia de infección por el VHS-2 es variable; en Europa es de alrededor del 15%. La infección primaria por el VHS-2 puede cursar de forma asintomática o con lesiones genitales. Aun en presencia de infección asintomática, se produce la liberación del virus de forma intermitente en el tracto genital, con mayor frecuencia en el VHS-2 y durante los 12 primeros meses35. La mayoría de los pacientes que presentan síntomas durante la infección primaria suelen presentar recurrencias, con una media de 4 o 5 al año, o más si la primoinfección ha sido más grave. Las recurrencias son mucho menos habituales en las infecciones genitales por el VHS-135. En los pacientes con infección por el VIH (especialmente cuando el recuento de linfocitos CD4 es bajo) las reactivaciones son más frecuentes y de mayor duración y gravedad. El herpes genital se ha relacionado con un incremento del riesgo de transmisión del VIH, y viceversa, debido a la presencia de úlceras genitales. En mujeres africanas con infección por el VIH, el tratamiento supresor ha demostrado reducir la excreción genital tanto del VHS como del VIH, lo que podría reducir la probabilidad de transmisión de ambas infecciones36.
El herpes genital37 primario siempre debe tratarse con antivirales por vía oral o intravenosa en función de la gravedad. No se recomiendan los antivirales tópicos dada su escasa utilidad38. Las recurrencias leves y poco frecuentes pueden no requerir tratamiento. Las recurrencias de gravedad moderada pueden controlarse con ciclos cortos de antivirales por vía oral cuando su frecuencia de aparición es baja y con prodromos claros. El valaciclovir ha demostrado una eficacia similar al aciclovir, tanto en el tratamiento de los episodios recurrentes de herpes genital como en el tratamiento supresor14. Leone et al compararon la eficacia del valaciclovir (500mg/12h) administrado durante 5 días o 3 días, sin que se observaran diferencias entre ambas pautas: la mediana de tiempo hasta la curación de las lesiones fue de unos 4 días y medio y la duración del dolor de unos 2 días y medio39. Aoki et al realizaron un estudio multicéntrico aleatorizado, doble ciego y controlado con placebo para evaluar la eficacia de famciclovir (1g/12h) durante un día iniciado por el paciente en las primeras 6h tras la aparición de los prodromos o las lesiones genitales. El famciclovir redujo el tiempo de curación de las lesiones (4,3 días frente a 6,1 días con placebo), así como la duración del dolor, y el porcentaje de sujetos en los que las lesiones no progresaron fue mayor40. Aunque no existen comparaciones directas entre las pautas cortas de famciclovir y otros antivirales, los resultados sugieren una eficacia igual o mayor del famciclovir, con unas pautas más cómodas para el paciente, pero suponen un mayor coste30.
En la actualidad, se tiende más al empleo de tratamiento supresor continuado durante 6–12 meses debido a su eficacia y seguridad y al beneficio en la calidad de vida del paciente. Adicionalmente, podría reducir la transmisión de la enfermedad. El tratamiento supresor reduce en un 70–80% las recurrencias y es de elección si aparecen más de 6 episodios por año o si éstos son graves41. También debe considerarse en parejas serodiscordantes35. Se prefieren fármacos con una semivida más larga y pautas más cómodas, como el valaciclovir o el famciclovir, y es necesario mantener una adecuada adherencia al tratamiento para evitar períodos con concentraciones plasmáticas bajas que faciliten la replicación viral37. La necesidad de continuar con este tratamiento debe reevaluarse a los 6–12 meses, ya que existe una tendencia natural a la reducción de la frecuencia de las recurrencias en el tiempo.
En pacientes que, a pesar del tratamiento supresor, no logren controlar las recurrencias puede ser necesario aumentar las dosis o realizar un test de resistencia. En un estudio del CDC, la prevalencia de aislados del VHS resitentes al aciclovir fue del 0,18% en pacientes no infectados por el VIH en comparación con el 5,3% en los VIH positivos. A pesar de un aumento en el uso del aciclovir, la prevalencia de resistencias se ha mantenido estable durante los últimos 20 años38. En algunos casos, la resistencia puede revertirse al suspender el aciclovir37. Los aislados resistentes pueden tratarse con foscarnet o cidofovir por vía intravenosa o tópica. Se han publicado algunos casos de éxito con foscarnet al 2,4% en fomentos de 20min 2 veces al día42 o cidofovir crema al 1% una vez al día (fórmula magistral)37, aunque los datos son limitados y se ha descrito también ausencia de eficacia con foscarnet en crema al 0,3%. La dosis máxima tolerada de cidofovir en crema queda por definir, aunque se han empleado concentraciones de entre el 0,3 y el 5% y la toxicidad local ha dependido de la dosis37.
Actualmente se están realizando ensayos clínicos en diferentes fases con vacunas para el herpes genital. Aunque es poco probable que estas vacunas puedan impedir la infección genital por el virus, sí parecen útiles para reducir la gravedad de los síntomas41. Se están investigando asimismo formulaciones de liberación retardada de aciclovir basadas en micropartículas para mejorar las pautas posológicas.
Virus de la varicela-zósterEl virus de la varicela-zóster (VVZ) causa 2 tipos de enfermedades: la varicela y el herpes zóster (HZ). La infección se controla mediante la inmunidad humoral y celular. Después de la infección primaria, el virus permanece en forma latente en los ganglios de las raíces dorsales, y puede reactivarse ante cualquier alteración de la inmunidad celular y producir el HZ11. La varicela en niños menores de 12 años habitualmente es autolimitada y no requiere tratamiento (sólo debe tratarse en caso de que el niño o sus contactos presenten enfermedades de base). En adolescentes, adultos, durante el embarazo o en pacientes inmunodeprimidos puede ser más grave. Alertan sobre la presencia de una infección grave los síntomas respiratorios, una elevada densidad de vesículas, la presencia de exantema hemorrágico o hemorragia (hemoptisis, hemorragia digestiva, etc.), la afectación neurológica o la persistencia de fiebre y aparición de nuevas vesículas después de 6 días11. Las complicaciones graves son la neumonitis, la encefalitis o la necrosis retiniana externa rápidamente progresiva en pacientes con infección por el VIH36. En todos estos casos es necesario iniciar el tratamiento antiviral de forma temprana. Las sobreinfecciones bacterianas son frecuentes en la varicela y requieren tratamiento antibiótico adicional11.
El tratamiento de la varicela debe iniciarse en las primeras 24h para obtener algún beneficio. Sin embargo, es difícil que los pacientes acudan al médico en este intervalo, por lo que se sugieren 24–48h. Pasadas 24–48h, solo debe considerarse el tratamiento en los casos graves. Los inmunodeprimidos deben tratarse en caso de nuevas lesiones o fiebre en las 24–48h previas, independientemente del tiempo transcurrido desde la aparición de las primeras lesiones11. Tunbridge et al, en las guías de la British Infection Society, establecen un algoritmo de tratamiento según el cual los pacientes inmunodeprimidos, los que cumplan criterios de gravedad y las gestantes a término o con amenaza de parto prematuro deben tratarse con aciclovir intravenoso. En pacientes no inmunodeprimidos en los que no hayan aparecido nuevas vesículas en las últimas 24–48h se recomienda tratamiento sintomático y monitorización clínica (si aparecen signos de gravedad, deben tratarse con antivirales por vía intravenosa). Aunque el uso de corticoides puede ser de utilidad en algunos casos de neumonía por varicela, en la actualidad no existe suficiente evidencia científica que apoye su uso11. En pacientes no inmunodeprimidos en los que hayan aparecido nuevas vesículas en las últimas 24–48h se recomienda tratamiento con antivirales orales (o por vía intravenosa si hay signos de gravedad). Por vía oral se prefieren el valaciclovir o el famciclovir, dado que presentan una mejor biodisponibilidad que el aciclovir y el VVZ presenta una IC90 elevada. Se recomienda una duración mínima del tratamiento de 7 días. Los pacientes inmunodeprimidos o con enfermedad grave pueden requerir 2 semanas de tratamiento (tabla 2)11. En estos pacientes puede emplearse como coadyuvante la inmunoglobulina frente al VVZ (Varitect®) en dosis de 1–2ml (25–50UI) por kg con administraciones adicionales en función de la evolución clínica43.
La infección primaria por varicela durante el embarazo afecta aproximadamente de 2 a 3 de cada 1.000 embarazos44 y se asocia a un elevado riesgo de neumonitis y otras complicaciones. En cualquier momento del embarazo puede dar lugar a muerte fetal y aumenta el riesgo de aborto o parto prematuro11. Durante los 2 primeros trimestres puede dar lugar, aproximadamente en un 12% de los casos, al síndrome de varicela congénita, caracterizado por lesiones cutáneas, defectos neurológicos, enfermedades oculares y anomalías esqueléticas44. El fármaco de elección es el aciclovir, ya que existe mayor experiencia sobre su uso durante el embarazo, y debe iniciarse en las primeras 24h. En caso de gestación menor de 36/40 semanas sin riesgo de parto prematuro ni criterios de gravedad, puede administrarse aciclovir oral. En gestantes a término, amenaza de parto prematuro o con criterios de gravedad, debe administrarse aciclovir intravenoso (tabla 2)11. En el neonato, la causa de la varicela es la adquisición del virus por parte de la madre durante las 3 últimas semanas de gestación, que se transmite por vía transplacentaria y se manifiesta en el recién nacido en los primeros 10–12 días de vida. Si la madre presenta la erupción cutánea entre los 5 días preparto a 2 días posparto, el neonato puede presentar, en el 20% de los casos, una varicela neonatal grave o incluso mortal, que requiere tratamiento urgente con aciclovir intravenoso en dosis altas, además de la administración de inmunoglobulina frente al VVZ44.
En el adulto, la profilaxis frente a la varicela con inmunoglobulina tras una exposición de riesgo estaría indicada en pacientes inmunodeprimidos susceptibles (o sus contactos) que hayan tenido una exposición de riesgo (contacto de más de 15min en la misma habitación o 5min en una conversación cara a cara con un paciente afectado de varicela susceptible de transmitir la enfermedad —desde 48h antes de la aparición del exantema cutáneo hasta la formación de costras en las lesiones— o bien contacto con un paciente afectado de HZ diseminado o con lesiones cutáneas activas —úlceras y vesículas—). Si se repite el contacto después de 3 semanas o más, se requiere una nueva administración de inmunoglobulina. La inmunoglobulina frente al VVZ (Varitect®) ha demostrado reducir en un 40% el riesgo de infección y atenuar su gravedad11. Para la indicación de profilaxis postexposición, la dosis recomendada es de 1ml (25UI)/kg por vía intravenosa y debe administrarse dentro de las 96h después de la exposición. En caso de contactos repetidos (convivencia) es preferible emplear dosis mayores43. La inmunoglobulina específica frente al VVZ no se encuentra comercializada en España y puede importarse a través del departamento de Medicamentos Extranjeros del Ministerio de Sanidad y Consumo. Sin embargo, como alternativa pueden utilizarse las inmunoglobulinas inespecíficas que son igualmente eficaces y más baratas. Existen diferentes preparados comerciales de inmunoglobulinas inespecíficas por vía intravenosa e intramuscular; sin embargo, el inconveniente de los preparados por vía intramuscular es el elevado volumen que debe administrarse y que obliga a realizar varias inyecciones. El contenido puede variar en función de la marca comercial, el lote y el país de procedencia. Los laboratorios fabricantes pueden ofrecer información detallada del contenido de cada inmunoglobulina específica en los distintos lotes de inmunoglobulina inespecífica, aunque en general 100–200mg/kg de inmunoglobulina inespecífica intravenosa contienen las concentraciones adecuadas de inmunoglobulina antivaricela45. Algunos autores recomiendan dosis mayores de hasta 400mg/kg3.
El HZ se produce por la reactivación de la infección por el VVZ latente, habitualmente debido a una alteración de la inmunidad celular. Su incidencia en la población europea varía de entre 0,3 cada 1.000 niños menores de 10 años a 10 cada 1.000 adultos de más de 80 años17. Un segundo episodio de HZ ocurre en menos del 5% de casos, aunque con mayor frecuencia en pacientes inmunodeprimidos12. El HZ se asocia con frecuencia a neuralgia postherpética46–48. No se conocen con precisión los factores desencadenantes. Es más frecuente en pacientes con déficit de inmunidad celular como ancianos, pacientes con linfoma o pacientes con infección por el VIH. Puede ser grave en pacientes inmunodeprimidos con trasplante de médula ósea o TOS12,13. A diferencia de la varicela, el HZ durante el embarazo no se ha asociado a defectos en el neonato44.
La estrategia de prevención es la vacuna con el virus de la varicela atenuado (cepa Oka). Esta vacuna ha demostrado una alta efectividad en la prevención de la varicela en niños. También deberían vacunarse las personas con riesgo de presentar una varicela grave (inmunodeprimidos) y las personas que conviven con ellas si no han padecido esta enfermedad. En el año 2006, tanto la Food and Drugs Administration como la European Medicines Agency autorizaron una nueva vacuna frente al HZ (Zostavax®), obtenida también a partir de la cepa Oka pero con un contenido de virus atenuado 14 veces mayor que la vacuna de la varicela. Esta vacuna está indicada para la prevención del HZ en individuos con una edad de 50 años o más y se administra mediante una dosis única por vía subcutánea. Se tolera bien, y sus principales efectos adversos, de carácter leve, son reacciones en el punto de inyección. La autorización se basó en los resultados de un ensayo clínico aleatorizado, doble ciego y controlado con placebo49 en 38.546 adultos con una edad de 60 años o más. La vacuna redujo el número de casos de HZ a la mitad y la incidencia de neuralgia postherpética un 66%.
El tratamiento antiviral sistémico del HZ está claramente recomendado en pacientes imunodeprimidos o en los inmunocompetentes que cumplan alguno de los siguientes criterios: 50 años o más, dolor moderado a intenso, exantema moderado a grave o afectación extratroncal12. Los resultados de ensayos clínicos aleatorizados controlados y de metaanálisis indican que la administración de aciclovir, valaciclovir, famciclovir o brivudina50(tabla 2) en las primeras 72h tras la aparición del exantema reducen la gravedad y la duración de éste, la formación de nuevas vesículas y el dolor agudo. Asimismo, los resultados de los metaanálisis y de la mayoría (aunque no todos)51 los ensayos clínicos aleatorizados han demostrado una reducción de la incidencia y la duración de la neuralgia postherpética. En los ensayos clínicos comparativos, el famciclovir, el valaciclovir y la brivudina han demostrado una eficacia similar en cuanto a curación de lesiones cutáneas y reducción del dolor agudo12. El famciclovir administrado en distintas pautas (250mg/8h, 500mg/12h o 750mg/24h por vía oral) ha demostrado una eficacia comparable al aciclovir (800mg 5 veces al día por vía oral)52,53. El famciclovir, el valaciclovir y la brivudina han demostrado una eficacia algo superior al aciclovir en lo que se refiere a la duración de la neuralgia postherpética50,54. Esto podría deberse en parte al mejor perfil farmacocinético del famciclovir, el valaciclovir y la brivudina en comparación con el aciclovir cuando éste se administra por vía oral (tabla 1). Los antivirales por vía tópica carecen de eficacia. La administración intravenosa de aciclovir es de elección en los pacientes gravemente inmunodeprimidos, dado que ha demostrado prevenir la diseminación del VVZ habitual en estos pacientes. Los pacientes trasplantados con sospecha de diseminación visceral (encefalitis o neumonitis) deben recibir aciclovir intravenoso en dosis altas (10mg/kg o 500mg/m2 cada 8h)12,16. Cuando la inmunodepresión es de menor gravedad, puede valorarse la administración oral (tabla 2)12.
El HZ debe tratarse dentro de las primeras 72h de la aparición de las lesiones cutáneas para minimizar el daño neuronal; sin embargo, este límite se debe a la escasez de estudios que evalúan el inicio posterior del tratamiento. Algunos pacientes podrían beneficiarse del tratamiento antiviral iniciado aun después de que hayan transcurrido más de 72h, entre ellos: a) los que presenten aparición de nuevas vesículas (la aparición de nuevas vesículas después de 7 días alerta sobre una posible inmunodeficiencia); b) pacientes de 50 años o más; c) pacientes que tengan dolor intenso o alteraciones neurológicas para reducir el riesgo de neuralgia postherpética; d) pacientes con HZ oftálmico, ya que en un pequeño porcentaje de pacientes puede dar lugar a secuelas graves, como inflamación ocular crónica, pérdida de visión y dolor, y e) pacientes con afectación grave (neumonitis, encefalitis)12,13. En pacientes con infección por el VIH se recomienda iniciar el tratamiento aun después de las 72h debido a que es frecuente la aparición de lesiones durante más de una semana y a que la afectación de la rama oftálmica del trigémino reviste una especial gravedad36. En general, se recomienda una duración del tratamiento de 7 días, dado que la información disponible sugiere un beneficio mínimo con una duración superior; sin embargo, se requieren más estudios al respecto. Debe considerarse prolongar el tratamiento en los pacientes que presenten nuevas vesículas tras 7 días de tratamiento o en aquellos que presenten complicaciones cutáneas, motoras, oculares o neurológicas. En los pacientes con infección por el VIH, debido al riesgo de recaída, debe mantenerse el tratamiento hasta la curación de las lesiones.
Aunque es poco frecuente, se han descrito cepas del VVZ resistentes al aciclovir en pacientes inmunodeprimidos con infección por el VIH55. Ante la presencia de lesiones atípicas o la ausencia de curación con el tratamiento antiviral después de un tratamiento correcto, debe evaluarse la presencia de resistencia. En caso de resistencia al aciclovir, puede utilizarse foscarnet56 o cidofovir (aunque este último no se recomienda en caso de encefalitis debido a su escasa penetración en el sistema nervioso central)12. Finalmente, durante el embarazo, si bien puede producirse varicela congénita, no se ha documentado su asociación con HZ materno. Se recomienda tratar a las mujeres embarazadas cuando el beneficio potencial sea superior al riesgo (exantema grave, dolor agudo intenso o HZ oftálmico). El fármaco de elección es el aciclovir. Durante los últimos meses de embarazo, el riesgo potencial para el feto es menor12.
Respecto a la profilaxis del VHS y el VVZ, en pacientes inmunodeprimidos seronegativos puede emplearse la inmunoglobulina inespecífica después de un contacto de riesgo, como ya se ha descrito anteriormente. Si se han sobrepasado las 96h después del contacto, puede valorarse la profilaxis posexposición con antivirales orales57. En pacientes trasplantados seronegativos, puede emplearse en la vacuna con el virus de la varicela atenuado. Esta vacuna debe administrarse como mínimo de 4 a 6 semanas antes del trasplante y está contraindicada en el postrasplante. Debería también administrarse a sus contactos próximos. Las profilaxis empleadas habitualmente para el CMV son también activas frente al VHS y al VVZ; sin embargo, si se utiliza tratamiento anticipado para el CMV, se recomienda el empleo de profilaxis con antivirales entre 30 y 90 días postrasplante. Se han empleado dosis de aciclovir de entre 200 y 400mg/8–12h57. Boeckh et al15 realizaron un ensayo clínico aleatorizado, doble ciego y controlado con placebo para evaluar la eficacia de una profilaxis a largo plazo con aciclovir para la prevención de la enfermedad por el VVZ después de un alo-TPH. Se incluyó a 77 pacientes que recibieron aciclovir (800mg/12h) o placebo desde 1–2 meses hasta un año después del trasplante. El aciclovir redujo significativamente las infecciones por el VVZ hasta el primer año después del alo-TPH (HR: 0,16), si bien este efecto beneficioso no se mantuvo después de la suspensión de la profilaxis.
A continuación se describen los principales antivirales utilizados en las infecciones por VHS y VVZ, así como los nuevos fármacos en investigación. Sus principales características se describen en la tabla 1, sus indicaciones y pautas posológicas se indican en la tabla 2 y su ajuste de dosis en caso de insuficiencia renal en la tabla 3.
AciclovirEl aciclovir es un nucleósido sintético análogo de la purina, estructuralmente relacionado con la guanina. Para su activación requiere la fosforilación a su derivado trifosfato. La timidina-cinasa viral convierte al aciclovir en aciclovir monofosfato (de ahí la selectividad por las células infectadas) y, posteriormente, enzimas celulares realizan la conversión a difosfato y trifosfato activo. El aciclovir trifosfato inhibe la síntesis del ADN y la replicación viral, compite con la desoxiguanosina trifosfato por la ADN-polimerasa viral y se incorpora en el ADN viral, lo que causa la terminación de la cadena. Este proceso es altamente selectivo para las células infectadas. El aciclovir intravenoso es el fármaco de elección para el tratamiento de las infecciones graves causadas por el VHS tipo 1 y 2 o el VVZ. En las infecciones menos graves puede utilizarse por vía oral, aunque su biodisponibilidad es baja. El VHS puede desarrollar resistencia a aciclovir a través de la selección de mutantes deficientes en timidina-cinasa o de la alteración de la especificidad del substrato por parte de esta enzima. Sin embargo, los virus deficientes en timidina-cinasa suelen presentar una menor infectividad. Más raramente, las resistencias pueden producirse mediante mutaciones del gen de la ADN-polimerasa viral58. A pesar de su amplio uso, la frecuencia de aparición de resistencias a aciclovir es baja (el 0,3% en pacientes inmunocompetentes y el 6–12% en los inmunodeprimidos)58. Las cepas del VHS resistentes a aciclovir habitualmente presentan resistencia cruzada a penciclovir y a famciclovir3. Las infecciones por el VHS o el VVZ resistentes a aciclovir pueden responder a foscarnet5, ya que este fármaco no requiere la timidina-cinasa viral para su activación.
Dado que el aciclovir se elimina principalmente inalterado por vía renal, debe ajustarse la dosis en pacientes con insuficiencia renal (tabla 3). Debe utilizarse también con precaución en pacientes con alteraciones neurológicas, hipoxia importante, alteraciones electrolíticas e insuficiencia hepática grave.
El aciclovir puede causar alteraciones gastrointestinales, cefalea y erupciones cutáneas. Por vía intravenosa puede producir flebitis e inflamación en las zonas de infusión o extravasación. El aciclovir intravenoso también puede causar disfunción renal reversible debida a nefropatía cristalina; la infusión rápida, la deshidratación, la insuficiencia renal y las dosis altas aumentan el riesgo. Es por esto que debe administrarse en perfusión lenta (1h), asegurar una adecuada hidratación del paciente y evitar la asociación a otros nefrotóxicos. El fármaco por vía intravenosa (y raramente por vía oral) se ha asociado a encefalopatía, incluyendo letargia, somnolencia, temblores, alucinaciones, convulsiones y coma. El riesgo es mayor en ancianos y en pacientes con insuficiencia renal. Raramente se ha descrito hepatitis. Se han descrito algunos casos de púrpura trombótica trombocitopénica y síndrome hemolítico-urémico en pacientes inmunodeprimidos que recibieron dosis altas por vía parenteral.
Por vía tópica, especialmente cuando se aplica a lesiones genitales, puede producir escozor, prurito y eritema. La pomada ocular puede producir también escozor, blefaritis o conjuntivitis.
ValaciclovirEl valaciclovir es un profármaco del aciclovir (éster de valina) que se metaboliza casi totalmente a aciclovir tras su administración oral. Su eficacia es similar a la del aciclovir y su mejor biodisponibilidad (55%) permite una posología más cómoda. Con 2g/8h de valaciclovir por vía oral se alcanzaron unas concentraciones plasmáticas similares a las alcanzadas con 10mg/kgc/8h de aciclovir por vía intravenosa59 y de 3 a 4 veces mayores a las alcanzadas con aciclovir oral11. El valaciclovir requiere ajuste de dosis en caso de insuficiencia renal (tabla 3). Suele tolerarse bien, con efectos adversos superponibles al aciclovir dado que es su profármaco.
PenciclovirAl igual que el aciclovir, es un análogo de guanosina pero, debido a su escasa biodisponibilidad oral, solamente está indicado por vía tópica en el tratamiento del herpes labial. Su posología es incómoda (cada 2h, excepto de noche) y su eficacia limitada, por lo que se lo utiliza poco.
FamciclovirEl famciclovir es un profármaco (diacetilester) del penciclovir y se convierte rápidamente en éste tras su administración oral. Constituye una alternativa al aciclovir con una mejor biodisponibilidad (75%). Al igual que el aciclovir y el valaciclovir, requiere fosforilación mediante la timidina-cinasa viral y es un inhibidor competitivo de la ADN-polimerasa, sin embargo, se diferencia en que no causa terminación de la cadena58. Aunque el aciclovir tiene mayor afinidad por la ADN-polimerasa viral, el penciclovir trifosfato tiene una mayor semivida intracelular17, lo que se traduce en una eficacia clínica similar. Su larga semivida permite pautas posológicas más cómodas, aunque su coste es mayor. Es activo frente al VHS-1 y 2 y el VVZ. No obstante, las cepas del virus del VHS y del VVZ resistentes a aciclovir o valaciclovir suelen presentar resistencia cruzada a famciclovir. Las resistencias a famciclovir se asocian a mutaciones en la timidina-cinasa viral y, en menor medida, en el gen de la ADN-polimerasa17.
Dado que el famciclovir se elimina principalmente inalterado por vía renal, debe ajustarse la dosis en pacientes con insuficiencia renal (tabla 3). Los efectos adversos más frecuentes de este fármaco son cefalea, náuseas y diarrea.
BrivudinaLa brivudina es un análogo de la timidina con una elevada potencia y selectividad in vitro frente al VVZ y al VHS-1. La brivudina está indicada en el tratamiento del HZ en pacientes adultos y no debe administrarse a pacientes inmunodeprimidos. La brivudina no debe administrarse conjuntamente con 5-fluorouracilo, incluyendo también sus preparaciones tópicas o sus profármacos (por ejemplo, capecitabina, floxuridina, tegafur) u otras 5-fluoropirimidinas (por ejemplo, flucitosina). Ello se debe a que el principal metabolito de la brivudina, el bromoviniluracilo, inhibe la enzima dihidropirimidina deshidrogenasa, encargada del metabolismo de las 5-fluoropirimidinas, por lo que estos fármacos podrían acumularse y producir toxicidad hematológica grave (potencialmente mortal) por supresión de la médula ósea. Es necesario respetar un intervalo mínimo de 4 semanas antes de iniciar un tratamiento con fármacos 5-fluoropirimidínicos y, como precaución adicional, debe monitorizarse la actividad de la enzima dihidropirimidina dehidrogenasa antes de iniciar cualquier tratamiento con 5-fluoropirimidinas en pacientes a los que se haya tratado recientemente con brivudina. No se requiere ajuste de dosis en ancianos ni en caso de insuficiencia renal o hepática12,60–62.
Nuevos fármacosSe están investigando nuevas formulaciones para mejorar el perfil farmacocinético del aciclovir (polímeros solubles, micropartículas y liposomas, entre otros) y optimizar su eficacia terapéutica, aunque estas formulaciones tardarán todavía en estar disponibles para su uso en la clínica diaria63. Los antivirales empleados en la actualidad para tratar el VHS tienen como diana terapéutica la ADN-polimerasa del virus. Una diana alternativa es el complejo enzimático helicasa primasa del VHS-1 y 2. El primer fármaco descubierto del grupo fue el T157602. Otros fármacos en investigación que actúan sobre este complejo son el BILS 179BS, el BILS 22BS y el BAY 57-1293. Todos ellos son potentes inhibidores de la replicación del VHS. El BAY 57-1293 ha demostrado una actividad superior a los antivirales disponibles en la actualidad en modelos animales y podría ser una alternativa terapéutica útil, incluso en caso de resistencia a aciclovir. Sin embargo, un inconveniente es la facilidad con la que aparecen resistencias a estos fármacos in vitro. Se han detectado aislados resistentes a BAY 57-1293 en aislados clínicos del VHS-164.
Respecto al VVZ, se encuentra en investigación una nueva clase de análogos de nucleósidos con estructura de pirimidina bicíclica. Estos fármacos presentan una actividad selectiva para el VVZ (no son activos frente al VHS ni otros virus) debido a una elevada selectividad por la timidina-cinasa del VVZ. Se cree que su diana terapéutica es la ADN-polimerasa del VVZ. Sus compuestos más representativos son el Cf 1743 y su éster de valina, el FV-100, con una mejor farmacocinética. Se están realizando los primeros ensayos clínicos con FV-10064.
Antivirales activos frente a citomegalovirusEl CMV es un betaherpesvirus ubicuo que infecta a animales y humanos. Entre un 40 y un 90% de la población es seropositiva para CMV33. El CMV puede causar infección o enfermedad: infección es la evidencia de replicación viral en ausencia de síntomas clínicos, mientras que la enfermedad por CMV es la presencia de replicación viral asociada a sintomatología, que puede ir desde un síndrome viral hasta una enfermedad invasiva. Existen métodos de detección precoz que permiten detectar la presencia de infección antes de que aparezca la enfermedad. Los métodos empleados con mayor frecuencia son la antigenemia (detección del antígeno pp65 del virus en leucocitos de sangre periférica) y la detección del ADN del virus mediante reacción en cadena de la polimarasa (PCR)65.
Tras la infección primaria, que suele pasar desapercibida, el CMV humano persiste en una forma latente que puede reactivarse y producir enfermedad por CMV. Esta reactivación suele producirse en pacientes inmunodeprimidos (trasplantados o con infección por el VIH) o en huéspedes con el sistema inmunológico inmaduro. En los pacientes con infección por el VIH, suele ser más frecuente en aquéllos con inmunodepresión avanzada (CD4<50/μl) que no reciben tratamiento antirretroviral o en los que éste ha fracasado36. En el paciente trasplantado, la infección por CMV puede ser por reactivación en un receptor seropositivo (R+) o también como consecuencia de una exposición primaria al virus (por el injerto o por la administración de productos sanguíneos) en un receptor seronegativo (R-) o bien de la reinfección por una segunda cepa viral procedente del donante en un R+66. Los trasplantes con mayor riesgo son aquellos en los que el donante es seropositivo (D+) y el receptor es R-, dado que el receptor carece de inmunidad frente al CMV; en cambio, se ha relacionado la presencia de una elevada respuesta CD8 específica frente al CMV con un menor riesgo de enfermedad33. Respecto al tipo de trasplante, el riesgo es elevado en el alotrasplante de pulmón, intermedio en los de páncreas y corazón, y bajo en los de hígado y riñón. El riesgo está también relacionado con el tipo de tratamiento inmunodepresor utilizado, y es mayor con la administración de anticuerpos antitimocíticos u OKT3 (muromonab-CD3)33. En los pacientes con TPH, el riesgo de enfermedad por CMV es mayor en el trasplante alogénico que en el autógeno. La aparición de enfermedad del injerto contra el huésped es un factor de riesgo para la infección por CMV. Tanto en el TOS como en el TPH, la infección por CMV suele producirse en los 3 primeros meses, aunque el empleo de medidas profilácticas ha hecho que se vean reactivaciones tardías (>100 días), que tienen el mismo pronóstico desfavorable y deben tratarse67.
La presentación clínica más común y menos grave es el síndrome mononucleósico, que consiste en la aparición de fiebre, mialgias, artralgias, odinofagia y mal estado general, junto con leucocitopenia, trombocitopenia y elevación ocasional de las enzimas hepáticas66. En pacientes inmunodeprimidos, la infección activa por CMV puede producir enfermedad invasiva (nefritis, hepatitis, miocarditis, pancreatitis, colitis, esofagitis o retitinitis) y afectación del SNC, así como efectos indirectos: enfermedades linfoproliferativas, síndrome de Guillain-Barré, enfermedades cardiovasculares y afectación crónica del injerto68. La inmunodepresión que produce puede facilitar la aparición de enfermedades oportunistas65.
El tratamiento de elección (tabla 2) es el ganciclovir intravenoso. La duración del tratamiento varía habitualmente entre las 2 y las 4 semanas en función de la respuesta clínica y virológica33. El ganciclovir oral ya no se utiliza debido a su escasa biodisponibilidad. En su lugar se emplea el valganciclovir, profármaco del ganciclovir que se administra por vía oral y ha demostrado una eficacia comparable al ganciclovir con incluso mayor actividad antiviral (menor incidencia de viremia y picos menores de carga viral de CMV durante el tratamiento con valganciclovir)33. El estudio VICTOR, un ensayo clínico aleatorizado y multicéntrico en el que se incluyó a 321 pacientes con TOS e infección por CMV, demostró que el valganciclovir frente al ganciclovir intravenoso no es inferior (ambos se utilizaron durante 21 días en dosis de tratamiento, seguido de valganciclovir en dosis profilácticas durante 28 días)69. Len et al, investigadores de la Red de Estudio de Infección en el Trasplante (RESITRA)70, presentaron los resultados de un estudio prospectivo de cohortes en el que se compararon 3 estrategias (ganciclovir intravenoso, ganciclovir intravenoso seguido de valganciclovir oral o únicamente valganciclovir oral) en el tratamiento de la enfermedad por CMV en pacientes con TOS. Se incluyó a 3.467 pacientes que se siguieron durante 2 años. No se observaron diferencias significativas en cuanto a eficacia entre las 3 pautas70.
El tratamiento durante un tiempo prolongado o con dosis subóptimas puede favorecer la aparición de cepas resistentes a ganciclovir (y, por tanto, a valganciclovir). La frecuencia de aparición de cepas de CMV resistentes a ganciclovir en pacientes con TOS puede llegar a un 5–15% en grupos de alto riesgo, como el de trasplante de pulmón. En caso de resistencia a ganciclovir puede emplearse foscarnet. La resistencia a foscarnet es excepcional entre las cepas de CMV resistentes a ganciclovir32. El cidofovir es de segunda elección debido a su toxicidad y habitualmente conserva su actividad frente a CMV resistentes a los anteriores.
Después del tratamiento de inducción durante 3 semanas (2 semanas en caso del cidofovir), los pacientes inmunodeprimidos requieren tratamiento de mantenimiento para evitar las recaídas. Este puede realizarse con dosis menores de ganciclovir intravenoso o valganciclovir oral (tabla 2). En pacientes con retinitis por CMV, las pautas que incluyen implantes intraoculares de ganciclovir consiguen mejores resultados y reducen sustancialmente la progresión de la retinitis en comparación con las que incluyen solo ganciclovir intravenoso. Estos implantes deben ir asociados a tratamiento sistémico con ganciclovir o vanganciclovir para evitar la infección del ojo contralateral o la diseminación extraocular10,36. El aciclovir no debe emplearse en el tratamiento del CMV dado que su actividad es mucho menor y los ensayos clínicos no han demostrado beneficio33.
En los pacientes trasplantados hay 2 estrategias para prevenir la enfermedad por CMV: la profilaxis y el tratamiento anticipado. La profilaxis consiste en la administración de un antiviral con actividad frente a CMV en dosis profilácticas a un paciente sin síntomas clínicos ni datos microbiológicos de infección por CMV durante un período de tiempo determinado de mayor riesgo de infección. Su objetivo es evitar la infección en pacientes seronegativos para CMV o la reactivación en pacientes seropositivos para CMV. El tratamiento anticipado consiste en la administración de un antiviral con actividad frente a CMV en dosis terapéuticas en un paciente sin síntomas pero con datos de infección por CMV mediante antigenemia o PCR. Estas determinaciones deben realizarse de forma periódica y debe iniciarse tratamiento ante una única determinación positiva de antigenemia o 2 determinaciones consecutivas positivas de PCR71. No existe consenso acerca de cuál de los 2 abordajes (profilaxis o tratamiento anticipado) es mejor. La selección de uno u otro se realizará en función de diferentes factores, incluyendo el riesgo del paciente. La profilaxis ha demostrado reducir la incidencia de enfermedad por CMV y enfermedades oportunistas, así como la mortalidad relacionada con CMV y la mortalidad por todas las causas. Adicionalmente, previene la reactivación del VHS y del VVZ33. En general, la profilaxis suele reservarse para los pacientes con mayor riesgo, dado que implica un mayor tiempo de exposición al fármaco. El tratamiento anticipado presenta las ventajas de una menor exposición al fármaco (que teóricamente reduciría el riesgo de aparición de resistencias), toxicidad y coste. Sin embargo, el éxito de su aplicación depende de la posibilidad de realizar de forma continuada y periódica las determinaciones de antigenemia o PCR. Kalil et al72 y Small et al73 realizaron 2 metanálisis en los que comparaban la profilaxis con el tratamiento anticipado. Estos autores concluyeron que ambas aproximaciones reducen la enfermedad por CMV en comparación con placebo, sin que se observen diferencias significativas; sin embargo, sólo la profilaxis ha demostrado ser efectiva en los pacientes de alto riesgo (D+/R-). Si bien ambas redujeron el rechazo, sólo la profilaxis redujo las infecciones bacterianas y fúngicas72. Una revisión de la biblioteca Cochrane evaluó el riesgo-beneficio del tratamiento antiviral para la prevención de la enfermedad por CMV y la mortalidad en el TOS. Se concluye que, cuando el receptor es R+ o cuando es R- y el donante es D+, la profilaxis con aciclovir, valaciclovir o ganciclovir, en comparación con placebo o ausencia de tratamiento, reduce significativamente el riesgo de enfermedad por CMV (19 estudios: riesgo relativo [RR] de 0,42; IC95%: 0,34–0,52), infección por CMV (17 estudios: RR de 0,61; IC95%: 0,48–0,77) y muerte por todas las causas (17 estudios: RR de 0,63; IC95%: 0,43–0,92). En los estudios que comparaban directamente diferentes fármacos, el ganciclovir fue más efectivo que el aciclovir en la prevención de la enfermedad por CMV (RR de 0,37; IC95%: 0,23–0,60)74.
En pacientes con TPH, la administración de ganciclovir como profilaxis uniforme, una vez que el injerto funcione, ha conseguido reducir la infección y la enfermedad por CMV de forma significativa con respecto a placebo (el 0–10 frente al 24–29%), pero con un aumento no despreciable de períodos adicionales de neutrocitopenia (30–50%) y un RR de infección bacteriana 4,3 veces mayor. Además, esta estrategia no se acompaña de una disminución de la mortalidad global y favorece la aparición de enfermedades tardías al suprimirse la profilaxis por falta de reconstitución inmunológica34. El valganciclovir ha demostrado una buena biodisponibilidad incluso en pacientes con enfermedad del injerto contra el huésped intestinal de grados i y ii71. El aciclovir y el valaciclovir son alternativas aceptables para evitar la toxicidad del ganciclovir, el valganciclovir o el foscarnet en profilaxis prolongadas. Sin embargo, dado que su eficacia frente a CMV es modesta, han de emplearse siempre bajo elevada supervisión y tratamiento anticipado de la infección por CMV con ganciclovir, valganciclovir o foscarnet71. No se recomienda el empleo de inmunoglobulinas para la prevención de la infección o enfermedad por CMV en el TPH65.
En el 2005 se publicaron en esta revista las recomendaciones del Grupo de Estudio de la Infección en el Trasplante de la SEIMC y la RESITRA sobre prevención y tratamiento de la infección por CMV en pacientes trasplantados, en las que discuten ampliamente los aspectos comentados anteriormente65. Los Dres. Humar y Chou33 realizan una excelente revisión sobre el CMV en el TOS. Se recomienda asimismo consultar los protocolos clínicos de la SEIMC32 y los propios de cada centro (en la tabla 2 se indican las dosificaciones de antivirales activos frente a CMV en las situaciones clínicas más frecuentes).
A continuación se describen los principales antivirales utilizados en las infecciones por CMV así como los nuevos fármacos en investigación.
GanciclovirEs un antiviral relacionado estructuralmente con el aciclovir. Al igual que éste, el ganciclovir requiere fosforilación a su forma activa, a la primera de las cuales realiza una proteincinasa viral (UL 97). El ganciclovir inhibe la unión de la desoxiguanosina trifosfato a la ADN-polimerasa, lo que da como resultado la inhibición de la síntesis del ADN viral. Actúa tan sólo frente a virus en replicación y no es activo frente a virus latentes. Es activo frente al VHS y al CMV, sin embargo, el uso clínico está limitado debido a su toxicidad. El 5–15% de los pacientes abandonan el tratamiento por este motivo.
El ganciclovir se utiliza en el tratamiento de la retinitis y otras infecciones graves por CMV en inmunodeprimidos (con sida, trasplantados, en quimioterapia antineoplásica), tanto en profilaxis y tratamiento anticipado como en el tratamiento mismo. Con el tratamiento prolongado pueden aparecer resistencias. Éstas se deben habitualmente a mutaciones del gen UL97, aunque también puede producirse por mutaciones del gen UL54 (pol) o ambos. La mutación del UL54 aparece después de tratamientos prolongados y puede condicionar resistencia a otros fármacos como cidofovir o foscarnet. Las mutaciones de UL54 pueden conferir resistencia cruzada a ganciclovir-foscarnet (raramente) o a ganciclovir-cidofovir. La resistencia cruzada a ganciclovir-foscarnet-cidofovir es excepcional33.
El ganciclovir alcanza unas concentraciones elevadas en el SNC (el 67% de las plasmáticas). Se elimina principalmente por vía renal, por lo que requiere ajuste de dosis en pacientes con insuficiencia renal (tabla 3). Está contraindicado en el embarazo por su efecto mutagénico. Se recomienda utilizar medidas anticonceptivas durante su uso y hasta 90 días después. En niños, deben extremarse las precauciones por su carcinogenicidad y toxicidad gonadal.
Los efectos adversos observados con más frecuencia incluyen alteraciones hematológicas (anemia, neutropenia y trombocitopenia), que suelen ser reversibles y cuyo riesgo aumenta con la asociación a otros fármacos mielotóxicos como la zidovudina, la azatioprina o el micofenolato de mofetilo, entre otros. La mielosupresión es un problema especialmente importante en los pacientes con trasplante de médula ósea y suele aparecer durante la segunda semana de tratamiento. Se recomienda suspender el tratamiento cuando el recuento de neutrófilos sea <500cél/μl o el de plaquetas <25.000/μl hasta que éstos aumenten a 750cél/μl o 50.000/μl, respectivamente75. La administración de factores estimulantes de colonias de granulocitos puede ser útil para la recuperación de los neutrófilos. Otros efectos secundarios que pueden aparecer son alteraciones gastrointestinales, desprendimiento de retina (en pacientes con retinitis por CMV), nefrotoxicidad (15%), fiebre, erupciones cutáneas, flebitis, confusión, cefalea, alteración en las pruebas de función hepática y, raramente, alteraciones psiquiátricas y convulsiones.
ValganciclovirEs un profármaco del ganciclovir con una biodisponibilidad 10 veces mayor que éste. Tras su absorción, rápidamente se convierte en ganciclovir a través del metabolismo de primer paso intestinal y hepático, por lo que sus precauciones y efectos secundarios serán los del ganciclovir. El valganciclovir debe administrarse con alimentos. Por vía oral, con una dosis de 900mg se alcanzan concentraciones plasmáticas similares a las obtenidas con una dosis de 5mg/kg de ganciclovir intravenoso76.
FoscarnetAntiviral utilizado en el tratamiento de la retinitis por CMV, incluso en la enfermedad progresiva por cepas resistentes a ganciclovir, y en las infecciones por el VHS o el VVZ resistentes a aciclovir ya que, a diferencia del aciclovir o el ganciclovir, no requiere la proteincinasa viral para activarse. Se administra directamente en la forma activa y actúa inhibiendo la ADN-polimerasa viral. Aunque es poco frecuente, durante el tratamiento pueden aparecer cepas de VHS, VVZ o CMV resistentes a foscarnet por mutación de la polimerasa viral. La asociación de foscarnet y ganciclovir es sinérgica in vitro y puede ser beneficiosa en algunos pacientes con resistencia a ganciclovir. Sin embargo, su asociación no aporta ventajas desde el punto de vista clínico en ausencia de resistencias a ganciclovir65. Se han descrito cepas de CMV resistentes a ambos fármacos. En pacientes con infección por el VHS resistente a foscarnet, el cidofovir puede ser de utilidad (no debe emplearse en caso de encefalitis)36.
Debido a su escasa absorción por vía oral, el foscarnet se administra solamente por vía intravenosa. La presentación comercial al 2,4% (24mg/ml) puede administrarse sin diluir por una vía central, o diluido a la mitad (12mg/ml) con suero salino fisiológico o suero glucosado al 5% si se administra por vía periférica. Se elimina principalmente por vía renal y es muy nefrotóxico, por lo que las dosis deben ajustarse adecuadamente en presencia de alteración de la función renal (tabla 3). Cabe recordar que la nefrotoxicidad del foscarnet se incrementa con el uso simultáneo de ciclosporina o tacrolimus, lo que supone una limitación para su uso en pacientes trasplantados32.
El uso de foscanet está contraindicado durante el embarazo y lactancia, en niños y en pacientes con insuficiencia renal moderada-grave.
Es un fármaco muy nefrotóxico que puede llegar a producir insuficiencia renal en un tercio de los pacientes tratados. La insuficiencia renal suele ser reversible, sin embargo, en algunos casos puede llegar a ser necesaria la realización de hemodiálisis. Debe evitarse en lo posible la asociación a otros fármacos nefrotóxicos e hidratar correctamente al paciente. Se recomienda monitorizar la creatinina sérica cada 48h en el tratamiento de inducción y cada 7 días durante el mantenimiento. Otros efectos adversos son náuseas, vómitos, anemia, fatiga, cefalea, ulceraciones genitales, alteraciones nerviosas centrales, hipocalcemia (y con menor frecuencia hipercalcemia), hipofosfatemia o hiperfosfatemia, hipopotasemia e hipomagnesemia. El riesgo de hipocalcemia grave aumenta con su asociación a la pentamidina, por lo que esta asociación está contraindicada.
CidofovirEl cidofovir es un análogo nucleósido sintético que lleva ya incorporada una fosforilación y por esto, al igual que el foscarnet, no requiere proteincinasas virales para su activación. Cinasas intracelulares fosforilan el cidofovir a cidofovir difosfato, que actúa como inhibidor competitivo de la ADN-polimerasa viral. El cidofovir presenta un amplio espectro de actividad frente a virus de tipo ADN, incluyendo herpesvirus, adenovirus, papilomavirus y poxvirus. De entre los poxvirus, presenta actividad frente a virus vacunal, viruela, Molluscum contagiosum y orfvirus. De la familia herpesvirus, destaca su actividad frente a CMV, única indicación para la que está autorizado. Sin embargo, debido a su elevada toxicidad, constituye una alternativa de segunda elección. Puede aparecer resistencia a cidofovir por mutación de la polimerasa viral. Sin embargo, habitualmente cidofovir mantiene la eficacia frente al VHS resistente a aciclovir y al CMV resistente a ganciclovir y foscarnet. El cidofovir puede ser una alternativa a la ribavirina (RBV) en infecciones graves por adenovirus. Un aspecto interesante ante la amenaza de bioterrorismo es la actividad del cidofovir frente al virus de la viruela.
Debido a su baja biodisponibilidad oral, cidofovir se administra solamente por vía intravenosa, aunque en la actualidad se están investigando profármacos para poder administrarlo por vía oral64. El cidofovir se elimina a través del riñón por filtración glomerular y secreción tubular, por lo que requiere ajuste de dosis en caso de insuficiencia renal (tabla 3). Su semivida de eliminación en fase terminal es de 2,5h, aunque la vida media intracelular de su forma activa puede llegar hasta 65h.
El cidofovir está contraindicado en pacientes con insuficiencia renal moderada-grave y la función renal debe monitorizarse antes de cada administración. Se recomienda también realizar exploraciones oftalmológicas y recuento de neutrófilos periódicamente, ya que puede aparecer neutrocitopenia hasta en un 20% de los pacientes.
El cidofovir ha mostrado carcinogenicidad y embriotoxicidad en animales, por lo que no se debe administrar durante el embarazo (se recomienda que ambos miembros de la pareja utilicen métodos anticonceptivos complementarios). Las mujeres deben mantener el método anticonceptivo hasta un mes después y los hombres hasta 3 meses después de finalizado el tratamiento. También puede producir infertilidad masculina.
El cidofovir presenta una elevada toxicidad, especialmente renal y ocular (nefrotoxicidad, neutrocitopenia y acidosis metabólica, iritis, uveítis e hipotonía ocular), que ha causado la interrupción del tratamiento en aproximadamente un 25% de los pacientes. Se han descrito casos de insuficiencia renal aguda después de la primera o la segunda dosis, incluyendo casos mortales. El cidofovir solamente puede administrarse por vía intravenosa y para reducir la toxicidad renal es necesario hidratar al paciente con suero fisiológico (un litro pasado en 1–2h antes de la administración de cidofovir y, si puede recibir fluidos adicionales, otro litro en 1–3h, empezando al mismo tiempo o justo después de finalizar la perfusión del fármaco) y coadministrar probenecid (2g 3 horas antes y 1g a las 2h y 8h postinfusión). Puede mostrar toxicidad aditiva con otros nefrotóxicos, por lo que éstos deben suspenderse por lo menos 7 días antes de la administración de cidofovir. Los pacientes que presenten hipotonía ocular deben abandonar el tratamiento con cidofovir, en cambio, la uveítis y la iritis aisladas pueden responder a la aplicación tópica de corticoides y ciclopléjicos, y permiten continuar el tratamiento con cidofovir. Sin embargo, si la sintomatología no remite, el cidofovir debe suspenderse. Otros efectos secundarios descritos son náuseas, vómitos, fiebre, astenia, reacciones cutáneas, alopecia, disnea, alteración de las pruebas de función hepática, pancreatitis, neutropenia reversible y diabetes insípida nefrogénica.
FomivirsenEs un oligonucleósido antisentido utilizado por vía intravítrea para el tratamiento de la retinitis por CMV en pacientes con infección por el VIH que no toleran otros fármacos o no han respondido a ellos. Se encuentra comercializado en algunos países de la Unión Europea, aunque no en España. El fomivirsen actúa uniéndose al ARN mensajero del CMV, induce su degradación y evita así la formación de proteínas necesarias para el virus. Es un fármaco altamente específico para el CMV. Se administra por vía intravítrea y, tras su administración, presenta niveles intravítreos adecuados durante 7–10 días. Se recomienda no utilizarlo en pacientes que hayan recibido cidofovir entre las 2 y las 4 semanas previas.
Los efectos secundarios más frecuentes son uveítis, vitritis, aumento de la presión intraocular y alteraciones visuales.
Nuevos fármacosEl fármaco que se hallaba en fases más avanzadas de desarrollo, era maribavir (benzamidavir, 1263W94).77 Sin embargo, tras no alcanzar los endpoints primarios en un ensayo que evaluaba su eficacia en la profilaxis de la infección por CMV en pacientes sometidos a un TPH, la compañía Viropharma finalizó prematuramente otro estudio con este fármaco en pacientes trasplantados de hígado. A pesar de que no existen estudios bien controlados, se han utilizado en algunos casos los siguientes fármacos: artesunato, leflunomida y adefovir. Algunos estudios han demostrado reducción de la reactivación de la infección por CMV con los inmunodepresores inhibidores de la cinasa mTOR: sirolimus y everolimus78. Se encuentran también en investigación el sevirumab (un anticuerpo anti-CMV dirigido contra la glicoproteína H de la envuelta) y el lobucavir (un análogo de nucleósidos con actividad frente a herpesvirus, incluyendo VHS resistente a aciclovir, CMV resistente a ganciclovir y hepatitis B), así como formulaciones de cidofovir por vía oral79.