El desarrollo de resistencias a numerosos antimicrobianos por parte de diferentes patógenos constituye un grave problema de salud pública, ya que limitan extraordinariamente las opciones de tratamiento en aquellas infecciones causadas por los mismos. Además, la escasa aportación de nuevas moléculas capaces de actuar frente a estas cepas modificadas ha desarrollado la necesidad de explorar otras vías, como puede ser el rescate de antiguos agentes antimicrobianos o las asociaciones de algunos otros que puedan resultar activos1,2. En esta línea, fosfomicina es un antibacteriano conocido desde hace varias décadas, activo frente a una gran variedad de microorganismos, incluyendo cepas de bacilos gramnegativos multirresistentes. Sin embargo, la principal limitación para el uso de fosfomicina en el tratamiento de infecciones sistémicas es la aparición de resistencia durante la terapia, relacionada con la alta frecuencia de mutaciones observada en diferentes estudios in vitro3, aunque esta limitación puede ser evitada utilizando el antibiótico en combinación con otras moléculas, consiguiendo, por otra parte, una actividad antibacteriana sinérgica2,4. Aunque los datos obtenidos in vitro son sugerentes y apuntan en esa dirección, su traslado a la práctica clínica no es demasiado frecuente. Aquí presentamos un caso de infección de malla quirúrgica por una cepa de Enterobacter cloacae productora de carbapenemasa, refractaria a diferentes pautas antimicrobianas, que finalmente pudo ser tratada con éxito con una combinación de ciprofloxacino y fosfomicina que presentaban una actividad sinérgica frente al microorganismo demostrada previamente en el laboratorio.
Se trata de una mujer de 75 años, hipertensa, asmática y con ingresos recientes por reagudizaciones de su EPOC, que en el contexto de uno de ellos desarrolla una incarceración intestinal de una hernia supraumbilical previa. Se realiza intervención quirúrgica con colocación de malla, que en el postoperatorio inmediato presenta signos de infección con fistulización; se aislaron diferentes microorganismos en el cultivo del exudado de la fístula, que fueron tratados con distintos regímenes de antimicrobianos pero sin mejoría clínica sostenida. En la última toma del exudado se aísla una cepa de Enterobacter cloacae productora de una carbapenemasa tipo VIM detectada inicialmente por métodos fenotípicos y posteriormente confirmada por PCR, mediante amplificación de un fragmento interno del gen blaVIM (350nt); no se secuenció el amplicón obtenido, por lo que no se definió la variante enzimática concreta. La cepa era sensible únicamente a tigeciclina y aminoglucósidos. En una TAC abdominal se objetiva una fístula entre colon transverso y una colección de partes blandas adyacente a la malla quirúrgica, instaurándose tratamiento antimicrobiano con amikacina (750mg/día) y tigeciclina (dosis de inicio 100mg, seguidos de 50mg cada 12h por vía parenteral). Dos meses más tarde se interviene de nuevo, extrayéndose parcialmente la malla infectada con cierre de la fístula. La paciente desarrolla un episodio de fracaso renal agudo reversible y al noveno día del postoperatorio presenta un pico febril, aislándose de nuevo en el exudado de la fistulización Enterobacter clocae productor de VIM, resistente ahora a tigeciclina y únicamente sensible a amikacina. Ante la persistencia de la colección infraumbilical, nuevamente observada por TAC, se pauta la combinación de ciprofloxacino (400mg/8h vía parenteral) y fosfomicina (1g/8h vía parenteral), ya que la asociación demostró ser sinérgica para el microorganismo, tanto mediante gradientes de difusión combinados (E-Test) como mediante el diseño de curvas de letalidad con los citados antimicrobianos. A las 24h la paciente queda afebril, objetivándose en los días sucesivos una mejoría clínica y analítica. Un mes más tarde, al alta, se sustituye el tratamiento por ciprofloxacino 500mg/12h por vía oral y fosfomicina 500mg/8h por vía oral. Tras un año de tratamiento se suspende el mismo, permaneciendo la paciente asintomática desde entonces.
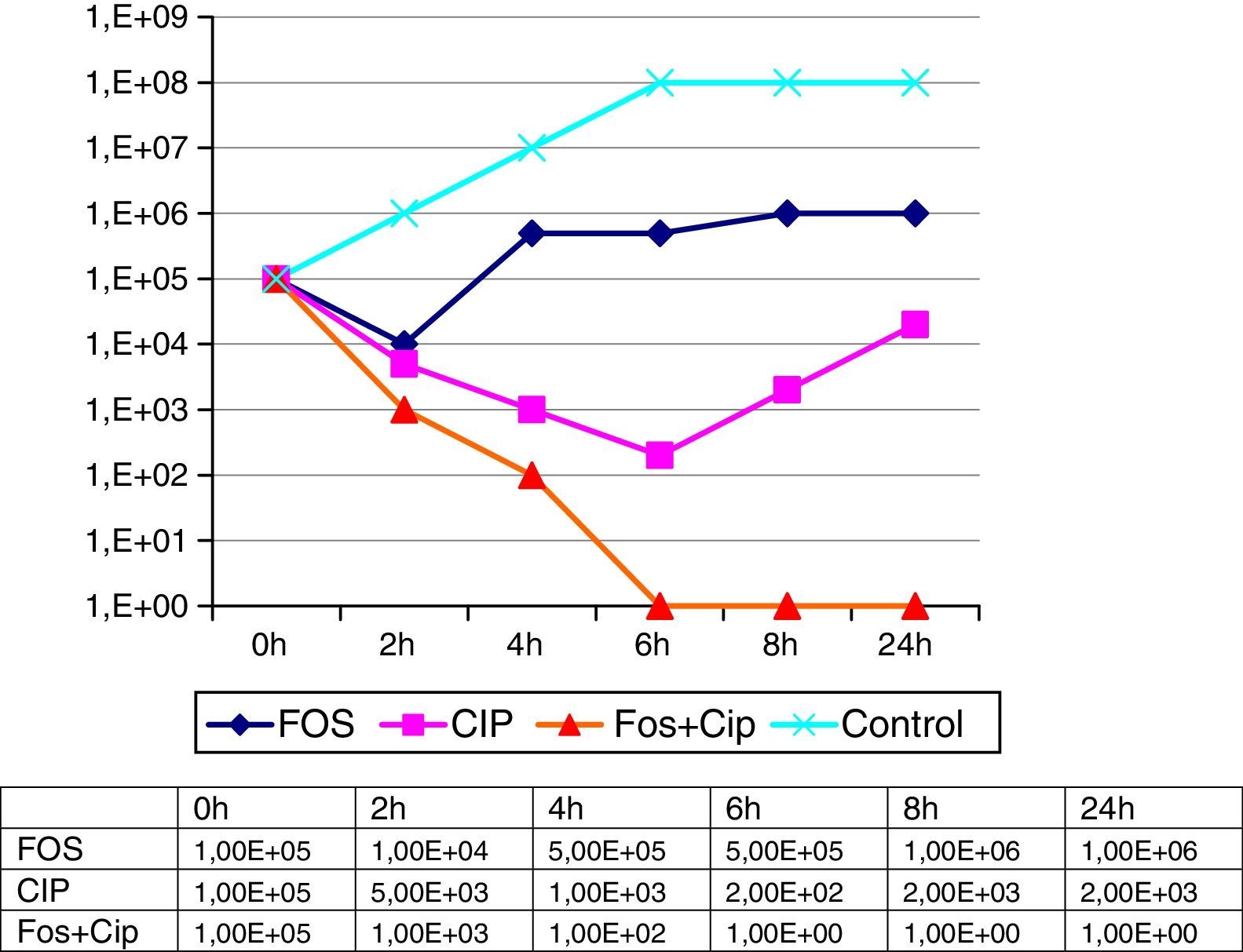
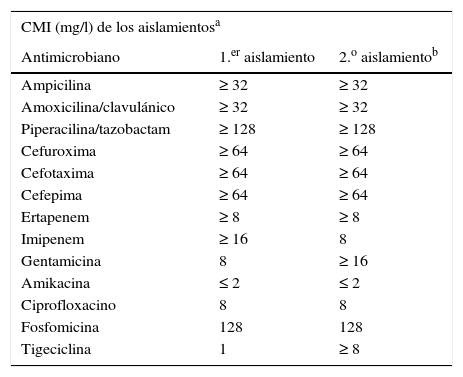
Las concentraciones mínimas inhibidoras de las cepas aisladas fueron las mismas en ambas ocasiones, mostrando un patrón de alta resistencia frente a la mayoría de los antimicrobianos probados (tabla 1). Los análisis fenotípicos de los aislamientos presentaron idéntico patrón, sugerentes en ambos casos de una cepa productora de una metalocarbapenemasa. La actividad de fosfomicina y ciprofloxacino, solos y en combinación, se llevaron a cabo mediante un estudio dinámico de curvas de letalidad empleando un inóculo inicial de 5×105ufc/ml del microorganismo a partir de las CMI correspondientes de ambos compuestos. El número de ufc se determinó a las 2, 4, 6, 8 y 24h, considerándose un efecto sinérgico la disminución en el número de ufc/ml de 100 veces con la combinación respecto al componente individual más activo de la asociación (fig. 1). En estas curvas de letalidad se observó una reducción inicial de crecimiento bacteriano al probar individualmente los 2 componentes de la asociación, aunque a partir de las 2h para fosfomicina y de las 6h para ciprofloxacino se objetivó un sobrecrecimiento igual o superior al inóculo inicial. Por el contrario, el efecto sinérgico de los dos fármacos en combinación se puso de manifiesto a partir de las 2h, incrementándose progresivamente, sin observarse recrecimiento en ninguna de las etapas horarias establecidas hasta las 24h. De igual forma, se estudió la posibilidad de sinergia para el microorganismo con fosfomicina+amikacina, otra combinación estudiada en la literatura y que en este caso, además, ofrecía la circunstancia de la baja CMI de amikacina presentada individualmente. Sin embargo, la asociación solamente presentó un leve efecto aditivo, por lo que fue desechada a la hora de implantar el tratamiento combinado.
Patrones de sensibilidad de una cepa de Enterobacter cloacae productora de VIM en una infección de malla quirúrgica
| CMI (mg/l) de los aislamientosa | ||
|---|---|---|
| Antimicrobiano | 1.er aislamiento | 2.o aislamientob |
| Ampicilina | ≥ 32 | ≥ 32 |
| Amoxicilina/clavulánico | ≥ 32 | ≥ 32 |
| Piperacilina/tazobactam | ≥ 128 | ≥ 128 |
| Cefuroxima | ≥ 64 | ≥ 64 |
| Cefotaxima | ≥ 64 | ≥ 64 |
| Cefepima | ≥ 64 | ≥ 64 |
| Ertapenem | ≥ 8 | ≥ 8 |
| Imipenem | ≥ 16 | 8 |
| Gentamicina | 8 | ≥ 16 |
| Amikacina | ≤ 2 | ≤ 2 |
| Ciprofloxacino | 8 | 8 |
| Fosfomicina | 128 | 128 |
| Tigeciclina | 1 | ≥ 8 |
La combinación de fosfomicina con otros antimicrobianos es un dato frecuentemente citado en la literatura de los últimos años5-7. Entre las asociaciones probadas, la combinación con ciprofloxacino ha ofrecido resultados aceptables, relacionándose la actividad sinérgica entre ambos antimicrobianos con factores como el probable efecto postantibiótico para ciprofloxacino8 y la disminución del inóculo bacteriano por la acción de la fosfomicina, permitiendo a la fluoroquinolona expresar su actividad frente a un menor número de microorganismos activos9,10. En nuestro caso, la monoterapia establecida inicialmente sirvió, verosímilmente, para seleccionar la cepa de Enterobacter cloacae multirresistente, que tampoco obedeció al tratamiento instaurado posteriormente con amikacina y tigeciclina y que hubo de suspenderse ante la aparición de fracaso renal, sumado a la evolución de la resistencia a tigeciclina. Sin embargo, una vez llevadas a cabo las determinaciones de la combinación fosfomicina-ciprofloxacino, y puesto en marcha este último tratamiento, la paciente quedó afebril al día siguiente, objetivándose de forma progresiva una mejoría franca clínica y analítica con la desaparición del microorganismo de los cultivos subsiguientes. El tratamiento se mantuvo durante un año debido a la imposibilidad de la retirada total de la malla. Transcurrido este tiempo la paciente permanece asintomática, la colección infraumbilical ha desaparecido y el microorganismo no se ha recuperado en los controles posteriores.
Probablemente esta pauta terapéutica no es extensible a todos los pacientes con infecciones profundas por microorganismos productores de carbapenemasas o simplemente multirresistentes, ya que la sinergia encontrada no se repite en series in vitro en todos los casos4,7, pero nos asoma a la necesidad, siempre que sea posible, de «personalizar» los tratamientos antimicrobianos con combinaciones de ellos, mientras no existan alternativas con monoterapias suficientemente contrastadas para el tratamiento de las infecciones producidas por estos microorganismos de alto y extendido nivel de resistencia.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Al Programa de Vigilancia de la Resistencia a Antibióticos del Centro Nacional de Microbiología por la caracterización molecular de la carbapenemasa.