Las bacterias presentes en las biocapas bacterianas son muy resistentes a los tratamientos antimicrobianos; tanto es así, que la concentración requerida para alcanzar actividad bactericida puede ser de varios órdenes de magnitud comparada con la sensibilidad de bacterias planctónicas, y es extremadamente complicado esterilizar completamente las superficies colonizadas. Este tipo de resistencia es multifactorial y atiende fundamentalmente a las características estructurales y fisiológicas de la biocapa. Se han diseñado diversas estrategias de control para inhibir la formación de biocapas sobre dispositivos médicos, con escaso éxito en la mayoría de los casos. En este documento discutimos los principales mecanismos de resistencia asociados a biocapas bacterianas y su efecto sobre la actividad de los principales grupos de antimicrobianos.
Bacterial biofilms are very resistant to antimicrobial activity. The concentration of drugs required to achieve bactericidal activity may be several orders of magnitude higher than the sensitivity for planktonic bacteria, since it is very difficult to completely sterilize infected surfaces. Biofilm antimicrobial resistance is a multifactorial process and is mainly related to the structural and physiological characteristics of the biofilms. Various control strategies have been designed to inhibit biofilm formation on medical devices, in most cases with little success. The most important mechanisms of biofilm resistance to antimicrobial agents and their effect on the activity of the main groups of antimicrobials are discussed.
Los microorganismos presentes en las biocapas bacterianas son resistentes a una amplia variedad de agentes antimicrobianos, antisépticos y desinfectantes. El concepto convencional de resistencia antimicrobiana se refiere a resistencia adquirida por parte de las bacterias planctónicas mediante inactivación del antimicrobiano (betalactamasas), modificación de la diana sobre la que los antimicrobianos actúan (resistencia a vancomicina en enterococos) o disminución del antimicrobiano en el interior de la bacteria (sistemas de expulsión activa). Todos estos mecanismos están mediados a través de mutaciones o adquisición de uno o más genes por medio de intercambios genéticos y, generalmente, son irreversibles. Como veremos en este capítulo, los mecanismos por los que las bacterias presentes en las biocapas bacterianas se hacen resistentes a los antimicrobianos son diferentes y atienden fundamentalmente a las características estructurales y fisiológicas de la propia biocapa.
En los últimos años el uso de dispositivos protésicos en humanos ha aumentado considerablemente. Entre ellos, sistemas de drenaje de líquido cefalorraquídeo, dispositivos intravasculares, válvulas protésicas cardíacas, prótesis ortopédicas, dispositivos de ventilación asistida, drenaje de las vías urinarias, catéteres para hemodiálisis o implantes oculares y dentarios. En todos ellos es frecuente la aparición de infecciones asociadas a la presencia de biocapas bacterianas. Si consideramos que los resultados obtenidos en un antibiograma convencional no son aplicables a biocapas, el tratamiento de estas infecciones es muy complicado y requiere, en la mayoría de los casos, la retirada del material protésico para erradicar la infección.
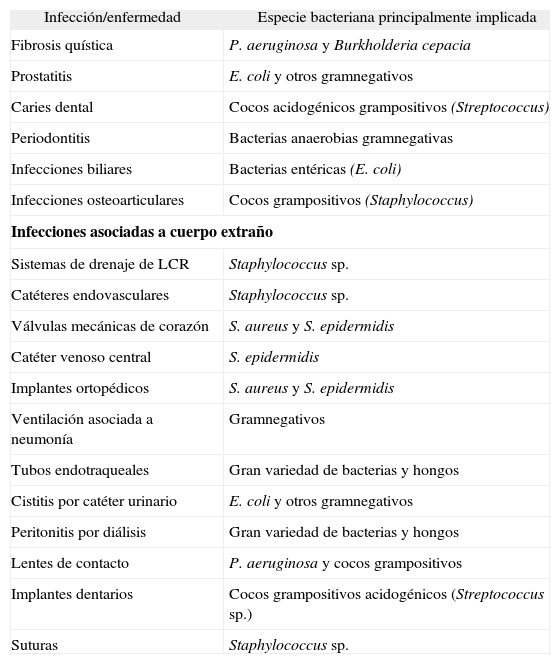
La capacidad de las bacterias para colonizar diferentes superficies (epitelios/mucosas o cuerpos extraños como material protésico) formando biocapas es utilizada por determinadas especies para establecer una relación negativa con el hospedador. La tolerancia de las biocapas bacterianas a los agentes antimicrobianos tiene importantes consecuencias clínicas, ya que, actualmente, más del 60% de las infecciones bacterianas están asociadas a formación de biocapas1. En la tabla 1 se muestra una lista parcial de las principales infecciones del ser humano, asociadas o no a material protésico, en las que las biocapas bacterianas están involucradas y que pueden ir desde infecciones cutáneas menores hasta infecciones que hagan peligrar la vida del paciente2-4. El éxito del tratamiento depende, entre otras cosas, del uso de elevadas dosis de antimicrobianos y, con frecuencia, de la retirada del cuerpo extraño implantado, con el correspondiente coste económico.
Principales infecciones humanas producidas por biocapas bacterianas
| Infección/enfermedad | Especie bacteriana principalmente implicada |
| Fibrosis quística | P. aeruginosa y Burkholderia cepacia |
| Prostatitis | E. coli y otros gramnegativos |
| Caries dental | Cocos acidogénicos grampositivos (Streptococcus) |
| Periodontitis | Bacterias anaerobias gramnegativas |
| Infecciones biliares | Bacterias entéricas (E. coli) |
| Infecciones osteoarticulares | Cocos grampositivos (Staphylococcus) |
| Infecciones asociadas a cuerpo extraño | |
| Sistemas de drenaje de LCR | Staphylococcus sp. |
| Catéteres endovasculares | Staphylococcus sp. |
| Válvulas mecánicas de corazón | S. aureus y S. epidermidis |
| Catéter venoso central | S. epidermidis |
| Implantes ortopédicos | S. aureus y S. epidermidis |
| Ventilación asociada a neumonía | Gramnegativos |
| Tubos endotraqueales | Gran variedad de bacterias y hongos |
| Cistitis por catéter urinario | E. coli y otros gramnegativos |
| Peritonitis por diálisis | Gran variedad de bacterias y hongos |
| Lentes de contacto | P. aeruginosa y cocos grampositivos |
| Implantes dentarios | Cocos grampositivos acidogénicos (Streptococcus sp.) |
| Suturas | Staphylococcus sp. |
LCR: líquido cefalorraquídeo.
El mecanismo por el que las bacterias presentes en biocapas son multirresistentes parece ser multifactorial y puede variar de unas especies a otras. Se ha propuesto una amplia variedad de estrategias para combatir este tipo de infecciones. El propósito de este capítulo es dar una visión general sobre la actividad de los principales grupos de antimicrobianos sobre biocapas bacterianas, sobre los mecanismos de resistencia presentes en éstas que conducen a fracaso terapéutico, así como de diversas estrategias alternativas para combatir este tipo de infecciones.
Mecanismos de resistencia a los agentes antimicrobianos en biocapas bacterianasLas características estructurales y fisiológicas de las biocapas confieren una resistencia innata tanto a antibióticos como a desinfectantes y a germicidas. Las bacterias de las biocapas son resistentes de los agentes antimicrobianos por mecanismos adicionales y diferentes a los de las células planctónicas, es decir, sistemas de expulsión activa, mutación de la diana y enzimas modificadoras, principalmente. En muchos casos, la concentración de antimicrobiano requerida para alcanzar actividad bactericida frente a biocapas suele ser muy superior a la de las bacterias planctónicas dependiendo de la especie y el fármaco5. Otra característica importante es que las bacterias que forman parte de las biocapas recuperan la sensibilidad original de la cepa bacteriana una vez que se dispersan de la misma3. Teniendo en cuenta estos datos, parece que la resistencia de las biocapas a los agentes antimicrobianos no se debe probablemente a mecanismos codificados genéticamente ni a la selección de mutantes resistentes presentes en subpoblaciones, ya que los altos niveles de resistencia desaparecen por ejemplo cuando, en el caso de pacientes con dispositivos médicos infectados por biocapas bacterianas, éstos son retirados. Está bien demostrado que la resistencia en este tipo de estructuras es multifactorial, varía de unas especies a otras y se debe más bien a las características fisiológicas de las bacterias individuales de la biocapa, así como a la ultraestructura de la misma1. Los mecanismos responsables del elevado grado de resistencia son uno o más de los siguientes: a) impermeabilidad de la biocapa a los agentes antimicrobianos; b) tasa alterada de crecimiento de los organismos de la biocapa; c) el microambiente de la biocapa que antagoniza la actividad antimicrobiana; d) mecanismos de resistencia expresados en bacterias planctónicas; e) elementos genéticos de transferencia horizontal y, en ocasiones, f) el papel del biomaterial en la inducción de resistencias. A continuación se detalla cómo cada uno de estos mecanismos afecta a la actividad de los principales grupos de antimicrobianos.
Impermeabilidad de las biocapas a los agentes antimicrobianosEl primer paso para que los agentes antimicrobianos ejerzan su actividad es que alcancen su diana. Las biocapas poseen una capa de glucocáliz que protege a las bacterias infectantes de los sistemas de defensa del paciente, así como de la difusión de los agentes antimicrobianos hacia las dianas celulares, actuando de este modo como una barrera que impide o reduce el transporte de los antimicrobianos al interior de la biocapa (tabla 2). Por ejemplo, se ha demostrado que el alginato embebido en las biocapas de Pseudomonas aeruginosa impide el transporte de imipenem y tobramicina; estas biocapas son hasta 1.000 veces más resistentes en comparación con la forma de vida planctónica6. En otros estudios se ha investigado la penetración de fluoroquinolonas, betalactámicos, macrólidos o aminoglucósidos en biocapas producidas por P. aeruginosa. Parece que los macrólidos son los que mejor atraviesan estas biocapas, seguidos de las fluoroquinolonas y los betalactámicos7.
Mecanismos de resistencia a antimicrobianos en biocapas bacterianas
| Mecanismo de resistencia | Especies bacterianas estudiadas | Principales agentes antimicrobianos afectados | Referencia |
| Impermeabilidad de las biocapas a los agentes antimicrobianos | P. aeruginosa | Aminoglucósidos | Coquet et al (1998)6; Bdi-Ali et al (2006)7; Hatch et al (1998)8 |
| Betalactámicos | Coquet et al (1998)6; Bdi-Ali et al (2006)7 | ||
| S. epidermidis | Vancomicina | Rodríguez-Martínez et al (2007)9; Souli y Giamarellou (1998)49 | |
| Teicoplanina | Souli y Giamarellou (1998)49 | ||
| Tasa alterada de crecimiento | P. aeruginosa | Betalactámicos | Tanaka et al (1999)15 |
| E. coli | |||
| S. epidermidis | Ciprofloxacino | Costerton et al (1999)1 | |
| El microambiente de las biocapas afecta a la actividad antibacteriana | Característica general de las biocapas | Aminoglucósidos | Jorgensen JH et al (1999)17, Field et al (2005)18 |
| Macrólidos | Jorgensen et al (1999)17 | ||
| Tetraciclinas | Jorgensen et al (1999)17 | ||
| Mecanismos de resistencia expresados en bacterias planctónicas | P. aeruginosa | Azitromicina | Gillis et al (2005)20 |
| Betalactámicos | Bagge et al (2000)19 | ||
| Tobramicina | Mah et al (2003)21 | ||
| Elementos genéticos de transferencia horizontal | Enterobacteriaceae | Betalactámicos | Reisner et al (2006)25 |
| Aminoglucósidos | |||
| L. lactis | Betalactámicos | Luo et al (2005)26 | |
| Quorum-sensing | P. aeruginosa | Aminoglucósidos | Singh et al (2000)4 |
| Quorum-sensing inhibitors | Bjarnsholt et al (2005)50 |
En el caso de Staphylococcus epidermidis, la producción de slime tiene un efecto similar, aunque no del mismo modo con todos los agentes antimicrobianos8. Por ejemplo, la vancomicina y la teicoplanina se afectan más que la rifampicina o la clindamicina. Del mismo modo, y de acuerdo con nuestros estudios, el linezolid presenta mayor actividad que la vancomicina frente a biocapas de S. epidermidis sobre catéteres de silicona, y este efecto es debido, al menos parcialmente, a la capacidad de el linezolid para concentrarse en biocapas en comparación con la vancomicina9. En gramnegativos, nuestro grupo ha informado de una mayor actividad in vitro de ciprofloxacino y amoxicilina-ácido clavulánico frente a P. aeruginosa y Escherichia coli (productor o no de betalactamasas de espectro extendido) en comparación con fosfomicina y cotrimoxazol10; al mismo tiempo, el ciprofloxacino y la amoxicilina-ácido clavulánico presentaron las mayores tasas de penetración en biocapas bacterianas maduras.
Teniendo en cuenta estos datos, la actividad antimicrobiana depende, en parte, de la estructura de la biocapa bacteriana y de las características bioquímicas de los componentes del glucocáliz, dependiendo de la especie bacteriana y del tamaño y características químicas del antimicrobiano en cuestión. Todos estos datos realzan la importancia de la impermeabilidad de las biocapas en la reducción de la actividad de los agentes antimicrobianos11.
Alteraciones del crecimiento bacteriano en biocapasEl segundo mecanismo propuesto en relación con la resistencia antimicrobiana de las biocapas bacterianas está relacionado con la tasa de crecimiento de las bacterias. Las bacterias en las biocapas presentan una tasa de crecimiento más lenta en comparación con las células planctónicas, retrasando la acción de los antimicrobianos (v. tabla 2). En el interior de las biocapas bacterianas existe una limitación de nutrientes, lo cual conduce a un retraso en el crecimiento. De este modo, la transición de la fase exponencial a la fase estacionaria se ve acompañada por un aumento de la resistencia12,13. Este mecanismo se ha puesto de manifiesto en diferentes trabajos. Anderl et al14 desarrollaron un modelo para caracterizar experimentalmente la relación entre la disponibilidad de nutrientes y el estado de crecimiento de las biocapas. En este estudio la penetración de glucosa y oxígeno se redujo en las biocapas y, por ejemplo, la actividad catalasa se incrementó en las mismas en grados similares a los encontrados en fase estacionaria en células planctónicas. Mediante microscopia electrónica se pudo apreciar que la acción de ampicilina afectó a la biocapa sólo superficialmente, pero no al interior de la misma. Estos resultados indican que la limitación de nutrientes genera diferentes regiones en las biocapas con mayor y menor tasa de crecimiento. Estas regiones de menor tasa de crecimiento presentan menor sensibilidad a la actividad bactericida de los agentes antimicrobianos.
Tanaka et al15 han evaluado el efecto de la tasa de crecimiento sobre la sensibilidad a determinados agentes antimicrobianos (betalactámicos y fluoroquinolonas) en un mutante de P. aeruginosa que requiere leucina para su crecimiento. En este caso, la acción bactericida de los betalactámicos se vio afectada por la tasa de crecimiento, mientras que la actividad de las fluoroquinolonas fue mayor e independiente de la tasa de crecimiento. Esta situación parece similar en bacterias grampositivas. En las biocapas de S. epidermidis la tasa de crecimiento afecta notablemente a la sensibilidad antimicrobiana, y se correlaciona la tasa de crecimiento con la actividad de ciprofloxacino16.
Efecto del microambiente de las biocapas en la actividad antimicrobianaEl microambiente en el interior de las biocapas es un factor que afecta a la actividad antimicrobiana in vitro debido a diferentes variables como la pO2, pCO2, concentración de cationes divalentes, niveles de hidratación, pH o concentraciones de pirimidinas, produciendo efectos adversos en la acción de los antimicrobianos en el interior de la biocapa donde las condiciones ácido-básicas y aeróbicas-anaeróbicas pueden variar17 (v. tabla 2). Field et al18 han demostrado que las limitaciones de oxígeno pueden reducir la sensibilidad a tobramicina en biocapas de P. aeruginosa. Presiones relativamente altas de CO2 pueden comprometer la actividad de aminoglucósidos, macrólidos o tetraciclinas. Por otro lado, la naturaleza polianiónica del exopolisacárido de alginato producido por P. aeruginosa, debido a su capacidad para concentrar cationes divalentes, puede alterar la actividad de antimicrobianos como aminoglucósidos o tetraciclinas17.
Todas estas manifestaciones de resistencia de las biocapas debidas a su estructura y características bioquímicas(impermeabilidad, tasa de crecimiento reducida y condiciones microambientales extremas) complican en gran medida la terapia antimicrobiana para combatir estas infecciones asociadas. Sin embargo, al margen de estos mecanismos, existen otros, como veremos a continuación.
Mecanismos de resistencia a antimicrobianos en bacterias planctónicasEn principio, la resistencia a los antimicrobianos de las bacterias en biocapas parecía independiente de los mecanismos de resistencia expresados por bacterias planctónicas como sistemas de expulsión activa, mutaciones en las dianas celulares o enzimas modificantes. Las primeras observaciones indicaban que estos mecanismos no eran suficientes para explicar los grados de resistencia alcanzados por las infecciones causadas por biocapas bacterianas. Sin embargo, estas evidencias no excluyen la posibilidad de que los mecanismos convencionales de resistencia se expresen en biocapas y contribuyan a la resistencia antimicrobiana de las biocapas bacterianas. Por ejemplo, se ha demostrado la desrepresión de la betalactamasa cromosómica en biocapas de P. aeruginosa tras tratamiento prolongado con betalactámicos, contribuyendo a la persistencia de la infección19. Del mismo modo, los sistemas de expulsión activa MexAB-OprM y MexCD-OprJ en P. aeruginosa actúan como un mecanismo específico de resistencia a azitromicina en biocapas20. También en relación con P. aeruginosa, recientemente se ha descrito un mecanismo de tolerancia en biocapas21. El gen responsable, ndvB, está implicado en la síntesis de glucanos periplásmicos que interaccionan y secuestran al antimicrobiano tobramicina, impidiendo que alcancen su diana. Este mecanismo abre la posibilidad de que las biocapas no sean simplemente barreras de difusión para los antimicrobianos, sino que más bien estas comunidades bacterianas emplean diferentes mecanismos para resistir la acción de los antimicrobianos.
Hasta el momento, el papel de los mecanismos de resistencia a antimicrobianos expresados en bacterias planctónicas en biocapas bacterianas no es claro. Sin embargo, algunos de estos mecanismos se han descrito en biocapas bacterianas, contribuyendo a la resistencia de las mismas (v. tabla 2).
Papel de los elementos genéticos de transferencia horizontalLas biocapas son estructuras idóneas para los eventos de transferencia de genes horizontalmente debido a la acumulación de microorganismos y estabilización física de los mismos. Los plásmidos son elementos capaces de transferir genes entre microorganismos de la misma especie o de especies diferentes mediante conjugación22. Al mismo tiempo, los productos de los genes necesarios para la maquinaria de conjugación promueven el contacto célula-célula con lo cual pueden facilitar el proceso de formación de las biocapas bacterianas23,24. Los grandes plásmidos conjugativos encontrados frecuentemente en la familia Enterobacteriaceae suelen contener tanto genes de resistencia a antibióticos como determinantes de virulencia, con lo cual la presencia de estos plásmidos en biocapas bacterianas complica aún más la selección de una terapia exitosa25. Recientemente, se ha descrito en Lactococcus lactis (v. tabla 2), una especie grampositiva, un plásmido, pAMbeta1, con implicación tanto en la formación de biocapas como en la expresión de genes de resistencia a antibióticos26, lo cual puede tener importantes implicaciones clínicas.
Teniendo en cuenta estos datos, parece razonable decir que las biocapas, en las que pueden convivir bacterias de diferentes especies, son ambientes ideales para la transferencia horizontal de genes, dependiente del contacto célula-célula con alta frecuencia, favoreciendo la diseminación de genes de resistencia a agentes antimicrobianos y factores de virulencia en diferentes microorganismos relacionados con la formación de biocapas.
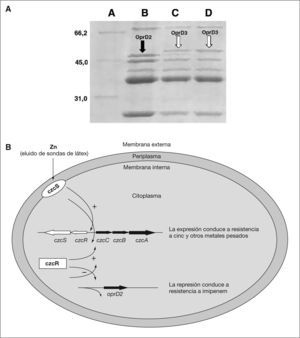
Papel del biomaterial en la inducción de resistenciasMuchos de los biomateriales plásticos son hidrofóbicos, lo cual facilita la unión inicial de las bacterias. Esta unión inicial no es específica y, por tanto, reversible. Es necesaria posteriormente la unión de modo específico mediante adhesinas que fijen el microorganismo a la superficie de un modo estable. Se han usado diversas estrategias para inhibir el crecimiento de las biocapas sobre dispositivos médicos. Además, la composición del biomaterial parece que tiene importancia en la adherencia bacteriana27 y se ha demostrado que puede inducir resistencia, si bien este fenómeno sólo se ha descrito con sondas de látex siliconizado y P. aeruginosa. En relación con este fenómeno, se observó que la actividad de imipenem frente a P. aeruginosa disminuye hasta 16 veces cuando crece en medio previamente incubado con sondas de látex siliconizado28, con lo cual P. aeruginosa se hace resistente a carbapenems. Este proceso está producido por la disminución de la expresión de una porina (oprD2) que es la vía de entrada de los carbapenems para alcanzar su diana. Posteriormente se determinó que esta disminución de la actividad de los carbapenems frente a P. aeruginosa debida a la pérdida de oprD2 es inducida por la presencia de cinc en el medio liberado de las sondas de látex siliconizado28. Perron et al29 han establecido la causa genética de este tipo de resistencia. De este modo, el cinc liberado de los catéteres urinarios de látex siliconizado es suficiente para inducir la expresión del sistema de expulsión activa CzcCBA y genes reguladores czcR-czcS, así como con la expresión reducida de oprD2 comprometiendo la actividad de estos antimicrobianos frente a P. aeruginosa (fig. 1). Este fenómeno se ha descrito de forma in vitro en el laboratorio y no existen datos acerca de las repercusiones in vivo del mismo.
Resistencia a imipenem en P. aeruginosa en presencia de catéteres de látex siliconizado. A) SDS-PAGE en el que se muestra los perfiles de proteínas de membrana externa de P. aeruginosa crecidas en medio Mueller-Hinton (línea B), eluados de catéteres urinarios de látex siliconizado (línea C), y medio suplementado con cinc (Zn) (línea D). Línea A: marcador de pesos moleculares expresados en kilodaltons. B) Esquema representativo del mecanismo implicado en resistencia a imipenem en P. aeruginosa debido a la presencia de cinc en las sondas de látex siliconizado. La expresión de czcS y czcR se activa en presencia de cinc. Posteriormente, czcR actúa activando el sistema de flujo czcCBA conduciendo a resistencia a cinc. Al mismo tiempo, czcR reprime la expresión de oprD2, una porina implicada en la permeabilidad de imipenem, conduciendo a la resistencia a este antimicrobiano.
La formación de una biocapa bacteriana es un proceso extraordinariamente complejo sujeto a una gran cantidad de factores ambientales difíciles de reproducir en los laboratorios. Los estudios de actividad antimicrobiana sobre biocapas tienen importantes limitaciones metodológicas que dificultan la comparación de los resultados. Factores tales como el tipo de cepa bacteriana, las condiciones de cultivo, la naturaleza del biomaterial, la concentración de antimicrobiano, el tiempo de formación de las biocapas, etc. van a ser determinantes, y modificaciones de los mismos pueden dar lugar a resultados controvertidos. Por todo ello, hay que ser extremadamente cauteloso a la hora de extrapolar los resultados obtenidos in vitro o en modelos experimentales a la situación clínica real.
Estrategias para destruir o impedir la formación de biocapas bacterianasSe ha desarrollado en los últimos años una gran cantidad de estrategias dirigidas a destruir o evitar la formación de biocapas bacterianas. Una posibilidad, que suele ofrecer buenos resultados, es el uso de combinaciones de antimicrobianos. En un modelo con diversas especies bacterianas de infecciones asociadas a implantes, Isiklar et al30 demostraron que la vancomicina sola era mucho menos activa que en combinación con la rifampicina. Nuestro grupo evaluó la actividad in vitro de la vancomicina y la tecoplanina (a cuatro veces la concentración mínima bactericida) solos o en combinación con amikacina (16 mg/l) o rifampicina (1 mg/l), frente a biocapas de S. epidermidis sobre diferentes catéteres de material plástico31. Estas combinaciones incrementaron significativamente la actividad de los glucopéptidos frente a bacterias sésiles y se alcanzaron altas tasas de esterilización sobre catéteres de poliuretano. En P. aeruginosa se ha observado una acción sinérgica entre fosfomicina y fluoroquinolonas32. Igualmente, la combinación de tobramicina con derivados de novispirina G10 puede resultar útil para el tratamiento de infecciones producidas por biocapas de P. aeruginosa33.
Otra alternativa requiere el uso de concentraciones subinhibidoras de antimicrobiano con el objetivo de impedir la formación de biocapas en las superficies de los biomateriales. Sin embargo, el uso de concentraciones subinhibidoras de algunos antimicrobianos, tales como tetraciclinas y estreptograminas, puede potenciar de 9 a 11 veces la expresión del operón ica implicado, en la formación de biocapas en S. epidermidis34. Un efecto similar se ha descrito para algunos aminoglucósidos e imipenem en P. aeruginosa35,36. En un estudio reciente se observó, sin embargo, que concentraciones subinhibidoras de piperacilina/tazobactam interfieren con el potencial patogénico de P. aeruginosa con relación a la estructura, la morfología bacteriana y el perfil de hidrofobicidad en la formación de biocapas37. En otro estudio se ha mostrado que concentraciones subinhibidoras de ceftazidima o ciprofloxacino podrían ser efectivas para prevenir la formación de biocapas de E. coli y Proteus vulgaris sobre poliestireno38. Las fluoroquinolonas también parecen suprimir la formación de biocapas de Stenotrophomonas maltophilia sobre este mismo material en estas concentraciones39.
Se han realizado diversos avances sobre el efecto de modificaciones en el material protésico para prevenir la formación de biocapas. Por ejemplo, la incorporación de fluoroquinolonas como el ciprofloxacino sobre material como poliuretano biodegradable reduce significativamente la formación de biocapas debido a la liberación del antimicrobiano como consecuencia de la acción de la enzima colesterol esterasa de los macrófagos. Esta estrategia, probada con diferentes antimicrobianos y antisépticos, implica el riesgo de selección de mutantes resistentes a la sustancia en cuestión40. Otra estrategia consiste en el uso de pulsos o campos eléctricos en la superficie de catéteres, los cuales disminuyen por sí mismos la formación de biocapas, potenciando, de este modo, la acción de los antimicrobianos41. En este proceso se producen compuestos como peróxido de hidrógeno o cloro libre por electrólisis en la superficie del catéter que evitan la colonización bacteriana. Esta estrategia es muy interesante ya que puede evitar el uso de antimicrobianos. Además, se ha demostrado que el uso de pulsos electromagnéticos puede potenciar la actividad de la gentamicina frente a biocapas de 5 días de S. epidermidis42. También los ultrasonidos se han usado para potenciar la penetración de los antimicrobianos en las biocapas bacterianas42. Así, exposiciones a pulsos de ultrasonidos de 24 h para biocapas de E. coli o de 48 h para biocapas de S. epidermidis potenciaron la actividad de gentamicina sobre discos de polietileno implantados de modo subcutáneo en un modelo en conejos42. Por último, los liposomas artificiales también se han usado como vehículos para concentrar los antimicrobianos en la interfase de la biocapa41.
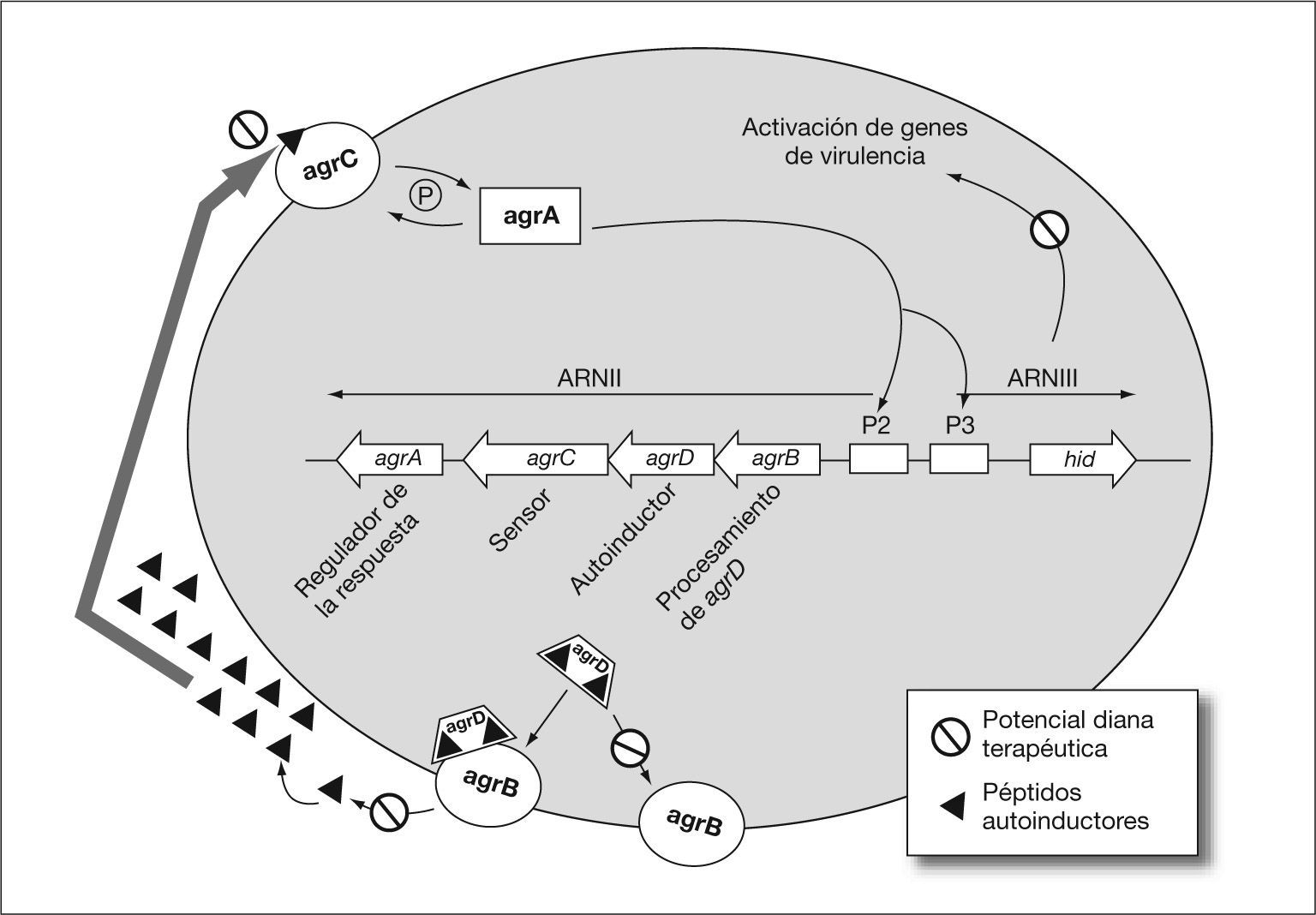
Otras estrategias alternativas que se han desarrollado para la prevención de la formación de biocapas han sido la interferencia bacteriana y el uso de inhibidores del quorum-sensing. La interferencia bacteriana consiste en la manipulación de la composición de las especies bacterianas presentes en la biocapa más que en la prevención del proceso de adhesión. La interferencia bacteriana o uso de especies benignas para prevenir infecciones sintomáticas parece que puede tener un gran uso potencial. En diferentes ensayos el uso de cepas de E. coli no patogénicas en pacientes con sondas urinarias redujo la frecuencia de infección del tracto urinario en comparación con los grupos control43. Estudios in vitro con estas mismas cepas de E. coli no patogénicas han mostrado que la incubación de los catéteres urinarios con estos microorganismos impidió la posterior unión y colonización del catéter por parte de otros patógenos urinarios44. En segundo lugar, la comprensión del complejo proceso de formación de estas biocapas bacterianas ha ayudado al diseño y selección de moléculas con actividad anti-quorum-sensing, es decir, moléculas capaces de interferir e inhibir el proceso de formación de la biocapas bacterianas, como una alternativa eficaz frente a este tipo de infecciones45. En P. aeruginosa, el sistema quorum-sensing está implicado tanto en la elevada tolerabilidad antibiótica de las biocapas como en la tolerabilidad al sistema immune45. El quorum-sensing es un sistema de regulación que capacita a las bacterias para tomar decisiones colectivas para la expresión conjunta de determinados genes en respuesta, por ejemplo, a la presión antibiótica, lo que conduce a la formación de bio-capas. Este sistema cuenta con pequeñas moléculas señal (p. ej. las N-acil-homoserina lactosas) para la comunicación entre bacterias en el aspecto poblacional, además de regular la expresión de factores de virulencia. Con estas características, este sistema se presenta como una diana idónea para el desarrollo de nuevas estrategias terapéuticas46,47. Estas nuevas estrategias conducirían a la disminución de la capacidad patogénica y a evitar la formación de biocapas. Shih y Huang48 comprobaron el efecto del quorum-sensing sobre la resistencia a antimicrobianos usando mutantes deficientes de esta vía en P. aeruginosa. En este trabajo las biocapas silvestres no se afectaron por kanamicina, incluso a 100 mg/l, mientras que las biocapas mutantes fueron sensibles tanto a altas (100 mg/l) como a bajas (10-50 mg/l) concentraciones de kanamicina. Los inhibidores del quorum-sensing pueden tener la capacidad para hacer a las biocapas más sensibles a los antimicrobianos, reduciendo al mismo tiempo la virulencia45. La combinación de estos inhibidores con los antimicrobianos de uso común puede resultar una alternativa prometedora. Las posibles dianas de inhibidores del quorum-sensing han sido estudiadas a tres niveles: generador de la molécula señal, molécula señal y receptor de la molécula señal. En la figura 2 se muestran los principales componentes del sistema agr de Staphylococcus aureus, así como las dianas terapéuticas sobre las que podrían actuar inhibidores del quorum-sensing. En este sistema parece lógico que moléculas que actuasen inhibiendo el sensor agrC, el autoinductor agrB o la activación de genes de virulencia podrían frenar la formación de biocapas en S. aureus. Muchos de estos compuestos se han obtenido de fuentes naturales, como, por ejemplo, los derivados cíclicos azufrados del ajo, las furanonas de Delinea pulchra, el ácido penucilínico u otros compuestos obtenidos de diversos hongos45. De los numerosos compuestos ensayados hasta ahora, sólo unos pocos han mostrado buenos resultados en modelos animales. Desafortunadamente, la mayoría de estos compuestos son tóxicos para el ser humano, como es el caso de las furanonas halogenadas45. El hallazgo de nuevas moléculas con similar actividad y menor poder tóxico puede contribuir notablemente al éxito de esta alternativa terapéutica.
Ilustración esquemática del sistema agr de S. aureus. Se muestra la organización molecular que conduce a la producción de péptidos autoinductores y activación de la respuesta agr. Se muestran los componentes o procesos que son dianas terapéuticas potenciales de los inhibidores del quorum-sensing.
Por último, el creciente conocimiento acerca del proceso de formación de biocapas bacterianas permitirá diseñar nuevas estrategias y nuevos biomateriales con características antiadhesivas, y disminuir de este modo el riesgo y la prevalencia de las infecciones mediadas por biocapas bacterianas relacionadas con el uso de materiales protésicos.