La amebiasis es la infección por Entamoeba histolytica, un protozoo capaz de invadir la mucosa intestinal y diseminarse a otros órganos, principalmente el hígado. Se estima que afecta en el mundo a aproximadamente 50 millones de personas y es causante de unas 100.000 muertes al año1. En la mayoría de los países de Europa y América del Norte, esta parasitosis ha sido prácticamente erradicada tras las mejoras de las infraestructuras de aguas potables y residuales que se realizaron en el siglo pasado. En estos países, la mayor parte de los casos son importados, y afectan a viajeros e inmigrantes procedentes de zonas endémicas2.
En los últimos años se ha detectado un aumento en el número de casos de absceso hepático amebiano (AHA) en pacientes que no han salido de España3–10. En el año 2005 se publicó un estudio que recogió 10 de estos casos11.
En este trabajo se describen 2 nuevos casos de AHA en pacientes que nunca habían salido de la Península Ibérica, se revisan los 21 casos descritos con anterioridad en España y se analiza su epidemiología así como las técnicas utilizadas en el diagnóstico microbiológico. Además, se describe una técnica molecular de reacción en cadena de la polimerasa (PCR) para la detección de E. histolytica, puesta a punto en el Laboratorio de Parasitología del Centro Nacional de Microbiología, que se emplea en el diagnóstico de la amebiasis extraintestinal.
Material y métodosRevisión de la literatura médica y descripción de 2 nuevos casos de absceso hepático amebianoSe realizó una revisión de la literatura médica mediante una búsqueda en MEDLINE (URL: www.pubmed.gov ), para esto, se introdujeron las palabras clave: «absceso hepático», «amebiasis», «autóctono» y «España». Asimismo, se incluyeron los datos clínicos y microbiológicos de 2 nuevos casos de AHA, diagnosticados en el hospital Gregorio Marañón de Madrid en 2006 y 2007, en pacientes que nunca habían salido de la Península Ibérica.
Descripción de la técnica de diagnóstico molecular basada en la reacción en cadena de la polimerasaLa técnica molecular se utilizó en el diagnóstico de la amebiasis extraintestinal según el siguiente protocolo:
Extracción de ADN: la extracción del ácido desoxirribonucleico (ADN) de la muestra obtenida por punción-aspiración del absceso hepático se realizó con un método comercial QIAamp DNA Mini Kit (QIAGEN, Hilden, Germany) de acuerdo con las recomendaciones del fabricante. Técnica de amplificación: se utilizó una técnica de nested PCR (PCR anidada), que emplea como diana el gen SSUrDNA del parásito. En la primera reacción se usaron los iniciadores, descritos previamente por Evangeloupulos12, E1 (5′-TGC TGT GAT TAA AAC GCT-3′) y E2 (5′-TTA ACT ATT TCA ATC TCG G-3′), que permiten amplificar un fragmento de 1.076 de pb. En la segunda amplificación, se emplearon unos iniciadores específicos para E. histolytica, Eh-l (5′-ACA TTT TGA AGA CTT TAT GTA AGT A-3′) y Eh-r (5′-CAG ATC TGA AAA CAA TGC TTC TCT-3′) y se obtuvo un producto de amplificación de 427 pb. La primera PCR se llevó a cabo con 3 μl de ADN en un volumen final de 50 μl. La mezcla de la reacción incluyó tampón 10X de PCR (75 mM [pH 9.0] de trometamol, ácido clorhídrico, 50 mM de cloruro de potasio, 20 mM de sulfato de amonio, 20 mM de cloruro de magnesio), 200 μM de desoxinucleótido trifosfato, 12,5 pmol de cada iniciador y 1,25 U de Thermus thermofilus ADN polimerasa. Todos los reactivos utilizados fueron adquiridos a Biotools (BIOTOOLS B&M Labs., S. A., España). Respecto a las condiciones de PCR, se realizó una preincubación a 94 °C seguida de 45 ciclos de desnaturalización a 94 °C durante 30 s, de anillamiento a 47 °C durante 30 s, y de extensión a 58 °C durante 30 s, se finalizó con una extensión final a 72 °C durante 10 min.
La segunda PCR se llevó a cabo con 5 μl del producto de la primera PCR y el resto de las condiciones son similares a las descritas para la primera reacción, excepto la temperatura de anillamiento, que fue de 60 °C. Los cebadores usados fueron sintetizados por Sigma-Genosys (Londres, Reino Unido).
Los productos de PCR se visualizaron tras someterlos a electroforesis en gel de agarosa al 2% en tampón TBE 1X y tinción con bromuro de etidio. Para observar los amplicones se empleó un transiluminador, GEL Doc 2.000 (Bio-Rad), mediante el programa Quantity One 4.4.0 (Bio-Rad).
La sensibilidad de la PCR se determinó con ADN obtenido a partir del cultivo axénico de la cepas de E. histolytica HM-1: IMSS, cedido por cortesía del Dr. Graham Clark (The London School of Hygiene & Tropical Medicine, Londres, Inglaterra). El estudio de especificidad de la técnica se realizó con el ADN extraído de 15 abscesos hepáticos no amebianos.
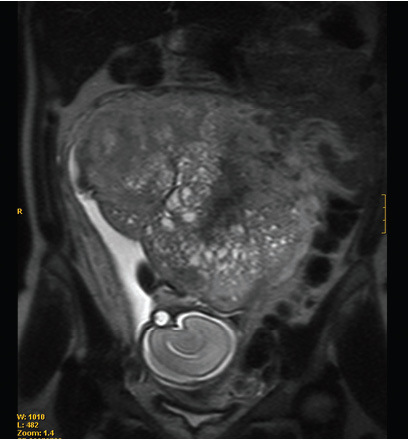
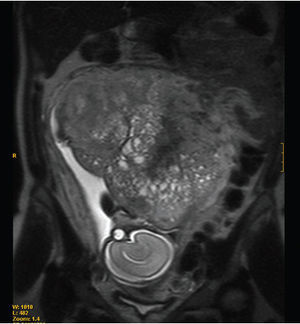
ResultadosDescripción de los 2 nuevos casos de absceso hepático amebianoCaso 1. Paciente de 35 años que acudió a urgencias por un cuadro de diarrea de 2 meses de evolución de hasta 20 deposiciones diarias blandas y sanguinolentas, fiebre, dolor en fosa ilíaca y pérdida de 5 kg de peso. Ni el paciente ni su familia habían viajado fuera de la Península Ibérica. Residía en zona urbana y negaba actividades sexuales u otros factores epidemiológicos de riesgo de gastroenteritis infecciosa. El enfermo presentaba al ingreso una temperatura de 38,8 °C, hepatomegalia discreta, leucocitosis y ligera alteración de las enzimas hepáticas. En la tomografía computarizada (TC) abdominal se observó engrosamiento de hasta 12 mm de la pared del íleon terminal y del colon ascendente, con líquido libre. En el segmento vi del hígado se observó un absceso de 7 cm de diámetro. Al ingreso del paciente se sospechó enfermedad inflamatoria intestinal y absceso hepático secundario. Los coprocultivos y el examen de parásitos en heces fueron negativos. La detección de anticuerpos frente a E. histolytica se llevó a cabo mediante una técnica de hemaglutinación (Cellognost-Amebiasis, Dade Behring, Marburg, Alemania) y se obtuvo un título de 1/512. El segundo día de ingreso se drenó el absceso y su examen microscópico fue negativo. Se remitió una muestra del drenaje del absceso al Servicio de Parasitología para su análisis mediante la técnica de PCR (fig. 1). El paciente evolucionó favorablemente de los síntomas gastrointestinales y sistémicos al recibir tratamiento con metronidazol (750 mg cada 8 h durante 10 días), tratamiento que se completó con paromomicina (500 mg 3 veces al día durante una semana).
Figura 1. Electroforesis en gel de agarosa teñido con bromuro de etidio de los amplificados de la reacción en cadena de la polimerasa anidada. Calle 1: muestra de un absceso no amebiano; calle 2: muestra del absceso del caso presentado; calle 3: control negativo; calle 4: control positivo de Entamoeba histolytica; calle 5: marcador de peso molecular.
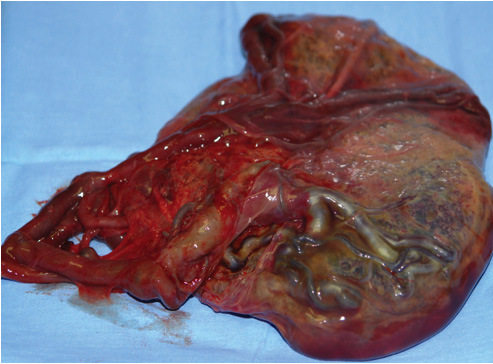
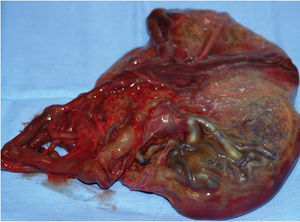
Caso 2. Varón de 51 años de edad que acudió a urgencias por presentar astenia, anorexia y dolor abdominal difuso, junto con náuseas y fiebre de 7 días de evolución sin alteración del tránsito gastrointestinal. El paciente estaba febril y sin alteraciones analíticas de interés. Se practicó una ecografía seguida de una TC abdominal y se detectaron múltiples lesiones hepáticas presentes, hipodensas y con alto componente necrótico (fig. 2 ) , engrosamiento mural del colon ascendente con cambios inflamatorios de la grasa adyacente, y una formación endoluminal en polo cecal, con adenopatías en la región pericecal y el área ilíaca, todo esto indicativo de la sesión tumoral metastatizada. Se realizó una hemicolectomía derecha, se realizaron biopsias de múltiples adenopatías y se extrajo el material purulento de las lesiones hepáticas que se envió para cultivo y examen histológico. En la pieza de colectomía se observaron trofozoitos y quistes de amebas con tinción de hematoxilina-eosina. En 3 ocasiones se realizaron punciones percutáneas de los abscesos hepáticos sin que se observasen microorganismos en las tinciones ni en los cultivos. La detección de anticuerpos frente a E. histolytica se realizó mediante una técnica de hemaglutinación (Cellognost-Amebiasis) y se obtuvo un título de 1/4096. Reevaluados los antecedentes epidemiológicos, el paciente negó haber viajado fuera de España. No obstante, hasta 6 semanas antes de su ingreso en el hospital, había estado en un centro penitenciario durante 3 años acompañado de una alta proporción de población extranjera y allí había mantenido relaciones con prostitutas africanas y sudamericanas; negó relaciones sexuales con varones. La evolución de la fiebre fue tórpida y persistió con picos intermitentes durante más de 35 días. Se trató la amebiasis con metronidazol en dosis de 750 mg cada 8 h y paromomicina en dosis de 500 mg 3 veces al día (ambos durante una semana), seguidas de cloroquina en dosis de 300 mg/día durante 5 semanas.
Figura 2. Imagen de scanner abdominal al ingreso en el que se aprecian abscesos hepáticos múltiples.
Revisión de la literatura médicaCon los casos descritos en el apartado precedente, se han reunido un total de 23 pacientes con AHA adquirido en España. Los datos epidemiológicos más destacados se muestran en la tabla 1. Veinte casos (87%) se dieron en varones. La edad de los enfermos varió entre 26 y 77 años. Dos de las 3 mujeres con amebiasis extraintestinal tenían el virus de la inmunodeficiencia humana. En 17 individuos no se encontraron datos de exposición a los que se les pudiera atribuir el contagio de la amebiasis. En los 6 restantes se registraron antecedentes de contacto directo con enfermos de amebiasis o con personas o alimentos sospechosos procedentes de zonas endémicas.
Tabla 1. Características de los casos de absceso hepático amebiano autóctonos descritos en España
| Año (referencia) | Sexo/edad en años | Antecedentes epidemiológicos | Serología | Observación en heces | Observación en el pus del absceso |
| 1985(11) | V/30 | No | HAI 1/1.280 | No | NR |
| 1985(11) | V/69 | No | NR | No | Sí |
| 1985(11) | V | Sía | – | – | – |
| 1985(11) | V/50 | No | HAI + | No | No |
| 1991(11) | V/31 | Síb | IFI 1/4.100 | Sí | Sí |
| 1995(11) | V | Síc | – | – | – |
| 1997(5) | M/(28–58) | No | HAI 1/2.048 | Sí | NR |
| 1999(11) | V/26 | No | IFI 1/1.100 | No | – |
| 1999(5) | V/(28–58) | No | HAI 1/2.048 | No | NR |
| 2000(10) | V/36 | No | ELISA Positivo | – | No |
| 2000(11) | V/77 | No | HAI 1/1.280 | No | Sí |
| 2001(5) | M/(28–58) | No | HAI 1/512 | Sí | Sí |
| 2001(5) | V/(28–58) | No | HAI 1/2.048 | No | NR |
| 2002(9) | V/72 | No | IFI 1/100 | No | Sí |
| 2004(11) | V/54 | No | HAI 1/2.560 | No | NR |
| 2004(6) | V(48) | No | AL Negativo | No | Sí |
| 2004(7) | V(38) | Síd | HAI Positivo | No | NR |
| 2004(8) | V(54) | No | HAI 1/2.560 | No | No |
| 2005(11) | V/48 | Síe | IFI 1/640 | No | NR |
| 2005(3) | V(69) | No | IFI 1/1.024 | No | No |
| 2007(4) | M(61) | No | ELISA 2,02 | No | No |
| 2006 | V (51) | Síe | HAI 1/4096 | No | No |
| 2007 | V (35) | No | HAI 1/512 | No | No |
AL: aglutinación con látex; ELISA: enzimoinmunoanálisis de adsorción; HAI: hemaglutinación indirecta; IFI: inmunofluorescencia indirecta; M: mujer; NR: no realizado; V: varón; –: sin datos.
a Relaciones sexuales con varón sudamericano.
b Convivencia con enfermo de amebiasis.
c Comerciante de frutas tropicales.
d Convivencia con sudamericana.
e Sexo con prostitutas sudamericanas y africanas.
Respecto a los métodos de diagnóstico microbiológico, en 19 casos la serología fue positiva, en 3 casos se observaron quistes de amebas en heces y en 6 enfermos (de los 13 en los que se investigó) se observaron trofozoítos de E. histolytica en el pus del absceso. Debe destacarse que en los 2 casos diagnosticados en 2007 se empleó la técnica molecular de PCR (descrita en el apartado anterior) a partir del material del absceso. En 2 de los enfermos no hay información sobre la técnica diagnóstica utilizada. En cuanto a la fecha de los casos, hay que resaltar que desde 1985 hasta 1997 se describieron 6 casos de AHA en españoles sin antecedentes de viaje a áreas endémicas: 4 en 1985, uno en 1991 y otro en 1995. En los últimos 10 años se han publicado 17 casos, y 9 de éstos en los últimos 4 años, lo que parece indicar un aumento en la prevalencia de esta infección.
Técnica de la reacción en cadena de la polimerasaLos resultados obtenidos con la PCR anidada al analizar cantidades decrecientes de ADN de E. histolytica procedente de un cultivo axénico pusieron de manifiesto que la última dilución de ADN detectada fue la equivalente a 0,001 parásitos. En cuanto al estudio de especificidad, no se obtuvo producto de amplificación al analizar mediante PCR anidada las muestras de abscesos hepáticos no amebianos.
DiscusiónLos casos comunicados y la revisión realizada obligan a incluir a la amebiasis entre las enfermedades potenciales de pacientes que nunca han salido de España, e indican un aumento reciente de esta entidad en el medio.
El fenómeno migratorio,y los intercambios comerciales son factores que pueden influir en la distribución global de determinados agentes infecciosos. Según el informe de 2007 de la Oficina Regional para la Inmigración de la Comunidad de Madrid (OFRIM), un 15,8% de la población empadronada en la Comunidad de Madrid es extranjera. De ésta, el 42,6% procede de Sudamérica y el 12,0% procede de África (áreas endémicas de infecciones, entre las que se encuentra la amebiasis). Muchos de estos inmigrantes trabajan en la horticultura intensiva (en ocasiones acomodados en infraviviendas), en la manipulación de alimentos, en la hostelería y en el servicio doméstico.
Si se tiene en cuenta lo anterior, resulta tentador asociar tanto el fenómeno migratorio como la importación de alimentos desde zonas endémicas a los casos autóctonos de amebiasis detectados en España en los últimos años. No obstante, tampoco debe descartarse que algunas de estas infecciones sean genuinamente autóctonas, dado que este parásito es cosmopolita y puede persistir en zonas con condiciones higiénicas deficientes. Es prudente prever que la amebiasis autóctona va a convertirse en una infección más frecuente de lo que ha sido hasta la fecha, ya que los fenómenos migratorios y el comercio a escala global no dejan de crecer.
En muchas ocasiones, la amebiasis intestinal es una infección asintomática, que pasa desapercibida en población inmigrante, lo que permite que aumente la circulación del parásito en el medio y, por tanto, la probabilidad de contagio. Ante esta nueva perspectiva, los procedimientos diagnósticos que se usan para detectar la amebiasis en España deberían ser reconsiderados. En primer lugar, debe incluirse en el diagnóstico diferencial de cuadros clínicos compatibles. En cuanto al diagnóstico microbiológico, es necesario utilizar herramientas que permitan identificar con fiabilidad las infecciones importadas que, hasta hace unos años, eran poco comunes en España. Para la detección del AHA en el laboratorio, la microscopia es una técnica de baja sensibilidad13. Sin embargo, las técnicas de PCR (como la descrita en este trabajo) tienen una elevada sensibilidad y especificidad para la detección de esta parasitosis. La sensibilidad de la técnica de PCR para la amplificación del ADN de E. histolytica a partir de la muestra obtenida por punción-aspiración del absceso hepático es cercana al 100%14,15. También se han utilizado otras muestras, como sangre, orina y heces, aunque con una sensibilidad muy inferior16. Las técnicas serológicas presentan una sensibilidad y especificidad aceptables, pero hay que destacar que en inmigrantes de zonas endémicas de amebiasis, el resultado de la serología no tiene valor diagnóstico, ya que los anticuerpos pueden persistir durante años tras una infección. Por tanto, en el caso de emplear una técnica serológica, el diagnóstico debe confirmarse por otro método (como los basados en la PCR), especialmente en la población que ha residido largos períodos de tiempo en zonas endémicas. Otro inconveniente de la serología son los falsos negativos debidos a la existencia de un período ventana en las primeras etapas de la enfermedad17,18.
Para concluir, la infección por E. histolytica está aumentando en prevalencia en los últimos años. Debería tenerse presente desde el punto de vista clínico y microbiológico en entidades compatibles, incluso en ausencia de antecedentes epidemiológicos de posible contacto con el parásito. Las técnicas basadas en la biología molecular, disponibles en centros de referencia, presentan mayor fiabilidad que los métodos microscópicos de diagnóstico, por lo que se recomienda su uso en el diagnóstico de la amebiasis en España19,20.
Autor para correspondencia.
Ma José Gutiérrez-Cisneros
Dirección: mjguti@isciii.es