El cáncer gástrico continúa siendo la segunda causa de muerte asociada a cáncer a nivel mundial. La técnica de disección endoscópica submucosa (DES) para remoción en bloque de las lesiones gástricas tempranas se ha convertido en el tratamiento de elección en países orientales.
ObjetivoEvaluar la curva de aprendizaje de la técnica de DES en modelo porcino ex vivo e in vivo de acuerdo a las recomendaciones internacionales (30 casos).
Material y métodosSe realizaron 2 DES por sesión de lesiones gástricas simuladas, inicialmente en 10 modelos ex vivo utilizando vísceras porcinas. Continuamos con modelos porcinos in vivo, realizando 2 DES en cada estómago porcino. Se simularon lesiones mucosas elevadas, planas y deprimidas, así como lesiones submucosas.
Análisis estadísticoSe formaron 3 grupos de 10 casos cada uno para comparar entre ellos mediante ANOVA la velocidad (área/tiempo) de disección, así como la tasa de éxito y sus complicaciones. Las pruebas paramétricas se expresaron como media ± desviación estándar con la prueba de t-student. Las variables cualitativas o categóricas nominales compararon proporciones y se analizaron por X2. Se consideraron significativas las diferencias con valor de p<0.05 con un poder β de 0.80.
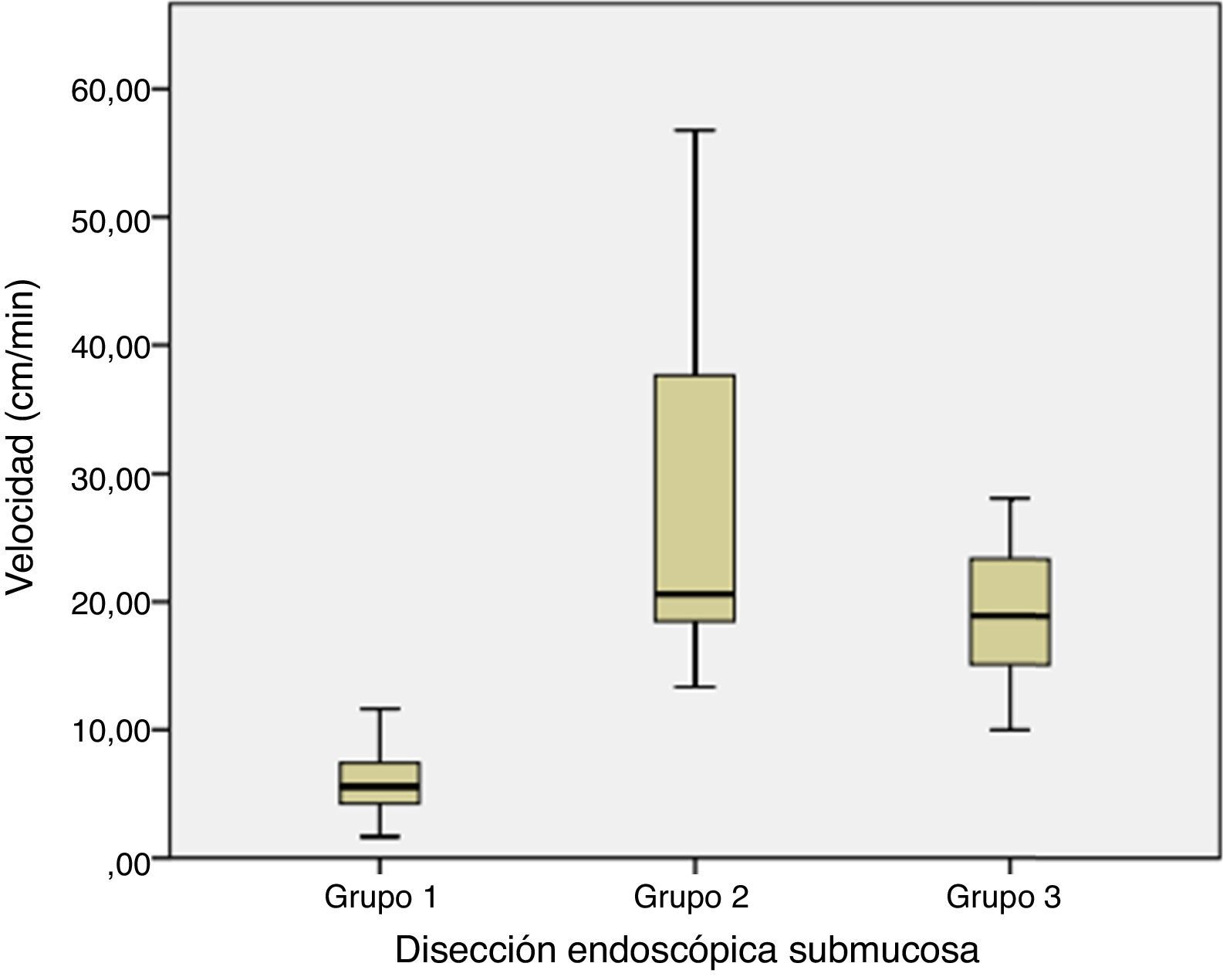
ResultadosSe realizaron 30 disecciones de lesiones gástricas simuladas. Los primeros 20 (67%) fueron realizados en modelos ex vivo y el resto (33%) en porcinos vivos. Veintiún casos (70%) se realizaron en lesiones mucosas, la mayoría de ellas elevadas (Paris 0-Ip) y 9 (30%) en lesiones submucosas (Paris 0-IIa). Cincuenta y siete por cien se localizaron en la pared posterior del estómago, 23% en antro y 20% la curvatura mayor. Se calculó el área de disección mediante la siguiente fórmula: área= (π · D2/4) y velocidad= (área / tiempo). El procedimiento fue exitoso en 93% (28/30) de los casos tras la resección en bloque del tejido. La tasa de complicaciones fue del 7% (2 perforaciones). Todos los puercos se mantuvieron vivos a las 72 horas de seguimiento. El tamaño de las lesiones resecadas fue significativamente mayor entre los 3 grupos (20 vs. 44 vs. 35mm; p<0.001), sin cambios en el tiempo de disección (58 vs. 59 vs. 51min; p=0.429). La velocidad de disección fue significativamente mayor en los grupos 2 y 3 comparados con el primero (6 vs. 27 vs. 19mm2/min; p<0.001).
ConclusiónEl programa de disección en modelos biológicos contribuye en la curva de aprendizaje de la técnica con una clara mejoría progresiva en las habilidades y con tasas de éxito y complicaciones similares a las descritas en la literatura. Los modelos porcinos ex vivo e in vivo son de gran utilidad para llevar a cabo la curva de aprendizaje de esta modalidad. Una vez adquiridos estos conocimientos la técnica podría aplicarse en seres humanos.
Gastric cancer remains the second leading cause of cancer-related death worldwide. The technique of endoscopic submucosal dissection (ESD) for “en bloc” removal of early gastric lesions has become the treatment of choice in eastern countries.
ObjectiveTo evaluate the learning curve of the ESD technique in ex vivo and in vivo porcine models according to international recommendations (30 cases).
Material and MethodsTwo ESD techniques per session of simulated gastric lesions were performed, initially in 10 ex vivo models using porcine viscera. These were followed by in vivo porcine models, with 2 ESD performed in each porcine stomach. Raised, flat and depressed mucosal lesions were simulated, as well as submucosal lesions.
Statistical analysisThree groups of 10 cases each were established and their dissection speed (area/time), success rate and complications were compared by ANOVA. Parametric tests were expressed as mean ± standard deviation using the Student t-test. Nominal categorical or qualitative variables were analysed and proportions compared by X2. Differences were considered significant at a value of p<.05 with a β power of .80.
Resultsa total of 30 dissections of simulated gastric lesions were performed. The first 20 (67%) were performed in ex vivo models and the rest (33%) in live pigs. Of these, 21 cases (70%) were performed on mucosal lesions, most of them elevated (Paris 0-Ip) and 9 (30%) on submucosal lesions (Paris 0-IIa). In total, 57% were located in the posterior wall of the stomach, 23% in the antrum and 20% in the greater curvature. The area and speed of the dissection were calculated using the following formulae: area=(π D2/4) and speed=(area/time). The procedure was successful in 93% (28/30) of cases after “en bloc” tissue resection. The complication rate was 7% (2 perforations). All pigs remained alive for the 72hours of monitoring time. The size of the resected lesions varied significantly between the 3 groups (p<.001), with no change in the time of dissection (p=.429). Dissection speed was significantly higher in groups 2 and 3 compared to the first group (p<.001).
ConclusionThe dissection program in biological models contributes to the learning curve of the technique with a clear and progressive improvement in the level of skill and success rate, as well as a complication rate similar to those described in the literature. Porcine ex vivo and in vivo models are very useful in the learning curve of this modality. Once this knowledge has been acquired, the technique can be applied in humans.
El cáncer gástrico continúa siendo la segunda causa de muerte asociada a cáncer a nivel mundial. Existe una gran variación geográfica en cuanto a la incidencia del cáncer gástrico; las tasas más altas se han reportado en países asiáticos como Japón, China y Rusia del este (alrededor de 70 casos por 100,000 habitantes). En Japón, el 57% de los casos de cáncer gástrico se detecta en etapas tempranas, comparado con un 15% de detección temprana en el resto del mundo. En México se ha estimado una incidencia de 23.6 casos por cada 100,000 habitantes, sin embargo, la incidencia de cáncer gástrico temprano en nuestro país no ha sido establecida debido a los diferentes programas de escrutinio y a la dificultad de la población para el acceso a los servicios de salud. Debido a la mayor incidencia de cáncer gástrico en países orientales, el estándar de oro en el tratamiento de lesiones tempranas, es decir, que no invaden la capa submucosa profunda, es la disección endoscópica submucosa. En nuestro país el estándar de oro continúa siendo la gastrectomía mediante cirugía abierta1.
La técnica de remoción en bloque de los tumores gástricos superficiales también conocida como disección endoscópica de la submucosa (DES), fue descrita desde 1988, pero no fue sino hasta 1999 que Gotoda et al. publicaron el primer reporte de DES en Japón, en donde actualmente se considera el tratamiento de elección para pacientes con lesiones superficiales como el carcinoma gástrico temprano y la displasia de alto grado en el tracto digestivo2,3. Los procedimientos realizados solo por algunos pioneros en Japón son ahora, más de 10 años después, una técnica de crecimiento rápido en Asia, Europa y Estados Unidos, debido a las diferentes ventajas que supone sobre la cirugía como los son: menor tiempo del procedimiento, recuperación más rápida con menor tiempo de estancia hospitalaria, menores costos, cirugía endoscópica mínimamente invasiva con tasas de éxito similares a la cirugía abierta3.
La preferencia de DES sobre resección endoscópica de la mucosa (REM), que es la otra opción de tratamiento endoscópico está sustentada debido a las tasas más altas de curación en pacientes sometidos a disección y resección en bloque así como menores índices de recurrencia3,4.
Las principales indicaciones para DES son aquellos pacientes con lesiones esofágicas, gástricas y/o colorrectales con displasia o carcinoma in situ mayores a 20mm de diámetro, confinadas a la capa mucosa o submucosa superficial. La principal contraindicación para la DES es la invasión de la capa submucosa profunda4.
En hospitales de alto volumen este entrenamiento se realiza de una forma progresiva y estructurada en donde inicialmente los endoscopistas participan como asistentes una vez que han obtenido los conocimientos teóricos y prácticos, para después iniciar con disecciones en el antro gástrico o en el recto guiados por un experto, para finalmente realizar disecciones en estómago proximal, colon o esófago4.
Los endoscopios convencionales de visión frontal como el panendoscopio y el colonoscopio son suficientes para llevar a cabo la técnica. Para disecciones en recto y colon izquierdo se recomienda el uso de panendoscopios. Es indispensable el uso de capuchones plásticos suaves o rígidos para todo procedimiento, lo que permite una mejor maniobrabilidad y fijación de los tejidos para el plano de disección. Es altamente recomendado realizar estos procedimientos con insuflación mediante bomba de CO2, ya que su absorción tisular es cien veces más rápida que la del aire ambiente, lo que se traduce en menor distensión abdominal y mayor comodidad para el paciente, además, en caso de una perforación, el CO2 se reabsorbe de forma mas rápida en la cavidad peritoneal4.
La DES requiere de técnicas más complejas y precisas que otros procedimientos en el campo de la endoscopia terapéutica ya que en las series más grandes los reportes de perforación oscilan del 1 al 5% y la hemorragia hasta en el 15% de los casos3. Se considera que estos porcentajes variarán de acuerdo a la experiencia del operador y a su curva de aprendizaje. Algunas publicaciones estiman que un total de 30 casos de DES en estómagos porcinos supervisados por una persona con experiencia en la técnica son necesarios para adquirir las habilidades y destrezas requeridas para la disección5.
En países occidentales, la detección de carcinomas tempranos es mucho menor, lo que resulta en una introducción más lenta a la técnica, dado lo anterior, se ha propuesto el aprendizaje de DES utilizando modelos animales inicialmente ex vivo y posteriormente in vivo para adquirir las habilidades técnicas necesarias antes de practicar la DES en humanos, sobre todo en ausencia de expertos, esto es lo sugerido en los trabajos realizados por Adolfo Parra-Blanco en España y Nicolás González en Uruguay, quienes establecieron el uso de modelos animales para desarrollar las habilidades técnicas necesarias antes de aplicarlas en pacientes2,5.
Descripción de la técnica de disección endoscópica submucosa en modelos animalesEn los modelos porcinos fueron simuladas lesiones mucosas gástricas elevadas, planas y deprimidas mediante colocación de ligadura con banda, coagulación monopolar o resección con asa térmica respectivamente.
Se requiere una cuidadosa inspección de la lesión para determinar los márgenes laterales para lo cual se recomienda el uso de cromoendoscopia digital o convencional.
Marcaje mucosoSe colocaron marcas en la periferia de la lesión utilizando dispositivos de coagulación (plasma de argón o coagulación monopolar de contacto). Las marcas se situaron de 5-10mm laterales al margen de la lesión con una separación de 2-3mm entre ellas6.
Inyección submucosaEn este estudio utilizamos una mezcla de 85ml de solución salina al 0.9% con 15ml de hidroximetilcelulosa con 3-5ml de índigo carmín o de azul de metileno para facilitar la identificación del espacio submucoso6.
Incisión circunferencialEsta incisión se puede realizar uniendo los puntos de coagulación del marcaje inicial, o bien, 5mm por fuera del margen realizado en el marcaje inicial6.
Disección submucosaEs esencial mantener un plano de disección constante de la capa submucosa para evitar lesiones de la capa muscular propia. Al completar la disección se debe inspeccionar cuidadosamente la úlcera artificial en busca de vasos sanguíneos.
El principio clave para manejar el tejido resecado es mantener su estado «en bloc» sin causarle ningún daño, para esto, se sugiere el retiro mediante succión dentro del cap o bien mediante pinzas atraumáticas. Se sugiere extender el tejido en corcho mediante alfileres dirigidos por ejes para su posterior fijación en formol6.
Ante la falta de expertos en países occidentales, se ha establecido que el uso de modelos animales porcinos ex vivo e in vivo es útil para desarrollar las habilidades necesarias en la DES2–16.
La técnica descrita anteriormente y propuesta en Japón por Gotoda et al. es la utilizada de manera estándar a nivel mundial. La curva de aprendizaje con modelos animales se ha realizado en Europa, Estados Unidos y Sudamérica para la cual empleamos la técnica establecida.
El objetivo primario de nuestro estudio fue evaluar la curva de aprendizaje de la técnica de disección endoscópica submucosa en modelo porcino ex vivo e in vivo de acuerdo a las recomendaciones internacionales (30 casos). Como objetivos secundarios se determinaron de manera progresiva la eficacia, seguridad y resultados de DES en modelos porcinos durante un periodo determinado de entrenamiento.
Material y métodosEstudio preclínico, experimental, longitudinal y prospectivo. Se utilizaron 10 modelos ex vivo de víscera porcina -esófago, estómago y duodeno- además de 5 modelos in vivo, realizando 2 DES por cada sesión.
Consideraciones éticasTodos los procedimientos que se llevaron a cabo en modelos porcinos fueron realizados de acuerdo a las normas establecidas en el bioterio del Hospital de Especialidades UMAE Siglo XXI y bajo la normativa de las buenas prácticas del Comité Institucional para el Cuidado y Uso de Animales de Laboratorio (CICUAL). Norma Oficial Mexicana NOM-062-ZOO-1999«Especificaciones técnicas para la produccio¿n, cuidado y uso de los animales de laboratorio». Norma en la cual se especifican las técnicas para la producción, cuidado y uso de los animales de laboratorio.
ProcedimientosEl estudio se realizó en 3 etapas:
Etapa 1: un endoscopista con experiencia en DES (OH) entrenó a un endoscopista sin experiencia en esta técnica (VG). El entrenamiento inicial consistió en una revisión extensa de artículos relacionados con DES y la revisión de vídeos de procedimientos realizados por expertos para obtener los conceptos teóricos de la técnica.
Etapa 2: inició el proceso de adiestramiento en la técnica descrita en la literatura primero en modelos animales ex vivo, utilizando vísceras de puercos de la raza Landrages, fijando esófago, estómago y duodeno a un maniquí para simular la situación anatómica fisiológica.
Etapa 3: el proceso continuó en modelos porcinos in vivo utilizando la misma técnica de disección, trabajando en el estómago porcino así como en la etapa 2.
Al inicio de cada sesión fueron simuladas lesiones mucosas elevadas, planas y deprimidas mediante ligadura con banda, coagulación monopolar y resección con asa respectivamente, así como lesiones submucosas simuladas tras la aplicación de cianoacrilato + lipiodol con inyección endoscópica de la capa submucosa. Estas lesiones fueron realizadas inmediatamente antes de iniciar la disección y todas ellas se localizaron en el estómago porcino. Las prácticas se llevaron a cabo en una sala de quirófano de medicina experimental en el bioterio del Hospital de Especialidades Centro Médico Nacional Siglo XXI del Instituto Mexicano del Seguro Social, que cuenta con una temperatura de 16-27°C y una humedad relativa del 40 al 70%.
Los procedimientos se llevaron a cabo con un gastroscopio Fujinon modelo EG-530FP de 9.8mm de diámetro con un canal de trabajo de 2.8mm, con procesador Fujinon 4400, designado exclusivamente para prácticas en modelos animales.
Se utilizó un capuchón rígido marca Olympus D-201-12704, así como una unidad electroquirúrgica ERBE ICC 200 (ElektromedizinGmbH, Tübingen, Alemania) en modalidad «auto-cut» monopolar con una potencia de corte de 100 y 50 watts para coagulación, con un efecto de mezcla 3 («blend»). Se usó una bomba de irrigación marca EndoGator con fuerza de irrigación variable.
Todos los procedimientos fueron gravados en formato DVD y las imágenes respaldadas en formato JPG. En todos los casos se registró:
El tiempo total del procedimiento.
El tiempo de delimitación de la lesión.
El tiempo de marcaje.
El tiempo de inyección.
El tiempo de incisión circunferencial.
El tiempo de disección.
El tiempo de hemostasia.
Localización topográfica de la lesión en estómago.
Tamaño estimado de la lesión.
Materiales utilizados para la disección.
Tipo de resección.
Complicaciones.
Tamaño del espécimen obtenido.
Área de disección.
Velocidad de disección.
Inicialmente se trabajó en vísceras porcinas (esófago, estómago y duodeno) de animales machos/hembras de 30-85kg de peso, que se mantuvieron congeladas durante una semana a una temperatura de -12°C y se descongelaron a temperatura ambiente durante un lapso de 16 horas para preservar la elasticidad de la pared. Se requiere de una limpieza, por lo que una vez lavado el exterior se lavó y aspiró el interior con 5-8l de agua simple para remover moco y cualquier tipo de sedimento. Se fijó el esófago a la boca del maniquí mediante sutura con seda 2-0 cerrando el tracto de salida duodenal con seda 1-0 para lograr la insuflación.
Se empleó un maniquí marca Fuji para posicionar las vísceras de acuerdo al modelo anatómico.
Se utilizaron un total de 10 vísceras porcinas (una por semana) para realizar en cada una de ellas al menos 2 procedimientos de disección.
Los desechos tales como tejidos, líquidos corporales, materiales punzocortantes, jeringas y agujas hipodérmicas, entre otros, considerados residuos peligrosos biológico-infecciosos, fueron manejados y eliminados de acuerdo con la Norma Oficial Mexicana NOM-087-ECOL-94, así como a la Ley General del Equilibrio Ecológico y la Protección al Ambiente. Los desechos del bioterio no considerados contaminantes o biológicos infecciosos fueron destinados al depósito general de basura.
Modelo in vivoSe utilizaron puercos vivos macho o hembra de la raza Landrages de 3-5 meses de edad con un peso de entre 20-45kg, con certificado de buena salud emitido por un médico veterinario. Los animales permanecieron con dieta líquida durante 48 horas previas al procedimiento y en ayuno absoluto durante las últimas 8 horas para garantizar el vaciamiento gástrico adecuado y disminuir el riesgo de broncoaspiración. Se administró anestesia general por un veterinario certificado quien se encargó de vigilar los signos vitales y de controlar las posibles complicaciones durante los procedimientos.
Cada animal se premedicó con ketamina a dosis de 15mg/kg vía intramuscular. Fue bañado con jabón antiséptico previo a su ingreso al bioterio. Para la inducción anestésica se administró midazolam a dosis de 5mg/kg vía endovenosa y para el mantenimiento una dosis de 2mg endovenosos cada10–15 minutos de acuerdo a los requerimientos vigilando la frecuencia cardiaca y respiratoria para evitar depresión de las mismas. Durante el procedimiento se utilizó buprenorfina como analgesia a dosis de 0.01-0.04mg/kg vía endovenosa a través de la vena auricular del animal.
Cada porcino fue llevado a una área de recuperación fuera de la unidad del bioterio para iniciar una dieta líquida durante 24 horas y posteriormente reiniciar la dieta balanceada. Esta área tiene una superficie de concreto con rejilla conectada al drenaje para la limpieza adecuada de la misma con soluciones antisépticas y agua a presión; tiene una superficie de 8.75m2 y está equipada con un bebedero de 20×20cm de material no corrosivo con libre acceso a agua potable y un comedero de 20×40cm de material no corrosivo. Es un área cerrada con sistema de ventilación continua mediante extractor y ventilador eléctricos con lo que se consigue un recambio de aire de 15-18 veces por hora, iluminada mediante luz blanca de 350 lúmenes. El área de descanso del animal se encuentra sobre una plataforma de concreto de 2.25m2 elevada a 10cm del resto de la superficie para evitar el contacto con el agua de lavado cotidiano. La superficie de descanso se encuentra cubierta con una mezcla de paja y viruta de madera.
La alimentación antes y después del procedimiento se realizó con una mezcla de 16% de proteína cruda, 6% de fibra cruda, 3.5% de lípidos y el resto de carbohidratos por cada ración, con consumo de agua a libre demanda durante todo el día. Se les proporcionó una dosis de 20mg de omeprazol vía oral para acelerar la cicatrización gástrica.
EutanasiaLos cuidados del animal fueron realizados por el médico veterinario vigilando signos de sepsis, dolor, hemorragia, cambios en el comportamiento o en los hábitos de alimentación.
La eutanasia se llevó a cabo en el área de observación en donde los animales pasaron las últimas 72 horas posteriores al procedimiento endoscópico y apartados de cualquier otro animal.
Se produjo sedación e inconsciencia tras la administración inicial de ketamina a dosis de 15mg/kg vía intramuscular para reducir la ansiedad e inducir la inconsciencia en un tiempo mínimo. Una vez inconsciente se administró pentobarbital sódico a dosis de 200mg/kg de peso por vía endovenosa a través de la vena auricular del animal, causando paro cardiaco, respiratorio y pérdida de las funciones cerebrales. Se verificó la muerte del animal confirmando la ausencia de signos vitales. Solo se realizaron 2 disecciones por animal en un periodo de anestesia no mayor a 6 horas.
Análisis estadísticoSe formaron 3 grupos de 10 casos cada uno para comparar entre ellos mediante ANOVA de un factor la velocidad (área/tiempo) de disección de las lesiones, así como la tasa de éxito de los procedimientos y sus complicaciones. Las pruebas paramétricas se expresaron como promedio o media ± desviación estándar por medio de la prueba de t-student. Las variables cualitativas o categóricas nominales compararon proporciones y se realizaron por X2 como prueba no paramétrica. Se consideraron significativas las diferencias con valor de p<0.05 con un poder β de 0.80. Se realizó ANOVA de un factor para evaluar las diferencias entre los 3 grupos analizados (intragrupos, intergrupos y total).
Tamaño de la muestraNo probabilística y por conveniencia. Se realizaron un total de 30 procedimientos de disección de acuerdo a las recomendaciones internacionales (20 en modelos ex vivo y 10 en modelos in vivo).
ResultadosDurante el periodo comprendido del 5 de febrero 2014 al 14 de mayo 2014 se realizaron 30 procedimientos de disección endoscópica submucosa de lesiones gástricas simuladas. Los primeros 20 (67%) fueron realizados en modelos ex vivo y el resto (33%) en porcinos vivos. Se conformaron para el análisis 3 grupos de 10 procedimientos cada uno (grupo 1: procedimientos del 1 al 10, grupo 2: procedimientos del 11 al 20, grupo 3: procedimientos del 21 al 30). El 73% de los casos fueron hembras. La media del peso porcino fue de 58kg (±12) para los modelos ex vivo y 36kg (±10) para modelos vivos. Veintiuna disecciones (70%) se realizaron en lesiones mucosas, la mayoría de ellas elevadas (Paris 0-Ip) y 9 (30%) en lesiones submucosas (Paris 0-IIa).
En cuanto a la topografía de las lesiones, el 57% se localizaron en la pared posterior del estómago, 23% en el antro y 20% en la curvatura mayor gástrica. Se calculó el área de disección mediante la siguiente fórmula: área= (π · D2/4), en donde π=3.1416 y D2=diámetro al cuadrado. La velocidad de disección fue calculada con la siguiente fórmula: velocidad= (área / tiempo).
En los 3 grupos la media de tiempo total del procedimiento fue cercana a los 60 minutos, sin embargo, en los primeros casos el tamaño-área de las lesiones resecadas así como la velocidad de resección fueron mucho menor que en el resto de los casos, lo cual reflejó la falta de habilidades en la técnica del el operador. En el segundo grupo el tiempo total del procedimiento no tuvo modificaciones, no así para el tamaño y velocidad de resección. Fue en este grupo en donde iniciamos la disección de lesiones submucosas las cuales correspondieron al 60% de las lesiones del grupo, por lo tanto, estas lesiones requirieron mayor tiempo durante la fase de disección submucosa debido a la dureza del tejido derivada de la aplicación de cianoacrilato. En este grupo el tiempo no se vio afectado, a pesar del tipo de lesiones simuladas y al aumento en el tamaño de las mismas, debido a un incremento considerable en la velocidad de disección (p=0.001). En el grupo 3, el tiempo total del procedimiento se mantuvo sin modificaciones significativas y tanto la velocidad de disección como el tamaño de las disecciones disminuyeron discretamente debido a que el fue el grupo de modelos vivos, agregándose la variable de hemorragia.
La tabla 1 muestra las diferencias significativas en cuanto a la velocidad de disección entre los 3 grupos, reflejando así la curva de aprendizaje en la técnica de DES.
Se consideró exitoso el procedimiento en 93% (28/30) de los casos tras la resección en bloque del tejido. Durante el estudio se presentaron 2 casos de perforación transmural y ningún caso de hemorragia que impidiera continuar con el procedimiento, lo que equivale a una tasa de complicaciones del 7%. En uno de estos eventos la perforación impidió continuar con la disección por lo que el tejido fue resecado mediante asa térmica. Durante el seguimiento a las 72 horas, los 5 puercos se mantuvieron vivos, sin cambios en el comportamiento y todos reiniciaron la alimentación vía oral.
DiscusiónLa disección endoscópica submucosa es un procedimiento complejo ya que requiere de diversos pasos y el dominio de múltiples herramientas para llevarla a cabo. Las dificultades inherentes al procedimiento, el proceso de entrenamiento requerido y la baja frecuencia de neoplasias gástricas superficiales detectadas en nuestro país son algunas de las razones por las que muy pocos centros llevan a cabo esta técnica.
Hasta la fecha no existen publicaciones que estandaricen la técnica de manera universal en un programa de entrenamiento en modelos porcino para su aplicación subsecuente en pacientes. Gotoda et al.14 han desarrollado en Japón programas de entrenamiento en modelos porcino y sugieren que esta es una manera de incrementar rápidamente la curva de aprendizaje en la técnica de DES en un periodo de tiempo relativamente corto, por lo tanto, es una buena manera de favorecer su aprendizaje en países occidentales ante la falta de expertos. También han establecido que al menos 30 DES gástricas en modelos animales son necesarias para alcanzar cierto grado de competencia, ya que se estima una tasa de perforación del 20% durante la curva de aprendizaje.
Vázquez-Sequeiros et al.17 describieron en España un programa de entrenamiento secuencial y reproducible a través de 4 fases: 1) fase teórica basada en la adquisición del conocimiento básico de la técnica mediante revisión de la literatura científica al respecto; 2) entrenamiento en modelo animal ex vivo; 3) entrenamiento en modelos animales in vivo supervisados por un experto; 4) aplicación de la técnica de DES en pacientes.
En México, Tanimoto et al. establecieron en el año 2010 la utilidad del modelo canino in vivo para la práctica de disecciones en esófago y estómago9. El mismo año, Figueroa-Barojas et al. establecieron la factibilidad del uso de simuladores biológicos inanimados para el entrenamiento en DES8.
En el presente estudio se evaluó el impacto del uso de modelos animales, obteniendo buenos resultados en cuanto a eficacia y seguridad. En relación con el estado de las vísceras porcinas, la mayoría de los casos de DES fueron realizados en estómagos previamente congelados, lo que disminuye considerablemente la elasticidad del tejido y por lo tanto, consumiendo mayor tiempo en las fases de inyección submucosa y corte circunferencial.
De acuerdo con González et al.2, los estómagos procedentes de puercos más pesados, proporcionan mayor espacio para realizar múltiples disecciones. Por otro lado, los estómagos procedentes de animales más pequeños parecen demandar mayor habilidad del endoscopista ya que el espacio limitado incrementa el grado de dificultad.
Con respecto al tipo de tejido utilizado, recomendamos iniciar la curva de aprendizaje con modelos de porcino ex vivo, ya que actualmente el modelo porcino parece ser el que comparte más semejanzas con el tracto digestivo alto del ser humano. Por otro lado, iniciar la estandarización de la técnica en vísceras permite al operador identificar perfectamente el sitio de inyección, estimar el tamaño de la lesión antes y después de la disección, así como ubicar la localización precisa y las características de una perforación en caso de presentarse. El uso inicial de modelos ex vivo suprime la limitante del tiempo de anestesia así como los movimientos involuntarios y la variable de hemorragia de los modelos vivos. En contraparte, una vez familiarizados con la técnica y el dominio de los diferentes aditamentos, consideramos indispensable el progreso en modelos porcino in vivo ya que estos ofrecen diferentes ventajas: se simula un ambiente más realista en donde hay que trabajar acompañado de los movimientos peristálticos del estómago, de las secreciones intraluminales y de la hemorragia como una posible complicación. No hay ninguna justificación para utilizar inicialmente modelos in vivo ya que esto incrementa los costos, requieren de mayor preparación previa al procedimiento así como de asistencia técnica para el manejo del animal y no se considera éticamente correcto.
En nuestro estudio, se establecieron las siguientes variables como marcadores de habilidades técnicas para medir el progreso en el aprendizaje: tiempo total del procedimiento, tamaño obtenido del espécimen resecado, área, velocidad de la disección y el éxito del procedimiento. En virtud de estas variables, los resultados obtenidos del estudio demuestran que hubo un progreso en la curva de aprendizaje medido en relación con la velocidad de disección, el grado de complicaciones y la tasa de éxito del procedimiento.
Una de las limitantes de este estudio es que refleja la experiencia de un solo centro de entrenamiento y de un solo endoscopista. Las habilidades y experiencia de cada endoscopista son diferentes por lo que estos resultados no garantizan su reproductibilidad. Por otro lado, las lesiones gástricas tempranas descritas en la literatura no incluyen tumores submucosos. En nuestro estudio 9/30 casos se realizaron en lesiones submucosas, esto incrementa el grado de complejidad pero no homogeniza la muestra.
Consideramos importante que el endoscopista en entrenamiento de DES adquiera previamente experiencia en endoscopia terapéutica ya que debe ser capaz de manejar y resolver las posibles complicaciones durante el procedimiento como hemorragia y perforación. Es fundamental ser autocrítico para reconocer las limitaciones personales y recibir retroalimentación permanente para que la práctica de DES pueda llevarse a cabo de una manera segura y eficiente. Una vez que se realicen disecciones en humanos, es recomendable iniciar con lesiones pequeñas y en áreas de mayor seguridad como el antro gástrico para posteriormente progresar a lesiones de mayor tamaño y áreas de mayor dificultad como la curvatura menor y el fondo gástrico (fig. 1).
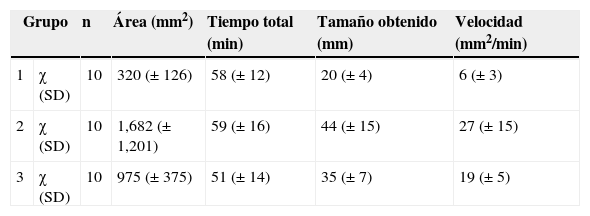
En conclusión, de acuerdo al análisis de los resultados obtenidos, en México el programa de entrenamiento secuencial de la técnica de disección endoscópica submucosa en modelos animales propuesta por expertos japoneses, contribuye en la adquisición de las habilidades requeridas para llevarla a cabo en modelos biológicos con una tasa de éxito y complicaciones similar a la descrita en la literatura, por lo que los modelos porcinos ex vivo e in vivo son de gran utilidad para llevar a cabo la curva de aprendizaje de esta técnica. Una vez adquiridos estos conocimientos la técnica podría aplicarse en seres humanos (tabla 1).
Diferencias de medias de las variables analizadas de acuerdo a grupos
| Grupo | n | Área (mm2) | Tiempo total (min) | Tamaño obtenido (mm) | Velocidad (mm2/min) | |
|---|---|---|---|---|---|---|
| 1 | χ (SD) | 10 | 320 (±126) | 58 (±12) | 20 (±4) | 6 (±3) |
| 2 | χ (SD) | 10 | 1,682 (±1,201) | 59 (±16) | 44 (±15) | 27 (±15) |
| 3 | χ (SD) | 10 | 975 (±375) | 51 (±14) | 35 (±7) | 19 (±5) |
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes. Por favor, añadir una remark para que los autores confirmen las responabilidades éticas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.