Detección y vigilancia de pólipos y cáncer
Felipe Zamarripa-Dorsey
Jefe del Servicio de Gastroenterología, Hospital Juárez de México, México D.F., México
Correspondencia:
Ejército Nacional 613. Despacho 204 Colonia Granada, México D.F. CP 11520.
Correo electrónico:gastrozama@yahoo.com.mx
Resumen
Se presenta un breve resumen de los resúmenes y ponencias para el tamizaje y la detección de pólipos y cáncer colorrectal, las cuestiones que se habla en el curso de posgrado en ASGE 2013.
Palabras clave: Polipectomía, cáncer colorrectal, hiperplásicos, adenomatosas, endomicroscopía, México.
Abstract
We present a brief resume of the abstracts and presentations for the screening and detection of polyps and colorectal cancer, the issues that were talked-about in the postgraduate course in ASGE 2013.
Keywords: Polypectomy, colorectal cancer, hyperplastic, adenomatous, endomicroscopy, Mexico.
El diagnóstico temprano y prevención del cáncer colorrectal (CCR), sin duda continúa impactando en la reducción de la mortalidad de esta enfermedad. Este estrategia depende del apropiado reconocimiento de las lesiones y en consecuencia de su retiro exitoso.1 Como parte de los indicadores de calidad de la colonoscopia está el indicador de tasa de detección de adenomas (ADR), el cual impacta en la mortalidad del CCR. Por ello, la detección de adenomas más polipectomía satisfactoria es el estándar de oro cuando el objetivo es la reducción de su mortalidad.2,3
Un tercio de los pólipos detectados son de características hiperplásicas representando lesiones benignas y con bajo potencial de malignizarse, sin embargo los estudios recientes, identifica subclase de pólipos previamente clasificados como hiperplásicos (ahora clasificados como adenomas aserrados o pólipos serratos), la gran mayoría de estos son lesiones hiperplásicas en el colon distal con bajo potencial de malignización.2
Hacer la diferencia entre lesiones polipósicas adenomatosas, aserrados y los tradicionales hiperplásicos se ha convertido en un tema de interés de gran importancia en la detección de lesiones de bajo riesgo. La polipectomía es un procedimiento seguro con complicaciones en < 1:1 000 en procedimientos de rutina y en < 1:500 en procedimientos terapéuticos (cuando se realiza polipectomía).3 Además de este bajo índice de complicaciones, tenemos el costo del procedimiento como una de sus limitaciones. La biopsia óptica se ha convertido en una herramienta tecnología de enorme potencial para detectar in vivo los pólipos, permitiendo la selección adecuada de aquellos pólipos seleccionados para su resección aún sin histología.
La biopsia óptica se define como el uso de un sistema básico óptico para evaluar el riesgo histológico de la lesión. La ASGE ha publicado los parámetros para el uso clínico de la biopsia óptica, estableciendo un valor predictivo negativo (VPN) del 90% para pólipos adenomatosos y una exactitud de al menos el 90% para predecir en forma correcta los intervalos de vigilancia.
Innovaciones tecnológicos para la detección
La endoscopia de alta resolución (AR) y de alta definición (AD) ofrecen ambas mejores imágenes, la AR puede llegar a tener hasta 1 400 000 pixeles en comparación con los endoscopios convencionales, en donde estos son capaces de trabajar la imagen con solo 400 000 pixeles, además de que las imágenes se pueden alargar hasta 150 veces para magnificarlas a través de la magnificación óptica. Como parte de los endoscopios de alta resolución contamos con la modalidad de NBI, el I-SCAN y el FICE basados todos ellos, en sistemas computacionales con filtros de luz que nos permiten visualizar la intensidad de los diferentes colores de la mucosa, de los vasos y de las lesiones.4
La endomicroscopía con focal láser (ECFL) integra una alta resolución y una magnificación de hasta 1 000 veces, permitiendo in vivo y en tiempo real un diagnóstico basado en la morfología vascular y celular. Existen dos sistemas de la ECFL y uno de los cuales cuenta con un escaneo en video de mayor velocidad. La aplicación de estos sistemas está orientado en hacer el diagnóstico y clasificación de los adenomas colorrectales y duodenales, con sensibilidades y especificidades aceptables. La limitación por un lado es la curva de aprendizaje y por el otro es el costo del equipo.5-10
Limitantes de la biopsia óptica
Sin duda una de sus limitantes es la comparación con la histología, la cual siempre será el estándar de oro para el diagnóstico de las lesiones y la diferenciación entre neoplásicas y no neoplásicas.11
Durante el curso de posgrado de la ASGE se enfatizó en la enorme utilidad de la biopsia óptica, en el sentido de que esta tecnología pudiera facilitar el diagnóstico de cambios neoplásicos tempranos. Los estudios in vivo y el análisis del tejido en su momento es una técnica promisoria en la detección de lesiones premalignas, sin embargo el alto costo, la baja disponibilidad y la curva de aprendizaje serán retos a superar con el tiempo. A pesar de estos retos y con la necesidad de bajar los costos en salud y mejorar la eficiencia, esto nos pudiera llevar a un futuro en donde no sean necesarios los estudios histológicos tradicionales.
Se presentaron más de 400 estudios ya sea en póster, e-póster o presentación oral en relación a los temas vigilancia y detección de pólipos y CCR.
Uno de los trabajos interesantes del hospital St. Paul de Vancouver, Canadá, habla de la presencia de neoplasias colónicas en pacientes con diverticulitis, en este estudio todo paciente con sospecha de diverticulitis fue sometido a tomografía multicorte, de un total de 302 pacientes en un periodo de seis años fueron analizados, 168 fueron incluidos en el reporte final, de este total el 58% fueron hombres con un promedio de edad de 58.7 +/-14.4 años. Seis pacientes (3.5%) se les detectó neoplasia en la misma zona previamente reportada con diverticulitis (cinco sigmoides y uno transverso). En 61 pacientes se les detectó al menos un pólipo (36.3%) y de éstos, en siete casos fueron adenomatosos. En conclusión de este estudio, mencionan que a pesar de contar con estudios de imagen de alta resolución en pacientes con diverticulitis habrá que realizarle colonoscopia en el seguimiento y se necesitarán un estudio en donde nos señale que características tomográficas pudieran hacernos pensar en neoplasias en pacientes con diverticulitis aguda.12
Un estudio que habla de la efectividad de la sigmoidoscopia vs. la colonoscopia en la prevención de CCR (implicaciones de un estudio inicial de detección que resultó negativo) (Sa1111-U. Wu, et al).
Es un estudio de la región sureste de California, de un periodo de 10 años (2000-2010) durante los cuales se incluyeron a 140 000 pacientes (95 700 con sigmoidoscopía negativa y 43 600 con colonoscopia negativa), la edad media del estudio inicial fue de 58 años, el 52% correspondió a pacientes del sexo femenino y el seguimiento fue de 47 meses, durante este periodo se detectaron 246 pacientes con CCR y el tiempo promedio de detección de la neoplasia fue de 42 meses. Se concluyó en este estudio que sin duda, la colonoscopia ofrece un efecto de protección y un riesgo menor de un probable CCR en relación a la sigmoidoscopia y que todo paciente mayor a 55 años debe ser estudiado mediante colonoscopia, como parte inicial de estudio de vigilancia y detección.13
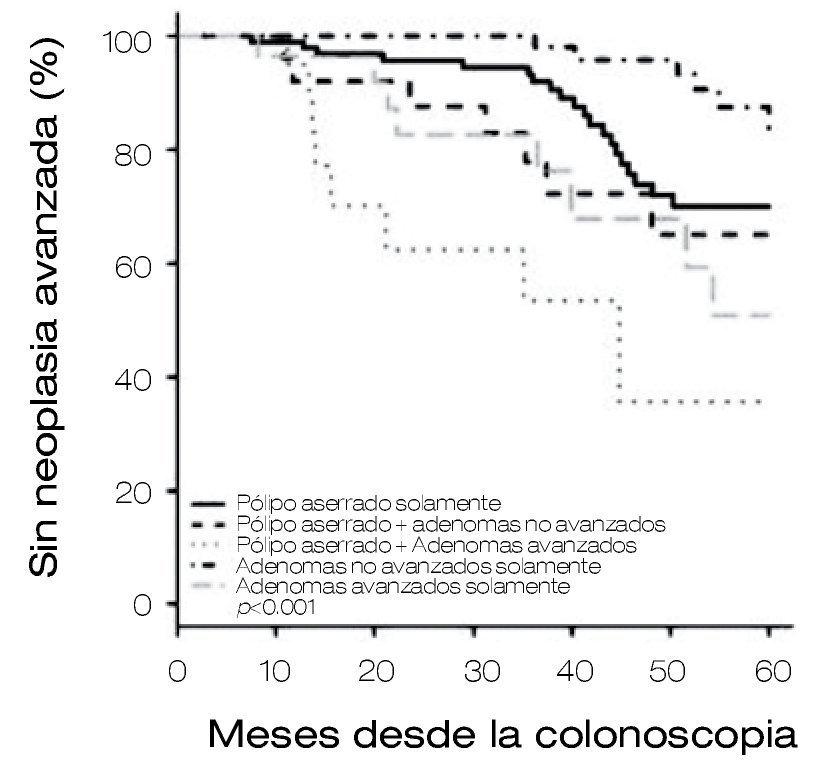
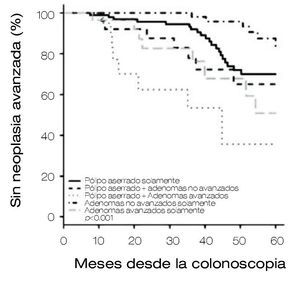
Sin duda, una de las preocupaciones es la detección y vigilancia de los pólipos aserrados (PS), ya que son precursores de CCR, se estudiaron todos los pólipos con la intención de determinar la tasa de neoplasia avanzada (NA) en pacientes con adenomas y/o PS. Los pacientes fueron agrupados dependiendo las características de los pólipos: 1) PS solamente, 2) adenomas avanzados (AA), 3) adenomas no avanzados (ANA), 4) PS+ANA y, 5) PS+AA.
Se incluyeron a 224 pacientes con un seguimiento a 44 meses en promedio. Se observó un riesgo mayor de neoplasia avanzada metacrónica en pacientes con PS y adenomas, concluyendo que todo paciente con PS y adenomas tienen tasas mayores de neoplasias metacrónicas avanzadas, por lo que el seguimiento de estos pacientes y los intervalos de vigilancia deben de ser más cortos (Figura 1).14
Figura 1. Sin neoplasia avanzada.
En México, sin duda el CCR se ha incrementado en los últimos años; basados en el número aproximado de colonoscopias que se realizan por año estaríamos hablando de un promedio de 100 000 estudios en una población > de 50 años de cerca de 30 millones, esto representa el 0.33% de pacientes estudiados, por lo que se tendrán que establecer estrategias para la detección oportuna de pacientes con riesgo para el desarrollo de CCR.
Referencias
1. Levin. Screening and surveillance for the early detection of colorectal cancer and adenomatous polyps. Ca Cancer J Clin 2008;58(3):130-160.
2. Sano Y, et al. Meshed capillary vessels by use NBI for differential diagnosis of small colorectal polyps. Gastrointest Endosc 2009;69(2):278-283.
3. Winawer, et al. Prevention of colorectal cancer by colonoscopy polypectomy. The National Polyp Study Workgroup. N Engl J Med 1993:329(27):1977-1981.
4. Kwon, et al. High resolution and high-magnification endoscopes. Gastrointest Endosc 2009;69:339-407.
5. Buchner, et al. The learning curve in vivo probe-based confocal laser endomicroscopy for prediction of colorectal neoplasia. Gastrointest Endosc 2011;73(3):556-560.
6. Wallace, et al. Probe-based confocal laser endomicroscopy. Gastroenterology 2009;136(5):1509-1513.
7. Hazewinket, et al. Colonoscopy: basic principles and novel techniques. Nat Rev Gastroenterol Hepato 2011;8(10):554-564.
8. Wallace, et al. Advance in endoscopic imaging of colorectal neoplasia. Gastroenterology 2010;138(6):2140-2150.
9. Yeung, et al. Advances in endoscopic visualization of colorectal polyps. Colorectal Dis 2011;13(4):352-359.
10. Neumann, et al. Review article. In vivo imaging by endocytoscopy. Alimet Pharmacol Ther 2011;33(11):1183-1193.
11. Matloff, et al. High resolution and optical molecular imaging for the earlly detection of colonic neoplasia. Gastrointest Endosc 2011;73(6):1263-1273.
12. Mo1239 (ABSTRACT DDW 2013) Diverticulitis and Colon Cancer: Is Colonoscopy Really Warranted? Nathan Chan et al.
13. Effectiveness of Flexible Sigmoidoscopy Versus Colonoscopy for Prevention of Colorectal Cancer: Implications of a Negative Initial Screening Examination Bechien. SA 1111 (ABSTRACT DDW 2013)
14. Patients With Adenomatous and Serrated Polyps Warrant Closer Surveillance Than Patients With Adenomas Only Carole Macaron. Tu 1490 (ABSTRACT DDW 2013).
Polipectomía: no hay pólipo suficientemente grande
Rafael Barreto-Zuñiga
Adscrito al Departamento de Endoscopia, Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán", Profesor Asociado Organización Mundial de Gastroenterología (WGO), Profesor Asociado Curso Posgrado Endoscopia, UNAM, México D.F., México
Correspondencia:
Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán".
Vasco de Quiroga N° 15, Tlalpan, C.P. 14000,
Teléfono: 554324 6321.
Correo electrónico: barretozu@yahoo.com
Introducción
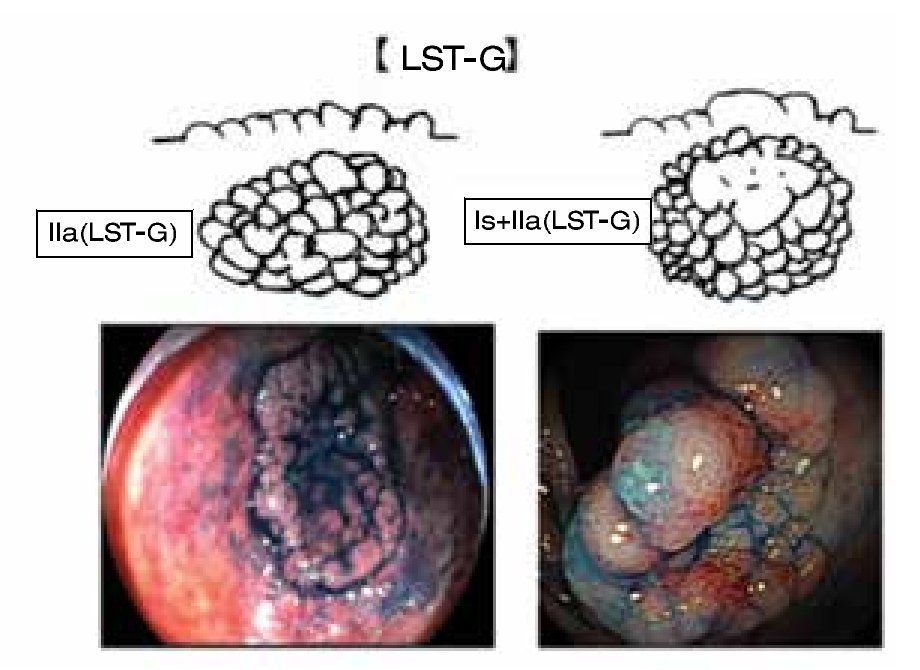
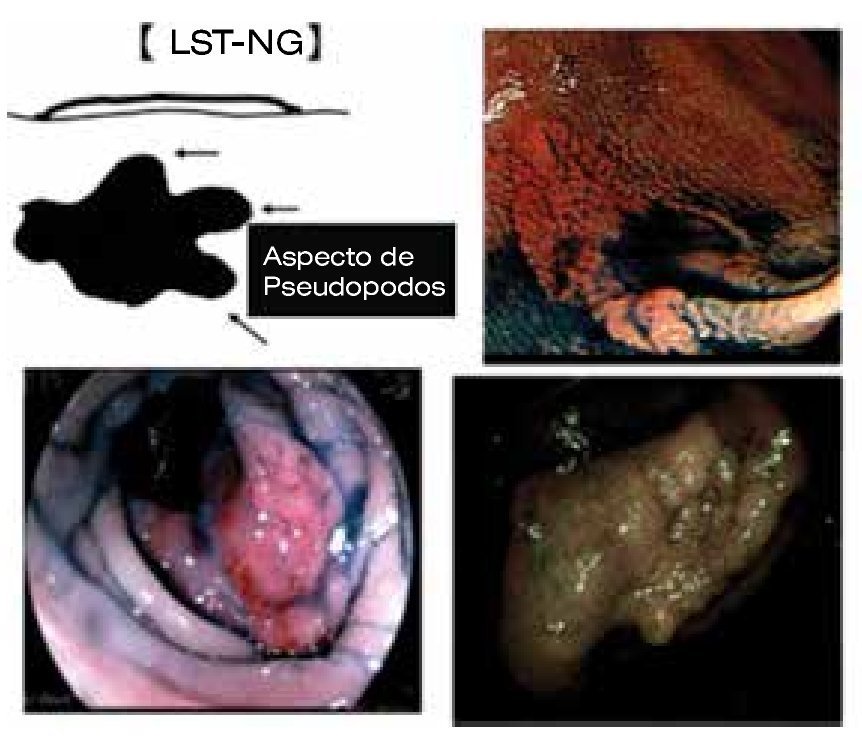
Es bien sabido que la polipectomía endoscópica (colonoscopia), es un método establecido para la reducción de la mortalidad del cáncer de colon y recto, la mayoría de pólipos resecados son adenomas menores de 10 mm, sin histología "compleja"; dichas lesiones presentan poco potencial de malignidad y son resecadas fácilmente mediante una técnica de polipectomía habitual, con un porcentaje menor de complicaciones. Lesiones no polipoides de colon y recto, mayores de 20 mm (NPCRs, Non Polyposic Colorectal Lesion) denominadas también como "lesiones planas", constituyen del 1% al 2% del total de las colonoscopias y son difíciles de tratar; estas lesiones son consideradas en el rubro de "polipectomía difícil" y en muchas ocasiones requieren cirugía. Tales lesiones presentan un alto grado de histología avanzada. Generalmente, estas lesiones se refieren a cirugía laparoscópica la cual es curativa, pero invasiva, costosa y asociada a comorbilidad en pacientes mayores de edad y enfermedades cardiovasculares concomitantes Aunque el diagnóstico definitivo de lesión no polipoide (NPCRS) debería ser histológico, la observación endoscópica nos permite el grado de elevación de la lesión (clasificación de Paris).1,2 Un subgrupo de lesiones elevadas superficiales (0-IIa) pueden alcanzar diámetros mayores de 1 cm y mantenerse planas; en el colon, estas lesiones se conocen como Laterally Spreading Tumors (LST) (Figura 1).
Lesiones lateralmente extendidas (LLE)
El cáncer de colon y recto (CCR) se desarrolla como resultado de mutaciones acumuladas en una manera escalonada. Los cambios genéticos característicos, incluyen la pérdida progresiva de un gen supresor tipo salvaje (wild type), con frecuencia la pérdida de heterogeneidad (LOH) en el cromosoma 5q (APC), 17p (p53) y 18q. La escasa prevalencia de lesiones planas permite la mayoría de las veces, datos controversiales para entender la genética que se presenta. La lesión mejor caracterizada en lesiones no polipoides, son aquellas relacionadas con K-ras.3
Recientemente, se ha establecido una nueva terminología para resección endoscópica, denominada como resección endoscópica extendida de la mucosa (WF-field, Wide-field endoscopic mucosal resection), dicha técnica ha permitido una terapia alternativa para evitar cirugías. Es un procedimiento ambulatorio, seguro y más costoefectivo, que la cirugía.4,5
Objetivos
Uno de los objetivos del presente trabajo es mostrar y enseñar las técnicas de resección extendida de pólipos mayores de 20 mm del tipo denominado "pólipo lateralmente extendido" (LST) y pólipos sésiles mayores de 20 mm de colon y recto, mostrando la metodología simple para caracterizar las lesiones, además en determinar el grado de invasión (mucosa o submucosa).
Caracterización y evaluación de la lesión
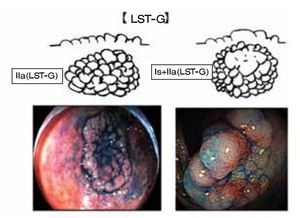
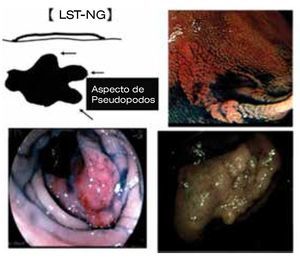
Una cuidadosa y sistemática evaluación endoscópica es crucial para determinar el diagnóstico y tratamiento, fundamentada en dos aspectos básicos. Primero, se cataloga a la lesión de acuerdo a la clasificación de neoplasia intramucosa o clasificación de Paris.1,2 Un altura de 2.5 mm (la altura de la pinza cerrada) nos permite diferenciar una lesión elevada (0-Is) de una plana (0-II). Importante es la evaluación de la morfología de la superficie (topografía), así las lesiones se pueden dividir en: granular (nodular y no granular (lisa) (Figuras 1 y 2). Aproximadamente, del 10% a 20% presentan un componente mixto o no se pueden clasificar. La clasificación de Paris no permite establecer un perfil de riesgo y grado de profundidad de las lesiones (invasión submucosa). La importancia de dichas características es que una lesión de alto riesgo de invasión SM no podría ser resecada (resección en fragmentos o en "piecemeal"). El segundo elemento a evaluar es la presencia de áreas de "alto riesgo" (nódulo o depresión central), en las cuales la invasión de la submucosa es más probable. La caracterización de la morfología del patrón de criptas y microvasculatura se pueden evaluar con equipos de endoscopia de última generación, los cuales utilizan alta definición e imágenes de Banda Estrecha (NBI), equipos denominados como de "apretar un botón". Aún sin un detallado conocimiento de las clasificaciones existentes, uno puede hacer una evaluación para estimar el grado de profundidad hacia la submucosa. Observar la línea de transición del patrón mucoso de la superficie, con la zona de depresión del nódulo. En general, las áreas de invasión se presentan como zonas amorfas o irregulares (Kudo V o Sano III). En base a esta "clínica endoscópica" se podrá definir la estrategia, y pudiera efectuar un cambio en el tipo de resección. Si existiera invasión submucosa se prefiere la resección en bloque.
Figura 1. Morfología de la superficie (topografía). LST-G.
Figura 2. Morfología de la superficie (topografía). LST-G.
Puntos clave en la técnica de resección endoscópica de mucosa (REM)
Existen múltiples formas y tamaños de asas de polipectomía necesarias para REM, el asa espiral de tipo trenzado aumenta la captura y corte del tejido normal marginal, para disminuir el riesgo de recurrencia. Asas pequeñas y delgadas facilitan el acceso en ángulos cerrados, fibrosis de la submucosa, y se pueden retirar fragmentos pequeños de tejido residual. Al resecar lesiones lateralmente extendidas (LLE), se deberán cortar en el menor número de fragmentos posible. De elección, la resección en bloque es técnicamente posible en lesiones mayores de 20 mm en colon derecho y 25 mm en colon izquierdo (recto), permitiendo una mejor evaluación histológica, con menores posibilidades de error y reduciendo el riesgo de recurrencia. Para la resección extendida (> 40 mm) se prefiere un secuencia de inyección y corte,6,7 en lo posible se evita elevar inicialmente toda la lesión, esto crea excesiva tensión con el "colchón" submucoso, limitando así el posicionar el asa y disminuyendo la secuencia de corte. La primera resección es la más importante, facilitándose si se siguen los siguientes puntos clave:
• La lesión se coloca a las seis en la posición del reloj.
• Primero resecar el área más difícil y terminar con la más fácil.
• Colocar la aguja de inyección en un ángulo de 30º-60º (45º ideal), inyectando en la submucosa y evitando la exteriorización de la inyección (más difícil en colon derecho por la pared más delgada).
• Incluir mínimo de 1-2 mm de margen normal (como margen normal de resección).
• Trabajar de forma secuencial del punto de la primera entrada dentro del plano de la submucosa, y colocar la posición del asa, la cual se alinea con el plano (evitar islas de tejido residual, las cuales a futuro serán difíciles de resecar).
• Con el asa abierta sobre la lesión, con firmeza empujar con la cremallera mayor hacia la submucosa y aspirar (reduce la tensión del colon), haciendo una especie de colchón mientras se aumenta la captura del tejido.
• Posicionar la punta del catéter de su asa de distal a proximal, lo cual permite tener control sobre el cierre.
• Cerrar el asa de manera superficial para evitar la capa muscular propia (MP) al capturar el tejido, si se utiliza un asa trezada (espiral), no es posible cortar un tejido mayor de 10 mm de diámetro sin el uso de diatermia.
• Tomar el asa y evaluar la tensión para estar seguro de no tomar tejido profundo, tomando en consideración los siguientes puntos:
• Evaluar la movilidad del tejido "atrapado" movilizando el asa de arriba-abajo y lateralmente, esto podría "acomodar" la mucosa. Si el tejido se tensa en bloque, evite resección y reposicione el asa.
• La sección del pólipo podría ser rápida, el asa se mantiene firmemente cerrada mientras el pedal de la unidad electro-quirúrgica se pisa, generando pulsos eléctricos, alternando impulsos de alta frecuencia y pulsos cortos, cortando en una base de corriente de coagulación entre 1-3 pulso para resecar el tejido. Una sección larga aumenta la preocupación de atrapamiento de muscular profunda o una invasión neoplásica más profunda. Estos movimientos no se realizan en ciego o en retrovisión; en el colon derecho, se usan "pulsos cortos" del pedal, cortando la lesión, evitando la pared del colon (tensión hacia la luz del colon). Una vez efectuada la resección, evaluar la base del mismo en busca de vasos que pudieran sangrar y/o perforación, además de revisar tejido residual (cromoendoscopia vital).
Complicaciones
La complicación más frecuente del REM extendida es el sangrado y la más peligrosa es la perforación (ocurre en el 6% a 7%), el riesgo es mayor en el colon derecho (OR=4) y uso de antiagregantes plaquetarios.8 En muchos casos, se presentan en las primeras 48 horas y más del 60% pueden ser manejadas sin reintervención. Aquellos que se presentan con hematoquezia o que no responden a medidas generales, se repite la endoscopia con buenos resultados en la mayoría de los casos. La perforación ocurre en 1% a 2% en REM extendida. Para evitar dichas complicaciones, un oportuno reconocimiento permite manejarlas evitando secuelas mayores. En la mucosectomía extendida se exponen múltiples vasos submucosos, los cuales podrían resultar en sangrado durante el procedimiento, lo cual compromete la seguridad y eficacia, existiendo múltiples intervenciones de control de sangrado con algunas limitaciones (intercambio de accesorios en caso de argón, falla de los clips, etc.), se propone el uso de la punta con coagulación suave para "parar el sangrado" con buenos resultados.9 Inspección cuidadosa del defecto mucoso después de REM. Identificar lesión en la profundidad de la submucosa (fibras de muscular propia), observar si existe el signo del "anilllo de tiro", podría haber un hueco evidente, aunque a veces podría haber una perforación tardía.6 El uso de CO2 durante la insuflación de gas, reduce el dolor posprocedimiento después de REM extendida.
Conclusiones
Basados en datos clínicos, podemos concluir que el grado de acuciosidad en el diagnóstico y detección de NP-CRNs es importante, y podría incorporarse a los programas educacionales de Gastroenterología y Endoscopia. Diagnosticar y tratar tales lesiones en la práctica diaria constituyen un reto, debido a la dificultad para reconocerlas, además de promover el uso de técnicas especiales para detectarlas (cromoendoscopia vital y digital), definir correctamente los subtipo de estas lesiones las cuales podrían requerir patólogos expertos familiarizados en la histopatología de dichas lesiones. Nuestra experiencia en este campo agrega evidencia parcial del mosaico de los aspectos clínicos a nivel global en el reconocimiento y manejo de NP-CRNs, lo cual nos garantiza que la prevención de CCR podría ser optimizada.
Referencias
1. Sano Y, Iwadate M. The importance of the Macroscopic Classif ication of Colorectal Neoplasm Gastrointest Endoscopy. Clin N Am 2010:20;461-469.
2. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002. Gastrointest Endosc 2003;58:S3-43.
3. Kahng L. Genetic Aspects of Non-Polypoid neoplasms. Gastrointest Endoscopy. Clin N Am 2010;20:573-578.
4. Swan MP, Bourke MJ, Alexander S, et al. Large refractory colonic polyps; is it time to change our practice? A prospective study of the clinical and economic impact of a tertiary referral colonic mucosal resection and polypectomy service (with videos), Gastrointest Endosc 2009;70:1128-1136
5. Moss A, Bourke MJ, Williams SJ, et al. Endoscopic mucosal resection outcomes and prediction of submucosal cáncer from adavanced colonic mucosal neoplasia. Gastroenterology 2011;140:1909-1918.
6. Holt B, Bourke MJ. Wide field endoscopic resection for advanced colonic mucosal neoplasia; current status and future directions. Clinical Gastroenterology and Hepatology 2012;10:969-979.
7. Bourke M. Endoscopic mucosal resection in the colon. A practical guide. Techniques in Gastrointest Endosc 2011;13:35-49.
8. Metz AJ, Bourke MJ, Moss A, et al. The Target sign; an endoscoipic marker for the resect ion of the muscu laris propr ia and potential perforation during colonic endoscopic mucosal resection. Gastrointest Endosc 2011;73:79-85.
9. Fahrtash-Bahin F, Holt AB, Bourke MJ, et al. SNARE Tip Soft Coagulation - a Novel Technique for Hemostasis of Intraprocedural Bleeding During Wide Field Endoscopic Mucosal Resection of Large Colonic Lesions. Sesion de carteles presentada en: DDW;2013 mayo 18-21; Orlando. FLO. Tu1499
Nuevas técnicas endoscópicas de sutura y cierre
Francisco Ramos-Narvaéz
Cirugía y Endoscopia Digestiva, Tuxtla Gutiérrez, Chis., México
Correspondencia:
2a. Av. Sur Pte, 557 Centro, C.P. 29000, Tuxtla Gutiérrez, Chis., México.
Teléfono: (961) 613 6666.
Correo electrónico: franciscoramosnarvaez@gmail.com
Introducción
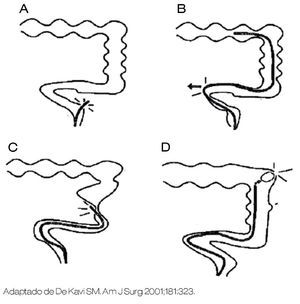
La perforación durante colonoscopia es una complicación rara pero que pone en riesgo la vida del paciente, tienen un rango de 0.01% a 0.8% para procedimientos diagnósticos los cuales se elevan a 5% para procedimientos terapéuticos (Disección Endoscópica de Submucosa, ESD).1 Los factores de riesgo incluyen: edad avanzada, sexo femenino, enfermedades asociadas, diverticulosis y cirugía abdominal previa.2 La perforación relacionada a la colonoscopia diagnóstica tienden a ser más largas y generalmente son provocadas por lesión mecánica (empuje excesivo, asa fija, etc.) (Figura 1), o por barotrauma (divertículo, exceso de aire en ciego). El recto-sigmoides es la zona más vulnerable debido al riesgo de enfermedad diverticular (múltiples y de boca ancha, mucosa redundante, ángulos cerrados, adherencias de cirugía pélvica previa). Las perforaciones relacionadas a daño térmico (asa de polipectomía, bisturí eléctrico para ESD), en general son más pequeñas y más fáciles de tratar mediante endoscopia. En un estudio, el promedio del diámetro de la perforación fueron de 19.3 mm y 5.8 mm para perforación durante procedimientos diagnósticos y terapéuticos, respectivamente.3 En otro estudio, la laparotomía fue requerida en el 88% de casos relacionados con perforación en colonoscopia diagnóstica, en contraste con el 9% de perforaciones relacionadas con colonoscopia terapéutica.4
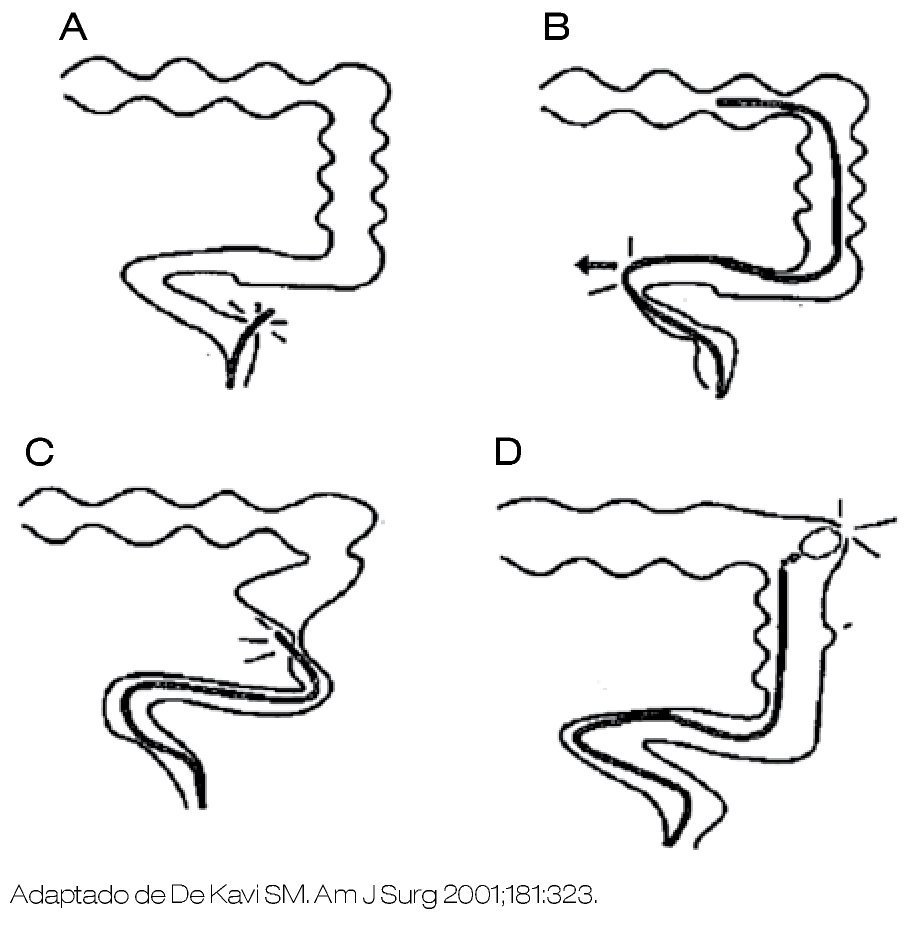
Figura 1. Maniobras que pueden provocar la perforación del colon durante la endoscopia. A) La perforación ocurre de manera directa a través de la pared intestinal. B) Desgarre debido a una presión en sitio de asa, puede causar una presión lateral suficiente para perforar. C) La perforación puede ocurrir a través de un sitio de estenosis o algún otro segmento "débil" de la pared de colon. D) La perforación puede ocurrir a través de exceso de aire (enfermedad diverticular) debido a que el gas puede causar sobredistensión y ruptura.
Diagnóstico
Un defecto por perforación se hace evidente como un hueco en la pared de colon y recto, con visualización de órganos intraabdominales o grasa serosa (apéndice epiploico). Un importante signo físico es el desarrollo de pneumoperitoneo.5 Mediante endoscopia es importante reconocer signos de perforación franca o inminencia, tales como el signo de "tiro al blanco" (marcador endoscópico de resección de la muscular profunda y perforación inminente) posterior a polipectomía, resección endoscópica de la mucosa (REM) o ESD.6 El paciente presenta dolor y distensión abdominal después del procedimiento. La ausencia de aire libre mediante radiografía simple de abdomen, no excluye la perforación y una TAC debería efectuarse ante la alta sospecha de perforación (TAC es más sensible).
Cierre endoscópico vs. reparación quirúrgica
La decisión entre cirugía y manejo conservador mediante cierre endoscópico, se basa en el tipo y localización de la lesión, calidad de la preparación intestinal, patología asociada al colon (REM incompleta, tumor obstructivo), estabilidad clínica del paciente, disponibilidad de accesorios y experiencia. Por supuesto que la cirugía está indicada en perforaciones grandes, datos de irritación peritoneal, patología concomitante, grado de deterioro clínico, entre otros. En la presencia de un colon bien preparado y una perforación pequeña (< 1-2 cm), podría evaluarse manejo conservador y posibilidad de manejo endoscópico inmediato.6,7 El uso de CO2 al momento de detectar el daño deberá ser utilizado. La decisión de cirugía no debería prolongarse después de 24 horas de haberse detectado la perforación y de haber hecho el cierre mediante endoscopia, si no mejoran los datos clínicos o existe empeoramiento del estado general del paciente. Otra situación difícil lo constituye el de una perforación no detectada al momento del procedimiento terapéutico (posterior a REM o ESD), pero descubierta por radiología o CT. En muchos casos podría haber microperforación y resuelta mediante manejo conservador.
Accesorios endoscópicos y técnicas de cierre mediante clips o grapas
Grapas a través del endoscopio: existen dos tipos de grapas o clips que pasan a través del canal de biopsia y se disparan con un liberador, con diferencias en la abertura, rotación y liberación. No existen estudios comparativos en humanos para establecer cuál es mejor en hemostasia y cierre de perforación. En general, los clips se utilizan para perforaciones menores de 2 cm, aunque se podrían cerrar defectos mayores (en promedio de tres a cuatro grapas).8
Se requiere conocimiento del asistente y endoscopista que utiliza los clips, aquí se mencionan tres puntos clave en la aplicación de los mismos:
Ligera succión para aproximar los bordes de la perforación y capturar más tejido con los brazos del clip.
Iniciar el cierre de izquierda a derecha para perforaciones transversales, y de arriba abajo para perforaciones longitudinales.
Colocar los clips a manera de "zipper" para asegurar un cierre adecuado.
Otras técnicas más bien anecdóticas han sido reportadas, tales como el cierre de grandes defectos, incluido el clip endoasa y el clip o grapa con parche de epiplón.9,10 El porcentaje de efectividad de los clips para cerrar perforaciones colónicas presenta un rango del 59% al 93%.8,9 Aunque los clips son efectivos para perforaciones menores de 20 mm, estos podrían no ser adecuados para defectos mayores (no alcanzan los brazos del clip). Recientemente se han utilizado nuevas técnicas de cierre basadas en la experiencia de NOTES (Natural Orifice Translumental Endoscopic Surgery), presentando nuevos accesorios tales como: OTSC, Ovesco Endoscopy® y el OverStitchTM, sistema endoscópico de sutura.11
Clips o grapas colocadas sobre el endoscopio
El clip sobre el endoscopio OTSC (por sus siglas en inglés, Over the Scope Clip) tiene un diseño distinto a los clips insertados a través del canal de trabajo. La forma del clip de nitinol semeja una "trampa de oso" (Figura 2) y viene precargado en un capucho de plástico (tipo ligador de várices), el cual se coloca en la punta del endoscopio. El capuchón de OTSC viene en varios tamaños (11, 12 y 14 mm) para colocarse en endoscopios de varios tamaños, con tres tipos de "mordida": atraumática (a), traumática (t) y cierre de gastrostomía (gc). El OTSC es un accesorio aprobado por la FDA para cierre de perforaciones intraluminales con tamaños menores de 20 mm (Figuras 3 y 4).
Figura 2. Grapa tipo "trampa de oso".
Figura 3. Accesorios de OVESCO.
Figura 4. Sistema OTSC de grapas montadas en el endoscopio.
Se ha demostrado un cierre mayor de OTSC comparado con clips habituales debido al mecanismo de cierre con mayor cantidad de tejido, el cierre deberá hacerse en lesiones con bordes "sanos", sin fibrosis, sin isquemia (en las primeras 24 horas).12 En un estudio prospectivo multicéntrico de 36 pacientes consecutivos con perforación aguda del tracto gastrointestinal, el OTSC alcanzó cierre sostenido de la perforación en el 89% de los casos.13 Otro estudio internacional multicéntrico (evalúa utilidad de OTSC en perforación, fistula y lago anastomótico) en un total de 188 pacientes (promedio 59 años, mayoría F). La indicación más común fue cierre de fístula (n=108; 57.4%) seguido de perforación (n=48; 25.5%) y lago de anastomosis (n=32; 17.1%). La localización más común de OTSC en tracto digestivo superior con un promedio en el tamaño del defecto fue de 7.7 mm, 10.6 mm y 8.5 mm para fístula, perforación y lago de anastomosis, respectivamente (Figura 1). Efectividad de la técnica en un 94.7%, no existieron efectos colaterales. Este estudio concluye que el manejo de OTSC en el manejo de defectos del tracto gastrointestinal fue seguro y eficaz.14 Una revisión sistemática de la efectividad total se estima en 89%. Limitaciones del OTSC incluyen la necesidad de retirar el endoscopio para colocar el dispositivo (tipo ligadura), dificultad de que el dispositivo pase a través de zonas estrechas anguladas (enfermedad diverticular sigmoides, adherencias con ángulos pronunciados), y dificultad para posicionar de "frente" a la perforación y agregaríamos en esta revisión los altos costos por unidad del dispositivo (50-100 dólares).11
Sutura endoscópica. El denominado OverStitchTM
Es un sistema endoscópico de sutura el cual se coloca en un endoscopio de doble canal (GIF 2T160, Olympus Corp, Tokyo, Japan), el sistema consiste en una aguja curva con mecanismo en la punta que lleva una sutura 2-0 de polipropileno. El accesorio de componente de aguja sigue el movimiento de la mano, pasando y saliendo sobre el tejido, el dispositivo es capaz de afrontar varias veces. Aún no se han publicado estudios clínicos sobre la aplicación del dispositivo para cierre de perforaciones en el colon, aunque sea utilizado de manera preventiva en ESD y EMR en grandes defectos en recto. Las limitaciones se refieren a que se necesita un endoscopio de doble canal, imposibilidad de acceder a sitios de colon (excepto recto) por su anatomía.15
Seguimiento estricto poscierre endoscópico
Un enfoque multidisciplinario es esencial en la vigilancia del cierre posterior a perforación. El manejo inicial establece reposo intestinal, hidratación intravenosa, antibióticos de amplio espectro, monitores de constantes vitales y laboratorio, estudios de imagen, etc. Es importante recordar que el aspecto endoscópico de un cierre seguro no es predictivo de un cierre prolongado efectivo, debido a que un desprendimiento del clip o rotación del mismo podría suceder posteriormente, por tal motivo se hace necesario el control estrecho, tomando en consideración el estado del paciente, (deterioro de sus signos, dolor, datos de choque séptico), un enema de TAC con medio hidrosoluble se incorpora en algunos algoritmos de manejo después de cierre de una perforación.16
Para situaciones en las cuales la evaluación clínica es insidiosa, la decisión de cirugía podría ser difícil (no prolongarse más de 24 horas), la evaluación de clínica, laboratorio y auxiliado por CT podría se útil para decidir la cirugía. La vía oral podría reiniciarse tan pronto como el dolor y fiebre han desaparecido, movimientos intestinales, laboratorios estables/leucocitosis y PCR. Pacientes en los cuales el curso ha sido satisfactorio se iniciará dieta líquida a las 48 horas después del procedimiento.
Conclusión
Por mucho tiempo la cirugía se ha constituido en la piedra angular en el manejo de perforación del colon, asociado con significativa morbimortalidad. Con el advenimiento de las técnicas de cierre mediante endoscopia, el manejo es más conservador con relativa efectividad en pacientes seleccionados, quienes presentan defectos menores de 20 mm. Un reconocimiento inmediato de la perforación evita verdaderas catástrofes abdominales, las cuales pudieron haberse corregido en tiempo y forma (endoscópica y quirúrgica). Las nuevas técnicas de OSCT y sutura constituyen un método promisorio en el cierre de perforaciones, aunque requieren estudios controlados con un número mayor de pacientes.
Referencias
1. Lohsiriwat V. Colonsocopic perforation: incidence, risk factors, management and outcome. World J gastroenterol 2010;16:425-430.
2. Arora G, Mannalithara A, Singh G, et al. Risk of perforation from a colonoscopy in adults: a large population-based study. Gastrointest Endosc 2009;69:654-664.
3. Iqbal CW, Cullinane DC, Schiller HJ, et al. Surgical management and outcomes of 165 colonoscopic perforations from a single institution. Arch Surg 2008;143:701-707.
4. Avgerinos DV, Llaguna OH, Lo AY, et al. Evolving management of colonoscopic perforation. J Gastrointest Surg 2008;12:1783-1789.
5. Baron TH, Wong Kee, Song LM, et al. A comprehensive approach to the management of acute endoscopic perforations. Gastrintest Endosc 2012;76:838-859.
6. Swan MP, Bourke MJ, Moss A, et al. The target sign: an endoscopic marker for the resection of the muscularis propia and potential perforation during colonic endoscopic mucosal resection. Gastrointest Endosc 2010;73:79-85.
7. Raju GS, Saito Y, Matsuda T, et al. Endoscopic management of colonoscopic perforations. Gastrointest Endosc. 2011;74:1380-1388.
8. Trecca A, Gaj, Gagliardi G. Our experience with endoscopic repair of large colonsocopic perforations and review of the literatura. Tech Coloproctol 2008;12:315-321.
9. Mocciaro F, Curcio G, Tarantino I, et al. Tulip bundle technique and fibrin glue injection:unusual treatment of colonic perforations World J Gastroenterol 2011;17:1088-1090
10. Katsinelos P, Chatzimavroudis G, Zavos C, et al. Closure of a Iatrogenic rectal perforation by using the endolloop/clip technique. Gastrointest Endosc 2009;70:405-406.
11. Banerjee S, Barth BA, Bath YM, et al. Endoscopic closure devices. Gastrointest Endosc 2012;76:244-251.
12. Hagel AF, Naegel A, Lindner AS, et al. Over -the-scope clip application yields a high rate of closure in gastrointestinal perforations and may reduce emergency surgery. J Gastrointest Surg 2012;16:2132-2138.
13. Weiland T, Fehlker M, Gottwald T, et al. Performance of the OTSC System in the endocopic closure of iatrogenic gastrointestinal perforations: a systematic review. Surg Endosc. 2013 Jan 24 (Epub ahead of print).
14. Chavez YH, Kratt T, Law KJ, et al. A Large international Multicenter Experience With an Over-the-Scope Clipping Device for Endoscopic Management of Gastrointestinal Perforations, Fistulae, and Leaks in 188 Patients. Sesion de Carteles presentados en DDW 2013 Mayo 18-21 Orlando Flo. Sa. 412
15. Diez-redondo P, Blanco Jl, Lorenzo-Pelayo S, et al. A novel System for endoscopic closure of iatrogenic colon perforations using the Ovesco clip omental patch. Rev esp Enferm Dig 2012;104:550-552.
16. Kowalczyk L, Forsmark CE, Ben-David K, et al. Algorithm for the Management of endoscopic perforations: a quality improvement Project. Am J Gastroenterol 2011;106:1022-1027.