Las tionamidas son fármacos ampliamente utilizados para el tratamiento del hipertiroidismo por su eficacia y su seguridad. Sin embargo, aunque con poca frecuencia, pueden producir toxicidad hepática y hemática. La neutropenia inducida por este tipo de fármacos puede ser muy grave, hasta el punto de comprometer la vida del paciente. Si se produce, es necesario suspender el tratamiento con antitiroideos y, si hay fiebre o agranulocitosis, instaurar tratamiento con antibióticos de amplio espectro y tratamiento definitivo con yodo radiactivo o cirugía.
Se presenta el caso de una mujer de 26 años, en tratamiento con carbimazol por una tirotoxicosis secundaria a enfermedad de Graves, que sufrió una sepsis grave como consecuencia de la neutropenia inducida por ese fármaco.
Thyonamides are widely used drugs to treat hyperthyroidism, because of their efficacy and security. However, although with less frequency, they can cause hepatic and haemathologic toxicity. Neutropenia produced for this kind of drugs, can be very serious, to such an extent it may jeopardize patient's life. If it appears, it is necessary to stop the antithyroid treatment and, if the patient have fever or agranulocytosis, start wide spectrum antibiotics and definitive treatment with radioiodine or surgery.
A file case report of a 26-years-old woman with a thyrotoxicosis secondary to Graves’ disease in treatment with carbimazole. She suffered a serious sepsis, as a consequence of the drug induciedinduced neutropenia.
Las tionamidas son el tratamiento de primera elección en los pacientes con enfermedad de Graves en nuestro medio. En general son fármacos seguros y bien tolerados. Aunque un 13% de los pacientes sufren efectos adversos tales como molestias gastrointestinales, artralgias, rash, etc., son leves y transitorios1. Sin embargo, pueden producir cuadros de toxicidad hepática y hemática que pueden ser mortales2.
El caso que se expone es un ejemplo de uno de esos efectos adversos, raros pero graves: neutropenia mediada por fármacos.
OBSERVACIÓN CLÍNICAMujer de 26 años que acude a urgencias por un cuadro de malestar general, fiebre y odinofagia. Entre los antecedentes personales destacaba enfermedad de Graves con afección ocular diagnosticada 6 meses antes, en tratamiento con carbimazol (40mg/día) y propanolol (40mg/8h). Dado el mal control clínico y de la función tiroidea que imposibilitaba la disminución de dosis del antitiroideo, se encontraba en lista de espera para tratamiento quirúrgico definitivo. Hacía 1 mes había sufrido un episodio de aftas orales sin neutropenia. En la exploración física se objetivó hipotensión arterial, taquicardia sinusal a 140 lat/min, fiebre de 40,2°C y lesiones herpéticas en los labios. Presentaba retracción palpebral y proptosis izquierda y se palpaba un bocio de grado 2. El resto de la exploración física fue anodina, sin evidencia de ningún otro foco de infección. El hemograma reveló una neutropenia extrema (< 10 neutrófilos/μl), las demás pruebas complementarias (bioquímica, sistemático de orina y radiografía de tórax) fueron normales. Ante la sospecha de sepsis por agranulocitosis secundaria a carbimazol, se suspendió el tratamiento antitiroideo, se extrajeron cultivos de sangre, heces y orina (que posteriormente fueron negativos) y se inició tratamiento antibiótico empírico con ceftazidima, amikacina y valanciclovir. Por otro lado, se incrementó la dosis de bloqueadores beta para el control de los síntomas y se realizó monitorización estricta del recuento de neutrófilos y la función tiroidea por el riesgo de crisis tirotóxica. Al día siguiente, dada la gravedad de la situación, se inició tratamiento con factor estimulador de colonias de granulocitos (C-GSF). Sin embargo, la persistencia de la neutropenia 1 semana después pese a haberse agregado a la antibioterapia inicial vancomicina y haberse iniciado el C-GSF obligó a descartar otras posibles causas subyacentes; se llevaron a cabo inmunología, serologías y biopsia de médula ósea. La biopsia fue compatible con neutropenia farmacológica y las demás determinaciones fueron negativas, lo que confirmó el diagnóstico de sepsis secundaria a agranulocitosis por carbimazol. Una vez que el recuento leucocitario alcanzó márgenes de seguridad y dado el mal control de la función tiroidea (que llegó a cifras de tirotropina < 0,01 μU/ml; tiroxina no unida a proteínas, 10,4ng/dl [0,9-1,7]; triyodotironina libre > 30,8pg/ml [2-4,4]), se decidió realizar tiroidectomía urgente, previa estabilización de las concentraciones hormonales con yoduro potásico (60mg/8h durante 10 días). Un mes después las cifras de neutrófilos se normalizaron. Actualmente, la paciente se mantiene eutiroidea con 125μg de tiroxina al día.
DISCUSIÓNLos antitiroideos son la principal causa de neutropenia (neutrófilos < 1.500/μl) y agranulocitosis (< 500/ μl) de origen farmacológico3. Aunque la prevalencia es baja, del 0,2-0,5%4, la mortalidad puede alcanzar un 5%5, por lo que es un efecto secundario que debemos conocer.
Hay controversia sobre la monitorización del recuento leucocitario en los pacientes en tratamiento con tionamidas. En lo que no hay lugar a dudas es en que debemos advertir a los pacientes que tengan dolor de garganta, fiebre, aftas orales u otro tipo de infección, principales manifestaciones clínicas de la neutropenia, para que suspendan el tratamiento y acudan a un centro sanitario donde se les realice un análisis de sangre que la descarte.
Tampoco hay un claro acuerdo entre los factores predisponentes. El estudio de Pearce6 recoge que la agranulocitosis es un efecto dependiente de la dosis que ocurre con más frecuencia en los primeros 2-3 meses de tratamiento y es más habitual con el uso de propiltiuracilo que con carbimazol o metimazol; sin embargo, Tamai et al7 encontraron que el desarrollo de agranulocitosis era independiente de la dosis, la edad, la duración o la exposición previa.
Por otro lado, se especula sobre si la neutropenia puede tener una causa autoinmunitaria, ya que frecuentemente se encuentran anticuerpos anticitoplasma de los neutrófilos (ANCA) positivos en los pacientes que toman antitiroideos, fundamentalmente propiltiuracilo8. No obstante, debido a que muchos individuos asintomáticos presentan ANCA positivos, sólo se recomienda su determinación si hay clínica de vasculitis.
Entre el 70 y el 90% de los casos de neutropenia se deben a fármacos4,9, por lo que, ante un paciente con agranulocitosis en tratamiento farmacológico, debemos considerar como primera posibilidad que el fármaco sea la causa. Sin embargo, no hay que olvidar otras posibles causas de neutropenia en el diagnóstico diferencial: neutropenia secundaria a la propia sepsis, hemopatías, hiperesplenismo o lupus eritematoso sistémico. Tras suspender el fármaco, una recuperación con más de 1.500 neutrófilos/μl en 1 mes confirmará el diagnóstico de agranulocitosis por fármacos9.
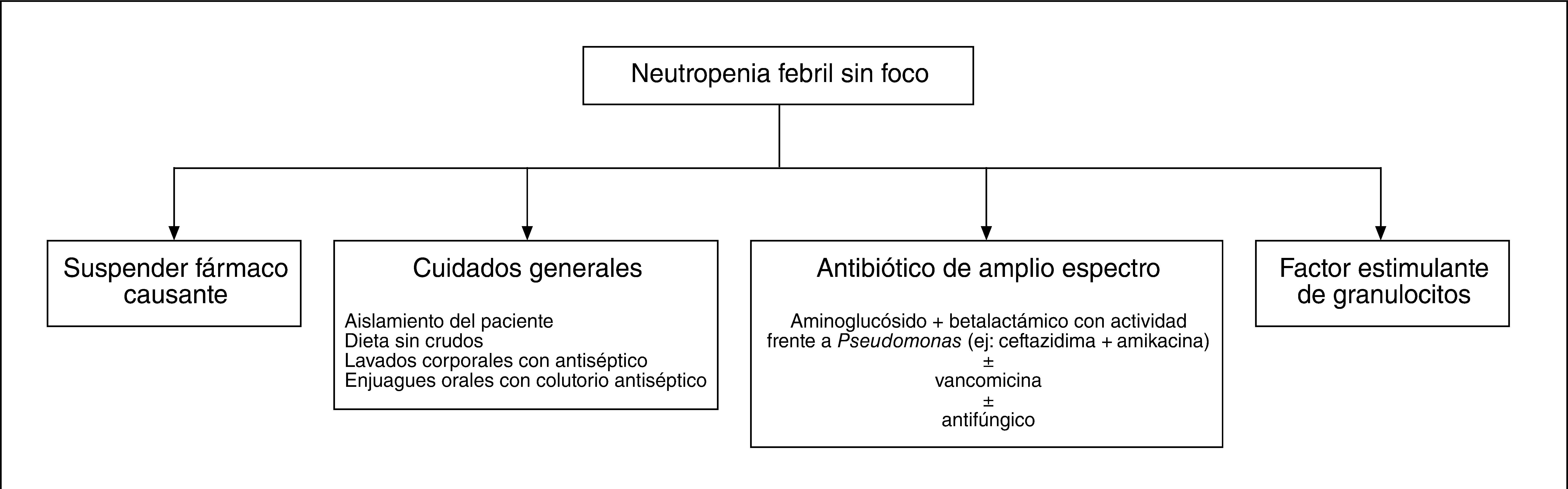
El tratamiento (fig. 1) comenzará por suspender el antitiroideo y no volver a prescribirlo. Pueden utilizarse bloqueadores beta (de elección propranolol), yodo (yoduro potásico, ácido yopanoico…), litio o glucocorticoides para el control de la función tiroidea y los síntomas. Como tratamiento definitivo suele emplearse el yodo radiactivo, a no ser que haya contraindicación, como ocurría con nuestra paciente, en la que la oftalmopatía hizo que nos inclináramos por la cirugía. Si el paciente presenta fiebre o agranulocitosis, se lo deberá ingresar. En todo paciente con fiebre y menos de 500 neutrófilos/μl hay que pensar que puede estar sufriendo una infección, sacar cultivos e iniciar tratamiento con antibióticos de amplio espectro, que deben ser eficaces contra bacterias gramnegativas como Pseudomonas. Suele utilizarse la combinación de cefalosporinas o quinolonas y aminoglucósidos. Se considerará añadir vancomicina en los sujetos con riesgo de infección por grampositivos resistentes o que no mejoran con la pauta anterior, y antifúngicos si persiste la fiebre a pesar del tratamiento anterior5.
En algunos casos se ha intentado tratamiento adyuvante con C-CSF para aumentar el número de neutrófilos de forma más rápida, pero su utilidad es incierta. Mientras que algunos trabajos no han demostrado beneficios10,11, en otros parece que acorta el tiempo de recuperación de la serie blanca, así como el tiempo de hospitalización, sin aumentar la toxicidad ni los efectos adversos5,12. Existe un único estudio en el que la mortalidad fue menor en los pacientes tratados con este fármaco13.
En cuanto al pronóstico, ya señalamos que la mortalidad se sitúa en torno al 5%, y los factores de mal pronóstico son la edad (peor en mayores de 65 años), comorbilidades graves como insuficiencia renal grave o insuficiencia cardíaca o respiratoria, recuento < 100 neutrófilos/μl y la bacteriemia o el shock séptico al diagnóstico14,15.
En conclusión, aunque las tionamidas son fármacos bastante seguros, no debemos olvidar que entre sus efectos secundarios está la neutropenia. Este efecto secundario puede ser grave e incluso comprometer la vida de los pacientes. Por ello es muy importante conocerlo, informar y educar a los pacientes sobre su existencia y reconocer los síntomas de alarma.
Al profesor John Wass por promover la publicación de este caso.