Se ha demostrado que el polimorfismo C358A de la amida hidrolasa de ácidos grasos (AHAG) se relaciona con la obesidad. EL objetivo de nuestro estudio fue evaluar la relación entre el polimorfismo (cDNA 385C->A) del gen de la amida hidrolasa de ácidos grasos parámetros antropométricos, factores de riesgo cardiovascular y niveles de adipocitoquinas en una muestra de pacientes con obesidad mórbida.
Material y métodosSe analizó una muestra de 66 pacientes con obesidad mórbida. A todos los pacientes se les determinaron el peso, la presión arterial, glucemia en ayunas, lipoproteína (a), proteína C reactiva (PCR), insulina, colesterol total, colesterol LDL, colesterol HDL, triglicéridos y adipocitoquinas, así como el genotipo del polimorfismo C358A de AHAG.
ResultadosLa edad de los pacientes fue de 48,0 (16,1) años, con un IMC de 44,4 (4,1), con un total de 17 varones (25,8%) y 49 mujeres (74,2%). Un total de 45 pacientes (8 varones/37 mujeres) (68,2%) presentaron un genotipo G358G (grupo salvaje) y 21 pacientes (4 varones/17 mujeres) G358A (31,8%) (grupo mutante).No se detectó ninguna diferencia significativa en los parámetros analizados entre ambos genotipos.
ConclusiónEl polimorfismo de la AHAG no se relaciona con variables antropométricas, bioquímicas o concentraciones de adipocitoquinas en pacientes con obesidad mórbida.
The 385 C/A polymorphism of fatty acid amide hydrolase (FAAH) has recently been demonstrated to be associated with overweight and obesity. The aim of our study was to investigate the association between missense polymorphism (cDNA 385 C->A) of the FAAH gene and anthropometric parameters, cardiovascular risk factors and adipocytokines in morbidly obese patients.
Material and methodsA sample of 66 morbidly obese patients was analyzed. In all patients, weight, blood pressure, fasting glycemia, lipoprotein(a), C-reactive protein, insulin, total cholesterol, low-density lipoprotein-cholesterol, high-density lipoprotein-cholesterol, triglyceride and adipocytokine levels, as well as the genotype of the C358A polymorphism of FAAH, were determined.
ResultsThe mean age was 48.0(16.1) years and the mean body mass index was 44.4 (4.1). There were 17 males (25.8%) and 49 females (74.2%). Forty-five patients (8 males/37 females) (68.2%) were G358G (wild genotype) and 21 patients (4 males/17 females) were G358A (31.8%) (mutant group). Biochemical, anthropometrical and adipocytokine levels showed no statistically significant differences between the two genotypes.
ConclusionIn patients with morbid obesity, the C358A polymorphism of FAAH was not associated with anthropometric parameters, biochemical markers or adipocytokine levels.
La obesidad es un problema epidemiológico de primer orden, calculándose que en España, 2 tercios de la población presentan sobrepeso1. Teniendo especial interés los pacientes con obesidad mórbida, donde el riesgo cardiovascular es mucho mayor. En estos momentos el tejido adiposo, que está en exceso en el paciente obeso, es considerado como un órgano activo, capaz de sintetizar multitud de moléculas (adipocitoquinas), que son capaces de modular el apetito, la sensibilidad a la insulina, el gasto energético, la inflamación y la inmunidad2.
En este contexto, debemos recordar que la planta Cannabis sativa (marihuana) presenta múltiples efectos psicoactivos en los humanos, incluyendo un incremento del apetito y del peso corporal3,4. En la actualidad es conocido que el sistema endocanabinoide es un importante modulador de la conducta humana5. Dentro de este sistema, el principal inactivador es un enzima, amida hidrolasa de ácidos grasos (AHAG)6. En algunos trabajos se ha demostrado cómo la actividad de este enzima puede regular el sistema endocanabinoide y, por tanto, los hábitos de la persona7.
En este sistema se ha descrito una mutación (cDNA 385C->A) que produce la sustitución de una treonina por una prolina en la posición 129 (P129T), habiéndose asociado con un mayor abuso de drogas8. Recientemente, Sipe et al9 han demostrado como los pacientes homocigotos AHAG 385A/A presentan más sobrepeso y obesidad. El grupo de Monteleone et al10 han confirmado estos hallazgos con una mayor expresión del alelo 38 A en los sujetos obesos. No obstante, en algunos trabajos no se ha conseguido demostrar esta asociación 11. Por tanto, teniendo en cuenta que el sistema endocanabinoide juega un papel importante en el control metabólico, de peso y comportamiento humano12, nuestro grupo ha decidido valorar la asociación de este polimorfismo de AHAG en parámetros relacionados con la obesidad. Nuestro diseño presenta especial interés al haber sido realizado en un grupo de obesos mórbidos, en los cuales todavía no se ha evaluado el papel de este polimorfismo.
El objetivo de nuestro estudio fue evaluar la relación entre el polimorfismo (cDNA 385C->A) del gen de la AHAG y parámetros antropométricos, factores de riesgo cardiovascular y niveles de adipocitoquinas en una muestra de pacientes con obesidad mórbida.
Pacientes y métodosPacientesSe analizó de manera prospectiva una muestra de 66 obesos mórbidos (IMC>40kg/m2) mediante un muestreo no probabilístico consecutivo en la Consulta de Nutrición. Los pacientes fueron evaluados en una Unidad de Nutrición Clínica y firmaron un consentimiento informado para participar en el estudio, que había sido aprobado previamente por el Comité de Ensayos Clínicos del hospital. Los criterios de exclusión, para homogeneizar la muestra y evitar factores de confusión no controlados, fueron historia previa de patología isquémica cardiovascular o cerebral en los 36 meses previos, elevación del colesterol > 300mg/dl, triglicéridos > 400mg/dl, presión arterial > 140/90mmHg, glucosa en ayunas >110mg/dl, así como la toma de cualquiera de las siguientes medicaciones: sulfonilurea, tiazolidindionas, insulina, glucocorticoides, inhibidores de enzima convertidora de la angiotensina y antagonistas del receptor II de la angiotensina.
ProcedimientoA todos los pacientes se les determinaron el peso, la presión arterial, glucemia en ayunas, lipoproteína (A), proteína C reactiva (PCR), insulina, colesterol total, colesterol LDL, colesterol HDL, triglicéridos y adipocitoquinas (leptina, adiponectina, resistina, tumor necrosis factor-α (TNFα), e interleukina 6).
Genotipado del receptor AHAGLos cebadores (oligonucleotide primers) y las sondas para los experimentos fueron diseñados mediante el programa Beacon Designer 4.0 (Premier Biosoft International®, LA, CA). La reacción en cadena de la polimerasa (RCP) se realizó con 50ng DNA genómico, 0,5Ul de primers (primer forward, 5’-CTA TCT GGC TGA CTG TGA GAC TC-3’; primer reverse, 5’-GAG GCA GAG CAT ACC TTG TAG G-3), y 0,25Ul de cada sonda (sonda salvaje: 5’-Fam-CTG TCT CAG GCC CCA AGG CAG G-BHQ-1–3’) y (sonda mutante: 5’-Hex- CTG TCT CAG GCC ACA AGG CAG G-BHQ-1-3’) en un volumen final de 25Ul (Termociclador iCycler IQ [Bio-Rad®], Hercules, CA). El ADN fue desnaturalizado a 95°C durante 3min; posteriormente, se realizaron 50 ciclos de desnaturalización a 95°C durante 15s y anillamiento a 59,3° durante 45s. La RCP se realizó en un volumen final de 25Ul que contenía 12,5Ul de IQTM Supermix (Bio-Rad®, Hercules, CA) con «hot start Taq DNA polymerase».
Determinaciones bioquímicasLas concentraciones de colesterol y triglicéridos se determinaron mediante ensayos enzimocolorimétricos (Technicon Instruments, Ltd., Nueva York, EE.UU.). Las concentraciones de HDL colesterol se determinaron enzimáticamente en el sobrenadante tras precipitación con dextrano sulfato-magnésico.
Las concentraciones de glucosa se determinaron mediante un método automatizado de glucosa oxidasa (Glucose analyser 2, Beckman Instruments, Fullerton, CA). La insulina fue medida mediante un ensayo enzimocolorimétrico (Insulina, WAKO Pure-Chemical Industries, Osaka, Japón) y se determinó la resistencia a la insulina mediante el modelo «homeostasis model assessment for insulin sensitivity» (HOMA)13. La PCR se determinó mediante immunoturbimetría (Roche Diagnostcis GmbH, Mannheim, Alemania), con unos límites de normalidad de (0–7mg/dl) y una sensibilidad analítica de 0,25mg/dl.
AdipocitoquinasLa resistina fue medida mendiante ELISA (Biovendor Laboratory, Inc., Brno, República Checa) con una sensibilidad analítica de 0,2ng/ml y unos límites de normalidad de 4–12ng/ml. La leptina fue medida mediante ELISA (Diagnostic Systems Laboratories, Inc., Texas, EE.UU.) con una sensibilidad de 0,05ng/ml y unos límites de normalidad de 10–100ng/ml. La adiponectina fue determinada mediante ELISA (R&D systems, Inc., Mineapolis, EE.UU.) con una sensibilidad de 0,246ng/ml y unos límites de normalidad de 8,65–21,43ng/ml. La interleukina 6 y el TNFα fueron medidos por ELISA (R&D systems, Inc., MN, EE.UU.) con una sensibilidad de 0,7pg/ml y 0,5pg/ml, respectivamente. Los valores de normalidad fueron para interleukina 6 de (1,12–12,5pg/ml) y para TNFα (0,5–5,6pg/ml).
Calorimetría indirectaPara la determinación del gasto energético, los sujetos fueron evaluados en una Unidad Metabólica. Tras 12h de ayuno y reposo, los pacientes fueron sometidos en condiciones homogéneas a una calorimetría mediante máscara ajustable (MedGem; Health Tech, Golden, EE.UU.). Se calcularon el gasto energético basal (kcal/día) y el consumo de oxígeno (ml/min)14.
Determinaciones antropométricasEl peso fue medido mediante una báscula con una precisión de 0,1kg y el IMC se calculó con la fórmula (peso/talla2). Se determinó el perímetro de la cintura y de la cadera para calcular el índice cintura cadera (ICC). Se realizó una impedanciometría tetrapolar para determinar la composición corporal15 (Biodynamics Model 310e, Seattle, WA, EE.UU.). Se utilizaron la resistencia y la reactancia para calcular el agua corporal total, la grasa y la masa libre de grasa.
La presión arterial fue determinada 2 veces con el paciente en reposo mediante un esfingomanómetro de mercurio y se realizó el promedio de las 2 determinaciones.
Ingesta dietéticaLos pacientes fueron encuestados durante 3 días mediante un registro escrito de 24h para evaluar su ingesta dietética. Los registros fueron evaluados por un dietista utilizando un software con bases de alimentos nacionales16. El ejercicio físico realizado por los pacientes fueron 3 sesiones de ejercicio aeróbico de 1h a la semana.
Análisis estadísticoEl tamaño muestral fue calculado para detectar una diferencia de peso de 3kg con un poder del 90% y un error alfa del 5% (n=60). Los resultados se expresaron como media±desviación estándar. La normalidad de las variables fue analizada mediante el test de Kolmogorov-Smirnov. Las variables cuantitativas con una distribución normal fueron analizadas con el test t de Student. Las variables no paramétricas fueron analizadas con los tests W-Wilcoxon y U de Mann Whitney. Las variables cualitativas fueron analizadas con el test de la chi-cuadrado, con la corrección de Yates, cuando fue necesario, y el test de Fisher. El análisis de correlación se realizó con el test de Pearson. El análisis estadístico fue realizado con la combinación de los genotipos (G385A y A385A como grupo mutante) y del genotipo G385G como grupo salvaje (modelo dominante). Se consideró estadísticamente significativa una p inferior a 0,05.
ResultadosUn total de 66 pacientes obesos mórbidos fueron reclutados. Los pacientes presentaban un peso estable en las 2 semanas previas a su inclusión La edad de los pacientes fue de 48,0 (16,1) años con un IMC de 44,4 (4,1), con un total de 17 varones (25,8%) y 49 mujeres (74,2%).
Un total de 45 pacientes (8 varones/37 mujeres) (68,2%) presentaron un genotipo G358G (grupo salvaje) y 21 pacientes (4 varones/17 mujeres) G358A (31,8%) (grupo mutante).
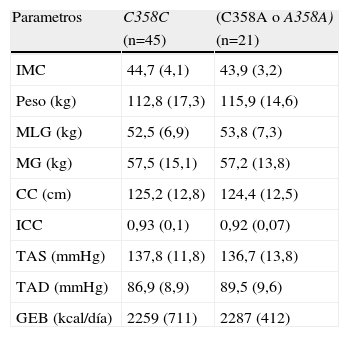
La tabla 1 muestra las variables antropométricas. El peso, IMC, masa grasa y magra, así como gasto energético y control tensional, no encontrándose diferencias estadísticamente significativas entre ambos grupos. Por tanto, este polimorfismo no parece relacionarse con parámetros antropométricos generales como el peso y el IMC, ni con parámetros antropométricos compartimentales como la masa grasa o la magra.
Variables antropometricas
| Parametros | C358C | (C358A o A358A) |
| (n=45) | (n=21) | |
| IMC | 44,7 (4,1) | 43,9 (3,2) |
| Peso (kg) | 112,8 (17,3) | 115,9 (14,6) |
| MLG (kg) | 52,5 (6,9) | 53,8 (7,3) |
| MG (kg) | 57,5 (15,1) | 57,2 (13,8) |
| CC (cm) | 125,2 (12,8) | 124,4 (12,5) |
| ICC | 0,93 (0,1) | 0,92 (0,07) |
| TAS (mmHg) | 137,8 (11,8) | 136,7 (13,8) |
| TAD (mmHg) | 86,9 (8,9) | 89,5 (9,6) |
| GEB (kcal/día) | 2259 (711) | 2287 (412) |
CC: circunferencia de la cintura; ICC: índice cintura cadera; IMC: índice de masa corporal; GEB: gasto energético basal; MG: masa grasa; MLG: masa libre de grasa; TAD: tensión arterial diastólica; TAS: tensión arterial sistólica.
No existieron diferencias estadísticamente significativas.
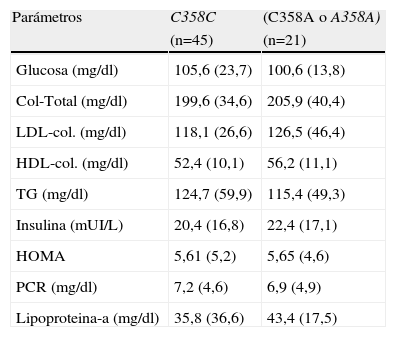
La tabla 2 muestra los factores de riesgo cardiovascular. No se detectaron diferencias estadísticamente significativas en las concentraciones lipídicas, glucosa, insulina, PCR o lipoproteína (A)y HOMA. Por tanto, este polimorfismo no parece asociarse ni con el perfil lipídico ni con el metabolismo de los glúcidos ni marcadores inflamatorios, como la PCR.
Factores de riesgo cardiovascular clásicos
| Parámetros | C358C | (C358A o A358A) |
| (n=45) | (n=21) | |
| Glucosa (mg/dl) | 105,6 (23,7) | 100,6 (13,8) |
| Col-Total (mg/dl) | 199,6 (34,6) | 205,9 (40,4) |
| LDL-col. (mg/dl) | 118,1 (26,6) | 126,5 (46,4) |
| HDL-col. (mg/dl) | 52,4 (10,1) | 56,2 (11,1) |
| TG (mg/dl) | 124,7 (59,9) | 115,4 (49,3) |
| Insulina (mUI/L) | 20,4 (16,8) | 22,4 (17,1) |
| HOMA | 5,61 (5,2) | 5,65 (4,6) |
| PCR (mg/dl) | 7,2 (4,6) | 6,9 (4,9) |
| Lipoproteina-a (mg/dl) | 35,8 (36,6) | 43,4 (17,5) |
Col: Colesterol total; HOMA: Homeostasis model assessment; TG: Trigliceridos; PCR: proteína C reactiva.
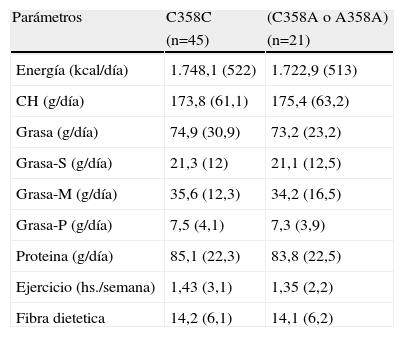
La tabla 3 muestra la ingesta dietética de estos pacientes, siendo similar en ambos grupos.
Ingesta dietética
| Parámetros | C358C | (C358A o A358A) |
| (n=45) | (n=21) | |
| Energía (kcal/día) | 1.748,1 (522) | 1.722,9 (513) |
| CH (g/día) | 173,8 (61,1) | 175,4 (63,2) |
| Grasa (g/día) | 74,9 (30,9) | 73,2 (23,2) |
| Grasa-S (g/día) | 21,3 (12) | 21,1 (12,5) |
| Grasa-M (g/día) | 35,6 (12,3) | 34,2 (16,5) |
| Grasa-P (g/día) | 7,5 (4,1) | 7,3 (3,9) |
| Proteina (g/día) | 85,1 (22,3) | 83,8 (22,5) |
| Ejercicio (hs./semana) | 1,43 (3,1) | 1,35 (2,2) |
| Fibra dietetica | 14,2 (6,1) | 14,1 (6,2) |
CH: Carbohidrato; Grasa-S: grasa saturada; Grasa-M: grasa monoinsaturada; GRasa-P grasa polinsaturada.
No existieron diferencias estadísticamente significativas.
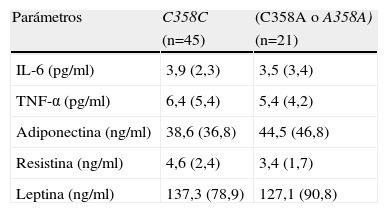
En la tabla 4 se muestran las concentraciones de adipocitoquinas, presentando ambos genotipos los mismos niveles de leptina, resistina, adiponectina, interleukina 6 y TNFα.
Adipocitoquinas circulantes
| Parámetros | C358C | (C358A o A358A) |
| (n=45) | (n=21) | |
| IL-6 (pg/ml) | 3,9 (2,3) | 3,5 (3,4) |
| TNF-α (pg/ml) | 6,4 (5,4) | 5,4 (4,2) |
| Adiponectina (ng/ml) | 38,6 (36,8) | 44,5 (46,8) |
| Resistina (ng/ml) | 4,6 (2,4) | 3,4 (1,7) |
| Leptina (ng/ml) | 137,3 (78,9) | 127,1 (90,8) |
IL-6: interleukina-6.
No existieron diferencias estadísticamente significativas.
En los últimos años se ha relacionado claramente la carga genética del paciente con la predisposición a la obesidad y la relación de estas con distintos factores de riesgo cardiovascular. Los estudios existentes en la literatura sobre el efecto del polimorfimos C358A del gen de la enzima AHAG son contradictorios8–11. En nuestro estudio no existió ninguna relación entre este polimorfismo y los datos antropométricos, factores de riesgo cardiovascular o adipocitoquinas.
Con respecto a la prevalencia del polimorfismo en nuestra muestra, el genotipo AC representó el 31,8%, muy similar al descrito en otros trabajos realizados también en pacientes caucásicos, pero con IMC entre 30–35; 28,1%9; 24,1%17 y 36,5%10.
La ausencia de relación de este polimorfismo con datos antropométricos en pacientes obesos se ha descrito en otros estudios. Los datos de nuestro trabajo están en consonancia con los obtenidos por Jensen et al11 y Papazoglou et al17, estando en contraposición con los obtenidos por Sipe et al9. En este último estudio el IMC fue superior en los sujetos con el genotipo A385A9. Una posible explicación a esta relación es el efecto del alelo A en el aumento de la regulación de la ingesta de alimentos dulces y palatables relacionados con la obesidad. Esta hipótesis se sustenta teniendo en cuenta que el circuito mesolímbico se relaciona con el núcleo accumbens, presentando una alta expresión de la enzima AHAG y el receptor endocanabinoide CB118. No obstante, la falta de relación de este polimorfismo con datos antropométricos, descrita en nuestro trabajo y en los de otros autores11–17, muestra la complejidad de las relaciones entre el ambiente y la genética en los pacientes con obesidad. Por otra parte, es necesario tener en cuenta la posible existencia de sesgos no detectados en los estudios, de este modo nuestra población es una muestra de pacientes con obesidad mórbida, con las peculiaridades que conlleva este tipo de obesidad. En segundo lugar, el análisis de la ingesta es un parámetro importante ya que puede alterar los posibles nexos de unión descritos en algunos de los estudios realizados anteriormente18, en el cual no se realiza ningún análisis de la ingesta dietética de los pacientes en el que se compare si existen, por ejemplo, diferencias en el aporte calórico.
Con respecto a la posible influencia de este polimorfismo en factores de riesgo cardiovascular bioquímicos o en las concentraciones de adipocitoquinas, no encontramos ningún dato significativo. Solo existe un trabajo en la literatura que ha demostrado la relación de este polimorfismo con marcadores bioquímicos. Este trabajo de Aberle et al19, detecta que los pacientes obesos con un alelo A presentan un descenso superior a los pacientes con genotipo salvaje en las concentraciones de colesterol total y triglicéridos, tras recibir una dieta hipocalórica baja en grasas.
Puede que este polimorfismo produzca a nivel del sistema endocanabinoide una alteración en el balance energético y en la lipogénesis20, habiéndose demostrado que los pacientes con este polimorfismo presentan un 50% menos de actividad en la enzima AHAG que los sujetos con genotipo salvaje. No obstante, esta relación entre el polimorfismo C358A de la AGHA y el perfil bioquímico solo ha sido detectada en este trabajo tras una intervención dietética19 y no ha sido detectado en ningún trabajo que haya analizado a los pacientes en condiciones basales. Este dato puede ser explicado por una relación de este polimorfismo con la respuesta posprandial de ácidos grasos libres, que pudiera alterar las concentraciones de lípidos en función del genotipo presente.
A pesar de las limitaciones del estudio por su bajo tamaño muestral y el estudio de un rango de obesidad muy extremo, podemos concluir que el polimorfismo de la AHAG, C358A, no se relaciona con variables antropométricas, bioquímicas o concentraciones de adipocitoquinas en pacientes con obesidad mórbida. No obstante, es necesario realizar nuevos diseños, incluso de intervención, para valorar el efecto del sistema endocanabinoide en la etiología y tratamiento de la obesidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.