66ALDOSTERONA, INFLAMACIÓN E HIPERTENSIÓN. PARTICIPACIÓN DEL SISTEMA NFκB/ IκB
D. Sanz-Rosa, M. Miana, N. de Las Heras, E. Cediel, B. Martín, P. Oubiña, V. Cachofeiro y V. Lahera
Departamento de Fisiología Fac. Medicina U.C.M. Madrid.
Se estudió la participación de la aldosterona en el proceso inflamatorio vascular asociado a hipertensión. Además, se valoró el papel del sistema NFcB/ IκB en dicha participación. Se utilizaron ratas (n = 24) espontáneamente hipertensas (SHR) de 22 semanas de edad que fueron tratadas durante 10 semanas con dos dosis de eplerenona: una dosis de 30 mg/Kg/día (E-30) con un efecto pequeño sobre la presión arterial y una dosis de 100 mg/Kg/día (E-100) con un efecto antihipertensivo marcado. Se utilizaron ratas (n = 8) normotensas (WKY) como grupo control. Al final del tratamiento se midieron los valores plasmáticos de las interleuquinas 1Beta y 6 (IL-1 Beta y IL-6) y se estudió la expresión vascular del ARNm de las interleuquinas 1 Beta y 6 (IL-1 Beta y IL-6), y del factor de necrosis tumoral α (TNF-α)) así como la expresión vascular del ARNm del precursor p105 de la subunidad p50 del NFκB y su inhibidor IκB. Las SHR presentaron unos valores de presión arterial sistólica mayores (p < 0,05) que las ratas controles WKY (199,8 ± 4,2 vs 126,1 ± 1,0 mmHg). El tratamiento con eplerenona redujo (p < 0,05) estos valores de manera dosis dependiente (E30 178 ± 0,6 y E100 156,3 ± 2,8 mmHg).
Los niveles elevados (p < 0,05) de presión arterial en las SHR se asociaron a un aumento (p < 0,05) en la concentración plasmática de IL-1 Beta e IL-6 así como una mayor expresión (p < 0,05) del ARNm en la aorta de IL-1 Beta, IL-6 y TNF-α. Las SHR presentaron también un incremento (p < 0,05) en la expresión del ARNm del precursor de la subunidad p50 del NFκB así como una reducción (p < 0,05) en los niveles del ARNm de su inhibidor IκB. Los tratamientos con Eplerrenona a baja como a alta dosis redujeron (p < 0,05) los niveles de las IL-1 Beta, IL-6 y PCR de manera similar en ambos grupos. De igual manera, ambas dosis de eplerenona redujeron (p < 0,05) de manera similar la expresión vascular de IL-1 Beta, IL-6 y TNF-α. El bloqueo de los receptores de aldosterona disminuyó (p < 0,05) la expresión de NFκB y aumentó la de su inhibidor, IκB. La aldosterona participa en el proceso inflamatorio vascular asociado a la hipertensión a través de una estimulación del factor de transcripción NFκB y una reducción de su inhibidor IκB.
Financiación: FIS (01/0088-02), CICYT (SAF2001-1864) y CAM (08.4/0002.1/2003).
67CAMBIO EN EL CONTROL GLUCÉMICO CON PIOGLITAZONA EN COMBINACIÓN CON SULFONILUREAS O METFORMINA. SEGUIMIENTO A 12 MESES DEL ESTUDIO ECLA
A. Rodríguez Bernardino, P. García Polavieja, I. Julián Ortega y J. Reviriego Fernández
Departamento de Investigación Clínica Lilly, S.A. Alcobendas (Madrid), Grupo del Estudio ECLA.
Objetivo: Evaluar el cambio en el control glucémico, y presión arterial sistólica (PAS) y diastólica (PAD), en pacientes con diabetes mellitus tipo 2 (DM2) cuyos datos se recogieron para un estudio observacional llevado a cabo en España. El estudio se diseñó para evaluar la efectividad de pioglitazona (PIO) en combinación con sulfonilureas (PIO+SU) o metformina (PIO+MET) y la de la combinación SU+MET en cuanto a la hemoglobina glicosilada (HbA1c), glucosa plasmática en ayunas (GPA), perfil lipídico y presión arterial en pacientes con DM2 tratados en un entorno clínico habitual.
Métodos: Estudio Fase IV, observacional, prospectivo, multicéntrico, no intervencionista, de un año de duración de acuerdo con la legislación vigente. Se obtuvieron datos basales de 2465 pacientes. Novecientos quince pacientes (37,1%) comenzaron tratamiento con PIO+SU, 771 (31,3%) con PIO+MET y 779 (31,6%) con SU+MET. La mayoría de los pacientes tratados con PIO (85,8%) recibieron la dosis de 30 mg. Tras 12 meses se obtuvieron datos de 2294 pacientes (851 con PIO+SU, 723 con PIO+MET y 720 con SU+MET). La proporción de pacientes con tratamiento para la hipertensión arterial durante el estudio fue de 39,5% (PIO+SU), 36,8% (PIO+MET) y 41,7% (SU+MET). Se llevó a cabo un análisis de la covarianza incluyendo los valores basales como covariable y como variable independiente el cambio desde el valor basal al último valor registrado.
Resultados: Los cambios medios tras 12 meses se muestran como MMC ± EEM.
Se realizaron análisis adicionales en el caso de la PA dependiendo de si los pacientes estaban recibiendo tratamiento antihipertensivo o no. Los cambios medios absolutos fueron mayores tanto para la PAS como para la PAD en los pacientes con tratamiento específico.
Conclusión: En este estudio de 12 meses de duración, todos los grupos de tratamiento mejoraron significativamente el control glucémico en pacientes con DM2 tratados en un entorno clínico habitual. Aunque no se pueden descartar sesgos debido a la elección del tratamiento por el investigador, las combinaciones de PIO se asociaron con bajadas significativamente mayores de HbA1c tras 12 meses en comparación con una combinación de agentes orales ampliamente utilizada. Se observó una ligera mejoría de la PA en todos los grupos, sin diferencias significativas entre los mismos.
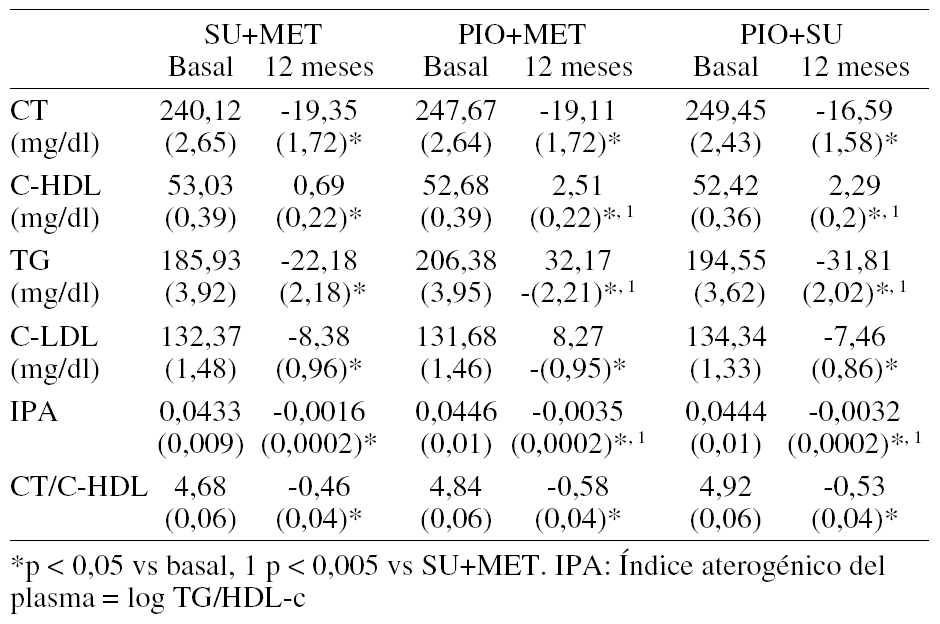
68CAMBIO EN LOS PARÁMETROS LIPÍDICOS CON PIOGLITAZONA EN COMBINACIÓN CON SULFONILUREAS O METFORMINA. SEGUIMIENTO A 12 MESES DEL ESTUDIO ECLA
J. Reviriego Fernández, I. Julián Ortega, P. García Polavieja y Á. Rodríguez Bernardino
Dpto. de Investigación Clínica Lilly, S.A. Alcobendas (Madrid), Grupo del Estudio ECLA.
Objetivo: Evaluar el cambio en el control lipídico en pacientes con diabetes mellitus tipo 2 (DM2) cuyos datos se recogieron para un estudio observacional llevado a cabo en España. El estudio se diseñó para evaluar la efectividad de pioglitazona (PIO) en combinación con sulfonilureas (PIO+SU) o metformina (PIO+MET) y la de la combinación SU+MET en cuanto al control glucémico, perfil lipídico y presión arterial en pacientes con DM2 tratados en un entorno clínico habitual.
Métodos: Estudio Fase IV, observacional, prospectivo, multicéntrico, no intervencionista, de un año de duración de acuerdo con la legislación vigente. Se obtuvieron datos basales de 2465 pacientes. Novecientos quince pacientes (37,1%) comenzaron tratamiento con PIO+SU, 771 (31,3%) con PIO+MET y 779 (31,6%) con SU+MET. La mayoría de los pacientes tratados con PIO (85,8%) recibieron la dosis de 30 mg. Tras 12 meses se obtuvieron datos de 2.294 pacientes (851 con PIO+SU, 723 con PIO+MET y 720 con SU+MET). La proporción de pacientes con tratamiento hipolipemiante durante el estudio fue de 26,3% (PIO+SU), 27,7% (PIO+MET) y 29,9% (SU+MET). Se llevó a cabo un análisis de la covarianza incluyendo en el modelo el tratamiento y el valor basal como covariables y como variable independiente el cambio desde el valor basal al último valor registrado.
Resultados: Los cambios medios tras 12 meses se muestran como MMC ± EEM.
Se realizaron análisis adicionales para todas las variables dependiendo de si los pacientes estaban recibiendo tratamiento hipolipemiante o no. Los cambios medios absolutos para todas las variables (salvo C-HDL) fueron mayores para los pacientes con tratamiento para la dislipidemia, aunque se observó un patrón similar en los pacientes no tratados.
Conclusión: En este estudio de 12 meses de duración, todos los grupos de tratamiento se asociaron con mejorías en el control lipídico en pacientes con DM2 tratados en un entorno clínico habitual. Aunque no se pueden descartar sesgos debido a la elección del tratamiento por el investigador, las combinaciones de PIO se asociaron con bajadas significativamente mayores de IPA y TG, y aumentos significativamente mayores de C-HDL tras 12 meses en comparación con una combinación de agentes orales ampliamente utilizada.
69CONTRIBUCIÓN DIFERENCIAL DE LOS RECEPTORES SST1, SST2 Y SST5 AL EFECTO DUAL ESTIMULADOR/ INHIBIDOR DE LA SOMATOSTATINA SOBRE LA SECRECIÓN DE HORMONA DEL CRECIMIENTO (GH) EN SOMATOTROPAS
M. Durán-Prado, E. Delgado-Niebla, R.M. Luque, A.J. Martínez-Fuentes, S. García-Navarro, M.M. Malagón y J.P. Castaño
Dpto. de Biología Celular, Fisiología e Inmunología Universidad de Córdoba. Córdoba.
La somatostatina (SRIF) ejerce sus múltiples acciones a través de una familia de 5 receptores transmembrana (sst1-sst5). Su función como regulador esencial de la secreción de GH por las somatotropas constituye un excelente modelo de investigación para conocer sus complejos mecanismos de acción. Nuestro grupo descubrió hace diez años que, en contra de lo descrito en otras especies, en las somatotropas porcinas el SRIF ejerce una acción dual, inhibidora/estimuladora, que es dosis-dependiente. Así, mientras que dosis altas (microM) de SRIF inhiben la secreción de GH inducida por GHRH en cultivos de células hipofisarias porcinas, dosis bajas (pM) de SRIF estimulan la secreción de GH. Esta estimulación paradójica es especialmente llamativa en una de las dos subpoblaciones de somatotropas de la hipófisis, caracterizada por su elevado contenido en gránulos de secreción. Para conocer los subtipos de sst que median esta acción dual del SRIF, evaluamos la secreción de GH in vitro en respuesta a una serie de agonistas no peptídicos específicos para cada sst (cedidos por Merck). Los resultados obtenidos sugieren que sst1 y sst2 median las acciones inhibidoras del SRIF, mientras que el sst5 trasmitiría sus efectos estimuladores. De hecho, estudios de PCR y western blot indican que los receptores sst1 y sst2 predominan en la subpoblación de somatotropas con menor contenido de gránulos de secreción, que muestra una respuesta inhibidora clásica a concentraciones altas de SRIF. En cambio, el receptor sst5 muestra una distribución más compleja y abundante en la subpoblación de somatotropas altamente granuladas, que responden a SRIF con una estimulación paradójica. Para conocerlos mejor, hemos clonado estos receptores y estamos analizando sus propiedades estructurales y funcionales. Así, el estudio del sst2 porcino expresado en la línea celular CHO-K1 demuestra que este receptor posee las propiedades de unión típicas de un sst2 (Kd = 0,27 nM) y es capaz de inducir una inhibición moderada pero significativa de los niveles de AMPc estimulados por forscolina. Por su parte, el sst5 porcino (1160 bp; 371 aas), muestra una alta homología con otros sst5, pero contiene un motivo poco habitual de 8 Gly repetidas en su dominio N-terminal extracelular. Más aún, muy recientemente hemos identificado dos nuevas isoformas truncadas del sst5, que podrían estar relacionadas con la acción dual del SRIF. En conjunto, estos resultados permiten comprender mejor los complejos efectos del SRIF en las somatotropas porcinas y pueden también ayudarnos a entender las bases moleculares de las respuestas anómalas y paradójicas de otros tipos celulares, normales y tumorales, al SRIF y sus análogos sintéticos.
Financ: CVI-139(J.And.);BFI 2001-2007;BFU2004-03883/BFI (MEC/FEDER).
70DISOCIACIÓN DE DIFERENTES RESPUESTAS DEPENDIENTES DE ESTRÓGENOS EN EL ÚTERO DE RATAS CÍCLICAS
M. Gaytán Muñoz*, C. Bellido Gámez*, C. Morales Jiménez**, J.E. Sánchez Criado* y F. Gaytán Luna*
*Dpto. Biología Celular, Fisiología e Inmunología, **Dpto. de Especialidades Médico-Quirúrgicas Universidad de Córdoba. Córdoba.
Los cambios cíclicos en el útero son fundamentalmente dependientes de la ciclicidad de los esteroides ováricos. Los efectos de los estrógenos sobre el útero se han investigado principalmente en ratas castradas, donde está claramente establecido que el estradiol induce hiperplasia e hipertrofia del epitelio uterino, e inhibe la apoptosis. Sin embargo, en las ratas cíclicas los efectos de los estrógenos están modulados por el ambiente esteroideo, debido a la presencia de ovario. Hemos evaluado los cambios que se producen en la actividad proliferativa (mediante marcaje con BrdU), en la altura del epitelio y en la apoptosis (evaluadas morfológicamente) en el epitelio uterino (variables estrógeno-dependientes en la rata castrada) y su correlación con los cambios cíclicos en los niveles circulantes de estradiol. La proliferación es máxima en metestro, mientras que la altura del epitelio es máxima en estro, 48 y 24 horas después de la secreción preovulatoria de estradiol, respectivamente. La apoptosis se produce casi exclusivamente en el día de estro. El bloqueo de los efectos de la secreción preovulatoria de estradiol, mediante tratamiento con el antagonista estrogénico puro ICI 182, 780, en diestro y proestro, inhibe la proliferación, la hipertrofia y la apoptosis, mientras que el bloqueo en estro, no inhibe la proliferación. Por otra parte, la administración de benzoato de estradiol (25 µg/rata), tanto en proestro como en estro, induce hipertrofia e inhibe la proliferación y la apoptosis. Estos resultados indican que dos respuestas estrogénicas clásicas (hipertrofia e hiperplasia) del epitelio uterino, están cronológicamente disociadas en las ratas cíclicas, y en ratas tratadas con altas dosis de estradiol, que presentan hipertrofia, pero no hiperplasia. Por el contrario, la apoptosis es inhibida tanto por el bloqueo de los estrógenos, como por el mantenimiento de altos niveles de estradiol, durante el proestro.
71EFECTO DE LA VITAMINA D Y DEL NEUROTÓXICO 6-OHDA SOBRE LA EXPRESIÓN DE GDNF
B. Sánchez Rey*, C. Segura Iglesias** y R. Pérez Fernández*
*Dpto. Fisiología, **Dpto. Ciencias Morfológicas Facultad de Medicina. Santiago de Compostela.
El factor neurotrófico derivado de la glia, GDNF (Glial Derived Neurotrophic Factor) pertenece a la superfamilia TGF-?. GDNF estimula la supervivencia de las neuronas dopaminérgicas, las cuales al degenerar, pueden inducir la aparición de trastornos neurodegenerativos. La 6-hidroxidopamina (6-OHDA), es un neurotóxico que puede actuar lesionando específicamente la población de neuronas dopaminérgicas, pero también lo hace inespecíficamente sobre otros tipos celulares. Según trabajos realizados in vivo, la lesión con 6-OHDA incrementa la expresión de GDNF, probablemente en un intento de revertir el daño. En trabajos previos, hemos demostrado que la administración intraperitoneal de vitamina D incrementa la expresión de GDNF en el núcleo estriado. En este trabajo, en cultivos primarios neuronales de núcleo estriado de rata, se pretende estudiar tanto el efecto de la administración del neurotóxico 6-OHDA como de la vitamina D sobre la expresión de GDNF. A partir de ratas neonatales de 3 días se establecieron cultivos primarios neuronales, los cuales: a) fueron tratados con vitamina D, b) lesionados con 6-OHDA y finalmente, c) pretratados con vitamina D y lesionados con 6-OHDA. Se determinaron los niveles de ARNm y proteína de GDNF por RT-PCR y Western blot. Los resultados demuestran que, en cultivo primario de neuronas de núcleo estriado de rata, la administración de vitamina D, o la administración del neurotóxico 6-OHDA incrementan la expresión de GDNF. No obstante, el pretratamiento con vitamina D antes de administrar el tóxico, no parece generar un efecto aditivo sobre la expresión de GDNF.
Trabajo financiado por la Xunta de Galicia (PGIDIT03 PXIB20802PR).
72EFECTO DE PIT-1 SOBRE LA PROLIFERACIÓN DE CÉLULAS TUMORALES MAMARIAS
C. Gil Puig*, C. Segura Iglesias** y R. Pérez Fernández*
*Dpto. Fisiología, **Dpto. Ciencias Morfológicas Facultad de Medicina. Santiago de Compostela.
El cáncer de mama es la neoplasia con mayor índice de mortalidad entre las mujeres. Se trata de una enfermedad hormonodependiente, donde tanto las hormonas ováricas como hipofisarias, juegan un importante papel, no solo en el desarrollo normal de la glándula mamaria, sino también en el inicio y progresión del cáncer de mama. Estudios epidemiológicos muestran que los niveles séricos de la hormona de crecimiento (GH), en pacientes con cáncer de mama, son más elevados que en individuos normales. Además, se ha demostrado que la expresión de GH es mayor en tumores de mama que en tejido mamario normal. Al igual que ocurre en hipófisis, donde el principal regulador de la expresión de GH es el factor de transcripción Pit-1, estudios realizados por nuestro grupo, muestran que la línea celular MCF-7 (adenocarcinoma mamario humano), además de expresar GH, ésta hormona es regulada por Pit-1, y que la expresión de este factor de transcripción es mayor en tumores que en mamas normales. Para conocer el posible papel de Pit-1 sobre la proliferación de células tumorales mamarias, se utiliza la línea celular MCF-7, la cual es transfectada con el plásmido de expresión de Pit-1, pRSV-hGHF-1 (10 ng, 50 ng, 250 ng, 500 ng y 1000 ng) durante 72 horas, y, tras incubar con bromodeoxiuridina, se cuantifican las células que están en fase S respecto al núcleos totales teñidos con DAPI-. Los resultados obtenidos demuestran un incremento de la proliferación celular asociada al incremento de la expresión de Pit-1, lo que nos indica que la proliferación dependiente de Pit-1 es dosis-dependiente. Estos datos sugieren que Pit-1, directamente o a través de otros factores, puede estar implican el desarrollo y/o proliferación del cáncer de mama.
Trabajo financiado por la Xunta de Galicia (PGIDIT03 PXIB20802PR) y FIS (PI040518).
73EFECTO DEL AYUNO SOBRE LA SECRECIÓN DE GHRELINA EN EXPLANTES DE HIPOTÁLAMO Y TEJIDO GÁSTRICO
O. Al-Massadi Iglesias, M. Lage Varela, Y. Pazos Randulfe, S. Pérez Romero y L.M. Seoane Camino
Laboratorio de Endocrinología Molecular. Departamento de Medicina Universidad de Santiago de Compostela. Complejo Hospitalario Universitario de Santiago de Compostela. Santiago de Compostela.
La ghrelina como su receptor, se expresan en diversos tejidos, tanto dentro del sistema nervioso central como de la periferia, indicando que está implicada en diferentes funciones fisiológicas. La ghrelina incrementa la secreción de GH en rata y en humano y es un potente regulador de la ingesta, aunque es producida en diversos tejidos su principal fuente de producción es el estómago. Existen evidencias del efecto que el ayuno ejerce sobre los niveles de plasma y ARNm, pero no de la secreción de la hormona directamente del tejido gástrico e hipotálamo.
Objetivos: Poner a punto un mecanismo "in vitro" que nos permita estudiar la secreción de ghrelina directamente a partir de explantes tisulares. Esclarecer como el ayuno afecta a la secreción de ghrelina por parte del tejido gástrico e hipotalámico. Estudiar los cambios en la secreción de ghrelina mediante la adición de diferentes sustancias sobre el tejido aislado.
Métodos: Se midió la secreción de ghrelina a partir de explantes hipotalámicos y estomacales en ratas alimentadas "ad libitum2, en diferentes períodos de ayuno y con realimentación. Se incubaron los explantes de tejido, añadiendo al medio sustancias potencialmente reguladoras de la secreción de ghrelina. Dentro de cada uno de estos grupos se utilizaron subgrupos (n = 5) y la secreción se recogió a tiempos de 1, 3, 6, 12 horas. La secreción de la hormona se midió mediante RIA.
Conclusiones: Los explantes estomacales e hipotalámicos mantenidos in vitro segregan ghrelina de forma tiempo-dependiente, siendo significativamente más elevados en estómago que en hipotálamo. Los explantes hipotalámicos no se ven afectados por el ayuno. Los explantes estomacales obtenidos a partir de ratas en ayuno producen unos niveles de ghrelina significativamente elevados con respecto a los que proceden de ratas alimentadas "ad limitum". Los explantes estomacales obtenidos de ratas sometidas a una realimentación de 2 h, producen una secreción de ghrelina significativamente menor con respecto al tejido de ratas alimentadas "ad limitum" y por lo tanto respecto al tejido extraído de ratas en ayuno. La secreción de ghrelina es viable a tiempos cortos (1-3 h).
Este trabajo ha sido financiado por el FIS y el Instituto de Salud Carlos III, Ministerio de Sanidad y Consumo, Red de Grupos RGTO (G03/028), Red de Centros RCMN (C03/08).
74EFECTO DEL BLOQUEO DE LA ACCIÓN DE TNF-* SOBRE LA PROGRESIÓN DE LA NEFROPATÍA DIABÉTICA EXPERIMENTAL
P. Vieitez García*, O. Gómez Torres*, E. Ruiz Uceda*, B. Canovas Gaillemín** y M.E. Vera Meneses*
*Endocrinología Hospital Ramón y Cajal. Madrid, **Endocrinología Hospital Virgen de la Salud. Toledo.
La nefropatía diabética es la causa más común de complicaciones microvasculares en pacientes con diabetes mellitus tipo 1. Se ha evidenciado una estrecha relación entre TNF-α, factor implicado en la respuesta inflamatoria, con el desarrollo de nefropatía. En un trabajo previo, empleando un modelo de diabetes tipo 1 inducida por estreptozotocina en rata, demostramos que la diabetes crónica aumenta la expresión de TNF-α glomerular y tubular. El objetivo del actual trabajo fue el de evaluar si el bloqueo de la acción de TNF-α, tiene un efecto protector sobre estos cambios tempranos en la evolución de la nefropatía diabética. Para ello, a ratas Sprague Dawley de 5-6 semanas se les administró intraperitonealmente una dosis de estreptozotocina de 65 mg/kg. Se consideraron ratas diabéticas cuando el nivel de glucosa en sangre fue mayor a 300 mg/dl. Para mantener el peso corporal y lograr la supervivencia prolongada, se les administró insulina subcutáneamente todos los días, manteniendo una glucemia superior a 300 mg/dl. Transcurridos ocho meses, los animales fueron separados en tres grupos (n = 10). El primer grupo fue tratado durante dos semanas con la forma soluble del receptor de TNF-α, Etanercept (0,3 mg/kg/día). El segundo grupo fue tratado con vehículo el mismo período de tiempo. Un tercer grupo se empleó para aislar glomérulos y cultivarlos 24 horas en presencia de cuatro dosis distintas de Etanercept (0, 1, 10, 100 µg/ml). En el experimento in vivo, Etanercept no afectó a la presión arterial, al control metabólico ni a la histopatología renal característica de diabetes, pero sí redujo de forma significativa la proteinuria. Tanto en el experimento in vivo como in vitro, Etanercept redujo la expresión glomerular de VEGF y PDGF, sin embargo, en al caso de TGF-β1 no hubo diferencias en el experimento in vivo pero si in vitro. Todos estos factores están implicados en el aumento de la matriz mesangial y la existencia de proteinuria que ocurre en diabetes. Los resultados demostraron que el tratamiento con Etanercept reduce algunos de los cambios tempranos que ocurren en el riñón diabético cuando se administra de forma sistémica o local. Por tanto, el sistema TNF-α tiene un papel fundamental en el desarrollo de algunas de las alteraciones más importantes que ocurren en el riñón diabético. Además, considerando el efecto del bloqueo de TNF-α en glomérulos aislados, nos permite plantear que el efecto beneficioso del tratamiento sistémico con Etanercept es, al menos parcialmente, debido al bloqueo del sistema TNF-α local. Esta citoquina, así como las interacciones autocrinas/paracrinas en el glomérulo deben de ser fundamentales en el desarrollo de la nefropatía diabética.
75EFECTO DEL BLOQUEO DE LA CITOQUINA TNF-β SOBRE EL DESARROLLO DE RETINOPATÍA DIABÉTICA EXPERIMENTAL
E. Ruiz Uceda*, O. Gómez Torres*, P. Vieitez García*, B. Canovas Gaillemín** y M.E. Vera Meneses*
*Endocrinología Hospital Ramón y Cajal. Madrid, **Endocrinología Hospital Virgen de la Salud. Toledo.
La retinopatía diabética es una de las causas más comunes de complicaciones microvasculares en pacientes con diabetes mellitus tipo 1. Se ha evidenciado una estrecha relación entre algunos de los factores implicados en la respuesta inflamatoria y el desarrollo de retinopatía. En un trabajo previo, empleando un modelo de diabetes tipo 1 inducida por estreptozotocina en rata, demostramos que la diabetes crónica aumenta la expresión de TNF-α sobre todo en las capas ganglionares y en zonas próximas a capilares. Simultáneamente, existe aumento en la permeabilidad vascular de la retina e incremento en la expresión de VEGF, factor inductor de permeabilidad y neovascularización. El objetivo del actual trabajo fue evaluar si el bloqueo de la acción de TNF-α tiene un efecto protector sobre estos cambios tempranos en la evolución de la retinopatía diabética. Para ello, a ratas Sprague Dawley de 5-6 semanas se les administró intraperitonealmente una dosis de estreptozotocina de 65 mg/kg. Se consideraron ratas diabéticas cuando el nivel de glucosa en sangre fue mayor a 300 mg/dl. Para mantener el peso corporal y lograr la supervivencia prolongada, se les administró insulina subcutáneamente todos los días, manteniendo una glucemia superior a 300 mg/dl. Transcurridos ocho meses, los animales fueron separados en tres grupos (n = 10). El primer grupo, GE fue tratado durante dos semanas con la forma soluble del receptor de TNF-α, Etanercept (0,3 mg/kg/día). El segundo grupo fue tratado con vehículo durante el mismo período de tiempo. Al tercer grupo, se les practicó una inyección intravitreal por la que se administró Etanercep en el ojo izquierdo y vehículo en el derecho. En todos los casos, se midieron la permeabilidad vascular y la expresión de VEGF, FGF-b, TNF-α por Western blot e inmunohistoquímica. Los resultados demostraron que el tratamiento con Etanercept reduce la permeabilidad vascular de la retina en ratas diabéticas cuando se administra de forma sistémica o local. También se reduce la expresión proteica de VEGF y FGF-b sin que existan cambios significativos en la expresión de TNF-α. Por tanto, el sistema TNF-α juega un papel importante en el desarrollo de las alteraciones tempranas en la retina diabética. Además, dado el efecto de la inyección intravitreal, nos permite plantear que el efecto beneficioso del tratamiento sistémico con Etanercept es, al menos parcialmente, debido al bloqueo del sistema TNF-α local. Esta citoquina y las interacciones autocrinas/paracrinas existentes en retina deben ser fundamentales en el desarrollo de esta patología.
76
ESTUDIO FUNCIONAL DE LA DELECIÓN (825DELC) DEL GEN TITF1/NKX2.1 CARACTERIZADA EN DOS HERMANAS CON HIPOTIROIDISMO CONGÉNITO Y COREOATETOSIS
C.M. Moya1, G. Pérez de Nanclares2, N. Potau3, J.R. Bilbao2, A. Carrascosa4, M. Bargadá5, R. Coya2, P. Martul2, L. Castaño2, E. Vicens-Calvet4 y P. Santisteban1
1Endocrinología Molecular Instituto de Investigaciones Biomédicas. CSIC-UAM. Madrid, 2Grupo de Investigación en Endocrinología y Diabetes Hospital de Cruces, Universidad del País Vasco. Barakaldo, Bizkaia, 3Laboratorio de Hormonas, 4Departamento de Endocrinología, 5Departamento de Psicología Hospital Materno Infantil Vall d'Hebron, Escuela de Medicina. Barcelona.
Mutaciones en el gen TITF1/NKX2.1, que codifica para el factor de transcripción tiroideo TTF-1, se han descrito en pacientes con hipotiroidismo congénito, problemas neurológicos y alteraciones pulmonares. Recientemente se ha definido una nueva deleción (825delC), en el exón 3 de uno de los alelos del gen, en dos hermanas identificadas en el programa de screening de hipotiroidismo congénito que además presentaban coreoatetosis con ausencia de problemas respiratorios.
Objetivo: Estudiar los mecanismos moleculares que originan el anterior fenotipo. Para ello se ha generado mediante mutagénesis dirigida, usando PCR asimétrica, un vector de expresión conteniendo la deleción encontrada en las pacientes, a partir de un vector conteniendo la secuencia normal de TTF-1. Ambos vectores (control y mutado) se han expresado in vitro para estudiar su unión al ADN, y mediante transfecciones transitorias se evaluó su capacidad transactivadora. Los resultados obtenidos indican que la deleción, localizada en el dominio de transactivación, genera una proteína TTF-1 sin sentido con 75 aminoácidos (aa) diferentes y 22 aa menos que la proteína normal, lo que origina un dominio rico en cargas positivas en el extremo C-terminal. La proteína mutada se une con menor eficiencia a su secuencia específica en los promotores de dos de sus genes diana, el de Tiroglobulina (Tg) y el del surfactante pulmonar-B (SP-B) y además no interfiere en la capacidad de unión de la proteína control. En los ensayos de transfección transitoria hemos observado que la proteína mutada no transactiva ni al promotor de Tg, ni al de SP-B. Sin embargo en estos mismos ensayos cuando se co-expresa la proteína mutada, con la proteína control, reproduciendo lo que ocurre in vivo en las dos pacientes, hemos podido demostrar que la proteína mutada actúa como dominante negativo sobre el promotor de Tg inhibiendo su transcripción, pero no sobre el promotor del surfactante pulmonar. Ello explicaría que las pacientes presenten problemas tiroideos pero no problemas pulmonares y además se demuestra la función diferencial de TTF-1 en los diferentes tejidos en donde se expresa. El hecho de que además las pacientes tengan problemas neurológicos ratifica lo ya demostrado por otros grupos de un papel importante de TTF-1 sobre el desarrollo neuronal.
Financiado con FIS, ISCIII (RCGC-C03/10), FIS, ISCIII (RCMN-C03/08), FIS, ISCIII (PI041216), FIS, CP03/0064, BFU2004-03169/BMC, y Laboratorios Pfizer.
77EXPRESIÓN Y REGULACIÓN DE ADIPONECTINA EN PLACENTA HUMANA Y DE RATA
S.A. Tovar*, M.J. Vázquez*, R. Nogueiras*, C.R. González*, J.E. Caminos*, R. Gallego**, T. García-Caballero**, F.F. Casanueva*** y C. Diéguez*
*Fisiología Facultad de Medicina, **Ciencias Morfológicas, ***Medicina Molecular Fac de medicina. Santiago de Compostela.
La adiponectina, también conocida como ACRP30, es una hormona adipocítica de 30 kDa que se encuentra involucrada en el metabolismo tanto de los lípidos como de la glucosa. Recientemente, se han clonado dos receptores de esta hormona (adipo-R1 y adipo-R2).
Objetivo: Examinar de qué manera la adiponectina está expresada en la placenta de humanos y en la de ratas y evaluar su regulación mediante distintos factores, como la gestación y el estado nutricional. Nuestros resultados demuestran que la adiponectina se localiza en la placenta de ambas especies. Se localizaron en las células del citotrofoblasto y el sincitiotrofoblasto. Sin embargo, la adiponectina de rata cambia su tinción específica de tipo celular durante la gestación. Además, la expresión del ARNm de adiponectina en placenta se incrementa durante la gestación en la rata. En este estudio también hemos medido el efecto de la restricción alimenticia (30%) durante la preñez y hemos observado que los niveles de ARNm de adiponectina disminuyeron después de 16 días de restricción alimenticia. En conjunto, estos resultados sugieren que la adiponectina puede estar involucrada en la regulación de diferentes funciones placentarias tanto en humanos como en roedores.
78FAMILIAS DE INHIBIDORES DEL CICLO CELULAR COOPERAN PREVINIENDO EL DESARROLLO DE TUMORES HIPOFISARIOS
G. Martínez*, C. Carneiro*, C. de La Hoz**, A. Koff*** y A. Vidal*
*Dept. Fisioloxia. Fac. Medicina. Univ. Santiago de Compostela. Santiago de Compostela., **Dept. Biología Celular e Histología. Univ. Pais Vasco. Leioa, Vizcaya, ***Molecular Biology Program. Memorial Sloan-Kettering Cancer Center. New York, Usa.
En este trabajo estudiamos la cooperación del inhibidor de CDKs p27Kip1, y los miembros de la familia de pRb, p130 y p107. Para ello generamos cepas de ratones knockout (KO) con combinaciones de deleciones en estos genes y observamos la aparición de tumores espontáneos. Como estaba descrito, los ratones knockout para p27 desarrollaron hiperplasia del lóbulo intermedio de la hipófisis con penetrancia completa, que, a edad avanzada, evolucionó a adenoma en una fracción de los animales (50% a los 12 meses). En todos los casos se trató de tumores benignos y bien encapsulados. El análisis de los animales doble knockout para p27 y 130 a un año de edad reveló una mayor incidencia de adenomas hipofisarios (11/29 en p27 -/- vs 25/33 en p130 -/-; p27 -/-, p < 0,01). Estos tumores presentaron un mayor índice proliferativo (2,4 ± 1,8% vs 15,2 ± 7,1% células positivas para Ki67) y alcanzaron mayores tamaños que los aparecidos en los animales p27-/-. La cepa p107 ±; p130 -/-; p27 -/- presentó supervivencia reducida, con una mortalidad mayor del 50% antes del año de edad. De hecho, la heterozigosidad de p107 aceleró significativamente la aparición de tumores en hipófisis (20/22 vs 10/23, p < 0,001, para animales de edad entre 35 y 51 semanas). Es de gran importancia destacar que en estos animales los tumores de hipófisis resultaron auténticos adenocarcinomas, con infiltración en los lóbulos adyacentes o el cerebro circundante, indicando que la reducción en dosis génica de p107 incrementa la malignidad de estos tumores. Para estudiar los mecanismos moleculares de estos fenómenos de supresión tumoral, se realizó un análisis genómico de expresión génica en tumores hipofisarios de los diferentes genotipos. Se discutirán los patrones génicos obtenidos. En resumen, estos resultados ponen de manifiesto la función supresora de tumores de p107 in vivo, y sugieren un papel parcialmente redundante con p130 y p27 en la prevención del desarrollo tumoral de la hipófisis.
Trabajo financiado por Ministerio de Educación y Ciencia, Xunta de Galicia y Cultek S.L.
79IDENTIFICACIÓN DE GENES SENSIBLES A HORMONA TIROIDEA EN EL CEREBRO ADULTO
B. Morte Molina*, D. Díez Ruiz*, M.C. Grijota*, P. Agretti**, G. Di Marco**, M. Tonacchera**, A. Pinchera** y J. Bernal Carasco*
*Endocrinología Molecular Instituto de Investigaciones Biomédicas. Madrid, **Endocrinología Universita Degli Studi di Pisa. Pisa.
Alteraciones de los niveles de hormona tiroidea (HT) en el cerebro adulto puede profundamente alterar la función mental influyendo en el conocimiento y las emociones. Existen numerosos datos clínicos que apuntan a una estrecha relación entre disfunción tiroidea y enfermedades mentales. Por ejemplo, se sabe de la eficacia del tratamiento de ciertas depresiones con HT. Además, recientemente, algunos estudios funcionales del cerebro adulto mediante técnicas de imágenes han revelado en general una disminución en el metabolismo y la actividad funcional en la deficiencia de HT. Sin embargo, los mecanismos por los que la HT controla las funciones cerebrales y el comportamiento todavía permanecen sin esclarecer. La HT ejerce su acción, a través de la unión a sus receptores nucleares, controlando la expresión génica. En el cerebro adulto los genes regulados por HT son difíciles de identificar debido en parte a la gran complejidad del cerebro y la sensibilidad regional a la HT. Para ello hemos aplicado la técnica de DNA microarrays, que constituye una herramienta muy potente para los estudios de expresión génica, para identificar genes regulados directamente por HT en el caudado, hipocampo, cerebelo y corteza de ratas adultas. Hemos analizado el patrón de expresión de ratas hipotiroideas e hipotiroideas tratadas con T3 24 horas antes del sacrificio. El hipotiroidismo se indujo mediante tiroidectomía quirúrgica y administración de 0,02% de MMI en el agua de bebida a ratas de 2 meses que se sacrificaron pasadas 3 semanas. Se emplearon 6 animales de cada grupo y para minimizar la variabilidad interindividual se hibridaron pooles de RNA de cada grupo con el chip de Affymetrix RAE 230 A, que contiene aproximadamente 15.000 genes. Los datos se analizaron con el paquete Affy de Bioconductor en la plataforma R aplicando el método RMA. Entre las 4 regiones analizadas hemos identificado (por una variación de 2 ó más) 204 genes que responden al tratamiento con T3, 165 genes fueron upregulados y 39 downregulados por la T3. El patrón de expresión muestra una diversidad de respuesta transcripcional con genes con una regulación específica de región y genes con respuesta similar a T3 en varias regiones. Varios genes candidatos se validaron mediante PCR-Cuantitativa. Los resultados del análisis mediante Gene Ontology y de estudio de la bibliografía existente definieron un amplio grupo de genes relacionados con la transmisión sináptica, componentes de la vesícula sináptica, neurotransmisores, factores de transcripción y genes implicados en memoria y potenciación a largo plazo. Mediante este estudio hemos identificado nuevos genes sensibles a la HT en el cerebro adulto, hemos probado la sensibilidad regional a la HT y abierto vías funcionales de actuación de la HT que ayuden a una mejor comprensión de la función y patología tiroidea.
80LA ADENOSINA NO SE UNE AL RECEPTOR GHS-R1A DE LA GHRELINA PERO UTILIZA PARTE DE SU MECANISMO DE SEÑALAMIENTO INTRACELULAR
M.C. Carreira*, J.P. Camiña**, O. Ischenko*, R. Alvear***, C. Lloréns-Cortés*** y F.F. Casanueva*
*Laboratorio de Endocrinología Molecular. Departamento de Medicina. Facultad de Medicina. Complejo Hospitalario Universitario de Santiago. Santiago de Compostela, **Complejo Hospitalario Universitario de Santiago de Compostela. Santiago de Compostela., ***INSERM U 691 College de France. Paris, France.
El receptor de secretagogos de hormona de crecimiento tipo 1a (GHS-R1a) es el receptor de la ghrelina y está implicado en sus acciones biológicas. En células HEK 293 transfectadas establemente con dicho receptor (HEK-GHS-R1a), la adenosina induce una movilización de (Ca2+) y a partir de los depósitos sensibles a inositol trifosfato (IP3) así como la producción de AMPc. Por lo tanto, la adenosina ha sido propuesta como un agonista parcial del GHS-R1a. Con el objeto de verificar esta hipótesis, se estudió la unión específica de 3H-adenosina en células HEK 293 y HEK-GHS-R1a observando que no era bloqueada por los antagonistas del GHS-R1a D-Lys3-GHRP-6 y {D-Arg1, D-Phe5, D-Trp7,9, D-Leu11-} substance P. El pretratamiento con un activador de la PKC, el éster de forbol PMA, bloqueó la movilización de (Ca2+)i inducido por adenosina pero no por la ghrelina. Estos resultdos, sugieren para la adenosina una funcionalidad y una unión a un dominio del receptor diferentes de la ghrelina. Experimentos de saturación de unión de adenosina marcada, mostraron el mismo número de receptores tanto en células no transfectadas como transfectadas con el receptor GHS-R1a. Estudios con real time PCR mostraron que el receptor acrivo de la adenosina era el subtipo A3 En resumen, estos resultados sugieren: 1) Que la adenosina no se une al receptor de la ghrelina. 2) Que la transfección con el receptor GHS-R1a proporciona la maquinaria celular necesaria para que el receptor A3 previamente silente se transforme en funcional. 3) Que esta activación del receptor A3 silente tras la transfección pueda implicar entrecruzamiento entre las rutas de señalamiento de los receptores A3 y GHS-R1a.
Este trabajo ha sido financiado por el FIS y el ISC III: Red de grupos (G03/028) y Red de Centros (C03/08).
81LA INDUCCIÓN DE LA APOPTOSIS POR RET, EN CÉLULAS HIPOFISARIAS ES MEDIADA POR PIT 1
C.M. Canibano Acebes, N. Rodríguez Losada, M. García Lavandeira, C. Diéguez González y C. Álvarez Villamarín
Fisiología Facultad de Medicina. Santiago de Compostela.
RET es un receptor que pertenece a la super-familia de receptores tirosina kinasa unido a un segundo receptor por el que GDNF activa RET. El receptor RET se puede presentar bajo tres isoformas diferentes. Nuestro grupo, ha descrito la presencia de cada uno de estos componentes GDNF, RET y GFRa1, en células adenohipofisarias, somatotropas, de rata y humano (Urbano, 2000. Japón, 2001). Recientemente se ha propuesto la actividad apoptótica de RET en ausencia de ligando GDNF (Bordeaux, 2000).
Objetivo: Intentar entender el mecanismo a través del cual RET promueve apoptosis y cómo GDNF es capaz de bloquear dicho efecto. Cultivo una línea celular derivada de la adenohipófisis de rata. Transfección transitoria con pcDNAFWT, pcDNARETl y pcDNARETs. Serodeprivamos y tratamos con GDNF. Comprobamos los porcentajes apoptótico. Análisis proteico y RNA. Las células RET positivas no tratadas con GDNF presentaban unos porcentajes de apoptosis 60. 75% para la isoforma larga frente a un 9% de las células tratadas con GDNF y 60,80% para la isoforma corta, frente al 17% de apoptosis de células tratadas con GDNF. Los primeros análisis por Northern Blot para Pit-1 en células transfectadas con cualquiera de las formas de RET, Pit-1 aumentaba su transcripción y su expresión. En células tratadas con GDNF, Pit-1 disminuye. Ret es un receptor que promueve apoptosis en una línea celular derivada de adenohipófisis de rata, las GH4C1. RET promueve apoptosis a traves de Pit-1 un gen hasta ahora descrito en funciones de diferenciación. GDNF un factor implicado en supervivencia celular down-regula Pit-1.
82LA SOBREALIMENTACIÓN PERINATAL EN RATAS INDUCE OBESIDAD Y RESISTENCIA A LA LEPTINA EN ESTADO ADULTO
M.J. Vázquez*, M. López*, S.A. Tovar*, L.M. Seoane**, R. Nogueiras*, R. González*, M. García*, R. Señarís* y C. Diéguez*
*Fisiología, **Medicina Fac de Medicina- Universidad de Santiago de Compostela. Santiago de Compostela.
La "programación neonatal" es un modelo clásico para el estudio del efecto de la ingesta temprana. Las ratas que crecen en camadas de pequeño tamaño ganan más peso que las ratas que crecen en camadas de tamaño normal. Sorprendentemente estas ratas obesas mantienen este fenotipo en estado adulto. El objetivo de este trabajo fue investigar el mecanismo de control hipotalámico que regula la ingesta en ratas adultas obesas producidas por ingesta perinatal. Nuestros resultados demostraron que en estas ratas se produce un fenotipo obeso y hiperleptinémico, que se mantiene en estado adulto (media de Leptina circulante 4,5 pg/mL). Sin embargo los niveles de leptina en LCR fueron similares en ambos grupos, al igual que la expresión hipotalámica de los diferentes isoformas del receptor de Leptina. (Ob-Ra, Ob-Rb, Ob-Rc, Ob-Re y Ob-Rf). Por último, la expresión de diferentes neuropéptidos orexigénicos (NPY, AgRP) y anorexigénicos, fue asimismo similar en ambos, al igual que el efecto inhibidor de a Leptina (10 µg/ rata) sobre la ingesta. En resumen, estos datos demuestran que la sobrealimentación perinatal induce un estado de hiperleptinemia a nivel de adultos sin que ello repercuta en los mecanismos hipotalámicos de la regulación de la ingesta.
83PAPEL DE LA ALDOSTERONA EN EL ESTRÉS OXIDATIVO EN RATAS ESPONTÁNEAMENTE HIPERTENSAS
N. de Las Heras, D. Sanz-Rosa, M. Miana, B. Martín, E. Cediel, P. Oubiña, V. Lahera y V. Cachofeiro
Dpto. Fisiología Facultad de Medicina, UCM. Madrid.
Objetivo: Evaluar el papel de la aldosterona sobre los cambios en el estado redox asociados a hipertensión en ratas.
Metodología: Se utilizaron ratas macho espontáneamente hipertensas (SHR; n = 24) de 20 semanas, con o sin tratamiento con el antagonista de los receptores de aldosterona, eplerenona, a dos dosis durante 10 semanas: una dosis de 30 mg/Kg/día (E-30) con un efecto pequeño sobre la presión arterial y una dosis de 100 mg/Kg/día (E-100) con un efecto antihipertensivo marcado. Un grupo de ratas normotensas (WKY; n = 8) se utilizó como control. Se midió la presión arterial sistólica (PAS), los niveles plasmáticos de malonildialdehido (MDA) y los niveles hepáticos de glutatión peroxidasa (GSHPx), glutatión reductasa (GSHRed) y el índice de glutatión reducido/glutatión oxidado (GSH/GSSG). Asimismo, se valoró la expresión génica de la subunidad p22phox de la NADPH oxidasa en la aorta.
Resultados: Los niveles elevados de presión arterial (SHR: 190,2 ± 4,2 vs WKY: 126,1 ± 1,0 mmHg; p < 0,05) se asociaron a un incremento (p < 0,05) en la concentración plasmática de MDA así como a una reducción (p < 0,05) en el índice hepático GSH/GSSG. Además, las SHR presentaron un aumento en los niveles hepáticos de GSHRed y una reducción en los de GSHPx. La expresión de la subunidad p22phox fue mayor (p < 0,05) en la aorta de las SHR que en las WKY. El tratamiento con eplerenona disminuyó la PAS de manera dosis dependiente (184,6 ± 1,7 mmHg and 156,3 ± 2,8 mmHg, E-30 and E-100, respectivamente). Ambas dosis de eplerenona redujeron (p < 0,05) los niveles plasmáticos de MDA e incrementaron significativamente el índice hepático GSH/GSSG en SHR. Sin embargo, ninguna de las dosis fue capaz de modificar el efecto de la hipertensión sobre la concentración hepática de GSHRed o GSHPx. Eplerenona redujo los niveles aórticos de RNAm de la subunidad p22phox independientemente de la dosis.
Resumen y conclusiones: La SHR presenta un aumento en el estrés oxidativo no sólo como consecuencia de una mayor producción de aniones superóxido vasculares sino también por una reducción en la defensa antioxidante sistémica. La aldosterona juega un papel importante en el estrés oxidativo de la SHR, ya que el tratamiento con un antagonista de sus receptores se asocia a una reducción de éste.
84PAPEL DE LAS CÉLULAS DE KUPFFER EN EL EFECTO INHIBIDOR DE LA SEPSIS SOBRE LA SÍNTESIS HEPÁTICA DEL IGF-I
M. Granado García*, T. Priego Cuadra*, A.I. Martín**, M.A. Villanua Bernues* y A. López-Calderón Barreda*
*Dpto. de Fisiología Facultad de Medicina (UCM). Madrid, **Dpto. CC Morfológicas y Fisiología Universidad Europea. Villaviciosa de Odón.
El LPS ha sido ampliamente utilizado como modelo experimental de estrés inflamatorio. Diversos estudios demuestran que la administración de esta endotoxina produce una inhibición de la síntesis hepática y de los niveles séricos del IGF-I. El hígado, además de degradar el LPS, produce citoquinas y radicales libres en respuesta a su exposición y ésta es una respuesta que median principalmente las células de Kupffer. El objetivo de nuestro trabajo fue analizar el papel de las células de Kupffer en el efecto inhibidor del LPS sobre la síntesis hepática del IGF-I. Para ello realizamos: 1) cultivos primarios de hepatocitos y 2) cultivos primarios de hepatocitos y células no parenquimatosas (NP) a los que les añadimos distintas concentraciones de LPS (0,01, 0,1, 1, 10 µg/ml). Como índice inflamatorio valoramos la liberación de óxido nítrico (NO) al medio de cultivo. Tanto en cultivos de hepatocitos como en cocultivos de hepatocitos y células NP la administración de LPS produjo un aumento en la liberación de NO al medio de cultivo a todas las concentraciones estudiadas (P < 0,01). El LPS disminuyó la expresión del gen del IGF-I en cultivos de hepatocitos a partir de la concentración de 0,1µg/ml (P < 0,01). El efecto inhibidor del LPS sobre la expresión del gen del IGF-I fue mayor cuando se cultivaron hepatocitos junto con células NP. Para estudiar in vivo el efecto de los macrófagos en esta inhibición, administramos un inactivador de los macrófagos como es el Gadolinio (10 mg/kg i.v.) 24 horas antes de la administración de LPS (1 mg/kg i.p.). Observamos que el pretratamiento con gadolinio previno la inhibición, tanto de los niveles séricos (P < 0,01) como del contenido hepático de IGF-I (P < 0,01). Podemos concluir, por tanto, que las células tipo macrófago potencian la inhibición del IGF-I inducida por la administración del LPS.
Este trabajo ha sido financiado por la CAM (0,82/0017/2003 1) y por una beca a Miriam Granado (FPU, AP2003-2564) y a Teresa Priego (FPU, AP2001-0053).
85PIT-1 REGULA LA EXPRESIÓN DE PROLACTINA EN CÉLULAS DE ADENOCARCINOMA MAMARIO HUMANO
I. Ben Batalla*, V. Centeno Kabusch*, C. Segura Iglesias** y R. Pérez Fernández*
*Dpto. Fisiología, **Dpto. Ciencias Morfológicas Facultad de Medicina. Santiago de Compostela.
Introducción: La prolactina (PRL) es una hormona que se sintetiza y secreta principalmente en las células lactotropas de la hipófisis anterior. También ha sido identificada su expresión en otros tejidos, entre los que se encuentra la glándula mamaria. En este tejido, junto a otras hormonas, actúa sobre el desarrollo de las mamas durante el embarazo y en la preparación de éstas para la secreción de leche durante la lactancia. A nivel hipofisario el factor de transcripción Pit-1 es imprescindible para la transcripción de los genes de la hormona de crecimiento (GH) y PRL. Trabajos previos de nuestro grupo, han demostrado que Pit-1 también se expresa en mama normal y tumores de mama humanos, siendo su expresión significativamente superior en tumores. Además, en este tejido, Pit-1 regula la expresión de GH. Dado que el incremento de expresión de GH y PRL a nivel mamario ha sido relacionado con el aumento de proliferación celular, y por tanto con la aparición y/o desarrollo del cáncer de mama, en este trabajo estudiaremos si la expresión de PRL en la línea celular de adenocarcinoma de mama humano (MCF-7) es regulada, al igual que GH, por el factor de transcripción Pit-1.
Materiales y métodos: Se utilizó la línea celular MCF-7. Las células se transfectaron con el plásmido de expresión de Pit-1 (pRSV-Pit-1) y se cuantificó la expresión de PRL a las 24, 48 y 72 horas. La determinación de ARNm de PRL se realizó por PCR en tiempo real y el análisis de la proteína por Western blot.
Resultados: La sobreexpresión del factor de transcripción Pit-1 incrementó significativamente los niveles de ARNm de PRL a 24, 48 y 72 horas. Además, la expresión proteica de PRL también aumentó en respuesta a la sobreexpresión de Pit-1.
Conclusiones: El factor de transcripción hipofisario Pit-1 regula la expresión a nivel transcripcional y traduccional de PRL en la línea celular de adenocarcinoma de mama humana, MCF-7.
Trabajo financiado por la Xunta de Galicia (PGIDIT03 PXIB20802PR) y FIS (PI040518).
86PIT-1 REGULA LA EXPRESIÓN DEL RECEPTOR DE VITAMINA D
V. Centeno Kabusch*, S. Seoane Ruzo*, C. Segura Iglesias** y R. Pérez Fernández*
*Dpto. Fisiología, **Dpto. Ciencias Morfológicas Facultad de Medicina. Santiago de Compostela.
La 1,25 dihidroxivitamina D3 [1,25 (OH) 2 D3] es una hormona que ejerce sus acciones biológicas mediante la unión a su receptor nuclear, el receptor de vitamina D (VDR), el cual se une a secuencias específicas de ADN denominadas elementos de respuesta, modulando de esta forma la transcripción de genes específicos. 1,25 (OH) 2 D3 regula la homeostasis mineral y otras acciones celulares, alguna de ellas involucradas en la proliferación y diferenciación celular. Pit-1 es un factor de transcripción imprescindible para la transcripción hipofisaria de genes como la hormona de crecimiento (GH) y prolactina (PRL), desempeñando además una función determinante en la diferenciación celular durante el desarrollo de la hipófisis anterior. Se encuentra mayoritariamente en hipófisis, aunque estudios recientes lo han identificado en otros tejidos, como en mama, tanto normal como tumoral, así como en la línea celular de adenocarcinoma de mama humano (MCF-7). Dado que ha sido demostrado que en la región promotora del gen que codifica el receptor de vitamina D (VDR) existe una zona de unión para Pit-1, el objetivo de este trabajo fue estudiar el efecto de la sobreexpresión de Pit-1 sobre la expresión de VDR en la línea celular MCF-7. Se realizaron transfecciones transitorias con el plásmido de expresión pRSV-Pit-1 y pCMV-hVDR (utilizado como control positivo) durante 48 horas en la línea celular MCF-7. La cuatificación de ARNm de VDR se realizó mediante Real Time PCR y Northern blot y el análisis proteico mediante Western blot. La sobreexpresión de Pit-1 incrementó de forma significativa tanto los niveles de ARNm que codifica para VDR como la expresión de la proteína. Es probable que Pit-1 sea un regulador importante de la expresión de VDR a nivel transcripcional en las células de adenocarcinoma de mama humano. Posteriores estudios son necesarios para confirmar esta hipótesis.
Trabajo financiado por la Xunta de Galicia (PGIDIT03 PXIB20802PR) y FIS (PI040518).
87P27KIP1 Y P130RB2 SON ESENCIALES PARA EL RECLUTAMIENTO DE PROGENITORES ANGIOGÉNICOS POR EL VEGF
A. Vidal1, S. Zacharoulis2, D. Shaffer3, A. Bramley2, N. Yeh3, L. Frohman4, D. Lyden2 y A. Koff3
1Dpto. Fisioloxia. Fac. Medicina. Univ. Santiago de Compostela. Santiago de Compostela., 2Dpto. Pediatrics. Weill Medical College at Cornell University. New York, Usa., 3Molecular Biology Program. Memorial Sloan-Kettering Cancer Center. New York, Usa, 4Section of Endocrinology. University of Illinois. Chicago, Usa.
Una rápida revascularización es fundamental para restablecer el funcionamiento de órganos dañados, isquémicos o en regeneración. Este proceso de neo-angiogénesis requiere la participación de células madre derivadas tanto de la médula ósea como del parénquima vascular. Uno de los factores angiogénicos de más amplia distribución es el VEGF, que induce la expansión y el reclutamiento a lugares de neovascularización de dos poblaciones de células de la médula ósea: una subpoblación de células madre mieloides que expresan el receptor tipo 1 (VEGFR1) y progenitores endoteliales, que son positivos para el VEGFR2. Sin embargo, los mecanismos moleculares que median los efectos endocrinos del VEGF sobre proliferación, migración y diferenciación de los progenitores angiogénicos son desconocidos. En este estudio establecemos que los inhibidores de ciclo celular p27Kip1 y p130Rb2 actúan como mediadores en la respuesta angiogénica al VEGF. La inyección de adenovirus productores de VEGF (AdVEGF) en ratones induce una rápida movilización de progenitores VEGFR1+ y VEGFR2+ de la médula ósea a la circulación periférica, donde son detectados por citometría de flujo multiparamétrica. Ratones deficientes para p27 o p130 son capaces de responder del mismo modo al VEGF. Sin embargo, los ratones doble knockout para p27 y p130 (DKO) presentan una respuesta muy disminuida al VEGF, con niveles de progenitores circulantes casi indetectables. Mientras que en médula ósea la inyección de AdVEGF causa un incremento en el número de progenitores VEGFR1+ en ratones wiltype o KO simple, en los DKO este incremento no se produce. Este defecto en expansión es autónomo celular, ya que puede ser recuperado por transplante de médula ósea control a animales DKO irradiados. Sin embargo, aun en animales con médula reconstituida donde los progenitores angiogénicos son capaces de proliferar, éstos son incapaces de movilizarse a sangre periférica. Este defecto en movilización se asocia con un incremento en la expresión de SDF-1 en el estroma medular y el correspondiente aumento de células CXCR4+ en la región adyacente. En contraste, la fracción de osteoblastos fusiformes N-cadherina+, que contribuye a la expansión global de las células madre hematopoyéticas, no está afectada y, consecuentemente, los animales DKO muestran contajes normales de células sanguíneas, así como una cinética normal de recuperación tras mielosupresión inducida por fluorouracilo. Nuestros resultados identifican dos inhibidores del ciclo celular como moléculas esenciales en la angiogénesis inducida por VEGF y apoyan la visión de que la regulación del ciclo celular es crítica para el destino biológico de las células madre.
88RECEPTORES DE ADIPONECTINA EN RATA: DISTRIBUCIÓN, EXPRESIÓN Y REGULACIÓN EN AYUNO Y DESARROLLO POSTNATAL
C.R. González Diéguez, M.J. Vázquez Villar, S. Tovar Carro, R. Nogueiras Pozo y C. Diéguez González
Departamento de Fisiología Facultad de Medicina, USC. Santiago de Compostela.
La Adiponectina (ACRP30) es una hormona principalmente producida en el tejido adiposo y con efectos antidiabéticos y anti-aterogénicos. Han sido descrito dos receptores: AdipoR1 y AdipoR2, con mayor expresión en Músculo e Hígado, respectivamente. Hemos realizado un estudio de la expresión de los mismos en la rata, tanto de su distribución en los distintos tejidos, su respuesta al ayuno y en las distintas etapas del crecimiento de la rata. Lo primero que detectamos fue la expresión de AdipoR1 en sangre, por lo que nos centramos en el estudio AdipoR2. Su distribución en los tejidos es de mayor a menor expresión: hígado, adiposo blanco, pulmón, estómago, adrenal, yeyuno, adiposo pardo. En ayuno su expresión desciende a medida que aumenta el tiempo de restricción, a excepción del estómago. Durante las distintas etapas del desarrollo postnatal solo existen cambios de AdipoR2 en el hígado de las ratas macho, mientras que no hay diferencias de expresión entre ambos sexos. Sin embargo en el tejido adiposo blanco si existe un cambio de la expresión durante el desarrollo postnatal tanto en machos como en hembras, aunque no existen diferencias entre ambos sexos. Concluimos por tato que la regulación de la expresión en el tejido de la rata tanto en el ayuno como en las distintas etapas del desarrollo postnatal, es tejido-específica.
89SEGURIDAD DE PIOGLITAZONA EN COMBINACIÓN CON SULFONILUREAS O METFORMINA. SEGUIMIENTO A 12 MESES DEL ESTUDIO ECLA
P. García Polavieja, J. Reviriego Fernández, I. Julián Ortega y Á. Rodríguez Bernardino
Departamento de Investigación Clínica Lilly, S.A. Alcobendas. Madrid. Grupo del Estudio ECLA.
Objetivo: Evaluar el cambio en el peso, índice de masa corporal (IMC) y alaninoaminotransferasa sérica (ALT), así como la incidencia de episodios hipoglucémicos en pacientes con diabetes mellitus tipo 2 (DM2) cuyos datos se recogieron para un estudio observacional llevado a cabo en España. El estudio se diseñó para evaluar la efectividad de pioglitazona (PIO) en combinación con sulfonilureas (SU) o metformina (MET) y la de la combinación SU+MET en cuanto al control glucémico, perfil lipídico y presión arterial en pacientes con DM2 tratados en un entorno clínico habitual.
Métodos: Estudio Fase IV, observacional, prospectivo, multicéntrico, no intervencionista, de un año de duración de acuerdo con la legislación vigente. Se obtuvieron datos basales de 2465 pacientes. Tras excluir aquellos casos en los que no existían datos de seguimiento o violación de los criterios de entrada, 2294 pacientes fueron evaluados: 851 (37%) con PIO+SU, 723 (32%) con PIO+MET y 720 (31%) con SU+MET. Se llevó a cabo un análisis de la covarianza incluyendo en el modelo el tratamiento y el valor basal como covariables, y como variable independiente el cambio desde el valor basal al último valor registrado.
Resultados: Los cambios medios tras 12 meses se muestran como MMC ± EEM.
Los abandonos relacionados con los efectos adversos fueron similares entre los distintos grupos (1,76% para PIO+SU, 2,48% para PIO+MET y 1,38% para SU+MET). Los episodios hipoglucémicos a lo largo del estudio fueron significativamente menos frecuentes en el grupo de PIO+MET (5,4%) en comparación con PIO+SU y SU+MET (9,4% y 9,6% respectivamente; p < 0,01 en ambos casos).
Conclusión: Aunque no se pueden descartar sesgos debido a la elección del tratamiento por el investigador, PIO+SU se asoció con aumentos de peso y BMI estadísticamente significativos en pacientes con DM2 en el entorno clínico habitual, en comparación con aquellos que recibieron PI+MET o SU+MET. Se observó un descenso significativo del peso en el grupo de SU+MET. Todos los grupos de tratamiento se asociaron a mejorías en los valores de ALT, no existiendo diferencias significativas entre ellos. La frecuencia de episodios hipoglucémicos fue similar para los grupos de PIO+SU y SU+MET, y significativamente menor para PIO+MET.
90VALORACIÓN CLÍNICA Y GENÉTICA DEL SÍNDROME DE TURNER
T. Arévalo Saade, F. Vasconcelos Espada, P. Cabanas Rodríguez, L. Castro Feijoo, M. López Franco, J. Barreiro Conde y M. Pombo Arias
Unidad de Endocrinología Pediátrica, Crecimiento y Adolescencia Hospital Clínico Universitario de Santiago de Compostela. Santiago de Compostela.
Introducción: El Síndrome de Turner (ST) es un desorden genético asociado a anomalías de los cromosomas sexuales, con incidencia de 1/2000 2500 nacidos vivos, fenotípicamente niñas. Entre sus características destacan: rasgos dismórficos, disgenesia gonadal y en el 95% una importante afectación de la talla constituyendo una de las indicaciones de GH.
Objetivos: Evaluar de las características epidemiológicas y clínicas del ST. Valorar de la respuesta terapéutica al tratamiento con GH.
Material y métodos: Estudio retrospectivo de pacientes diagnosticadas de ST (enero 1984 a diciembre 2004). Se evaluaron aspectos demográficos, características clínicas, cariotipo (FISH) y crecimiento. Análisis estadístico: SPSS 11.0.
Resultados: Se diagnosticaron 36 pacientes. La primera consulta se realizó a los 7,6 años ± 4,1, siendo la talla baja el principal motivo de consulta. La edad media de diagnóstico fue 5,6 años ± 4,5. En el cariotipo (FISH) se evidencia: monosomía (45, X): 25%, mosaicismo: 50% y mosaico triple o complejo: 25%. Los rasgos clínicos más frecuentes son: 1. Obstrucción linfática: pterigium coli (51,6%), cabello y pabellones auriculares de implantación baja (41,9%), uñas hiperconvexas (25,8%), Linfedema de manos y pies (19,4%); 2. Trastornos del crecimiento esquelético: talla baja (67,7%), paladar ojival (74,2%) y cúbitus valgo (25,8%); 3. Otros hallazgos clínicos: tórax ancho (61,3%), mamilas lateralizadas (54,8%), estrabismo (38,7%), nevos (9,7%) e hipoacusia (9,7%); 4. Factores embriogénicos: anomalías renales (5,5%) y cardiovasculares (16,7%); 5. Otros trastornos endocrinológicos asociados: hipotiroidismo (11,1%), osteoporosis (8,3%), transaminasas elevadas y carcinoma papilar de tiroides; 6. Tratamiento con GH: el promedio de edad de inicio fue a los 8 años ± 3,1. El 61% cumplió tratamiento durante 7 años y alcanzó una talla final media de 146,9 cm. ± 6,3.
Conclusiones: El principal motivo de consulta así como el rasgo fenotípico más frecuente fue el retraso de crecimiento, sugiriendo la importancia del cariotipo en el estudio de la paciente con talla baja. La Técnica de FISH permitió constatar que la mayoría de cariotipos Turner son mosaicismos. La respuesta al tratamiento con GH ha sido similar al reportado en otros estudios, con una ganancia aproximada de 4 cms.