La dislipemia se relaciona frecuentemente con el síndrome metabólico, proceso de elevado riesgo cardiovascular. En ocasiones, el tratamiento con estatinas no es suficiente para alcanzar las concentraciones plasmáticas de lípidos recomendadas. El objetivo del estudio fue evaluar el efecto de ezetimiba administrado con estatinas en el perfil lipídico de pacientes dislipémicos que no alcanzaron los objetivos deseables sólo con estatinas, así como valorar la acción sobre parámetros de riesgo cardiovascular y su tolerancia.
MétodosEstudio descriptivo, prospectivo, realizado en 50 pacientes hipercolesterolémicos consecutivos mal controlados sólo con estatinas, en los que se valora la mejoría del perfil lipídico y las concentraciones de insulina, ferritina y homocisteína plasmáticos tras tratamiento combinado con ezetimiba al cabo de 3 meses.
ResultadosSe observó una disminución de las lipoproteínas de baja densidad (p<0,001), con una reducción media del colesterol total (p<0,001) y de los triglicéridos (p=0,002), así como la de las concentraciones plasmáticas de ferritina (p=0,016), insulina (p=0,010) y homocisteína (p < 0,001), con una reducción porcentual en las concentraciones del 5, el 5 y el 14%, respectivamente. No se objetivaron modificaciones en los parámetros de función hepática ni muscular.
ConclusionesLa coadministración de ezetimiba y estatina mejoró, de forma marcada y significativa, el perfil lipídico en pacientes con hipercolesterolemia mal controlada con estatinas, sin efectos deletéreos en los parámetros hepáticos o musculares y es probable que pueda acompañarse de efectos beneficiosos adicionales en las concentraciones plasmáticas de homocisteína, insulina y ferritina.
Dyslipidemia is frequently related to metabolic syndrome, which carries high cardiovascular risk. Statin therapy sometimes fails to achieve the recommended plasma lipid targets. The aim of this study was to evaluate the joint effect of ezetimibe and statin on lipid profile in dyslipidemic patients not achieving target values with statins alone and to determine the action of this combination on cardiovascular risk parameters, as well as its tolerability.
MethodsWe performed a descriptive prospective study in 50 consecutive hypercholesterolemic patients treated with statin alone and with poor metabolic control. Lipid profile and plasma concentrations of insulin, ferritin and homocysteine were evaluated after 3 months of combined treatment with ezetimibe.
ResultsWe found a significant reductionin low density lipoproteins (p<0.001), a mean reduction in total cholesterol (p<0.001) and triglycerides (p=0.002), as well as decreases in plasma concentrations of ferritin (p=0,016), insulin (p=0,010) and homocysteine (p<0.001) of 5%, 5% and 14%, respectively. There were no changes in either hepatic or muscular function.
ConclusionsCombined treatment with ezetimibe and statin significantly improved lipid profile in poorly-controlled hypercholesterolemic patients treated with statin alone. There were no collateral effects on either hepatic or muscular parameters and there may be additional benefits on plasma levels of homocysteine, insulin and ferritin.
La dislipemia es un factor importante de riesgo cardiovascular. Se caracteriza por un aumento en las concentraciones plasmáticas de triglicéridos (TG), colesterol total (CT), colesterol de las lipoproteínas de baja densidad (cLDL) y una disminución del colesterol de las lipoproteínas de alta densidad (cHDL). En ocasiones, el tratamiento con estatinas, inhibidores de la hidroximetilglutaril-coenzima A reductasa, no es suficiente para alcanzar las concentraciones de LDL recomendadas por el National Cholesterol Education Program-Adult Treatment Panel III (NCEP-ATP III)1, bien por mala respuesta del paciente o bien por intolerancia hepática (elevación de las transaminasas) o muscular (mialgias o rabdomiólisis). Por ello, es necesario buscar nuevas alternativas terapéuticas.
La ezetimiba es un nuevo hipocolesterolemiante, el primer inhibidor de la absorción de colesterol alimentario y biliar en la pared intestinal. No interfiere en la absorción de otras sustancias, como vitaminas liposolubles, ácidos grasos, ácidos biliares o triglicéridos2-4. Por lo tanto, tiene un mecanismo de acción distinto del de las estatinas, por lo que su coadministración logra la doble inhibición de la absorción y la síntesis de colesterol, que da lugar a mayores reducciones en sus concentraciones plasmáticas, que pueden llegar a ser del 50% e incluso del 5% en los triglicéridos5.
Es probable que la ezetimiba, además, pueda tener un efecto beneficioso en la resistencia a la insulina en pacientes con dislipemia, asociada o no a obesidad6-8, así como en otros marcadores de riesgo cardiovascular, como la ferritina y la homocisteína9, 10.
El objetivo del presente estudio fue evaluar el efecto del tratamiento con ezetimiba (10mg/día), asociada a estatinas, en el perfil lipídico en pacientes dislipémicos que no alcanzaron los objetivos deseables sólo con el tratamiento con estatinas, así como valorar la acción sobre otros parámetros de riesgo cardiovascular y su tolerancia.
MÉTODOSSe trata de un estudio descriptivo, prospectivo, realizado en 50 pacientes hipercolesterolémicos consecutivos, seguidos en la consulta de medicina interna y endocrinología del Hospital Clínico Universitario de Valladolid, que habían sido remitidos desde atención primaria u otras especialidades. Todos los pacientes tenían más de 18 años de edad. No se incluyó a las embarazadas. Habían sido diagnosticados de dislipemia según los criterios del NCEP-ATP III1 y tratados con estatinas durante al menos 3 meses previamente a la coadministración de ezetimiba, el 75,8% con atorvastatina (el 37,1% con una dosis de 40mg, el 11,3% con 80mg y el 27,4% con 20mg), el 21% con 40mg de fluvastatina y el 3,2% con 40mg de simvastatina, y mantenían concentraciones elevadas de CT y de cLDL a pesar del tratamiento. El 90% tenía diabetes mellitus tipo 2 (DM2) bien controlada, ninguno tratado con insulina. Todos firmaron el formulario de consentimiento informado.
Los pacientes incluidos en el estudio disponían de un perfil lipídico anterior a la coadministración de ezetimiba. El segundo control analítico se realizó a los 3 meses tras la coadministración de 10mg diarios de ezetimiba por vía oral y estatina, no se modificó la dosis de ésta durante el tiempo del estudio.
La variable de valoración principal fue el porcentaje de reducción de las concentraciones plasmáticas de CT, LDL y TG, así como el incremento en las concentraciones de cHDL. Como variables secundarias se evaluaron las modificaciones de homocisteína, ferritina e insulina plasmáticas, así como las variaciones de las transaminasas hepáticas, aspartatoaminotransferasa (AST) y alaninaminotransferasa (ALT) y creatincinasa (CPK) séricas.
Las concentraciones de insulina plasmática se determinaron mediante radioinmunoanálisis, los de glucosa por método enzimático colorimétrico y la microalbuminuria por inmunoturbidimetría. El resto de los parámetros bioquímicos se determinaron mediante un autoanalizador Hitachi.
Análisis estadísticoSe resumen las variables cualitativas con su distribución de frecuencias y las variables cuantitativas como media y desviación estándar (DE). Se contrasta la media de las diferencias de los parámetros estudiados con la prueba de la t de Student para datos apareados. Se presentan los efectos absolutos y su intervalo de confianza del 95%. Se rechaza la hipótesis nula con un error alfa menor de 0,05. El paquete estadístico utilizado fue el programa SPSS versión 12.0.
RESULTADOSLa media de edad de los pacientes fue 50,7 ± 2,3 años. Todos presentaban dislipemia tratada con una estatina a dosis variables (el 62% con atorvastatina, el 30% con fluvastatina y el 8% con simvastatina) y mal controlada. El 90% habían sido diagnosticados de DM2 y seguían tratamiento oral, con buen control glucémico durante el estudio.
La concentración media y la desviación estándar de las variables estudiadas antes y después del tratamiento con ezetimiba se exponen en la tabla 1.
Concentraciones plasmáticas de homocisteína, insulina y ferritina: efecto adicional con la administración de ezetimiba junto con el tratamiento ya iniciado con otras estatinas
| Pre-EZE | Post-EZE | Cambio absoluto | P | |
| CT (mg/dl) | 304,8 ± 35,8 | 199,3 ± 36,3 | −105,5 | < 0,001 |
| cHDL (mg/dl) | 55,6 ± 16,2 | 57,5 ± 17,2 | +1,9 | 0,3 |
| cLDL (mg/dl) | 209,2 ± 36,7 | 125,1 ± 37,0 | −84,1 | < 0,001 |
| TG (mg/dl) | 159,1 ± 104,7 | 120,5 ± 42,7 | −38,6 | 0,002 |
| AST (UI/l) | 28,6 ± 8,2 | 28,6 ±8,2 | 0 | 0,93 |
| ALT (UI/l) | 37 ±13,3 | 36 ±14,7 | −1,0 | 0,48 |
| CPKa (UI/l) | 138,8 ± 154,9 | 109,1 ± 43,8 | −32,7 | 0,1 |
| Homocisteínab (mmol/l) | 12,08 ± 6,1 | 9,93 ± 5,0 | −2,15 | < 0,001 |
| Insulinab (mU/ml) | 7,9 ± 5,5 | 6,9 ±3,9 | −1,0 | 0,010 |
| Ferritina (mg/dl) | 117,2 ±81,2 | 107,1 ±74,9 | −10,1 | 0,016 |
ALT: alaninaminotransferasa; AST: aspartatoaminotransferasa; cHDL: colesterol de las lipoproteínas de alta densidad; cLDL: colesterol de las lipoproteínas de baja densidad; CPK: creatincinasa; CT: colesterol total; Post-EZE: tras la administración de ezetimiba; Pre-EZE: antes de coadministrar ezetimiba; TG: triglicéridos.
Es de destacar la disminución significativa de las concentraciones plasmáticas del cLDL (p < 0,001), el CT (p < 0,001) y los TG (p = 0,002), así como las de ferritina (p = 0,016), insulina (p = 0,010) y homocisteína (p < 0,001) con una reducción porcentual en los valores del 5, el 5 y el 14%, respectivamente.
No se apreciaron modificaciones significativas en las concentraciones séricas de AST, ALT ni CPK.
DISCUSIÓNLa aterosclerosis es la principal causa de mortalidad en nuestro medio. Su desarrollo se encuentra estrechamente relacionado, entre otros factores de riesgo, con las concentraciones elevadas de lípidos plasmáticos y, fundamentalmente, con las de LDL. Por ello, está hoy bien establecido que la hiperlipemia es un factor de riesgo para la aterosclerosis.
Las estatinas han demostrado ser eficaces para reducir la síntesis de colesterol hepático, pero a veces no son suficientes para conseguir un buen control lipídico. Recientemente se ha demostrado que la ezetimiba, primer inhibidor conocido de la absorción del colesterol alimentario y biliar a través de la pared intestinal, puede ser un buen coadyuvante de las estatinas para conseguir este objetivo.
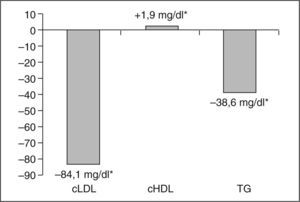
En este estudio el cotratamiento con ezetimiba, en pacientes que precisaban un mayor control lipídico por no llegar a los objetivos exigibles sólo con estatinas, ha resultado claramente efectivo, ya que consiguió una reducción media, entre su valor basal y a los 3 meses de tratamiento, del cLDL del 40,2%. Se acompañó de reducciones significativas del CT y los TG, sin incremento significativo en las concentraciones de cHDL (fig. 1). Estos resultados están en concordancia con los obtenidos por la mayoría de los autores, en otros estudios, que encuentran reducciones de LDL entre un 13,8 y un 25,1% y menor de los TG, del 7,5 al 14%11-14, y un incremento mínimo, aunque significativo, del cHDL, incluso en pacientes con alto riesgo cardiovascular, como los portadores de síndrome metabólico asociado15.
Cambio medio de los parámetros lipídicos tras 3 meses de tratamiento con ezetimiba 10mg coadministrado con el tratamiento en curso con estatinas. CT: colesterol total. cHDL: colesterol de las lipoproteínas de alta densidad; cLDL: colesterol de las lipoproteínas de baja densidad; TG: triglicéridos. *p < 0,001 frente a valores previos.
Se sabe que existe una correlación negativa entre las partículas de LDL y la concentración de triglicéridos plasmáticos y positiva con los valores de HDL, y que la enzima de transferencia de esteres de colesterol media en la transferencia de éstos desde las HDL y LDL a las lipoproteínas ricas en triglicéridos y la transferencia de triglicéridos en dirección opuesta16.
Los inhibidores de la absorción del colesterol reducen el contenido de éste en los quilomicrones, lo que puede llevar indirectamente a una disminución de las LDL y a la inhibición de la enzima de transferencia de esteres de colesterol.
Aunque la mejoría es evidente con el tratamiento combinado, hay que resaltar que en esta serie de pacientes, en la que el 90% presentaban DM2 y, por lo tanto, elevado riesgo cardiovascular, no se llega a alcanzar, aunque se aproximan a ellos, los objetivos deseables en las concentraciones plasmáticas de las LDL, que debieran ser inferiores a 100mg/dl e incluso a 70mg/dl como proponen las diferentes guías. Es probable que pueda ser debido, entre otras circunstancias, al corto tiempo de tratamiento.
Es interesante resaltar que la coadministración de ezetimiba y estatinas no modificó de forma significativa las concentraciones de enzimas hepáticas ni musculares y que fue bien tolerada por todos los pacientes de este grupo, ya que ninguno de ellos suspendió ni redujo la dosis de medicación. En la literatura hay datos contradictorios en este sentido. Aunque la mayoría no encuentra elevación de la AST y la ALT en grupos tratados con estatinas en monoterapia frente a la asociación de estatinas y ezetimiba11, 17-20, otros estudios21 sí que detectan elevación de las enzimas hepáticas en los tratados sólo con estatinas, y otros, en los tratados con la asociación estatinas-ezetimiba22. Dado que los diferentes estudios no son comparables por las dosis de estatinas utilizadas, es probable que pudiera haber una relación dependiente de la dosis.
Debido a que en la patogenia de la aterosclerosis intervienen otros muchos factores de riesgo, además de las concentraciones plasmáticas de lípidos, se creyó oportuno estudiar las modificaciones que el tratamiento combinado estatinas-ezetimiba tenía sobre algunos de ellos, como la insulina (por presentar la mayoría de los pacientes estudiados una DM2 y, por lo tanto, resistente a la insulina), la homocisteína (por correlacionarse bien con las concentraciones elevadas de colesterol y triglicéridos)9 y la ferritina; en este estudio se pudo observar una reducción significativa en las concentraciones plasmáticas de todos ellos, según las cifras basales, y preferentemente de la homocisteína.
Se sabe que la reducción de los lípidos plasmáticos con algunas estatinas, como la pravastatina, mejora la sensibilidad a la insulina en pacientes dislipémicos con síndrome metabólico e incluso podría disminuir el riesgo para desarrollar DM223, al igual que sucede con otras sustancias, como las glitazonas, sensibilizadoras de la insulina en los receptores PPARγ (peroxisome proliferation activated receptor)24, 25. Este hecho no ha sido, hasta ahora, demostrado con ezetimiba. Recientemente González-Ortiz et al26, al estudiar la sensibilidad a la insulina mediante la técnica del clamp euglucémico-hiperinsulinémico en 12 pacientes obesos dislipémicos, no encontraron diferencias significativas entre los tratados con ezetimiba y el grupo control tras 90 días de tratamiento, al igual que otros autores27.
La elevación de la homocisteína en plasma se correlaciona bien con las concentraciones elevadas de colesterol y triglicéridos9, de tal manera que su reducción se acompaña de una disminución de la serie lipídica, demostrada tanto clínica como experimentalmente28. Este hecho no está suficientemente explicado. Se supone que el aumento de producción de la lisofosfatidilcolina (lisoPC) durante la modificación de las LDL y la habilidad de la homocisteína para promover la producción hepática de colesterol pudiera justificarlo9. En el presente estudio los valores de homocisteína se han reducido de forma significativa, lo que daría una mayor potencia a esta asociación para la disminución del riesgo cardiovasular.
Con respecto a las cifras de ferritina no hemos encontrado en la literatura estudios en un sentido o en otro.
Estos interesantes y novedosos hallazgos, de ser confirmados en estudios aleatorizados y controlados, con un mayor número de pacientes, podrían aportar nuevas y adicionales perspectivas sobre los beneficios del tratamiento con ezetimiba29, sobre todo por el potencial efecto protector cardiovascular en pacientes de alto riesgo como los portadores de síndrome metabólico y resistencia a la insulina30, 31.
La coadministración de ezetimiba y estatina, una estrategia terapéutica que inhibe a la vez la absorción intestinal del colesterol y su síntesis hepática, mejoró de forma marcada y significativa el perfil lipídico en pacientes con hipercolesterolemia en la práctica clínica habitual, sin efectos deletéreos en los parámetros hepáticos o musculares y podría acompañarse de efectos beneficiosos adicionales en las concentraciones plasmáticas de homocisteína, insulina y ferritina.