El elevado riesgo cardiovascular que presentan los enfermos con nefropatía crónica impulsa a extremar el control de los factores de riesgo convencionales. Recientes estudios indican que, para el control lipídico, la combinación de una estatina con ezetimiba podría suponer un beneficio en esta población específica.
Material y métodosDesde septiembre de 2011 hasta septiembre de 2014 se incluyó a pacientes en seguimiento con enfermedad renal crónica estadio 3-4 que no alcanzaban cifras óptimas lipídicas con una estatina en monoterapia. Fueron incluidos 22 pacientes, con una edad media de 67±8 años. La mitad de los enfermos eran fumadores, un 68% eran diabéticos y todos recibían tratamiento antihipertensivo.
ResultadosSe realizaron controles basales, a los 6 meses y al año de seguimiento. El colesterol medio total basal y al año fue: 202±39mg/dl vs. 147±38 (p: 0,001), los niveles de LDL, HDL y triglicéridos, basales y al año fueron respectivamente: 123±27 vs. 73±28 (p: 0,0005), 45±12 vs. 49±11 (p: n.s) y 195±104 vs. 131±57mg/dl (p: n.s.). El filtrado glomerular estimado medio basal fue: 37±14ml/min y al año: 37±13ml/min (p: n.s), la MAU/Cr. basal fue de 679 vs. 523mg/g al año (p: n.s).
ConclusionesLa combinación de simvastatina con ezetimiba en pacientes con enfermedad renal crónica parece ser eficaz en el control lipídico y, al menos en este periodo de seguimiento, no se ha detectado ningún efecto secundario severo asociado. Es necesario un periodo mayor de seguimiento para poder evidenciar una reducción del riesgo cardiovascular asociado a un mayor control de las cifras lipídicas.
Maximizing the control of conventional risk factors should be crucial in patients with chronic kidney disease due to their high cardiovascular risk. Recent studies suggest that lipid control using the combination of a statin and ezetimibe may have benefits in this specific population.
Material and methodsFrom September-2011 to September-2014, 22 patients with chronic kidney disease, stage 3-4 who did not reach optimal lipid levels in monotherapy with statin were included in the study. Mean age 67±8 years. Half of the patients were smokers, 68% were diabetic and all of them received hypertensive treatment.
ResultsBaseline, 6 months and one year follow-up controls were performed. Total cholesterol mean baseline and at one year was 202±39mg/dl and 147±38 (P=.001), LDL, HDL and triglycerides baseline and at one year were as follows respectively: 123±27 vs. 73±28 (P=.0005), 45±12 vs. 49±11 (P=n. s.) and 195±104 vs. 131±57mg/dl (P=n.s.). The estimated glomerular filtration rate basal medium was 37±14ml/min and one year: 37±13ml/min (P=n.s.) and urinary albumine/creatinine ratio, UA/Cr. was basal and one year: 679 vs. 523mg/g (P=n.s.).
ConclusionsThe combination of simvastatin plus ezetimibe in CKD patients appears to be effective in lipid control at least in this follow-up period. No serious side effects associated have been observed. Demonstrating a reduction in cardiovascular risk associated with greater control of lipid levels requires a longer period of monitoring.
La enfermedad cardiovascular es la principal causa de mortalidad en los enfermos renales crónicos1. Una vez iniciado el tratamiento renal sustitutivo (TRS) las medidas habituales de control en población normal no han demostrado eficacia en reducir el riesgo cardiovascular, probablemente por factores adicionales en diálisis2–4. Por este motivo, el control previo al TRS parece ser clave en mejorar de alguna manera la expectativa de vida de los enfermos renales crónicos5,6. Este tipo de enfermos, con un elevado riesgo cardiovascular, por su complejidad, tienden a ser excluidos de los grandes estudios, por lo que la información aplicada suele ser extrapolada de la población general. No obstante, en los últimos años han surgido estudios centrados en pacientes con enfermedad renal crónica (ERC), en los que se ha puesto de manifiesto la necesidad de optimizar el control lipídico como uno de los aspectos clave para el control del riesgo cardiovascular7,8. Las guías más recientes aconsejan tratar de inicio al paciente renal y, en algunos casos, independientemente de las cifras lipídicas6. Las estatinas son la principal alternativa terapéutica pero no están exentas de riesgos, especialmente cuando es necesario incrementar la dosis para alcanzar objetivos mayores de control lipídico, tal como algunas guías recomiendan9–11. La asociación de ezetemiba a una estatina puede aportar un mejor control lipídico, potencialmente con menos efectos adversos, evitando dosis altas12–15. Presentamos nuestra experiencia en pacientes con ERC estadios 3-4 que no alcanzaban cifras óptimas de control lipídico con una estatina previa, tras su conversión a combinación fija de simvastatina con ezetimiba.
Material y métodosDesde septiembre de 2011 hasta septiembre de 2014 se ha analizado de forma retrospectiva a pacientes que presentaban seguimiento en consulta de nefrología por ERC. Los criterios de inclusión eran que fuesen mayores de 18 años, que presentasen enfermedad renal y que recibiesen previamente estatinas, sin alcanzar cifras óptimas de niveles lipídicos según las recomendaciones actuales. Se consideraron como cifras no óptimas los niveles de colesterol LDL>70mg/dl, en pacientes diabéticos y muy alto riesgo cardiovascular y niveles>100mg/dl, en pacientes con elevado riesgo cardiovascular10,11. No fueron incluidos pacientes con un filtrado glomerular estimado (FGE) por MDRD inicial<15ml/min/1,73m2, ni pacientes con hepatopatía o antecedentes previos de pancreatitis o enfermedad biliar. Los pacientes incluidos presentaban una ERC en estadio 3-4 según FGE por MDRD. Estos eran informados de la conversión a dosis de 10mg de ezetimiba con simvastatina de 20 o 40mg según la dosis previa de estatina que recibían. Si el paciente no presentaba dosis altas de estatina previa se administraban 20mg de simvastatina y si recibía dosis plenas o elevadas era convertido a simvastatina 40mg. Se realizaban los controles rutinarios según pauta habitual, estableciéndose un registro mínimo a los 6 y 12 meses. Se estableció analizar los niveles de creatinin-fosfocinasa si el paciente presentaba síntomas clínicos. Se analizaron los antecedentes personales previos al cambio de tratamiento, así como la evolución posterior a través de la historia clínica informatizada y su seguimiento en consulta. El colesterol LDL fue calculado mediante la fórmula de Fridewald (c-LDL=colesterol total - [c-HDL+triglicéridos/5]) cuando los triglicéridos eran inferiores a 400mg/dl. En caso de triglicéridos entre 400 y 800mg/dl su determinación debía hacerse por métodos directos de ultracentrifugación. El colesterol total fue analizado mediante el método enzimático colesterol oxidasa, el colesterol HDL mediante el método directo eliminación/catalasa y los triglicéridos mediante el método lipasa, glicerol-cinasa con lectura colorimétrica.
Análisis estadístico: Los resultados se expresan en media con desviación estándar. Los datos analizados tienen una distribución normal, por lo que se utilizaron tests paramétricos. Se ha utilizado el test de Student para datos apareados para la comparación de medias. Un valor de p<de 0,05 fue considerado estadísticamente significativo.
ResultadosEn ese periodo de seguimiento fueron incluidos 31 pacientes. Cuatro fueron perdidos durante el estudio antes del primer control y otros 5 pacientes no cumplieron al menos 3 meses de tratamiento, 3 porque se cambió el tratamiento en atención primaria sin motivo aclarado, uno porque refería tos asociada a la toma del fármaco y un quinto por el coste económico que le suponía. Finalmente, 22 pacientes realizaron seguimiento, 14 han cumplido un año mínimo y los otros 8, a fecha de septiembre de 2014, han cumplido al menos 6 meses con el tratamiento. De los 22 pacientes analizados, la mitad eran mujeres, con una edad media total de 67±8 años. Veintiuno eran hipertensos, 15 eran diabéticos y la mitad eran fumadores o habían fumado. Cuatro presentaban cardiopatía isquémica crónica, 3 habían sufrido un accidente isquémico transitorio previo y 5 presentaban claudicación intermitente al inicio del tratamiento. La etiología de la ERC se describe en la tabla 1. Doce pacientes recibían atorvastatina como tratamiento previo (dosis media: 28±13mg), 6 tomaban simvastatina (dosis media: 30mg±11mg), 2 estaban con pravastatina de 40mg, uno con fluvastatina a dosis de 80mg y otro recibía lovastatina de 20mg.
Características basales de los pacientes incluidos en el estudio
| Número de pacientes | 22 |
| Mujeres/varones | 11/11 |
| Edad media (años) | 67 ± 8 |
| Etiología de enfermedad renal crónica (%) | |
| Diabetes mellitus | 32 |
| Glomerulonefritis | 23 |
| Nefroangiosclerosis | 27 |
| Nefritis tubulointersticial | 9 |
| No filiada | 9 |
| Enfermedades asociadas previas (%) | |
| HTA | 95 |
| Diabetes mellitus tipo 1 o 2 | 68 |
| Tabaquismo (activo o previo) | 50 |
| Cardiopatía isquémica | 18 |
| Accidente cerebrovascular | 14 |
| Claudicación intermitente | 23 |
| Pancreatitis aguda | 0 |
| Cólico biliar | 0 |
| Tipo de estatina previa (%) | |
| Atorvastatina | 55 |
| Simvastatina | 27 |
| Pravastatina | 9 |
| Lovastatina | 4,5 |
| Fluvastatina | 4,5 |
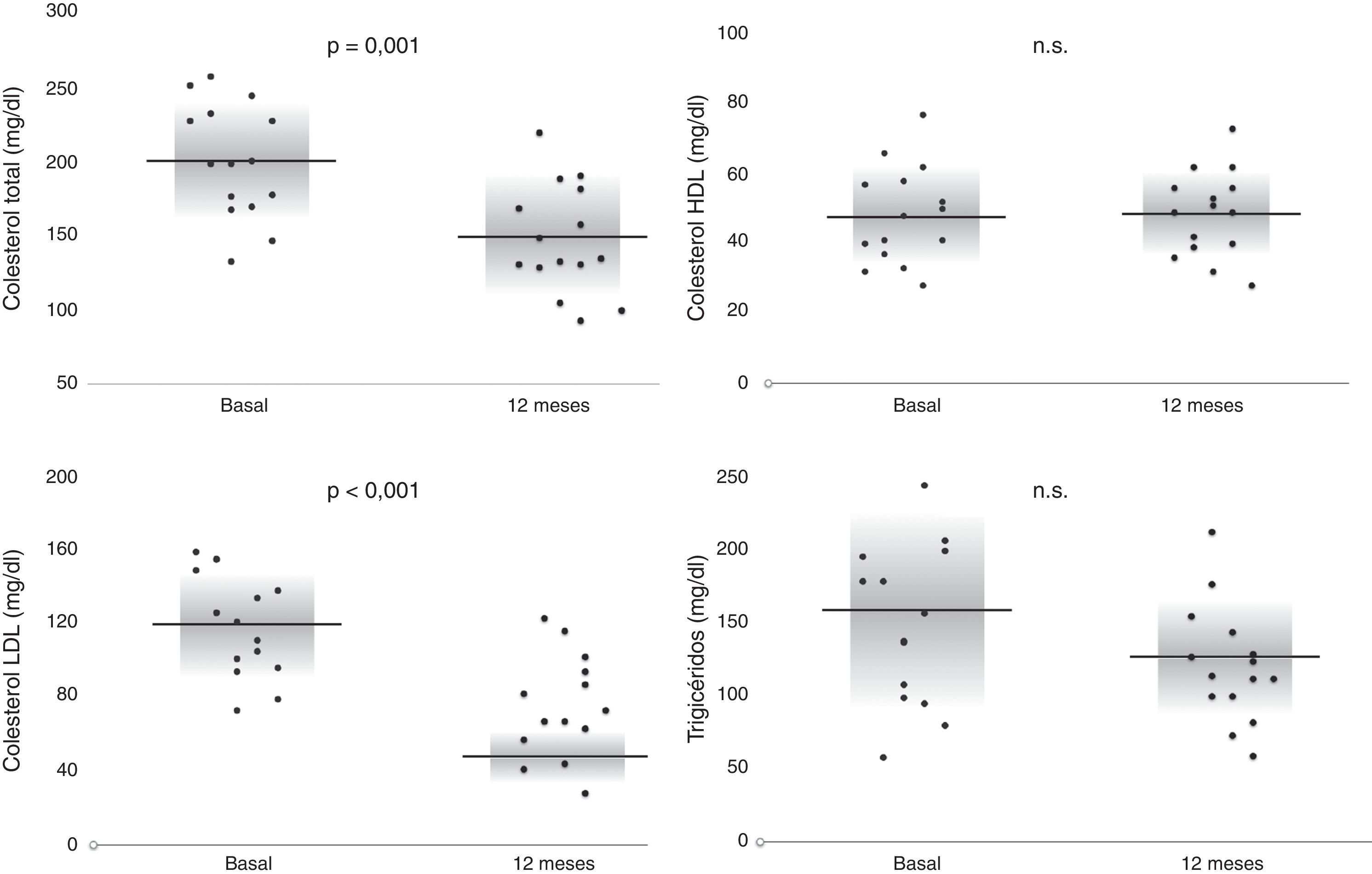
Los controles analíticos basales, a los 6 meses y al año se muestran en la tabla 2. El colesterol total basal (202±39mg) se redujo a los 6 meses (153±39mg/dl) y al año (147±38) de forma significativa, p=0,0002 y p=0,001, respectivamente. La cifras de colesterol LDL también se modificaron: los niveles basales eran de 123±27mg/dl, a los 6 meses de 79±32 (p=0,0006) y al año de 73±28 (p=0,0005). Las cifras de HDL no se modificaron y, aunque los niveles de triglicéridos descendieron, estos no fueron estadísticamente significativos al año. La modificación de los niveles basales y al año se muestran en la figura 1. En el control basal, pese a que todos los pacientes recibían tratamiento con estatina, ninguno presentaba niveles de colesterol LDL<70mg/dl; solo un 18% tenían una cifra entre 70 y 100mg/dl y hasta un 41% presentaban cifras>130mg/dl. A los 6 meses, el 41% de los pacientes presentaba cifras de LDL<70 y en un 68% de los mismos el colesterol LDL era<100. Todos los pacientes que alcanzaron un año de seguimiento presentaban cifras de LDL<130mg/dl, un 64% mostraban un LDL<70 y hasta un 78% de los pacientes tenían un LDL<100mg/dl.
Datos analíticos basales, a los 6 meses y al año
| Basal | 6 meses (n = 22) | 12 meses (n = 14) | |
|---|---|---|---|
| Hemoglobina (gr/dl) | 13,5 ± 2 | 13,5 ± 2 | 13 ± 2 |
| Hematocrito (%) | 41 ± 5 | 41 ± 7 | 41 ± 6 |
| Creatinina (mg/dl) | 1,8 ± 0,7 | 1,8 ± 1 | 1,7 ± 0,6 |
| FGE (ml/min) | 37 ± 14 | 39 ± 17 | 37 ± 13 |
| Colesterol total (mg/dl) | 202 ± 39 | 153 ± 39* | 147 ± 38** |
| LDL (mg/dl) | 123 ± 27 | 79 ± 32* | 73 ± 28* |
| HDL (mg/dl) | 45 ± 12 | 45 ± 13 | 49 ± 11 |
| Triglicéridos (mg/dl) | 195 ± 104 | 144 ± 59*** | 131 ± 57 |
| Bilirrubina (mg/dl) | 0,5 ± 0,3 | 0,5 ± 0,2 | 0,5 ± 0,2 |
| GOT (U/l) | 21 ± 8 | 22 ± 7 | 25 ± 10**** |
| GPT (U/l) | 20 ± 7 | 23 ± 11 | 26 ± 13 |
| GGT (U/l) | 35 ± 25 | 34 ± 22 | 42 ± 40 |
| MAU/Cr (mg/g) | 679 ± 820 | 689 ± 874 | 523 ± 481 |
Datos expresados en media y DE.
FGE: filtrado glomerular estimado por MDRD.
*p < 0,001.
**p = 0,001.
***p = 0,01.
****p = 0,02.
Resto de resultados sin significación estadística.
No hubo cambios en la función renal a lo largo del estudio (FGE 37±14ml/min basal y 37±13 a los 12 meses) ni en los niveles de proteinuria (p: n. s.) (tabla 2). Se observó un leve incremento en los niveles de GOT a los 12 meses (GOT basal 21±8 U/l vs. 25±10 U/l a los 12 meses; p=0,02), sin observarse cambios estadísticamente significativos en el resto de parámetros aunque con una tendencia al ascenso de la GPT y la GGT al finalizar el estudio. Los niveles no fueron mayores de 2 veces el límite alto de la normalidad para ser considerados relevantes clínicamente.
En el periodo de seguimiento ningún paciente ha presentado nuevos eventos cardiovasculares, tampoco se ha registrado en el primer año ningún episodio de cólico biliar o de pancreatitis, ni se ha observado miopatía asociada. Hasta el momento, ningún paciente ha requerido que se retirase el tratamiento por un efecto adverso destacable. De los 22 pacientes, solo un paciente suspendió el tratamiento a los 6 meses al iniciar diálisis. A su vez, solo un paciente requirió subir dosis de simvastatina en el control semestral para alcanzar niveles aceptados según las recomendaciones de las guías. Ningún paciente ha fallecido en el periodo descrito.
DiscusiónLos pacientes con ERC no en diálisis presentan un riesgo incrementado de mortalidad cardiovascular1. Las actuales guías así lo reconocen e insisten en que la atención sobre estos pacientes debería intensificarse y asegurarse un mejor cumplimiento del que se alcanza actualmente16,17. No obstante, la ausencia de grandes estudios en esta población ha limitado la aplicación de las recomendaciones aceptadas en la población general y diabética. Recientes estudios en población renal han puesto de manifiesto que la reducción de los niveles lipídicos en pacientes con ERC puede disminuir su mortalidad asociada a eventos cardiovasculares12,18–22.
Las actuales guías de práctica clínica para el manejo lipídico en la ERC de la KDIGO recomiendan el tratamiento con estatinas o con la combinación de estatina/ezetimiba en pacientes>50 años con un FGE<60ml/min, independientemente de las cifras de colesterol LDL6. Las guías de la Sociedad Española de Nefrología, al igual que otras guías europeas, han establecido un objetivo de colesterol LDL<100mg/dl en estos pacientes de alto riesgo cardiovascular10,11. En pacientes con un grado muy elevado de riesgo cardiovascular el objetivo debe ser mayor: alcanzar un LDL<70mg/dl, tal como recomiendan las guías de la Sociedad Europea de Cardiología del 20135. También recientemente, en el documento de consenso para la detección y manejo de la enfermedad renal crónica del 2014, se ha establecido el límite de LDL<70mg/dl o una reducción del 50% del nivel previo como objetivo para la población con ERC, dado su potencial riesgo cardiovascular23. Nosotros en nuestro estudio establecimos dichos niveles como objetivo, así el 78% de los pacientes con seguimiento al año presentaban un colesterol LDL<100mg/dl, con un cumplimiento terapéutico del 95% (solo un paciente suspendió el tratamiento al iniciar TRS). Aunque las guías KDIGO consideran innecesario el control posterior de las cifras lipídicas, nosotros, al igual que en otras guías, sí lo realizamos con el objetivo de valorar la respuesta, ajustar el tratamiento y, en muchos casos, establecer un feedback de cumplimiento terapéutico24.
En pocos trabajos sobre el control del riesgo cardiovascular, con terapia hipolipidemiante, se incluye población con FGE<60ml/min y, menos aún, evaluando la combinación con ezetimiba. El ensayo controlado Study of Heart and Renal Protection (SHARP) publicado en 2011 mostró que la asociación de simvastatina/ezetimiba producía una reducción de la mortalidad cardiovascular en pacientes con ERC, aunque su comparativa era con placebo12. En dicho estudio, los autores estimaban una reducción de la quinta parte del riesgo cardiovascular por cada mmol/l de reducción de colesterol LDL. En nuestro trabajo todos los pacientes recibían una estatina previa, pero no alcanzaban los niveles recomendados según las guías. La dosis media administrada de estatina en nuestro estudio fue mayor que la instaurada en el estudio SHARP y, aunque nuestra serie no permite un análisis de supervivencia, sí observamos una reducción significativa de los niveles de colesterol total y de LDL al modificar la monoterapia por la asociación simvastatina/ezetimiba, semejante a otros trabajos previos12,14. Al igual que en el trabajo de McCormack et al. la combinación simvastatina/ezetimiba permitió un mayor porcentaje de cumplimiento de objetivo terapéutico que la monoterapia15.
A su vez, los pacientes con ERC presentan un mayor número de efectos secundarios con dosis altas de estatinas, por lo que en muchas ocasiones es difícil conseguir el objetivo terapéutico. Las guías KDIGO recomiendan evitar dosis de atorvastatina>20mg al día, de simvastatina o pravastatina>40mg y de fluvastatina>80mg en situación de FGE estadio 3-56. La adición de ezetimiba no necesariamente implica un mayor número de efectos secundarios y permite alcanzar niveles más bajos de colesterol LDL12,14. La administración de una combinación fija en una solo toma nos ha permitido una buena adherencia terapéutica, sin evidencia de efectos adversos destacables, como los resultados descritos, en población mayor de 65 años, por Constance et al., o los de Mc Cormack et al., que comparaban la combinación de simvastatina/ezetimiba con dosis de atorvastatina de 40mg y de rosuvastatina de 5-10mg13,15. En nuestra serie, ningún paciente suspendió el tratamiento por un efecto adverso grave, no observamos complicaciones hepáticas de relevancia ni tampoco miopatía destacable. No observamos ningún episodio de pancreatitis ni de cólico biliar, complicado o no, y aunque se observa un discreto aumento de los niveles de transaminasas este no supera más de 2 veces el límite superior de la normalidad. En trabajos previos, la tasa de efectos secundarios también fue muy baja y su cumplimiento fue muy alto25.
Otros potenciales beneficios descritos asociados al uso de estatinas en publicaciones previas, como la preservación de la función renal o el descenso de proteinuria, no pueden ser confirmados con nuestro trabajo, aunque sí observamos que no hay modificación del FGE medio y hay un menor nivel de proteinuria, pero sin significación estadística. Aunque algunos trabajos con estatinas han observado una menor pérdida de función renal, otros estudios no lo han confirmado26–28. El metaanálisis publicado por Tonelli et al. mostraba que la reducción de los niveles de proteinuria era modesta, al igual que la reducción del descenso del FGE29. El papel de la ezetimiba en esos aspectos es incierto y sus potenciales efectos pleiotrópicos no están demostrados clínicamente30–32. A su vez, dado que el mecanismo de acción de la ezetimiba difiere de las estatinas, al inhibir la absorción intestinal del colesterol, su efecto aislado sobre el riesgo cardiovascular, la función renal y el control de la proteinuria están por dilucidar33,34.
Limitaciones: El trabajo expuesto presenta las limitaciones de un estudio retrospectivo, de un grupo reducido de pacientes, sin un grupo control ni una aleatorización de los pacientes. A su vez el seguimiento a un año no permite valorar la influencia en la supervivencia ni en la mejora del riesgo cardiovascular en la reducción de eventos. También la heterogeneidad del tratamiento lipídico previo puede condicionar unos resultados favorables. No obstante, este tipo de series puede ayudar a un mejor conocimiento de alternativas terapéuticas en una población de elevado riesgo cardiovascular, dada la dificultad para conseguir series grandes de enfermos renales y la escasez de estudios con suficiente poder estadístico.
ConclusionesLa asociación de ezetimiba/simvastatina es eficaz en la reducción de los niveles lipídicos, especialmente en el control del colesterol LDL, al menos durante el primer año en enfermos renales crónicos. Durante el periodo de seguimiento no se han observado efectos secundarios relevantes. La trascendencia de mejorar la supervivencia reduciendo los niveles lipídicos y, por lo tanto, disminuyendo potencialmente el riesgo cardiovascular, queda todavía por dilucidar en un seguimiento a más largo plazo. No obstante, dada la importancia de disminuir la mortalidad asociada al riesgo cardiovascular en los enfermos renales, estas alternativas pueden ser una opción viable en espera de estudios más concluyentes.
Conflicto de interesesLos autores no presentan ninguno.
Laboratorios Farmacéuticos ROVI S.A. no ha participado ni en el diseño del estudio, ni en el análisis de los datos, ni tampoco en la elaboración final del trabajo.
A Lorena Sanmartín Fellonera, facultativo especialista en Bioquímica Clínica del Hospital Universitario del Henares por sus aclaraciones técnicas.
A Laboratorios Farmacéuticos ROVI S.A. por su ayuda en el diseño de la figura 1.