La hiperplasia estromal pseudoangiomatosa (HEPA) es una lesión mamaria poco frecuente, de carácter benigno. Se caracteriza por un sobrecrecimiento benigno de tejido conectivo fibroso que produce numerosos espacios que semejan estructuras vasculares.
Generalmente afecta a mujeres en edad reproductiva, aunque se ha descrito en pacientes entre 12 y 75 años.
Suele presentarse como un hallazgo incidental en el estudio histológico tras cirugía por patología benigna o maligna, aunque ocasionalmente su presentación clínica es como una tumoración mamaria indolora, simulando un fibroadenoma.
La biopsia percutánea ecoguiada permite detectar la naturaleza de la lesión y descartar patología maligna, como el angiosarcoma de bajo grado.
Se describe una serie de cuatro casos con diferente presentación clínica. Los dos primeros se manifestaron como una tumoración mamaria palpable, única e indolora, el tercero fue un hallazgo histopatológico en la pieza quirúrgica de una cuadrantectomía, realizada como tratamiento de un carcinoma intraductal mamario y el cuarto caso fue en un varón diagnosticado de ginecomastia unilateral.
Pseudoangiomatous stromal hyperplasia (PASH) is a rare benign breast lesion, characterized by a benign overgrowth of fibrous connective tissue of the breast, which produces numerous spaces resembling vascular structures. This entity most commonly affects premenopausal women but cases have been described at all ages ranging from 12 to 75 years. PASH is usually an incidental histological finding after surgery for benign or malignant tumors but may also present as a mass or painless nodule mimicking fibroadenoma. Ultrasound-guided percutaneous biopsy allows the type of lesion to be determined and malignancies, such as low-grade angiosarcoma, to be excluded. We report four new cases of PASH with distinct clinical presentations. The first two cases presented as a single painless breast mass, the third as an incidental finding in the surgical specimen from a quadrantectomy performed for an intraductal breast carcinoma, and the fourth case occurred in a man with unilateral gynecomastia.
La hiperplasia estromal pseudoangiomatosa (HEPA) es una entidad benigna. Su presentación clínica-anatomopatológica oscila desde cambios microscópicos incidentales en el estudio histopatológico de especímenes de biopsias mamarias hasta una lesión detectada por mamografía o en la exploración clínica1.
Existe discrepancia en cuanto a su incidencia real. Ibrahim y cols. en su serie de 200 casos de estudio anatomopatológico de piezas de biopsias tanto benignas como malignas, refiere hallazgos “incidentales” microscópicos de PASH en el 23% de las mismas (46 casos de 200 estudiados de forma consecutiva en piezas tras biopsias mamarias o mastectomías)2. Otros autores como Polger, consideran que su frecuencia es notablemente inferior, en torno a un 0.4% (7 de 1661 biopsias mamarias)3.
Las pacientes sintomáticas suelen presentar una lesión nodular indolora, móvil y firme y, por lo general son mujeres premenopausicas o postmenopausicas que siguen tratamiento hormonal substitutivo (THS).
Caso clinico 1Paciente de 49 años de edad sin antecedentes médico – quirúrgicos de interés salvo 2 embarazos y partos.
Consultó por tumoración retroareolar en mama derecha a los 41 años de edad.
El estudio mamográfico mostró una imagen de configuración nodular bien delimitada, de 2 centímetros de diámetro. Tras diagnóstico por BAG de estroma fibroso con focos de hiperplasia estromal pseudoangiomatosa se acordó con la paciente la realización de controles periódicos.
A los 8 años del diagnóstico inicial se objetiva un crecimiento de la lesión nodular. Se palpa en unión de cuadrantes internos región periareolar de mama derecha un nódulo móvil, rodadero de 3cm de diámetro clínicamente compatible con fibroadenoma.
La mamografía muestra un nódulo retroareolar derecho de 4,5cm de diámetro de contornos bien delimitados, con incremento de tamaño con respecto a estudios previos (fig. 1). La ecografía mamaria muestra una lesión nodular paraareolar interna de 3,5 x 1,2cm de bordes bien delimitados (fig. 2).
Se realiza tumorectomía por vía periareolar (fig. 3). Se obtiene una tumoración ovoide bien delimitada de 4,5 x 2,8 x 2,5 centímetros y de 18 gramos de peso, de coloración blanco nacarado, homogénea con pequeños quistes en su interior (fig. 4). El informe anatomo-patológico es de estroma fibroso con focos de hiperplasia estromal pseudoangiomatosa en su interior. El componente epitelial presenta estructuras lobulillares características y ductos dilatados así como focos de atípica epitelial plana (fig. 5).
Paciente de 34 años que consultó por nódulo mamario izquierdo. No antecedentes médico-quirúrgicos de interés. Nuligesta.
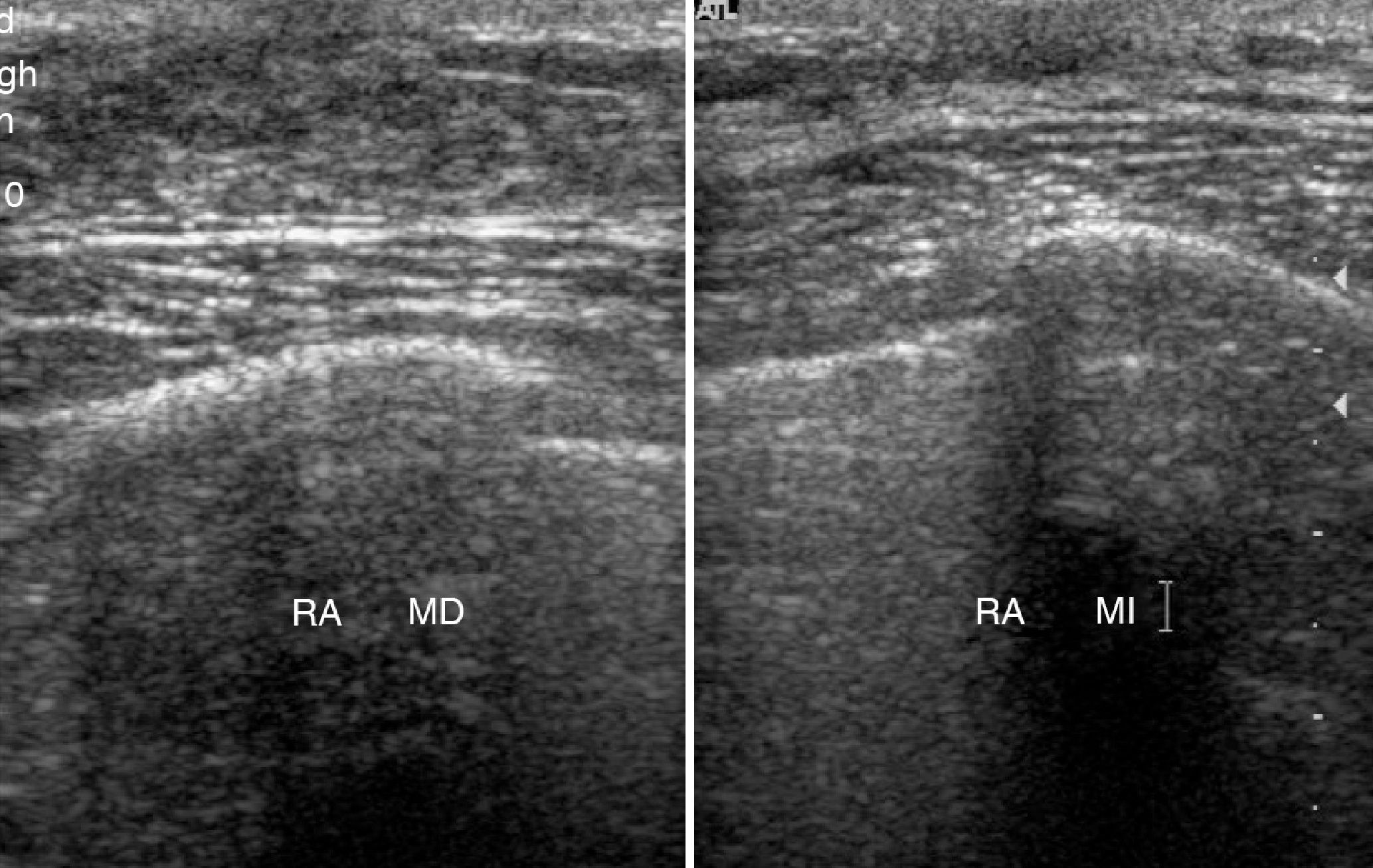
La exploración mamaria pone de manifiesto un nódulo móvil, polilobulado y bien delimitado de 5cm de diámetro en cuadrante supero-externo (CSE) de mama izquierda. El estudio mamográfico revela una masa en CSE de mama izquierda de unos 9 centímetros, de baja densidad y bordes bien delimitados. La ecografía mamaria describe una tumoración de 60 x 23mm, cuyo aspecto sugiere fibroadenoma o tumor phyllodes (fig. 6). Se realizó biopsia mamaria ecoguiada con informe anatomopatológico de fibrosis mamaria. Se realizó tumorectomía mamaria de una formación nodular, blanquecina de aspecto fibroso de 7,4 x 5,3 x 2,4cm. En el estudio microscópico se observa fibrosis extensa con hiperplasia pseudoangiomatosa del estroma (fig. 7).
Paciente de 35 años de edad. Antecedentes familiares de carcinoma de mama (madre y tía). Sin antecedentes personales de interés. Nuligesta. Usuaria de anticoncepción hormonal oral. En estudio mamográfico de screening se detecta un incremento de densidad de contornos espiculados asociado a microcalcificaciones en CSExterno de mama izquierda (birads 5). La exploración mamaria no detecta anomalias.
Se realizó biopsia percutánea ecoguiada (BAG) con informe anatomopatológico de carcinoma intraductal de alto grado con comedonecrosis. Se propuso cuadrantectomía con marcaje radiológico.
El diagnóstico anatomopatológico de la pieza fue de carcinoma intraductal con comedonecrosis GIII (foco de 5,25 x 4mm) con áreas de hiperplasia estromal pseudoangiomatosa (fig. 8).
Posterior tratamiento radioterápico con una dosis de 46Gy y una sobreimpresión sobre lecho tumoral de 14Gy. A los tres años del diagnóstico la paciente da a luz un varón tras embarazo normoevolutivo.
Actualmente la paciente se encuentra en remisión completa de su proceso oncológico de base tras una supervivencia libre de enfermedad de 45 meses.
Caso clinico 4Paciente varón de 29 años de edad que consultó por incremento de tamaño mamario derecho. El estudio mamográfico muestra presencia de parénquima fibroglandular compatible con ginecomastia verdadera (fig. 9).
Se realizó mastectomía subcutánea con informe anatomopatológico de pieza de 50,9 gramos de peso que microscópicamente muestra epitelio hiperplásico revestido por células sin atipias con un patrón micropapilar emitiendo proyecciones intraluminales. El estroma es mayoritariamente fibroso con áreas de hiperplasia estromal pseudoangiomatosa, compatible con ginecomastia (fig. 10).
DiscusiónLa hiperplasia estromal pseudoangiomatosa es una lesión benigna, descrita inicialmente por Vuitch y cols en 19864. En su publicación, se describieron 9 casos de masas palpables, bien delimitadas y no hemorrágicas en pacientes premenopausicas. Su estudio histológico mostró proliferación benigna del estroma mamario asociado a un patrón complejo de hendiduras “pseudovasculares” anastomosadas entre sí, delimitadas por células fusiformes. El término “pseudoangimatoso” describe esta similitud histológica con una proliferación angiomatosa.
Se ha asociado a un amplio abanico de lesiones mamarias, que van desde la involución mamaria, ginecomastia, lesiones benignas e incluso el carcinoma.
Generalmente se observa en mujeres premenopausicas de entre 30 y 40 años, aunque se han descrito algunos casos entre los 12 y los 75 años y en varones afectos de ginecomastia5.
En estos últimos casos, se ha descrito como hallazgo anatomo-patológico “incidental” en el 23.8% de los casos6, y ocasionalmente como tumoración palpable7.
Se caracteriza por su unilateralidad, aunque se ha descrito algún caso de bilateralidad, rápido crecimiento y modificación de su tamaño en relación con el ciclo menstrual, lo que sugiere en cierta medida dependencia hormonal8.
Aunque su patogenia es desconocida, algunos autores consideran que es secundaria a una respuesta aberrante de los miofibroblastos mamarios al estimulo hormonal (tanto endógeno como exógeno). Parece que es la progesterona la principal hormona implicada en este estímulo, de forma que su actividad comienza como una atenuación focal de los cambios fisiológicos de la mama en relación al ciclo menstrual. La rareza del diagnóstico de HEPA en mujeres mayores de 50 años, sugiere una relación etiológica con estímulos hormonales. De hecho, en más de la mitad de mujeres postmenopáusicas con HEPA se asocia a terapia hormonal substitutiva8–10.
En el análisis inmunohistoquímico de casos de HEPA se ha descrito intensa positividad para receptores de progesterona10.
Clínicamente se puede presentar como un nódulo único móvil, bien circunscrito y de consistencia firme y frecuentemente palpable o con mínimos cambios difusos, que clínicamente simula un fibroadenoma, con un tamaño entre 1 y 12 centímetros5,11. En el análisis de una serie de 80 casos, la PASH se manifestó clínicamente como un nódulo palpable en el 56% de los casos11.
También se ha documentado como una tumoración en cola de mama, afectar al complejo areola – pezón y en tejido mamario accesorio en axila13. De forma muy infrecuente, puede presentarse como un crecimiento difuso y masivo de la glándula mamaria14.
Celliers L y cols. en el análisis de una serie de 73 pacientes, la detección fue únicamente radiológica (clínicamente asintomática) en 46 casos (70,8%) y debutó como nódulo mamario palpable en 19 casos (29,2%). Los casos detectados mediante estudio mamográfico fueron catalogados como Birads 3 en el 80,9% y únicamente el 2,1% y el 17% fueron catalogados como birads 4 y birads 2 respectivamente15.
Los hallazgos radiológicos son inespecíficos por lo que no permiten un diagnóstico radiológico de certeza y pueden simular al de los fibroadenomas16.
En el estudio mamográfico se observa una masa única, de márgenes bien circunscritos o en forma parcial y generalmente sin calcificaciones15. Aunque en algún caso, los bordes son espiculados u ocultos. Los hallazgos ecográficos son muy variables, y generalmente muestran una masa sólida, hipoecógena, ovoidea, levemente heterogénea, con componentes quísticos pequeños y sin sombra acústica posterior.
La RMN mamaria ha sido descrita en un número limitado de pacientes con HEPA y no está adecuadamente estudiada. Se ha descrito que en imágenes potenciadas en T1 se visualiza isointensa en relación con el parénquima mamario que la rodea, presentando en T2 cambios quísticos. El realce tras contraste es rápido y persistente o progresivo (curva tipo I)17.
Los hallazgos de anatomía macroscópica muestran una lesión generalmente bien delimitada, no encapsulada y de consistencia firme y coloración blanquecina, rosada o amarillenta. No son comunes los cambios necróticos o hemorrágicos de la lesión.
Microscópicamente existe un sobrecrecimiento benigno del tejido conectivo fibroso que separa lóbulos y conductos mamarios. Se caracteriza por una proliferación de miofibroblastos con test de inmunohistoquímica que revela positividad para vimentina, actina, CD 34 y receptores de progesterona y marcadores vasculares negativos CD 31 y factor VIII5. El sobrecrecimiento estromal produce numerosos espacios anastomosados que semejan estructuras vasculares pero que no representan vasos sanguíneos18,19.
En cuanto al diagnóstico diferencial, el de más relevancia para el patólogo es el angiosarcoma de bajo grado. Se distingue del mismo en que los espacios de la HEPA contienen miofibroblastos en uno de los lados y un material polisacárido en su interior, mientras que en el angiosarcoma existen hematíes. Las células estromales de la HEPA tienen una apariencia nuclear benigna en contraste con la apariencia atípica de las células endoteliales del angiosarcoma.
Como consecuencia de la alta celularidad de la HEPA también puede ser confundida con un tumor phyllodes (aunque carece de de la configuración glandular anormal típica) o con un fibroadenoma si los espacios vasculares no son reconocidos. Tanto el miofibroblastoma mamario como el hamartoma deben también de ser tenidos en cuenta en el diagnóstico diferencial1.
Actualmente el diagnóstico lo proporciona la punción biopsia percutánea ecoguiada o por esterotaxia. Si el resultado de la biopsia con aguja gruesa no es concordante con la sospecha radiológica (bordes espiculados…), es conveniente su repetición con el fin de decartar una lesión infiltrante y planificar de modo adecuado el tratamiento quirúrgico20.
La punción con aguja fina (PAAF), no parece adecuada para el diagnóstico. En muchas ocasiones las muestras obtenidas son acelulares y cuando son adecuadas en material, los hallazgos citológicos son similares a los del fibroadenoma; aunque las muestras son mucho menos celulares21. Parece que la PAAF únicamente es útil para sugerir una “condición de benignidad” y no proporciona un diagnóstico preoperatorio definitivo.
Gresik y cols describen una serie de 80 casos de HEPA. De 65 pacientes en las que se realizó biopsia core, la sensibilidad en el diagnóstico de HEPA fue del 65% y en el 35% restante la biopsia core fue negativa13. con resultado anatomo-patológico de HEPA, en 27 (42%) se optó por seguimiento.
Aunque la mayoría de los autores recomiendan un tratamiento quirúrgico mediante tumorectomía, la bibliografía considera aceptable un seguimiento radiológico a corto plazo mediante controles con intervalos regulares de 6 meses, como una opción adecuada, siempre y cuando tengamos un diagnóstico histológico mediante una biopsia con aguja gruesa y el estudio radiológico no sea de sospecha. Si la biopsia no es concluyente se debe de realizar la exéresis quirúrgica. En caso de lesiones de gran tamaño, pacientes sintomáticas o en casos de discrepancia clinico – radiológica, debemos de considerar la opción quirúrgica.
En los casos con diagnóstico mediante biopsia core de HEPA en los que se ha optado por seguimiento, (27 casos de 65), se evidenció un incremento de tamaño en 7 casos (26%), 5 de ellos fueron sometidos a tratamiento quirúrgico y en dos se detectaron focos de carcinoma intraductal tipo papilar moderadamente diferenciado.
En 13 de los 38 casos en los que se optó por cirugía de entrada, la HEPA se asociaba a carcinoma intraductal, carcinoma lobulillar insitu o carcinoma infiltrante. Esto es, de 80 casos con diagnóstico inicial de HEPA, en 20 casos (25%) se asocia a focos de carcinoma intraductal o carcinoma infiltrante12.
Otros autores refieren que se asocia a carcinoma infiltrante en el 10% de los casos2,3.
No obstante, la HEPA puede coexistir en lesiones mamarias tanto benignas como malignas, incluyendo lesiones benignas proliferativas y no proliferativas, fibroadenomas, tumor phyllodes y carcinomas.
A pesar de lo referido, a día de hoy existe controversia en cuanto a su asociación real a carcinoma o lesiones premalignas de mama. En una reciente revisión de 9065 biopsias, se detecto carcinoma de mama en 34 mujeres del grupo con HEPA (5,9%) y en el 8,8% de mujeres sin HEPA, por lo que parece que el diagnóstico de HEPA no otorga un incremento de riesgo subsiguiente de carcinoma de mama, e incluso según estos datos, el riesgo parece inferior.
Los carcinomas descritos tras un diagnóstico de HEPA, ocurren generalmente en la mama ipsilateral y más de 5 años tras la biopsia que produjo el diagnóstico22.
Como consecuencia de la dudosa asociación a lesiones infiltrantes se debe de ser cauto a la hora de proponer una actitud expectante en vez de tratamiento quirúrgico.
El tratamiento médico no está bien establecido, aunque recientemente Pruthi ha publicado el caso de una mujer de 39 años de edad con una tumoración bilateral con PASH tratada con éxito tras 6 meses de hormonoterapia con tamoxifeno23.
El pronóstico es excelente. No se considera una lesión premaligna y cuando coexiste con procesos malignos, se considera más bien un hallazgo incidental que un precursor9.
Algunos estudios han descrito casos en los que la HEPA ha regresado espontáneamente8.
La tasa de recidiva es variable y oscila entre un 15 y un 22%3,4,8 y se asocia a exéresis incompleta de la lesión, presencia de lesiones multicéntricas que no fueron resecadas inicialmente o crecimiento “de novo”24, por lo que se recomienda un seguimiento a largo plazo para detectar posibles recidivas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.