El objetivo fue investigar las concentraciones de homocisteína y proteína C reactiva en pacientes menopáusicas tratadas con diosgenina como alternativa a la terapia de reemplazo hormonal. Se realizó una investigación de tipo explicativa, prospectiva y longitudinal, con un diseño cuasi experimental y un muestreo no probabilístico de 49 pacientes que asistieron a la consulta de menopausia del Hospital Central Dr. Urquinaona. Se determinaron las concentraciones de homocisteína y proteína C reactiva antes y después de 6 meses de tratamiento con diosgenina. El promedio ± desviación estándar de las mujeres menopáusicas fue de 51,6±2,9 años; la edad ± desviación estándar de aparición de la menopausia fue de 44,6±2,1 años y el tiempo desde la menopausia fue de 45,7±18,4 meses. Se encontró un incremento de más del 56% en la concentración de proteína C reactiva a los 6 meses de tratamiento en comparación con las concentraciones iniciales (p<0,05). Las concentraciones de homocisteína plasmática presentaron una ligera disminución (aproximadamente mayor del 5%) comparadas con las concentraciones iniciales (p=NS). Se concluye que la diosgenina produce aumento significativo en la concentración de proteína C reactiva sin inducir modificaciones en las concentraciones plasmáticas de homocisteína luego de 6 meses de tratamiento.
The aim of this study was to investigate homocysteine and C-reactive protein concentrations in postmenopausal women treated with diosgenin as an alternative to hormone replacement therapy. An explanatory, prospective and longitudinal study was performed with a quasi-experimental design and non-probabilistic sampling of 49 patients who attended the menopause clinic of the Dr. Urquinaona General Hospital. Homocysteine and C-reactive protein concentrations were determined before and after 6 months of treatment with diosgenin.
The mean age of the postmenopausal women was 51.6±2.9 years. Age at menopause onset was 44.6 ± 2.1 years and the time from m e n o p a use was 45.7±18.4 months. C-reactive protein concentrations were increased by more than 56% at 6 months of treatment compared with initial concentrations (P<.05). Plasma homocysteine concentrations slightly decreased (by more than 5%, approximately) compared with initial concentrations (P=NS). We conclude that diosgenin significantly increases C -reactive concentrations, without modifying plasma homocysteine concentrations after 6 months of treatment.
La enfermedad cardíaca coronaria es la causa de defunción más común en los países industrializados de Occidente1. Desde principios de los años sesenta se reconoce que la disminución de la producción de estrógenos por parte de los ovarios, posterior a la menopausia, natural o quirúrgica, causa los cambios ateroscleróticos en los vasos sanguíneos1–3.
Estudios de casos y controles evidencian que la terapia hormonal de reemplazo (THR) continua con estrógenos puede disminuir dramáticamente el riesgo de enfermedad cardiovascular y defunción por eventos cardíacos4. En tal sentido, el reemplazo de estrógenos parecía ser especialmente efectivo en pacientes que ya presentaban afecciones coronarias. Sin embargo, hallazgos en otros estudios demostraron lo contrario2,5,6.
La aterosclerosis está asociada con la inflamación crónica y adhesión entre las células del endotelio de la pared vascular y los leucocitos circulantes, los cuales desempeñan un papel importante en los eventos inflamatorios6,7. La mayoría de las formas de inflamación dentro del tejido dañado produce aumento en la concentración del reactante de fase aguda: la proteína C reactiva (PCR)8. A su vez, puede actuar como un procoagulante debido a que induce la expresión del factor tisular de monocitos, que desempeña un papel importante en la aterosclerosis9. Aunque el mecanismo subyacente que activa la inflamación es desconocido, la elevación de las concentraciones de PCR, en el contexto de la enfermedad cardiovascular, está involucrada en la fisiopatología de la progresión de la aterosclerosis y sus complicaciones9,10. En consecuencia, la elevación de los valores de PC R se observa en pacientes con infarto de miocardio, angina inestable y angina estable crónica6,11,12. También es un factor de riesgo independiente en varones con y sin enfermedad cardíaca coronaria y en mujeres menopáusicas sin evidencia clínica de la enfermedad13.
La elevación de las concentraciones plasmáticas de homocisteína es un factor de riesgo independiente para la enfermedad cardiovascular. Las concentraciones de homocisteína total son mayores en las mujeres menopáusicas que en las premenopáusicas14 y se ha demostrado que la THR disminuye sus valores15–17. Sin embargo, los estrógenos afectan a los parámetros de la coagulación, incrementando el riesgo de trombosis18 y de los marcadores de inflamación, lo cual puede aumentar el riesgo de enfermedad cardíaca coronaria17–23.
Se ha evidenciado la disminución de las concentraciones de homocisteína plasmática en pacientes tratadas con alimentos derivados de la soja24,25. Sin embargo, no se observaron variaciones en los valores de PCR en mujeres menopáusicas tratadas con productos derivados de la soja24 o isoflavonas26. Al mismo tiempo, los reportes obtenidos sobre los efectos de las sapogeninas sobre la homocisteína y la PCR sérica son muy escasos en mujeres menopáusicas y más aún los efectos de la diosgenina.
El objetivo del estudio fue investigar los efectos de la diosgenina en las concentraciones de homocisteína y PCR en mujeres menopáusicas.
MATERIAL Y MÉTODOSSe realizó una investigación de tipo explicativa, prospectiva y longitudinal, con un diseño cuasi experimental y un muestreo no probabilístico de 49 pacientes que asistieron a la consulta de menopausia del Hospital Central Dr. Urquinaona.
Se incluyó a mujeres menopáusicas sanas, con edades comprendidas entre los 45 y los 60 años, con ausencia de menstruaciones en los 12 meses previos al inicio del estudio y que presentaron valores de hormona foliculostimulante > 50 U/l y de estradiol < 35mg/dl. Se excluyó del estudio a las mujeres menopáusicas con anomalías clínicas o de laboratorio que sugieran alteraciones cardiovasculares, hepáticas o renales, con antecedentes de coagulopatías, uso de estrógenos, andrógenos o progestágenos orales o transdérmicos en los 6 meses previos al estudio y hábito tabáquico de más de 10 cigarrillos al día. Al inicio de la investigación se realizó un cuestionario clínico donde se incluyeron los antecedentes familiares, el examen físico y los resultados de laboratorio (química y hematología) y del electrocardiograma.
Las mujeres menopáusicas fueron tratadas con tabletas comerciales de ñame salvaje 170mg (el productor de la cápsula reporta que la concentración de diosgenina es mayor del 95%) 3 veces al día durante 6 meses. A todas las participantes se les tomó una muestra inicial de suero para determinar los valores basales de la homocisteína y la PCR y se repitió a los 6 meses. Las muestras de suero de todas las participantes se obtuvieron en ayunas para reducir los efectos de los alimentos. Las muestras se almacenaron a −80°C hasta el momento de la prueba. La PCR y la homocisteína se midieron mediante radioinmunoensayo. Los coeficientes de variación intra e interensayos fueron menores del 5%.
Los datos se presentan como promedio ± desviación estándar. Para el análisis estadístico de las diferencias en las concentraciones iniciales y después de 6 meses de tratamiento se utilizó la prueba de la t de Student para las muestras dependientes o relacionadas. El porcentaje de cambio (en comparación al inicio) en las concentraciones (conc) del parámetro se calculó como:
[(Conc 6 meses) – (conc inicial)/(conc inicial)] × 100
Se consideró estadísticamente significativo un valor de p < 0,05.
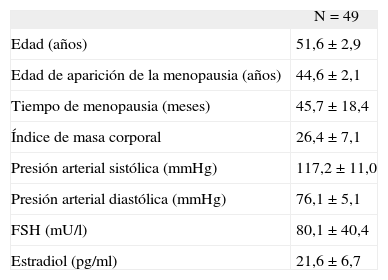
RESULTADOSSe seleccionó a un total de 49 pacientes, con una edad promedio ± desviación estándar de las mujeres menopáusicas de 51,6 ± 2,9 años (rango, 45–55 años); la edad de aparición de la menopausia fue de 44,6 ± 2,1 años (rango, 37–54 años) y el tiempo desde la menopausia fue de 45,7 ± 18,4 meses. En la tabla I se muestran las características clínicas y de laboratorio al inicio del estudio.
Características clínicas y de laboratorio al inicio del estudio
| N = 49 | |
| Edad (años) | 51,6 ±2,9 |
| Edad de aparición de la menopausia (años) | 44,6 ±2,1 |
| Tiempo de menopausia (meses) | 45,7 ± 18,4 |
| Índice de masa corporal | 26,4 ±7,1 |
| Presión arterial sistólica (mmHg) | 117,2 ± 11,0 |
| Presión arterial diastólica (mmHg) | 76,1 ±5,1 |
| FSH (mU/l) | 80,1 ±40,4 |
| Estradiol (pg/ml) | 21,6 ±6,7 |
FSH: hormona foliculostimulante.
Los valores se presentan como media ± desviación estándar.
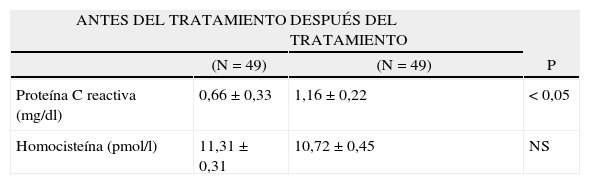
En la tabla II se presentan las variaciones en las concentraciones de PCR. Se encontró un incremento de más del 56% en comparación con las concentraciones iniciales de PCR a los 6 meses de tratamiento. La diferencia se consideró estadísticamente significativa (p < 0,05).
Concentraciones de proteína C reactiva y homocisteína antes y después de 6 meses de tratamiento con diosgenina
| ANTES DEL TRATAMIENTO | DESPUÉS DEL TRATAMIENTO | P | |
| (N = 49) | (N = 49) | ||
| Proteína C reactiva (mg/dl) | 0,66 ± 0,33 | 1,16 ±0,22 | < 0,05 |
| Homocisteína (pmol/l) | 11,31 ±0,31 | 10,72 ±0,45 | NS |
Los valores se presentan como media ± desviación estándar.
Después de 6 meses de tratamiento (tabla II), las concentraciones de homocisteína plasmática experimentaron una ligera disminución (aproximadamente > 5% comparado con las concentraciones iniciales), pero esta diferencia no fue estadísticamente significativa (p = NS).
DISCUSIÓNEn esta investigación se empleó diosgenina (una dosis total de 510mg/día), que demostró que tiene un efecto importante en las concentraciones de PCR y no produce modificaciones en las concentraciones de homocisteína, a diferencia de lo reportado para la soja24, isoflavonas26 y genisteína27. Según los resultados del estudio, luego de 6 meses de tratamiento las concentraciones de PCR presentan un incremento significativo y similar a la THR, que se ha reportado previamente17. El efecto de la diosgenina en la PCR fue similar en tiempo y magnitud al reportado por otros investigadores con el uso de estrógenos28,29.
La elevación de la PCR está relacionada con un incremento del riesgo cardiovascular y puede ser una de las posibles explicaciones de la enfermedad cardíaca coronaria y de tromboembolias venosas en pacientes tratados con THR18,30. Diferentes estudios han demostrado una disminución de las concentraciones de algunos marcadores de riesgo vascular (como selectina E y fibrinógeno) después de la THR en mujeres menopáusicas31,32. El incremento de la PCR y la disminución de las concentraciones plasmáticas de todos los otros marcadores de riesgo vascular sugieren que el incremento de la PCR puede estar relacionado con la activación metabólica hepática y no con una respuesta de fase aguda32. El escaso efecto de la THR transdérmica (el cual no tiene el efecto del primer paso hepático) en los valores de PCR puede apoyar esta hipótesis33–35. Este resultado, similar al de la THR oral, parece relacionarse con los estrógenos o las progestinas utilizados22,26,33,35,36. Sin embargo, se necesitan estudios mayores para establecer si los hallazgos de esta investigación persisten por un tiempo aún más largo.
El mecanismo por el cual la THR y la diosgenina aumentan los valores séricos de PCR en las mujeres menopáusicas no está claro. La PCR se produce en el hígado y el principal regulador de su síntesis son las citocinas proinflamatorias, como la interleucina 6 (IL-6), el factor de necrosis tumoral y la IL-1, por lo que se puede pensar que la administración de estrógenos y andrógenos aumenta la actividad de las citocinas inflamatorias37,38. Un estudio en mujeres menopáusicas no encontró un efecto significativo de los estrógenos sin oposición o combinados en los valores de IL-6 y fibrinógeno, esta última sintetizada igual que la PCR por el hígado bajo el control de las citocinas proinflamatorias39. Se ha reseñado en múltiples investigaciones que la THR aumenta tanto la IL-6 como la PCR en las mujeres menopáusicas con enfermedad cardíaca coronaria40. Un estudio controlado demostró que el tratamiento con la combinación estradiol-acetato de norestisterona lleva a un pequeño pero significativo aumento de la IL-6 y del antagonista del receptor de la IL-1, pero no de la IL-1, lo cual contrasta con la reducción de la producción de IL-6 por los estrógenos in vitro41.
Esto llevaría a pensar que los efectos progestagénicos del tratamiento con diosgenina produzca un ligero incremento de las citocinas proinflamatorias, aunque se ha sugerido que las progestinas pueden tener algún efecto antiinflamatorio38.
Varios estudios refieren que la THR en la forma de estradiol oral sin oposición, estrógenos equinos conjugados o combinaciones de estrógenos y progesterona aumenta los valores séricos de PCR durante la menopausia2,17,46–49. En la actualidad se ha reportado que el estradiol oral y transdérmico en mujeres menopáusicas sanas tienen diferentes efectos sobre el factor 1 similar a la insulina, el cual, como la PCR, es principalmente sintetizado por el hígado50. Se debe hacer notar, sin embargo, que la administración de pequeñas dosis (1mg) de estradiol por vía oral puede no afectar a los valores de PCR39. Por lo tanto, es posible que los efectos de la diosgenina en la PCR sérica se deban al efecto hepático y se necesitan estudios adicionales para aclarar esta hipótesis.
Se ha descrito que la progesterona micronizada y la trimegestona no afectan al porcentaje de cambio de la PCR durante la THR39,46,48,49, lo que sugiere que los efectos de la THR en este marcador de la inflamación son principalmente mediados por la activación de los receptores de estrógenos y no es alterada por las progestinas. El efecto de la adición de acetato de medroxiprogesterona aún no está claro; en algunos estudios no produce alteraciones, en otros disminuye la elevación inducida por los estrógenos51. No se debe olvidar que algunas progestinas tienen un efecto pro o antiinflamatorio per se.
Las implicaciones clínicas de las concentraciones elevadas de PCR en usuarias de diosgenina no están claras. El aumento espontáneo de los valores de PCR, aun en rangos normales, está asociado al aumento en el riesgo de eventos cardiovasculares en sujetos aparentemente sanos13. Sin embargo, las consecuencias farmacológicas del aumento de la PCR pueden ser diferentes de las de la elevación espontánea. Las estatinas, que son efectivas para reducir el riesgo de accidente cerebrovascular, reducen los valores séricos de PCR en sujetos sanos y en pacientes con enfermedad cardiovascular42,43, por lo que se puede pensar que el incremento de la PCR inducido por la diosgenina puede llevar a un incremento en el riesgo de eventos cardiovasculares.
También se ha demostrado que el estradiol aumenta transitoriamente la presencia de E-selectina inducida por el factor de necrosis tumoral, la molécula tipo 1 de adhesión de las células vasculares y la molécula tipo 1 de adhesión intracelular45.
Los valores plasmáticos de homocisteína, luego de 6 meses de tratamiento, no presentaron modificaciones significativas. Estos datos son diferentes a estudios previos realizados en mujeres menopáusicas que utilizaron compuestos con soja25 o THR15–17,36,48, en los cuales se observó una reducción significativa, similar a la de un estudio más reciente en el cual se utilizaron estrógenos y acetato de norestisterona17,52.
En conclusión, la diosgenina produce un aumento significativo en la concentración de PCR y no produce modificaciones en las concentraciones plasmáticas de homocisteína a los 6 meses de tratamiento.