La lisil oxidasa (LOX), enzima implicada en la maduración de la matriz extracelular, juega un papel clave en el mantenimiento de la homeostasis del endotelio. Sin embargo, se desconoce el mecanismo a través del cual la LOX regula la función de la célula endotelial. Nuestro objetivo ha sido caracterizar los procesos celulares controlados por la LOX en células endoteliales.
MétodosLa LOX se sobreexpresó en células endoteliales humanas de vena de cordón umbilical (HUVEC) utilizando un sistema lentiviral. Las consecuencias de la sobreexpresión de LOX sobre el patrón de expresión se determinaron mediante microarrays. La expresión de LOX y de la α2-macroglobulina (A2M) se evaluó mediante PCR a tiempo real y/o western-blot.
ResultadosEl sistema de expresión lentiviral incrementó muy significativamente la expresión de LOX en HUVEC (más de 20 veces). En concordancia, el análisis por western-blot evidenció un marcado aumento del nivel de proteína LOX en el extracto celular, tanto de la forma madura y catalíticamente activa como de la proenzima. Asimismo, se indujo la secreción de LOX al medio de cultivo. El análisis del perfil de expresión mediante microarrays demostró que la sobreexpresión de LOX en HUVEC modula genes implicados en señalización, comunicación y adhesión celular. Uno de los genes más fuertemente inhibidos por la sobreexpresión de LOX es la A2M, un inhibidor de proteasas de amplio espectro que puede desempeñar múltiples actividades biológicas.
ConclusionesLa sobreexpresión de LOX en células endoteliales altera el perfil de expresión génica y reduce significativamente la expresión de la A2M, lo que puede tener importantes repercusiones sobre la función del endotelio.
Lysyl oxidase (LOX) is an enzyme involved in extracellular matrix maturation that plays a crucial role in the maintenance of endothelial homeostasis. However, the specific mechanisms underlying the ability of LOX to regulate endothelial function are currently unknown. Our objective was to characterize the cellular processes controlled by LOX in endothelial cells.
MethodsLOX was overexpressed in human umbilical vein endothelial cells (HUVEC) when a lentiviral system was used. The consequences of LOX overexpression were analyzed by microarray. LOX and α2-macroglobulin (A2M) expression was assessed by real-time polymerase chain reaction and/or Western-Blot.
ResultsThe lentiviral expression system significantly increased LOX expression in HUVEC (more than 20-fold). In agreement with this result, Western-Blot analysis revealed a marked enhancement of LOX protein levels in the cell extract for both the mature and catalytically active form and for the pro-enzyme. This approach also increased the level of LOX secreted into the culture medium. By microarray analysis we demonstrated that LOX overexpression strongly alters the endothelial expression pattern and regulates genes mainly involved in the control of cell signaling, communication and adhesion. A2M, a panprotease inhibitor with multiple biological activities, was one of the genes most strongly inhibited in LOX overexpressing cells.
ConclusionLOX overexpression strongly affects the expression profile of endothelial cells and significantly reduces A2M expression, an effect that could have a substantial impact on endothelial cell function.
La lisil oxidasa (LOX) es una aminooxidasa dependiente de cobre que inicia el ensamblaje covalente de las fibras de colágeno y elastina de la matriz extracelular (MEX). Esta enzima cataliza la deaminación oxidativa de residuos de lisina e hidroxilisina dando lugar a la formación de peptidil semialdehídos altamente reactivos que condensan entre sí formando enlaces tanto intramoleculares como intermoleculares1–3. De este modo, la actividad LOX determina las propiedades mecánicas de la MEX y asegura su integridad, su estabilidad y su correcto funcionamiento.
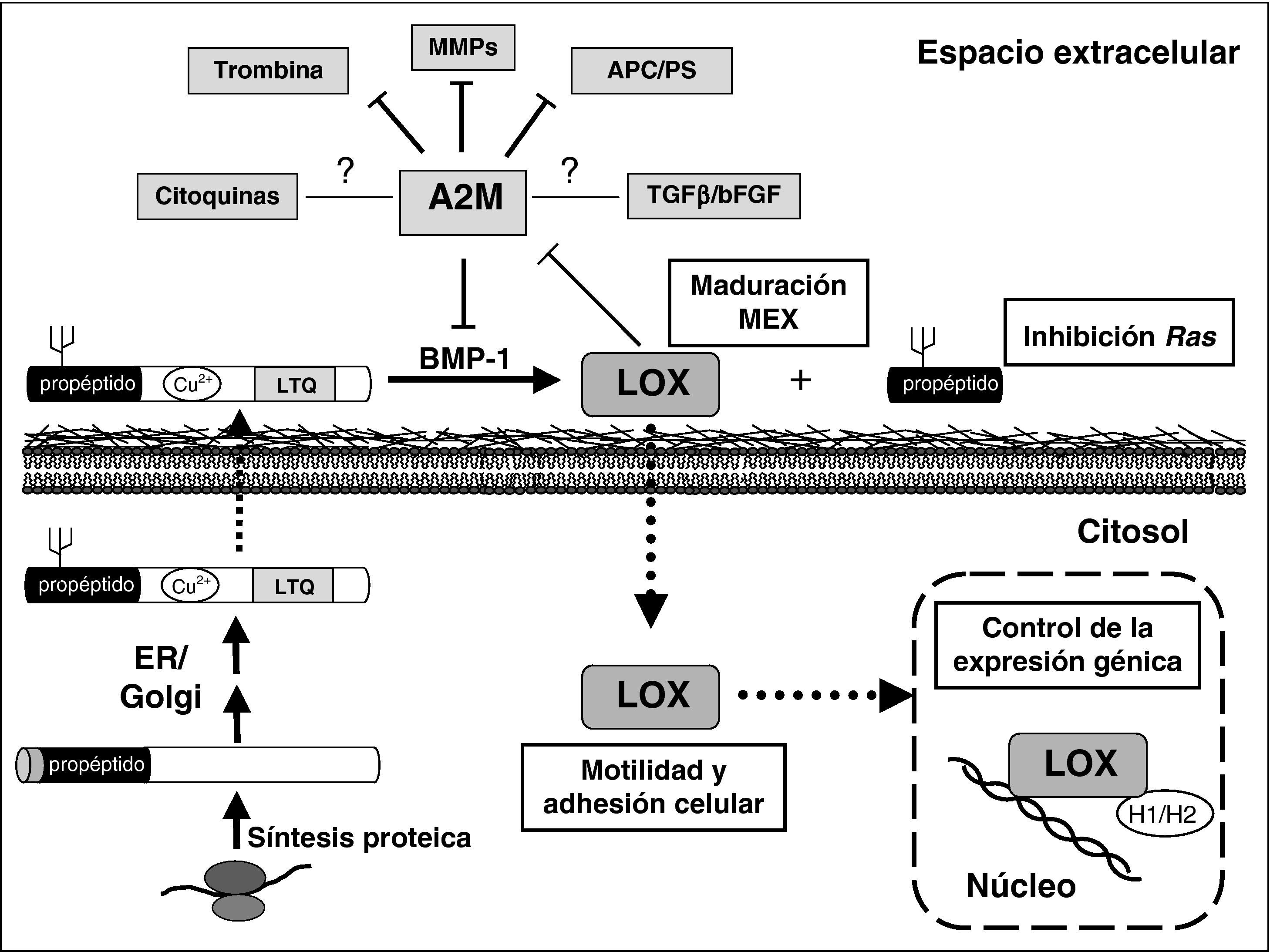
La LOX se sintetiza en forma de proenzima que es secretada al espacio extracelular, en donde se proteoliza por la bone morphogenetic protein 1 (BMP-1), liberando la forma madura y catalíticamente activa y un propéptido que también presenta actividad biológica2,3. Los estudios desarrollados en los últimos años han mostrado que la LOX es una proteína multifuncional que podría contribuir a la regulación de otros procesos tanto intracelulares como extracelulares, incluyendo el control de la expresión génica2,3. Por todo ello, la modificación del patrón de expresión de esta enzima podría alterar profundamente la homeostasis celular. No en vano se ha demostrado que la LOX es una enzima clave en el control de la metástasis tumoral y que deficiencias en la expresión de LOX podrían estar relacionadas con alteraciones vasculares como el aneurisma aórtico y la aterosclerosis2,4,5. En este sentido, nuestros trabajos previos indican que la inhibición de la actividad/expresión de la LOX estaría relacionada con la disfunción endotelial desencadenada por factores de riesgo aterosclerótico y por citoquinas proinflamatorias, lo que sugiere la implicación de esta enzima en la fisiopatología de la enfermedad aterosclerótica6–9. Sin embargo, se desconocen en gran medida los procesos biológicos controlados por la LOX y sus genes diana en células vasculares. En este estudio hemos querido caracterizar las propiedades reguladoras de la LOX en células endoteliales. Para ello, se ha analizado cómo afecta la sobreexpresión de LOX al patrón de expresión génica en células endoteliales humanas mediante microarrays. Entre los genes identificados mediante esta estrategia está la α2-macroglobulina (A2M), un inhibidor de proteasas de amplio espectro que puede desempeñar múltiples actividades biológicas10.
Material y métodosCultivo celularSe utilizaron células endoteliales humanas de vena de cordón umbilical (HUVEC) (proporcionadas por la Dra. M. Camacho, Hospital de la Santa Creu i Sant Pau, Barcelona). Las células, procedentes de entre 7-15 cordones, se cultivaron en medio M199 (Biological Industries) suplementado con 20mM de Hepes (pH 7,4), 20% de FCS, 1mM de piruvato sódico (Biological Industries), 30μg/ml de suplemento de crecimiento para células endoteliales (ECGS, Upstate Reactiva), 100μg/ml de heparina (SIGMA), antibióticos (0,1mg/ml de estreptomicina y 100 U/ml de penicilina G), y 2 mmol/l de L-glutamina, tal y como se describió previamente11. Las células se usaron entre los pases 3 y 5.
Construcción del vector lentiviral e infecciónEl cDNA correspondiente a la secuencia humana de la LOX se obtuvo a partir del clon HLO20 (clonado en pBluescript; proporcionado por el Dr Maki, Universidad de Oulu, Finlandia). Esta secuencia se clonó en el vector pLVX-Puro para generar el pLVX/LOX (Lenti-XTM Lentiviral Expression System; Clontech). Así mismo se generó un vector que expresaba la proteína verde fluorescente (GFP; pLVX/GFP) para evaluar la eficiencia de infección. Estas construcciones o el vector lentiviral vacío (pLVX-Puro) usado como control se transfectaron en células HEK 293T según el sistema Lenti-X HT Packaging System (Clontech) para obtener las partículas virales. Al cabo de 72h se recogió el sobrenadante celular que contenía las partículas virales. El título viral se determinó en células HeLa usando diluciones seriadas del virus y posterior selección con puromicina (Clontech) durante dos semanas. Se determinó el índice MOI (multiplicity of infection) para transducir un 90% de las células. Las HUVEC se sembraron en placas de 6 pocillos y se incubaron con los lentivirus recombinantes durante 36h en presencia de polybrene (8μg/ml). Pasados 5 días de selección con 0,7μg/ml de puromicina, se extrajo RNA de estas células que se utilizó para el análisis de expresión por microarray. La sobreexpresión de LOX mediante esta estrategia se confirmó mediante PCR a tiempo real y western-blot.
Extracción de RNAEl RNA total procedente de las células en cultivo se aisló mediante el reactivo RNeasy Mini Kit (Qiagen) según las instrucciones del fabricante. La cuantificación y verificación de la calidad del RNA se determinó mediante el RNA 6000 Nano Assay usando el equipo Agilent 2100 Bioanalyzer (Agilent Technologies). El índice RIN de estas muestras estuvo entre 9,6 y 9,812.
Estudios de expresión diferencial mediante microarraysLas consecuencias de la sobreexpresión de LOX en HUVEC se evaluaron comparando el patrón de expresión de células transducidas con el vector lentiviral vacío (pLVX-Puro) frente al de células transducidas con el vector pLVX/LOX. Para ello, el mRNA se amplificó y marcó dando lugar a fragmentos biotinilizados de cadena simple de DNA mediante el GeneChip® Whole Transcript (WT) Sense Target Labeling Assay (Affymetrix), que se hibridaron en microarrays (GeneChipTM Gene 1.0 ST Array; Affymetrix) según las indicaciones del fabricante. Se realizaron tres réplicas experimentales y dos réplicas técnicas por cada punto experimental. Los resultados se analizaron mediante el programa Partek Genomics Suite. Se consideraron significativos ratios de expresión génica superiores a 1,5 veces e inferiores a 0,5 para un false discovery rate (FDR) de 0,5.
PCR a tiempo realSe retrotranscribió 1μg de RNA total utilizando el High Capacity cDNA Reverse Transcription Kit (Applied Biosystems). La cuantificación de los niveles relativos de de mRNA se realizó mediante PCR a tiempo real utilizando el sistema ABIPRISM 7900 (Applied Biosystems) y oligonucleótidos y sondas TaqmanTM específicas Assay-on-DemandTM (Applied Biosystems) para la LOX (Hs00184700_m1), la LOX-like (LOXL)-1 (Hs00173746_m1), la LOXL2 (Hs00158757_m1), la LOXL3 (Hs00261671_m1), la LOXL4 (Hs00260059_m1) y la A2M (Hs00163474_m1), tal y como se describió previamente13. Los niveles de expresión de la proteína de unión a TATA (TBP, TATA-binding protein; HS99999910_m1) se usaron para normalizar los resultados9,14.
Western-blotPara la obtención del extracto de proteína total de HUVEC, la monocapa de células se lavó con tampón fosfato salino y se lisó con tampón de lisis (1% de dodecil sulfato sódico en 10mM Tris-HCl [pH 7,4], 1mM de ortovanadato). La concentración de proteína se determinó mediante el método del ácido bicinconínico (BCA Protein AssayTM, Pierce)15. Para confirmar la sobreexpresión de LOX en el espacio extracelular se concentró el sobrenadante de células transducidas con el vector lentiviral vacío o con el vector pLVX/LOX mediante la utilización de filtros Amicon Ultra 10K (Millipore)16. Los extractos proteicos se resolvieron mediante electroforesis en SDS (SDS-PAGE) en condiciones reductoras según el procedimiento descrito previamente. Las proteínas se transfirieron a membranas de nitrocelulosa de 0,45μm (Bio-Rad) que se incubaron con anticuerpos contra LOX (ab31238, Abcam). Los complejos antígeno-anticuerpo se detectaron mediante la incubación con un anticuerpo secundario conjugado a peroxidada utilizando como sustrato el reactivo SuperSignal West Dura Extendend Duration Substrate (Thermo Scientific). Las bandas correspondientes a la proteína de interés se visualizaron mediante autorradiografía por exposición en películas CURIX RP2 PLUS (Agfa). La homogeneidad de la carga proteica en cada carril se verificó mediante la tinción de Ponceau así como incubando la membrana con un anticuerpo contra β-actina (Sigma)15,16.
Análisis estadísticoLos resultados se expresan como media±desviación estándar. Las diferencias entre grupos se determinaron mediante ANOVA. Las diferencias se consideraron significativas a partir de p<0,05.
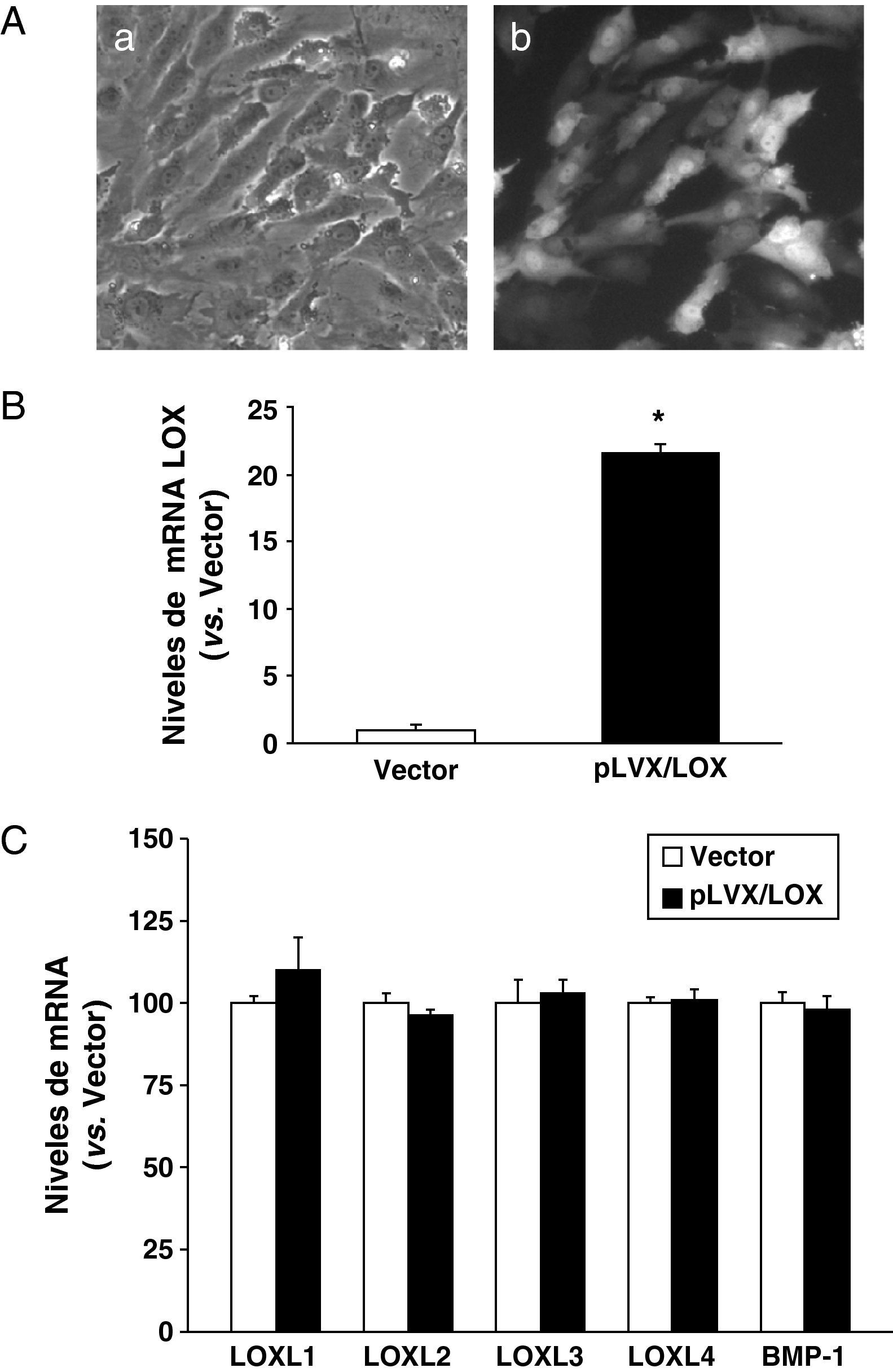
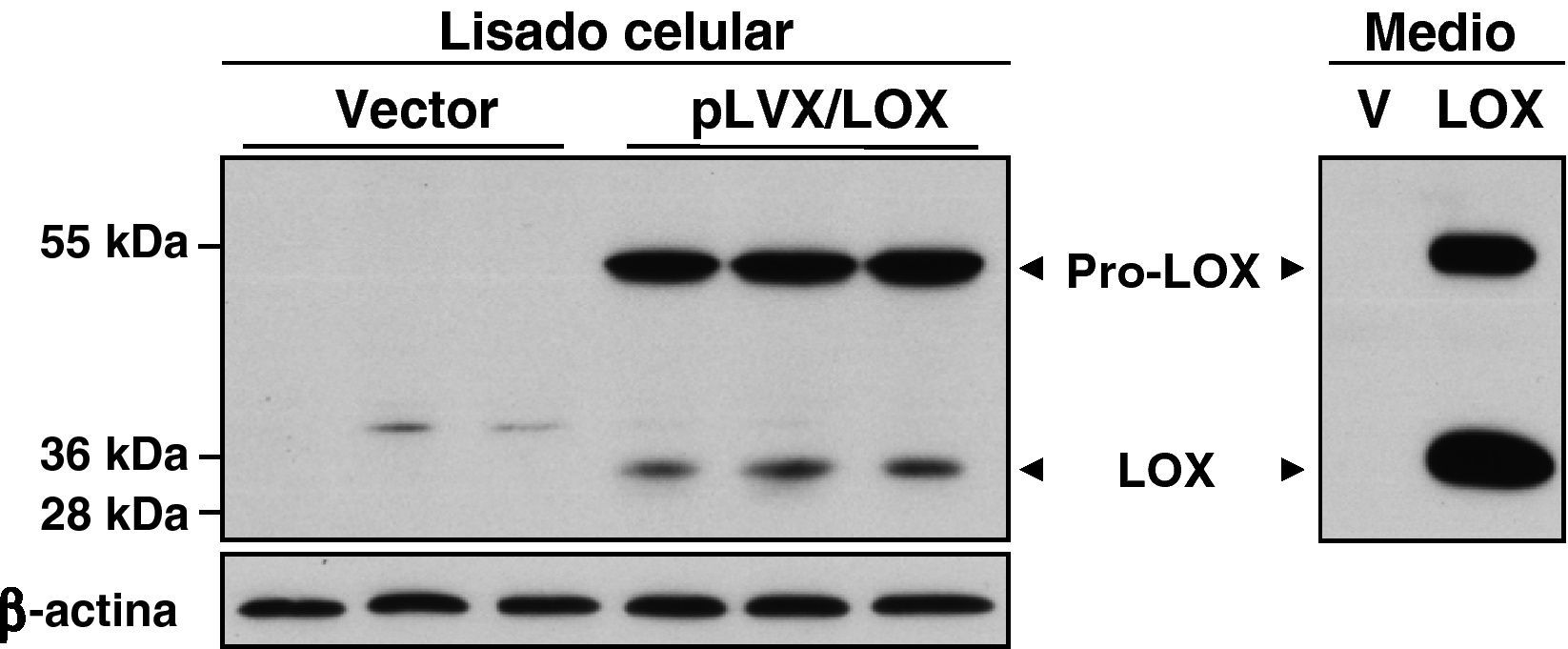
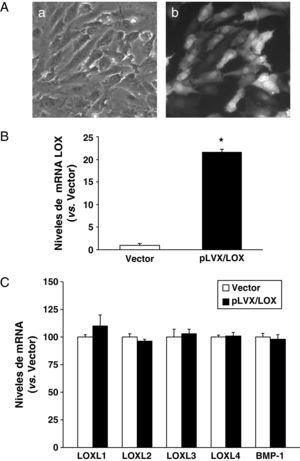
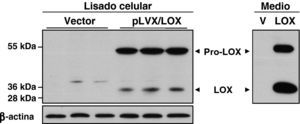
ResultadosDesarrollo de un sistema de expresión lentiviral para sobreexpresar LOX en HUVECLas células HUVEC se infectaron con partículas lentivirales que expresan LOX (pLVX/LOX), GFP (pLVX/GFP), o con las correspondientes al vector vacío (pLVX-Puro), y las células infectadas se seleccionaron con puromicina. Esta intervención no indujo cambios en el fenotipo celular ni en su viabilidad (datos no mostrados), y con ella se consiguió una eficiencia de infección superior al 80% estimada en base al nivel de expresión de GFP (fig. 1A). El nivel de mRNA de LOX se analizó mediante PCR a tiempo real. Como se observa, mediante la infección lentiviral la expresión de LOX se incrementó en más de 20 veces (fig. 1B). Por el contrario, la sobreexpresión de LOX no afectó al nivel de mRNA de otras isoformas pertenecientes a la familia de lisil oxidasas (LOX-like [LOXL]-1, LOXL2, LOXL3, LOXL4)13 ni modificó la expresión de la BMP-1 (fig. 1C). El incremento del nivel de mRNA de LOX se vio reflejado en los niveles de proteína. El análisis por western-blot del lisado celular demostró que la infección con el lentivirus recombinante que expresa LOX (pLVX/LOX) aumentó muy significativamente tanto el nivel de la forma madura de LOX (PM, 32 kDa) como el de la proenzima (PM, 45-50 kDa) en comparación con células transducidas con el vector lentiviral vacío. Análogamente, la sobreexpresión de LOX se tradujo en un aumento en el nivel de LOX (forma madura y proenzima) secretada al medio de cultivo (fig. 2).
El sistema de expresión lentiviral incrementa la expresión de LOX en HUVEC. A) Las células HUVEC se transdujeron con el vector lentiviral para GFP (pLVX/GFP) y se visualizaron en campo claro (a) o bajo fluorescencia (b) B) Las células HUVEC se transdujeron con el vector lentiviral vacío (vector; pLVX-puro) o con el pLVX/LOX. El nivel de mRNA de LOX (B), de sus isoformas (LOX-likes; LOXL) (C) y de la BMP-1 (C) se determinó mediante PCR a tiempo real. Los resultados, normalizados por el gen control (TBP), se expresan como la media±desviación estándar (n=3).
El sistema de expresión lentiviral incrementa en HUVEC el nivel de proteína LOX a nivel intra y extracelular. La sobreexpresión de LOX incrementó tanto el nivel de proenzima (pro-LOX; aprox 50 kDa) como el de LOX madura (LOX; 32 kDa), efecto evidente tanto en el análisis del extracto celular total como en el medio condicionado (Medio). Como control de carga se muestran los niveles de β-actina.
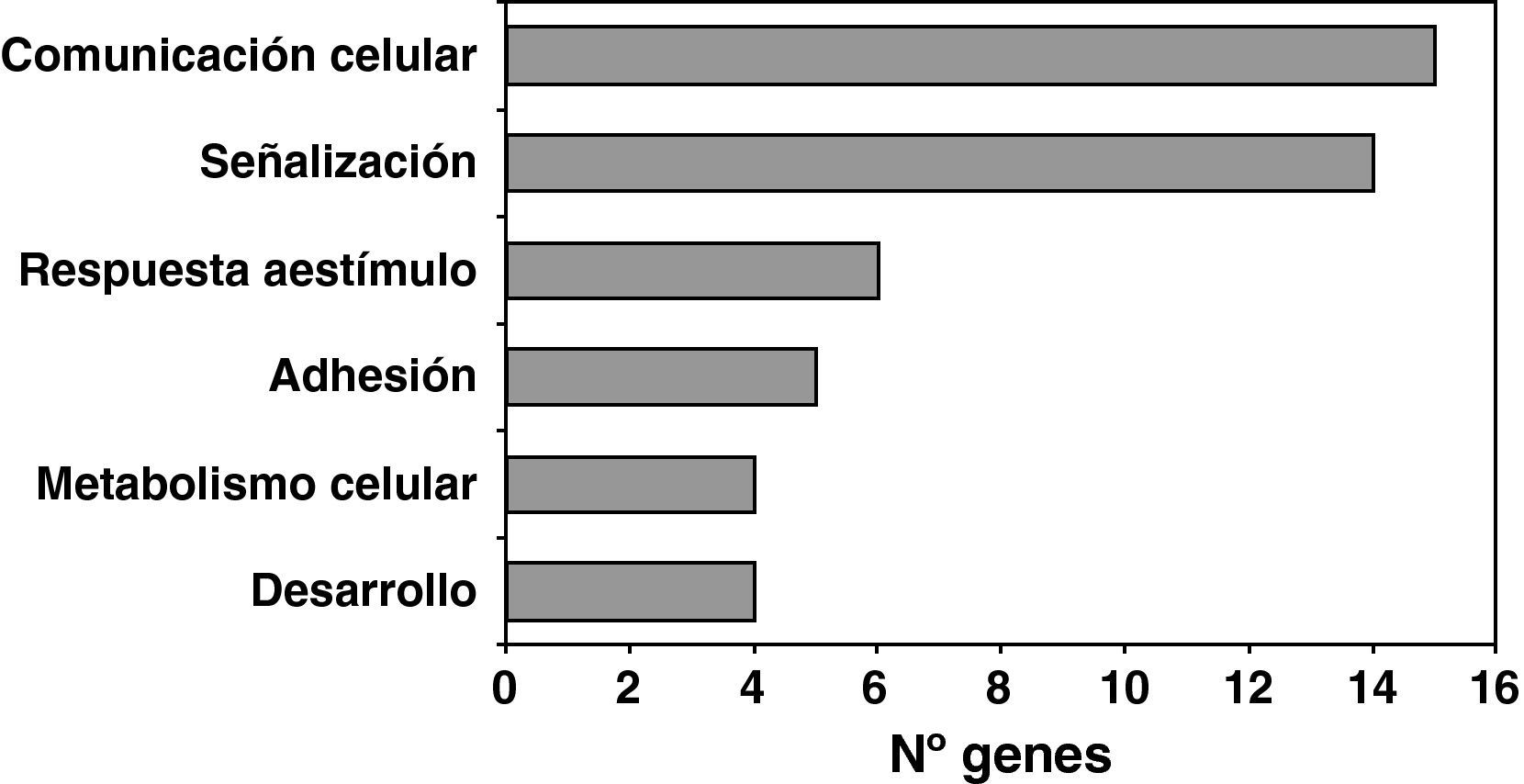
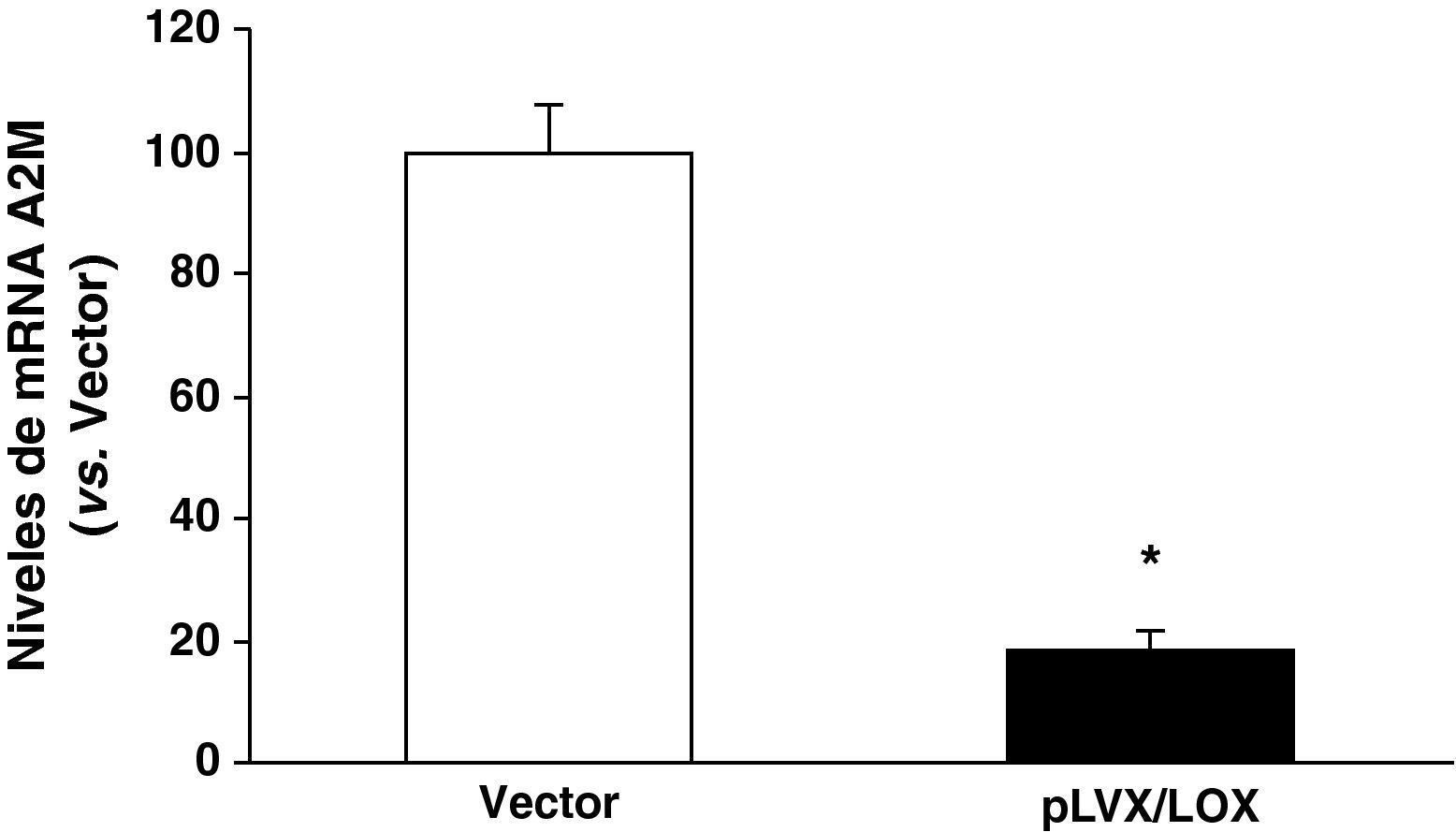
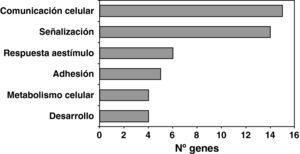
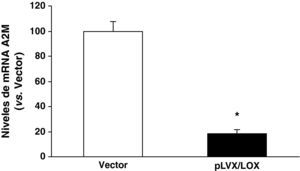
Una vez confirmada la eficiencia del sistema lentiviral para la sobreexpresión de LOX en HUVEC, analizamos las consecuencias de esta sobreexpresión sobre el perfil de expresión génica de estas células utilizando el sistema de microarray de Affymetrix (GeneChipTM Gene 1.0 ST Array). La sobreexpresión de LOX alteró significativamente la expresión de 62 genes. El análisis funcional por categorías o grupos realizado con el programa Partek Genomics Suite utilizando la base de datos Gene Ontology (GO) reveló la modificación significativa de genes implicados en señalización celular, comunicación célula-célula, genes de respuesta a estímulos y adhesión celular (fig. 3). Entre los genes más significativamente alterados por la sobreexpresión de LOX se encuentra la A2M, cuya expresión se inhibe significativamente (100±4.38 vs 47.3±7.006 p<0,001). Esta regulación se verificó mediante PCR a tiempo real en un análisis que incluyó las muestras utilizadas en el estudio de microarray y muestras generadas en una nueva infección. Como se observa en la figura 4, el análisis por PCR a tiempo real demostró que la expresión de la A2M se redujo en un 80% como consecuencia de la sobreexpresión de LOX.
La sobreexpresión de LOX reduce la expresión de la A2M en HUVEC. Las células HUVEC se transdujeron con el vector lentiviral vacío (vector; pLVX-puro) o con el pLVX/LOX. El nivel de mRNA de la A2M se determinó mediante PCR a tiempo real. Los resultados, normalizados por el gen control (TBP), se expresan como la media±desviación estándar (n=6).
En los últimos años ha surgido un interés creciente en el estudio de la biología de la LOX y su repercusión fisiopatológica debido al carácter multifuncional de esta enzima, que va más allá de su papel en el mantenimiento de la estructura de la MEX1–4. El descubrimiento de la actividad biológica del propéptido de LOX y de la existencia de formas intracelulares activas abre nuevas expectativas acerca de las funciones celulares que esta enzima pueda desempeñar17,18. De hecho, la LOX participa en el control de la transición epitelio-mesénquima, la diferenciación, la transformación y la migración celular, modula la actividad biológica de factores de crecimiento como el TGF-β y participa en la regulación de la expresión génica2,3. Efectivamente, un aspecto destacable de la LOX es su capacidad para regular la actividad transcripcional de otros genes, entre los que se incluyen el colágeno III y la elastina19,20, un efecto probablemente relacionado con la presencia de LOX en núcleo y con su capacidad de utilizar las histonas H1 y H2 como sustrato (fig. 5)18,21. Por tanto, parece evidente que la alteración de la actividad LOX puede afectar enormemente la homeostasis celular, lo que involucra a la LOX en diversos procesos patológicos2. En el contexto de la patología aterosclerótica, nuestros resultados indican que LOX tendría un papel relevante en el mantenimiento de la homeostasis vascular y más concretamente en el control de la función endotelial6–9. Por ello, en este estudio hemos caracterizado cómo afecta la sobreexpresión de LOX al perfil de expresión de la célula endotelial mediante una estrategia de microarrays.
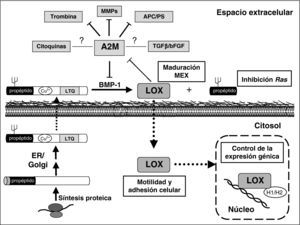
Se detalla el proceso de síntesis de la lisil oxidasa (LOX), sus funciones intra y extracelulares y las interacciones de la α-2-macroglobulina (A2M). La LOX se sintetiza en forma de proenzima y, tras su modificación en retículo endoplasmático y Golgi, se transloca al espacio extracelular en donde es proteolizada por la bone morphogenetic protein (BMP)-1. Este proceso libera la forma catalíticamente activa responsable de la estabilización de la MEX y un propéptido que, entre otras funciones biológicas, inhibe la transformación dependiente de Ras. Se han localizado formas catalíticamente activas en citosol y núcleo que participan en el control de la motilidad y adhesión celular y de la expresión génica, respectivamente. En HUVEC la sobreexpresión de LOX reduce el nivel de mRNA de la A2M, la cual inhibe metaloproteasas (MMPs), entre ellas la BMP-1, trombina (efecto anticoagulante) y el complejo APC/Proteína S (PS; efecto procoagulante). La interacción de la A2M con citoquinas y factores de crecimiento tiene consecuencias desconocidas, probablemente dependendientes del contexto celular. TGF: factor de crecimiento transformante; bFGF: factor de crecimiento de fibroblastos básico.
Nuestros resultados muestran la alta eficiencia del sistema lentiviral utilizado para la sobreexpresión de proteínas en células endoteliales, sobreexpresión que permite incrementar el nivel de proteína LOX en su forma proteolizada y catalíticamente activa, no sólo a nivel intracelular, sino también en el espacio extracelular. Cabe destacar que la sobreexpresión de LOX no se ve compensada por el resto de isoenzimas de la familia de lisil oxidasas, isoenzimas que si bien presentan actividad aminooxidasa probablemente tienen sustratos y funciones específicas en la vasculatura13. Entre los procesos biológicos regulados como consecuencia de la sobreexpresión de LOX en células endoteliales destacan los implicados en señalización celular y comunicación célula-célula, aspectos que pueden repercutir notablemente en la fisiopatología vascular.
La sobreexpresión de LOX en células endoteliales comporta una disminución muy significativa de la expresión de la A2M, un inhibidor de proteasas universal que se encuentra de forma abundante en el plasma y en el espacio extracelular10. Se sintetiza primariamente en el hígado, principal fuente de la A2M circulante; sin embargo, fibroblastos, astrocitos, células tumorales y macrófagos, entre otros, son capaces de secretar localmente esta proteína22–25. Aunque existe controversia respecto a su expresión en células endoteliales, la A2M ha sido también identificada en el endotelio de las arterias coronarias y de los vasos sanguíneos que irrigan el endometrio26,27, en concordancia con los resultados obtenidos en células HUVEC.
De entre las metaloproteasas fuertemente inhibidas por la actividad de la A2M cabe destacar la BMP-1, o procolágeno C-proteinasa, enzima que proteoliza el precursor de la LOX para dar lugar a la forma madura y catalíticamente activa de esta enzima28. Por tanto, a este nivel, la inhibición de la A2M promovería un incremento en los niveles de BMP-1 y una mayor activación proteolítica de la LOX, contribuyendo a la sobreexpresión de esta enzima (fig. 5). Hay que considerar que, además, la BMP-1 participa en el procesamiento biosintético de un amplio rango de precursores de la MEX, incluyendo colágenos fibrilares, prolaminina-5 y probiglican, así como promueve la liberación de un gran número de miembros de la superfamilia del TGF-β que se encuentran en forma latente (BMP-2, BMP-4, TGFβ1, entre otros)29. Por tanto, a través de múltiples mecanismos, la inhibición de la A2M potenciaría la síntesis y deposición de MEX incrementada ya por la propia sobreexpresión de LOX.
Además de interaccionar con virtualmente cualquier proteasa del espacio extracelular para promover su internalización y degradación lisosomal, en los últimos años se ha puesto en evidencia la extraordinaria capacidad de la A2M de unirse a una plétora de citoquinas y factores de crecimiento, entre los que se encuentran el factor de necrosis tumoral α (TNF-α), las interleucinas-1β, 2 y 6, el TGF-β y el factor de crecimiento de fibroblastos básico (bFGF) (fig. 5)10. En gran medida, el significado fisiológico de estas interacciones se desconoce. Se ha propuesto que, ante una situación inflamatoria, la interacción de la A2M con citoquinas y proteasas permitiría la eliminación rápida de estos agentes del punto focal en el que se liberaron y, por tanto, limitaría las acciones perjudiciales de estos efectores. Sin embargo, la unión a citoquinas y factores de crecimiento puede ser reversible y, tal y como se ha postulado en el caso del TGF-β, la A2M podría actuar como proteína transportadora que dirige a estos factores a su sitios de acción diana30. Destaca además el papel de la A2M en la regulación de la trombogénesis y la fibrinólisis, aspecto en el que esta proteína tendría un comportamiento dual, presentando efectos anticoagulantes, a través de la inhibición de la trombina, o procoagulantes, ya que suprime la formación del complejo anticoagulante APC/proteína S31–33. Por tanto, la A2M tendría la capacidad de modular múltiples respuestas biológicas en distintos tipos celulares10, lo que hace que pueda jugar un papel fundamental en el desarrollo de múltiples patologías. Queda por establecer las consecuencias fisiopatológicas que la inhibición de la A2M derivada de la sobreexpresión de LOX pueda ejercer sobre la homeostasis del endotelio.
FinanciaciónEste estudio ha sido financiado por la Fundación Española de Aterosclerosis, Beca SEA/FEA de Investigación básica 2009, el proyecto FIS PS09/01797 y la Red Temática de Investigación Cardiovascular (RECAVA; RD/06/0014/0027) del Instituto de Salud Carlos III, y el proyecto SAF2009-11949 del MICINN.
Conflicto de interesesLos autores declaran que no hay conflictos de intereses.
Agradecemos a la Dra. M. Camacho el suministro de células HUVEC y a Silvia Aguiló su apoyo técnico.