Se presenta un trabajo multidisciplinar realizado por especialistas de Cardiología, Hemostasia y Trombosis, Medicina Interna y Neurología en el que se exponen las evidencias científicas actuales que demuestran el mejor perfil de seguridad de los anticoagulantes orales de acción directa (ACOD) frente a los antivitaminaK (AVK) y se discuten indicaciones y el papel de los antídotos específicos y hemostáticos para la reversión del efecto anticoagulante. El análisis sugiere que el mejor perfil de seguridad de los ACOD los hace especialmente útiles en pacientes con alto riesgo hemorrágico.
A multidisciplinary panel of cardiologists, neurologists, internal medicine and specialists in hemostasis and thrombosis has elaborated this document showing recent scientific evidences supporting a better profile of direct oral anticoagulants (DOACs) versus vitaminK antagonists (VKA), as well as the indications of specific antidotes and hemostatic agents to reverse the anticoagulant effects of DOACs. The analysis reinforces the best profile of DOACs and its special benefit in patients with basal high hemorrhagic risk.
Este trabajo multidisciplinar, realizado por especialistas de Cardiología, Hematología, Medicina Interna y Neurología, expone sucintamente las evidencias científicas actuales que demuestran un mejor perfil de seguridad de los anticoagulantes orales de acción directa (ACOD) frente a los antivitaminaK (AVK). Además, considerando que en nuestro ámbito sanitario la financiación de la prescripción de ACOD está sometida a control administrativo, este análisis pretende concienciar sobre la preferencia de empleo de ACOD en los pacientes con perfil de riesgo hemorrágico elevado, como recomiendan las guías europeas de práctica clínica1.
¿Qué pacientes atendemos habitualmente en consulta con fibrilación auricular y necesidad de anticoagulación?Generalmente son enfermos con fibrilación auricular (FA) sin estenosis mitral moderada-severa o prótesis valvular mecánica pero que frecuentemente presentan enfermedad cardiaca estructural y otras comorbilidades, con un riesgo alto de complicaciones como ictus, insuficiencia cardiaca, demencia y elevada mortalidad. Son pacientes con una puntuación CHA2DS2VASc alta que precisan anticoagulación oral (ACO) y muy frecuentemente tienen además un elevado riesgo de sangrado, ya sea estimado mediante una puntuación ≥3 en la escala HAS-BLED1 o por la presencia de factores de riesgo hemorrágico modificables1. El ictus isquémico es una de las principales consecuencias de la FA y de todos los ictus isquémicos: aproximadamente el 20% tienen su origen en la FA, incluso si es silente. Estos ictus son generalmente graves y tienen un pobre pronóstico funcional, generando un índice elevado de ingresos y un incremento considerable del coste sanitario2,3. Para prevenir las complicaciones de la FA, y dependiendo del riesgo trombótico estimado por la escala CHA2DS2VASc1, es preciso instaurar ACO indefinida, tratamiento que no está exento de complicaciones, como la hemorragia mayor y la temida hemorragia intracraneal (HIC).
Los ACOD tienen mejor perfil de seguridad que los AVK1, y por ello nos parece prudente que los pacientes que tienen un alto riesgo hemorrágico basal reciban ACOD de forma preferente cuando inician terapia anticoagulante. Un ejemplo lo constituyen los pacientes con ictus extenso o síndrome coronario agudo añadido. La modificación de 2016 del documento de prescripción de ACOD ya incluye el uso preferente de ACOD en un supuesto: pacientes con alto riesgo trombótico y un HAS-BLED≥3.
Perfil de seguridad de los anticoagulantes de acción directaLos estudios principales y su metaanálisis confirman que la prevención del ictus en pacientes con FA es una estrategia más segura, sobre todo para evitar la hemorragia cerebral y la hemorragia mayor que amenazan la vida cuando se utilizan los cuatro ACOD disponibles frente a los AVK (tabla 1).
Resultados de seguridad de los estudios pivotales de ACOD vs warfarina
| Hemorragia (%) | RE-LYn=118.113Dabigatrán 110/150mg/12h vs warfarina | ROCKETAFn=14.264Rivaroxabán 20mg/día vs warfarina | ARISTOTLEn=18.201Apixabán 5mg/12h vs warfarina | ENGAGE-AFn=21.105Edoxabán 30, 60mg/día vs warfarina |
|---|---|---|---|---|
| Mayor | 2,71 vs 3,36, p=0,0033,11 vs 3,36, p=0,31 | 3,6 vs 3,4, p=0,58 | 2,13 vs 3,09, p<0,001 | 1,6 vs 3,43,2,75 vs 3,43, p<0,001 |
| Intracraneal | 0,23 vs 0,740,30 vs 0,74, p<0,005 | 0,5 vs 0,7, p=0,02 | 0,33 vs 0,80, p<0,001 | 0,26 vs 0,850,39 vs 0,85, p<0,001 |
| Gastrointestinal | 1,12 vs 1,02, p=0,431,51 vs 1,02, p<0,001 | 3,2 vs 2,2, p<0,001 | 0,76 vs 0,86, p=0,37 | 0,82 vs 1,23, p<0,0011,51 vs 1,23, p=0,03 |
En el estudio Randomized evaluation of long-term anticoagulation therapy (RE-LY)4, de comparación de dabigatrán frente a warfarina, se incluyeron 18.113 pacientes y se estudiaron dos dosis del fármaco: 110 y 150mg/12h. Los resultados de seguridad demostraron una incidencia de hemorragia mayor similar a warfarina con la dosis de 150mg y una reducción del 20% con la dosis de 110mg/12h. La incidencia de hemorragia intracraneal fue significativamente menor con ambas dosis de dabigatrán. El sangrado gastrointestinal mayor se incrementó un 48% con la dosis de 150mg/12h.
El estudio Rivaroxaban once daily oral direct factor Xa inhibition compared with vitaminK antagonism for prevention of stroke and embolism trial in atrial fibrillation (ROCKETAF)5 incluyó 14.264 pacientes en los que se comparó rivaroxabán 20mg/día frente a warfarina, y se evidenció una incidencia de sangrado mayor similar en el grupo de rivaroxabán y en el de warfarina El sangrado fatal, en órganos críticos e intracraneal era menos frecuente en el grupo de rivaroxabán. El sangrado mayor gastrointestinal fue un 46% mayor con rivaroxabán que con warfarina.
En el estudio Apixaban for reduction in stroke and other thromboembolic events in atrial fibrillation (ARISTOTLE)6, que incluyó 18.201 pacientes con FA y al menos un factor de riesgo de ictus, se comparó apixabán 5mg/12h frente a warfarina, y se demostró una reducción significativa del 31% de sangrados mayores en el grupo de apixabán vs warfarina. La incidencia de HIC fue significativamente menor con apixabán. La reducción del riesgo relativo de HIC era aún mayor en pacientes con un HAS-BLED ≥3 vs HAS-BLED0-1 (HR: 0,22 [IC95%: 0,10-0,48] vs 0,66 [0,39-1,12], p=0,064). Además, aunque no se encontró diferencia significativa entre apixabán y warfarina en la incidencia de hemorragia digestiva, esta fue un 11% inferior con apixabán.
Edoxabán, en dosis de 60 y 30mg/día, se comparó frente a warfarina en el estudio Effective anticoagulation with factor Xa next generation in atrial fibrillation—thrombolysis in myocardial infarction (ENGAGE-AF-TIMI 48)7, que incluyó 21.105 pacientes. La incidencia anual de hemorragia mayor e intracraneal fue significativamente menor con ambas dosis de edoxabán. La tasa anual de hemorragia mayor gastrointestinal fue más elevada con la dosis más alta de edoxabán que con warfarina, pero inferior con la dosis menor.
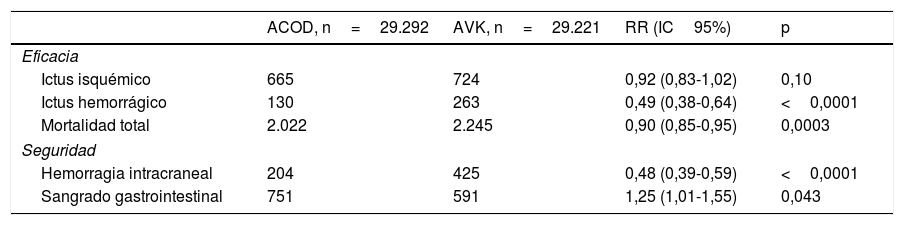
Por último, disponemos de un metaanálisis que incluye a los 71.683 pacientes de los cuatro estudios principales que ha hecho más comprensible el papel de los ACOD en la prevención del ictus en pacientes con FA. Ruff et al.8 demostraron que los ACOD disminuyen significativamente el ictus y el embolismo sistémico en un 19% comparado con warfarina (RR: 0,81; IC95%: 0,73-0,91; p<0,0001), principalmente por la disminución del ictus hemorrágico. Además, disminuyen significativamente todas las causas de mortalidad y la hemorragia intracraneal, aumentando sin embargo el sangrado gastrointestinal (tabla 2).
Metaanálisis que compara los eventos entre los ACOD y los AVK
| ACOD, n=29.292 | AVK, n=29.221 | RR (IC95%) | p | |
|---|---|---|---|---|
| Eficacia | ||||
| Ictus isquémico | 665 | 724 | 0,92 (0,83-1,02) | 0,10 |
| Ictus hemorrágico | 130 | 263 | 0,49 (0,38-0,64) | <0,0001 |
| Mortalidad total | 2.022 | 2.245 | 0,90 (0,85-0,95) | 0,0003 |
| Seguridad | ||||
| Hemorragia intracraneal | 204 | 425 | 0,48 (0,39-0,59) | <0,0001 |
| Sangrado gastrointestinal | 751 | 591 | 1,25 (1,01-1,55) | 0,043 |
Disponemos, por otro lado, de dos estudios realizados en la población de alto riesgo hemorrágico de enfermedad coronaria con revascularización e implantación de stent —PIONEER9 con rivaroxabán y REDUAL10 con dabigatrán— que demuestran mejor perfil de seguridad con doble terapia antitrombótica vs la triple terapia estándar.
El mundo real confirma el mejor perfil de seguridad de los ACODDisponemos en la actualidad de múltiples estudios de vida real y de un metaanálisis reciente con un número notable de pacientes de dabigatrán, rivaroxabán y apixabán11, puesto que aún no hay datos sobre edoxabán. Se incluyeron 28 estudios de rigurosa calidad de comparación de AVK y ACOD en pacientes con FA: 24 con dabigatrán, 14 con rivaroxabán y 7 con apixabán.
Los resultados referidos a la seguridad de los anticoagulantes son los siguientes:
DabigatránDabigatrán se asoció significativamente con una menor incidencia de hemorragia intracraneal en 12 estudios, con un total de 600.855 pacientes (HR: 0,42; IC95%: 0,37-0,49). No se encontraron diferencias significativas de hemorragia mayor entre dabigatrán y AVK en 13 estudios con un total de 348.896 pacientes (HR: 0,83; IC95%: 0,65-1,05)11. La hemorragia mayor gastrointestinal fue investigada en 10 estudios con 537.770 pacientes, que reportaron una incidencia mayor de sangrado gastrointestinal con dabigatrán vs AVK (HR: 1,20; IC95%: 1,06-1,36).
RivaroxabánRivaroxabán comparado con warfarina se asoció a una incidencia significativamente menor de hemorragia intracraneal en 7 estudios, con un total de 136.221 pacientes (HR: 0,64; IC95%: 0,47-0,86)11. No se encontraron diferencias significativas en la incidencia de hemorragia mayor entre rivaroxabán y AVK en 8 estudios con 167.532 pacientes (HR: 1,00; IC95%: 0,92-1,08)11. Se identificaron cuatro estudios con 71.368 pacientes que permitieron comprobar una incidencia de sangrado mayor gastrointestinal significativamente más frecuente con rivaroxabán vs AVK (HR: 1,24; IC95%: 1,08-1,41)11.
ApixabánApixabán comparado con AVK se asoció a una incidencia significativamente menor de hemorragia intracraneal en cuatro estudios con 66.482 pacientes (HR: 0,45; IC95%: 0,31-0,63)11, menor incidencia de hemorragia gastrointestinal mayor en dos estudios con 33.323 pacientes (HR: 0,63; IC95%: 0,42-0,95)9 y menor tasa de hemorragia mayor en cuatro estudios que incluían 89.036 pacientes (HR: 0,55; IC95%: 0,48-0,63)11.
En resumen, este metaanálisis de vida real muestra que los ACOD comparados con los AVK se asocian a menor incidencia de hemorragia intracraneal de forma uniforme, con un rango de reducción relativo que va del 36% para rivaroxabán al 58% para dabigatrán. En cuanto a la hemorragia mayor, apixabán se asoció a menor incidencia que AVK, y fue similar para rivaroxabán y para dabigatrán. El sangrado digestivo es mayor con dabigatrán y rivaroxabán que con AVK y menor con apixabán. Estos datos refuerzan la validez de las evidencias derivadas de los estudios principales.
¿Qué dicen las guías?La actual guía de la Sociedad Europea de Cardiología1 recomienda el empleo preferente de los ACOD frente a los AVK en pacientes con FA que inician ACO, con una indicación de claseI y evidenciaA. Esta recomendación deriva de varias ventajas de los ACOD frente a los AVK, como la mejor adherencia al tratamiento, la limitada interacción medicamentosa y con la comida, la no necesidad de ajuste de dosis y monitorización, pero principal y fundamentalmente por la disminución significativa de la hemorragia intracraneal que producen los ACOD comparados con los AVK.
La Sociedad Española de Cardiología adopta las recomendaciones de estas guías para el manejo de los antitrombóticos en la FA en nuestro país. Sin embargo, la financiación de la prescripción de ACOD en nuestro entorno está supeditada a un informe de posicionamiento terapéutico nacional y a un visado diferente por las distintas comunidades autónomas, lo que obliga a definir muy bien qué población se beneficia más de los ACOD.
Como hemos señalado, las evidencias científicas sobre los cuatro ACOD son consistentes en demostrar el mejor perfil de seguridad de estos sobre los AVK, sobre todo por la reducción de hemorragias cerebrales. Por ello, y aunque no existen estudios para la población específica de alto riesgo hemorrágico, parece razonable sugerir que los pacientes con FA, y especialmente aquellos con alto riesgo hemorrágico, sean candidatos a recibir ACOD de inicio preferentemente12.
Hemorragia cerebral y perfil de seguridad de los anticoagulantes directosLa hemorragia cerebral (HC) es la complicación más grave del tratamiento anticoagulante, y el 10-25% de todas las HC ocurren en pacientes en tratamiento con AVK. Además, esta es más grave porque la inhibición de la coagulación conlleva mayor riesgo de crecimiento del hematoma y mayor mortalidad13.
El uso cada vez más extendido de la anticoagulación en pacientes de edad avanzada con FA ha originado un aumento de la frecuencia de HC secundaria. Por ello, se debe priorizar la utilización de anticoagulantes que asocien un menor riesgo hemorrágico en estos pacientes, especialmente en aquellos con antecedentes de sangrado cerebral previo.
Los ACOD probablemente modificarán esta tendencia, dado que han demostrado menor riesgo de HC que los AVK. El metaanálisis de los ensayos clínicos ha confirmado el beneficio neto de los ACOD en todos los subgrupos de pacientes, con una reducción del riesgo relativo de HC de aproximadamente el 50% con respecto a los AVK, aunque con mayor riesgo de sangrado gastrointestinal8. En vida real los ACOD en pacientes con FA confirman este perfil más favorable frente a AVK, con datos incluso mejores que en los ensayos clínicos11.
El uso de ACOD conlleva tener en cuenta los factores que aumentan la HC y dosificarlos de forma adecuada: la edad avanzada, el peso corporal inferior a 50kg, la alteración en la función renal, el uso concomitante de fármacos antiagregantes, de inhibidores de glicoproteína-P (amiodarona, quinidina, verapamilo) o de inhibidores de recaptación de serotonina (con dabigatrán) y la trombocitopenia. En cuanto al uso concomitante de antiagregantes, un metaanálisis de los cuatro ensayos principales de ACOD que compara los pacientes con terapia dual con antiplaquetarios frente a los pacientes en tratamiento con el ACOD en monoterapia concluye que la combinación no reduce los eventos tromboembólicos y aumenta el riesgo de complicaciones hemorrágicas14.
En ausencia de estudios que comparen directamente el perfil de seguridad de los distintos ACOD, un metaanálisis que incluía 6 estudios concluyó que dabigatrán, rivaroxabán y apixabán reducen el riesgo de sangrado intracraneal en FA, sin diferencias significativas entre ellos, y que cualquiera puede ser usado en pacientes con elevado riesgo de hemorragia15.
Particularidades y manejo de la hemorragia cerebral asociada a ACODAunque los ACOD asocian menor riesgo de HC, con el aumento de pacientes tratados se está produciendo un incremento del número de HC secundarias a estos fármacos16,17. Los factores clásicamente relacionados con mal pronóstico de la HC son los mismos para los ACOD, fundamentalmente la gravedad clínica al ingreso, el tamaño del hematoma, su crecimiento precoz y la presencia de sangre intraventricular18.
Diversos estudios muestran que la HC por ACOD es igualmente grave, con un curso clínico, pronóstico y mortalidad similares a los producidos por AVK o antiagregantes19, con crecimiento del hematoma en los primeros días en el 38% de los casos y aumento secundario de la sangre intraventricular en el 18%, asociando una mortalidad o dependencia del 65%. Sin embargo, en otro registro multicéntrico prospectivo se objetivó que los pacientes con HC por ACOD vs HC por AVK tenían una afectación neurológica inicial más leve y un tamaño menor del hematoma inicial. En dicho estudio se realiza además un metaanálisis de estudios observacionales y se concluye que el pronóstico a los 3meses es mejor en el caso de las hemorragias por ACOD, con menor mortalidad20. En definitiva, parece que la HC producida por ACOD no es más grave ni tiene peor pronóstico que las producidas por AVK.
La HC por anticoagulantes orales ofrece la posibilidad de tratamiento activo mediante la reversión de la anticoagulación. Las guías terapéuticas recomiendan suspender el fármaco anticoagulante y revertir su efecto lo antes posible, aunque no hay evidencias de que ello se asocie a una mejoría de la evolución18. El tratamiento de los sangrados por anticoagulantes se describe con detalle más adelante.
Reintroducción de la anticoagulación oral en pacientes con antecedentes de hemorragia cerebral. Recomendaciones del uso de ACODDecidir en qué pacientes se podrá reintroducir el tratamiento anticoagulante y en qué momento hacerlo no es sencillo. Actualmente las guías clínicas recomiendan individualizar la decisión en función del riesgo trombótico y hemorrágico y las características del paciente, y reintroducir la anticoagulación en casos de alto riesgo de tromboembolismo21 (tabla 3). Para valorar el riesgo de recurrencia de sangrado se recomienda tener en cuenta los factores de riesgo contemplados en la escala HAS-BLED1, con especial atención al control de la presión arterial. Se han descrito algunas características de las hemorragias que podrían asociarse a un aumento del riesgo de recurrencias, como la localización lobular, la existencia de microsangrados que sugieran una angiopatía amiloide —las guías no recomiendan reintroducir la anticoagulación en estos casos— y los signos radiológicos de leucoenfalopatía vascular o leucoaraiosis. Los antecedentes de insuficiencia cardiaca y diabetes también asocian mayor riesgo21.
Factores que influyen en la decisión de reintroducir el tratamiento anticoagulante tras una hemorragia cerebral
| A favor de reintroducir anticoagulante | En contra de reintroducir anticoagulante |
|---|---|
| Localización profunda del hematomaCHA2DS2VASc elevadoHAS-BLED bajoIndicación de prevención secundaria (ictus isquémico previo)Válvula mecánicaEstado de hipercoagulabilidadBuen control de la presión arterial | Localización lobular del hematomaMicrosangrados en RMCHA2DS2VASc bajoHAS-BLED elevadoHTA mal controlada |
HTA: hipertensión arterial; RM: resonancia magnética.
Estudios recientes demuestran que la reintroducción de la anticoagulación en pacientes con FA que han sufrido una HC se asocia a una reducción significativa del riesgo de ictus isquémico y de mortalidad de cualquier causa, en comparación con la suspensión del tratamiento de forma mantenida o la sustitución por antiplaquetarios, sin que haya una diferencia significativa en el riesgo de recurrencia de la hemorragia entre los distintos grupos de tratamiento. Un metaanálisis de tres estudios observacionales concluye, además, que la reintroducción de la anticoagulación se asocia a mejor evolución funcional de los pacientes, incluso con angiopatía amiloide, si el riesgo de tromboembolismo es alto22. A la vista de estos datos, parece que la reintroducción de la anticoagulación es segura, y que la antiagregación en sustitución de la ACO no sería una alternativa útil, en contra de las recomendaciones actuales de las guías. En pacientes con elevado riesgo hemorrágico y contraindicación para ACOD el cierre percutáneo de la orejuela podría ser una alternativa a la ACO, y si bien los estudios disponibles no son concluyentes, se precisa un periodo posterior de 6meses de doble antiagregación, y la recomendación de las guías es una clase de indicaciónIIB.
Puesto que los pacientes con antecedentes de HC fueron excluidos de los ensayos principales con ACOD, y dado que hay pocos casos de tratamiento con ACOD recogidos en los estudios observacionales, la información existente sobre la utilidad de estos fármacos en estas situaciones es escasa y habrá que esperar a los resultados los estudios aleatorizados en curso. No obstante, los ACOD son una alternativa en pacientes con FA que sobreviven a una HC por AVK dado su riesgo hemorrágico menor, semejante al de la aspirina en monoterapia11.
El momento de la reintroducción del anticoagulante tampoco está claro, con discrepancias entre los escasos estudios disponibles. Las guías recomiendan entre 4 y 8semanas tras el cese del sangrado, y consideran la posibilidad de que sea precoz (2semanas) en casos de alto riesgo de tromboembolismo (tabla 3).
Hemorragia digestiva con anticoagulantes directosLa hemorragia digestiva (HD) es la complicación hemorrágica más frecuente del tratamiento anticoagulante23. Los estudios post hoc, los diferentes metaanálisis y los numerosos estudios de vida real han confirmado los datos de los estudios principales de ACOD. En comparación con warfarina, la HD mayor es más frecuente con dabigatrán a dosis de 150mg cada 12h, con rivaroxabán y con edoxabán a dosis de 60mg al día, pero no está aumentada con apixabán. En la patogenia de la HD relacionada con ACOD, además de su efecto anticoagulante sistémico, que favorece el sangrado por cualquier lesión preexistente de la mucosa del tubo digestivo, intervienen un efecto anticoagulante tópico debido a una absorción incompleta del fármaco, un efecto cáustico directo en el caso del ácido tartárico con el dabigatrán y un efecto de inhibición de la curación de la mucosa. En comparación con la HD mayor relacionada con warfarina, antiagregantes o antiinflamatorios no esteroideos (AINE), el sangrado relacionado con dabigatrán (y quizá con los otros ACOD) ocurre con mayor frecuencia en el tubo digestivo inferior, generalmente el intestino delgado. La asociación de HD mayor con edad avanzada en pacientes que toman ACOD puede reflejar una actividad anticoagulante tópica ejercida sobre lesiones frecuentes, vulnerables y asintomáticas, tales como erosiones en mucosas o angioectasias24.
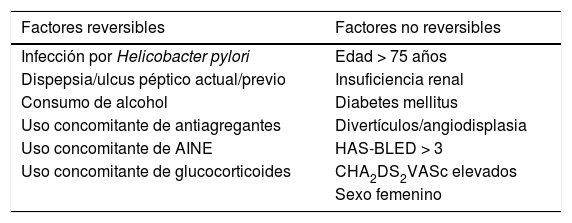
El riesgo de HD con ACOD se incrementa con factores reversibles y tratables y no reversibles (tabla 4). Se ha desarrollado un nuevo modelo de escala predictiva para el riesgo de HD aguda en pacientes que toman ACO, basado en cinco factores (no utilización de inhibidores de la bomba de protones [IBP], enfermedad renal crónica, EPOC, antecedentes de úlcera péptica y cirrosis hepática), que ha sido superior a la escala HAS-BLED25. Por el contrario, la utilización de IBP reduce el riesgo de HD en pacientes que reciben ACOD, sobre todo dabigatrán. Esta asociación es más fuerte para la HD alta que para la baja y en los pacientes con antecedentes de úlcera péptica o HD previa.
Factores que incrementan el riesgo de hemorragia digestiva con ACOD
| Factores reversibles | Factores no reversibles |
|---|---|
| Infección por Helicobacter pylori | Edad > 75 años |
| Dispepsia/ulcus péptico actual/previo | Insuficiencia renal |
| Consumo de alcohol | Diabetes mellitus |
| Uso concomitante de antiagregantes | Divertículos/angiodisplasia |
| Uso concomitante de AINE | HAS-BLED > 3 |
| Uso concomitante de glucocorticoides | CHA2DS2VASc elevados |
| Sexo femenino |
Las contraindicaciones gastrointestinales para el empleo de anticoagulantes son: el sangrado activo, las úlceras activas, la angiodisplasia hemorrágica, la hemorragia recidivante con necesidad de transfusiones repetidas, la presencia de lesiones gastrointestinales potencialmente hemorrágicas inaccesibles a los tratamientos endoscópicos o quirúrgicos y la cirrosis hepática en estadio Child-PughC. El antecedente de HD tiene un riesgo de recidiva pero no contraindica la anticoagulación definitivamente. Sin embargo, la mayoría de las contraindicaciones gastrointestinales para el uso de ACOD son temporales26.
Si un paciente anticoagulado tiene un episodio de HD, el momento de la realización de la endoscopia dependerá de la gravedad de la HD y de la situación hemodinámica del paciente. En los enfermos estables la endoscopia puede retrasarse 12-24h, y así se aumenta la visualización, la efectividad y la seguridad de la intervención, y una mejor limpieza del colon en la endoscopia baja. Por el contrario, en el paciente con HD grave e inestable hemodinámicamente la endoscopia debería realizarse con prontitud después de la estabilización. Las intervenciones radiológicas, quirúrgicas o ambas son el último recurso cuando falla el tratamiento endoscópico26.
La decisión de reanudar el tratamiento con ACOD y el momento óptimo para ello tras la HD debe ser individualizada y a menudo multidisciplinar, y depende del riesgo tromboembólico, del riesgo de recidiva hemorrágica y de la indicación de los ACOD. En el caso de la enfermedad tromboembólica venosa (ETV), si han transcurrido ≥3meses desde el episodio agudo y no es recidivante, no se trata de una trombofilia grave o una embolia pulmonar masiva o submasiva, debe considerarse firmemente la suspensión del tratamiento anticoagulante. En la mayoría de los casos de fibrilación auricular no valvular (FANV), si se ha solucionado la causa de la HD puede y debe reanudarse el tratamiento con ACOD lo antes posible26. Además, si el paciente tomaba rivaroxabán, dabigatrán a dosis de 150mg cada 12h o edoxabán, debería cambiarse el tratamiento a apixabán, de menor riesgo de HD en cualquier grupo de edad. En los mayores de 75años es preciso ajustar las dosis escrupulosamente a la función renal, que a menudo es cambiante.
Una de cada 12 HD mayores en pacientes con FA que toman AVK o dabigatrán está ocasionada por un cáncer subyacente. Se ha recomendado la realización de la prueba de sangre oculta en heces a todos los pacientes con ACOD, sobre todo durante el primer periodo del tratamiento. La HD franca u oculta en el enfermo que recibe tratamiento anticoagulante requiere siempre investigación27.
Aunque la HD puede ser grave, no puede igualarse en su repercusión clínica con el ictus cardioembólico o con la HIC, y en general el beneficio neto se considera favorable a los ACOD28. La mortalidad de la HD relacionada con anticoagulantes es, en general, baja, y puede ser menos grave en los pacientes que toman ACOD29.
¿Cómo actuar en caso de sangrado?Los pacientes que reciben ACOD pueden requerir una neutralización rápida de la actividad anticoagulante en situaciones de hemorragia con riesgo vital o en órgano crítico (intraocular, intraespinal, retroperitoneal, etc.), o que persiste a pesar de las medidas hemostáticas, así como en casos de cirugía urgente en pacientes con alto riesgo hemorrágico. La evaluación inicial de estos pacientes requiere determinar la gravedad de la hemorragia y el momento de la última toma del ACOD y monitorizar la función renal y la coagulación mediante pruebas específicas que determinen la intensidad de anticoagulación, como el tiempo de trombina diluido y test de ecarina para dabigatrán y actividad anti-Xa en el caso de inhibidores del factorXa30,31. Para el tratamiento de la hemorragia debe considerarse, asimismo, la vida media (aproximadamente 12h en adultos) y el grado de eliminación renal del fármaco (superior con dabigatrán). El tratamiento va a depender de la intensidad del cuadro: en hemorragias leves, la suspensión del fármaco acompañada de hemostasia local será suficiente; en hemorragias moderadas, además de la hemostasia quirúrgica y medidas de soporte (fluidoterapia, soporte hemodinámico y hemoderivados), se considerará el lavado gástrico, si la ingestión fue en las 2h previas y la hemodiálisis en caso de dabigatrán; en hemorragias graves o con riesgo vital, además de la suspensión del ACOD y medidas de soporte, se considerará cirugía o embolización, diálisis (si dabigatrán) y empleo de antídotos31,32 (tabla 5).
Tratamiento de la hemorragia en pacientes que reciben ACOD
| Revisar |
| Stop anticoagulación |
| Tiempo última dosis |
| Medicaciones previas |
| Parámetros de coagulación |
| Función renal |
| Fluidoterapia |
| Hemoterapia |
| Remover |
| Lavado gástrico |
| Carbón activado |
| Diálisis (dabigatrán) |
| Reparar |
| Hemostasia quirúrgica |
| Revertir |
| Dabigatran: idaruzizumab |
| Inhibidores factor Xa: concentrado complejo protrombínico |
Las opciones terapéuticas para la reversión de los ACOD pasan por agentes no específicos, como los concentrados de complejo protrombínico, cuya eficacia y seguridad son limitadas, siendo escasas las series que demuestran que son parcialmente efectivos y bastante seguros en el control de la hemorragia por inhibidores del factorXa.
Entre los antídotos específicos, en la actualidad solo idarucizumab (Praxbind®) ha obtenido aprobación en nuestro país para uso clínico en la reversión de dabigatrán. Se trata de un anticuerpo monoclonal humanizado que inhibe específicamente el efecto anticoagulante de dabigatrán. En el estudio en faseIII REVERSE-AD se observó una rápida reversión del efecto anticoagulante inducido por dabigatrán cuando se administra idarucizumab a la dosis de 5g por vía intravenosa, con cese de la hemorragia a las 3-5h. A los 90días el 6,3% de los pacientes presentaron complicaciones trombóticas. Los resultados de este estudio indican que idarucizumab es de gran eficacia para el control de la hemorragia relacionada con dabigatrán si se administra precozmente33. Por consiguiente, idarucizumab es el agente recomendado para la reversión del dabigatrán en casos de hemorragia grave o cirugía urgente, mientras que la eficacia de agentes empleados para la reversión de AVK, como los concentrados de complejo protrombínico, es controvertida. En la actualidad se están llevando a cabo ensayos clínicos con antídotos específicos para los inhibidores del factorX, como andexanet alfa, este muy avanzado y con aprobación reciente por la FDA, así como con pequeñas moléculas, como ciraparantag, también activas frente a heparinas, y fondaparinux.
En resumen, los antídotos de los ACOD estarían indicados en pacientes con hemorragia mayor o con riesgo vital, en pacientes inestables hemodinámicamente, con deterioro de la función renal, o que no responden a las medidas de soporte34.
ConclusionesLa presente revisión confirma el mejor perfil de seguridad de los ACOD sobre los AVK en pacientes con FA que precisan tratamiento anticoagulante. En los pacientes que presentan un riesgo hemorrágico elevado debería considerarse la terapia anticoagulante inicial con ACOD.
Grupo de Trombosis Cardiovascular de la Sociedad Española de Cardiología: Francisco Marín, José Luis Ferreiro, Vanessa Roldán, David Vivas.
Neurología: Ana Morales.
Medicina Interna: Luciano López Jiménez, José María Cepeda Rodrigo.
Hematología: Pere Domenech.
Ninguno.