La eficacia de los fibratos en el tratamiento de la dislipemia aterogénica, con una excelente repuesta en los pacientes con hipertrigliceridemia, obliga a considerar el tratamiento combinado de una estatina con un fibrato en los casos en los que es preciso controlar el colesterol unido a lipoproteínas de baja densidad (cLDL), pero que, además, y al margen de que se hayan alcanzado objetivos terapéuticos en cLDL, sea preciso controlar la hipertrigliceridemia, acompañada o no de cifras bajas de colesterol unido a lipoproteínas de alta densidad (cHDL). Los 2 factores determinantes de riesgo residual de origen lipídico son: la falta de control en cLDL y/o en la dislipemia colesterol no LDL dependiente. En consecuencia, sobre todo en los pacientes de alto riesgo, o en los que ya han sufrido enfermedad cardiovascular (CV), la prevención de las recurrencias pasa por optimizar el tratamiento hipolipemiante empleando —en su caso— una combinación de fármacos, en la que siempre se tendrá en consideración la eficacia y seguridad que ofrece una asociación de estatina con fenofibrato.
¿Cuál es el objetivo fundamental al tratar a los pacientes con dislipemia aterogénica?Las enfermedades CV continúan siendo la primera causa de mortalidad. Los valores elevados de cLDL son el mayor predictor de enfermedad CV y constituyen el objetivo primario en el tratamiento de las dislipemias1,2. El descenso del cHDL y el aumento de los triglicéridos (TG) también se asocian con un incremento de riesgo CV. Estas alteraciones se relacionan frecuentemente con situaciones de resistencia a la insulina, como la diabetes mellitus (DM) tipo 2 y la obesidad, que constituyen la denominada dislipemia aterogénica. Esta dislipemia se caracteriza por la elevación de los TG, el descenso del cHDL, hiperlipemia posprandial y cambios cualitativos de las partículas de cLDL, con aumento de las partículas LDL pequeñas y densas.
La prevalencia estimada de la dislipemia aterogénica suele ser muy elevada, aunque varía según la población estudiada; en los pacientes con diabetes, a pesar del tratamiento con estatinas, casi el 50% presenta anormalidades lipídicas compatibles con dislipemia aterogénica3. En unidades de lípidos en nuestro medio, el 20% de los pacientes presenta esta alteración en la primera consulta realizada4.
Los criterios diagnósticos para la dislipemia aterogénica se basan en los valores de TG y cHDL. Los TG son un factor independiente de riesgo CV. En el momento actual, valores de TG > 150 mg/dl se consideran como marcador de incremento de riesgo, aunque no hay evidencia de la disminución del riesgo por conseguir cifras < 150 mg/dl mediante tratamiento. Las bajas concentraciones de cHDL son también un factor de riesgo independiente; aunque no existe suficiente evidencia para considerar un valor determinado como objetivo terapéutico, en general se considera que valores < 40 mg/dl en varones y < 50 mg/dl en mujeres se pueden considerar como marcadores de incremento de riesgo CV5.
En el tratamiento de las dislipemias, las estatinas siguen siendo la primera elección para disminuir el cLDL; sin embargo, sabemos que el tratamiento con estatinas no elimina totalmente el riesgo CV residual asociado a dislipemia aterogénica6. En pacientes con TG > 200 mg/dl, el colesterol no HDL (colesterol total menos cHDL), que engloba tanto el cLDL como las lipoproteínas ricas en TG, es un objetivo secundario del tratamiento1,2. En este sentido, los fibratos han mostrado su eficacia, especialmente para reducir las cifras de TG, además de para modificar los diferentes parámetros de la dislipemia aterogénica. El tratamiento combinado estatina-fibratos es más eficaz que la monoterapia para la reducción del riesgo CV y se asocia con un menor riesgo de episodios CV7.
En general, ante un paciente con riesgo CV elevado, el objetivo fundamental es conseguir el valor adecuado de cLDL, ya que con cada descenso de 38 mg/dl (1 mmol/l) de cLDL se reduce el riesgo CV en un 20-25%. Conseguido este objetivo mediante el tratamiento con estatinas, si las cifras de TG superan los 150 mg/dl y las de cHDL < 40 o 45 mg/dl (dependiendo del sexo) es adecuado el tratamiento asociado de estatinas y fibrato (fenofibrato de elección); la intolerancia a los fibratos permite como alternativa el uso de los ácidos grasos omega-3.
Recomendaciones
- •
En los pacientes con riesgo CV: enfermedad CV establecida, DM (tipos 1 y 2) con ≥ 1 factor de riesgo CV (FRCV) o lesión de órgano diana (microalbuminuria), enfermedad renal crónica (ERC) con filtrado glomerular (FG) < 30 ml/m/1,73 m2 y SCORE > 10%, el objetivo primario de tratamiento es mantener el cLDL ≤ 70 mg/dl (o reducción del 50%).
- •
En los pacientes con riesgo CV alto: varios FRCV, DM (tipos 1 y 2) sin FRCV y sin lesión de órgano diana, ERC con FG 30-59 ml/m/1,73 m2, SCORE 5-10%, el objetivo primario es mantener el cLDL < 100 mg/dl.
- •
Con riesgo CV moderado: SCORE ≥ 1 y < 5%, el objetivo primario es cLDL < 100 mg/dl.
- •
Sin embargo, es preciso considerar otros objetivos diferentes al cLDL:
- -
En pacientes con TG > 200 mg/dl un objetivo secundario es el colesterol no HDL (30 mg/dl más que el cLDL).
- -
La apo B < 80 o < 100 mg/dl se puede plantear como objetivo según el riesgo CV muy alto o alto, respectivamente.
- -
No hay objetivos concretos para cHDL y TG, aunque se reconoce su papel en el riesgo CV.
- -
- •
Por este motivo, las guías recomiendan unos TG < 150 mg/dl y un cHDL > 40/45 mg/dl (varón/mujer) en los casos en los que se planteen objetivos secundarios por existir una dislipemia aterogénica.
Un hecho clínico conocido es que muchos pacientes con dislipemia aterogénica experimentan un primer episodio o episodios recurrentes de accidentes cardiovasculares (CV) en su evolución, a pesar de un tratamiento optimizado de acuerdo con las guías clínicas actuales. De hecho, en los pacientes tratados con estatinas persiste un riesgo de accidentes coronarios, que se puede estimar en aproximadamente un 77% del inicial1,2.
Los estudios epidemiológicos han sido concluyentes al comprobar que un valor bajo de cHDL (menor a 40 mg/dl en el varón y a 50 mg/dl en la mujer) es un factor de riesgo independiente para la cardiopatía isquémica. Un análisis de 4 estudios poblacionales prospectivos permite calcular que por cada descenso de 1 mg/dl en cHDL plasmático, el riesgo de enfermedad coronaria se incrementa en un 2-3%, independientemente de otros factores de riesgo, incluido el cLDL.
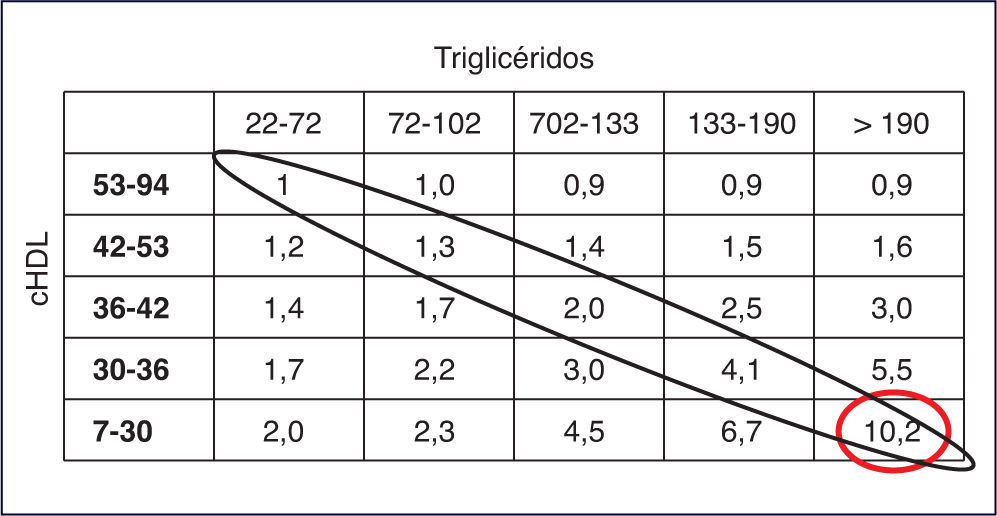
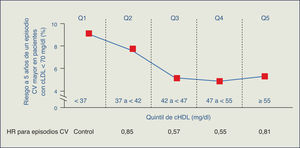
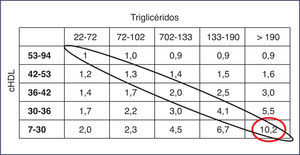
En el estudio PROCAM (Prospective Cardiovascular Münster), el riesgo CV para padecer un infarto agudo de miocardio se multiplica por 5 en pacientes que, teniendo controlado el cLDL, presentan aumento de TG y/o descenso de cHDL. En el estudio REALIST (Residual Risk Lipids and Standard Therapies), los TG y el cHDL están íntimamente ligados al riesgo residual en pacientes con síndrome coronario agudo, y contribuyen a dicho riesgo aun en presencia de cLDL < 130 mg/dl e incluso de 70 mg/dl. Además, TG y cHDL actúan de manera sinérgica, de tal forma que las cifras más elevadas de TG y las más bajas de cHDL multiplican por 10 el riesgo de enfermedad coronaria.
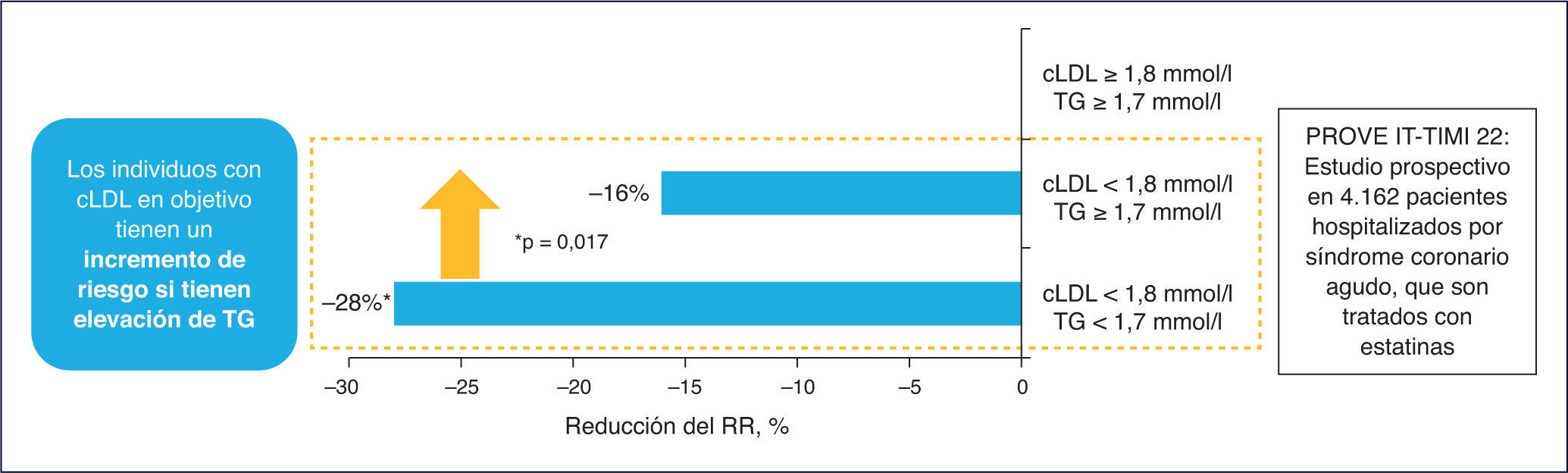
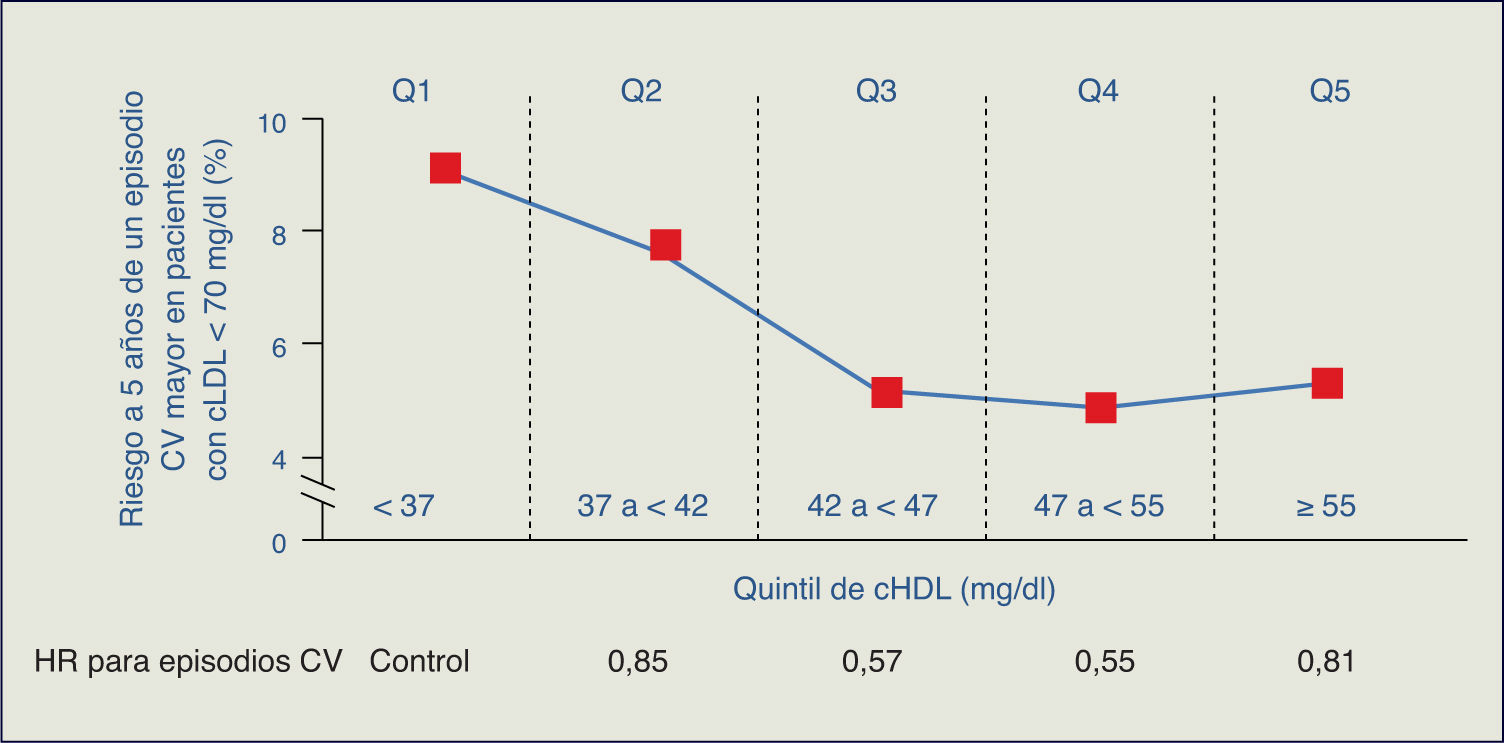
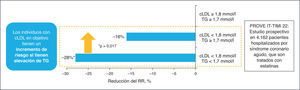
El estudio TNT resalta cómo en los pacientes con cLDL bajo (incluso < 70 mg/dl) y en tratamiento con dosis altas de estatinas, la cifra de cHDL se manifiesta como un determinante del riesgo CV3. Adicionalmente, en el estudio PROVE IT-TIMI 22, una cifra de TG > 200 mg/dl se asociaba a un elevado riesgo de accidentes coronarios recurrentes en los enfermos con cLDL < 70 mg/dl4. Por consiguiente, el tratamiento con estatinas, aunque particularmente útil, no garantiza la erradicación del riesgo residual de origen lipídico.
De este modo, un enfoque terapéutico adecuado sobre la dislipemia aterogénica puede tener un efecto positivo sobre el riesgo residual vascular de origen lipídico, que persiste después de un empleo eficaz de las estatinas con objeto de disminuir los valores de cLDL. Por consiguiente, la identificación de los factores lipídicos asociados al riesgo residual puede ser particularmente importante no solo para su tratamiento, sino también de cara a su detección en los enfermos con diferentes alteraciones en el perfil lipídico asociadas a un elevado riesgo CV.
La elevada prevalencia de este problema precisa un abordaje basado en las mejores evidencias científicas disponibles; esto ha llevado a estudiar combinaciones de fármacos ya existentes que pueden tener un efecto terapéutico añadido, con mecanismos de acción complementarios a los de las estatinas y cuyo objetivo es actuar sobre el riesgo producido por las fracciones lipídicas no LDL.
Actualmente, solo disponemos de 1 fármaco que haya demostrado eficacia sobre el riesgo residual en pacientes diabéticos, el fenofibrato. Además, su seguridad asociado a estatinas ha quedado suficientemente probada en diferentes estudios realizados en este tipo de pacientes con la asociación de estatinas y fenofibrato. Con esta asociación se comprueba, además de la normalización de las cifras de cLDL, un descenso notable de los niveles de TG y un incremento de las cifras de cHDL. La combinación de simvastatina y fenofibrato en el estudio Action to Control Cardiovascular Risk in Diabetes (ACCORD) fue la primera descripción de la eficacia de esta asociación, si bien no redujo significativamente los episodios CV no fatales y la muerte CV en pacientes diabéticos frente a la simvastatina en monoterapia. Los pacientes del grupo de dislipemia aterogénica presentaron un riesgo relativo un 70% más elevado de episodios CV graves en comparación con la población diabética sin dislipemia, a pesar de alcanzar un valor medio de cLDL de 80 mg/dl. Un análisis específico demostró que en pacientes con TG elevados (> 200 mg/dl) y cHDL disminuido (< 34 mg/dl), el riesgo relativo CV se redujo en un 31% en el grupo de terapia combinada frente a la monoterapia con simvastatina. Para prevenir un accidente CV es necesario tratar durante 5 años tan solo a 20 pacientes con la combinación (la reducción del riesgo absoluto resultó del 4,95%)5. El estudio Fenofibrate Intervention and Event Lowering in Diabetes Study (FIELD) se diseñó para evaluar el efecto a largo plazo del fenofibrato sobre episodios CV en pacientes con diabetes mellitus tipo 2 (DM2)6. Participaron 9.795 pacientes, con edades de entre 50 y 75 años. No se produjeron reducciones significativas en los objetivos primarios de mortalidad, pero el tratamiento con fenofibrato disminuyó los accidentes CV totales. Los pacientes más beneficiados fueron los que presentaron unos TG > 150 mg/dl y un cHDL < 40 mg/dl en varones y < 50 mg/dl en mujeres. En este estudio se demostró, además, un efecto beneficioso del fenofibrato en el riesgo microvascular, con una reducción en la progresión de la microalbuminuria, en el desarrollo y progresión de la retinopatía y en el riesgo de amputación en extremidades inferiores.
En consecuencia, para abordar la reducción del riesgo residual parece necesario contemplar la optimización de los resultados terapéuticos en la tríada lipídica: cLDL, cHDL y TG, eventualmente con una combinación de estatinas y fenofibrato, tal y como se ha comprobado hasta este momento.
Recomendaciones
- •
Los TG habrán de ser valorados para evaluar el riesgo CV.
- •
El cHDL es un importante factor de riesgo y se debe evaluar para la estimación del riesgo CV.
- •
Los fibratos están recomendados para el tratamiento de la hipertrigliceridemia.
- •
En pacientes con DM2, el objetivo primario es un cLDL < 100 mg/dl. El objetivo de colesterol no HDL debe ser < 130 mg/dl y apo B < 100 mg/dl.
- •
En los pacientes con DM2 y enfermedad CV previa (o con elevado riesgo CV aun sin antecedentes de enfermedad CV) los objetivos son: cLDL < 70 mg/dl, colesterol no HDL < 100 mg/dl y apo B < 80 mg/dl.
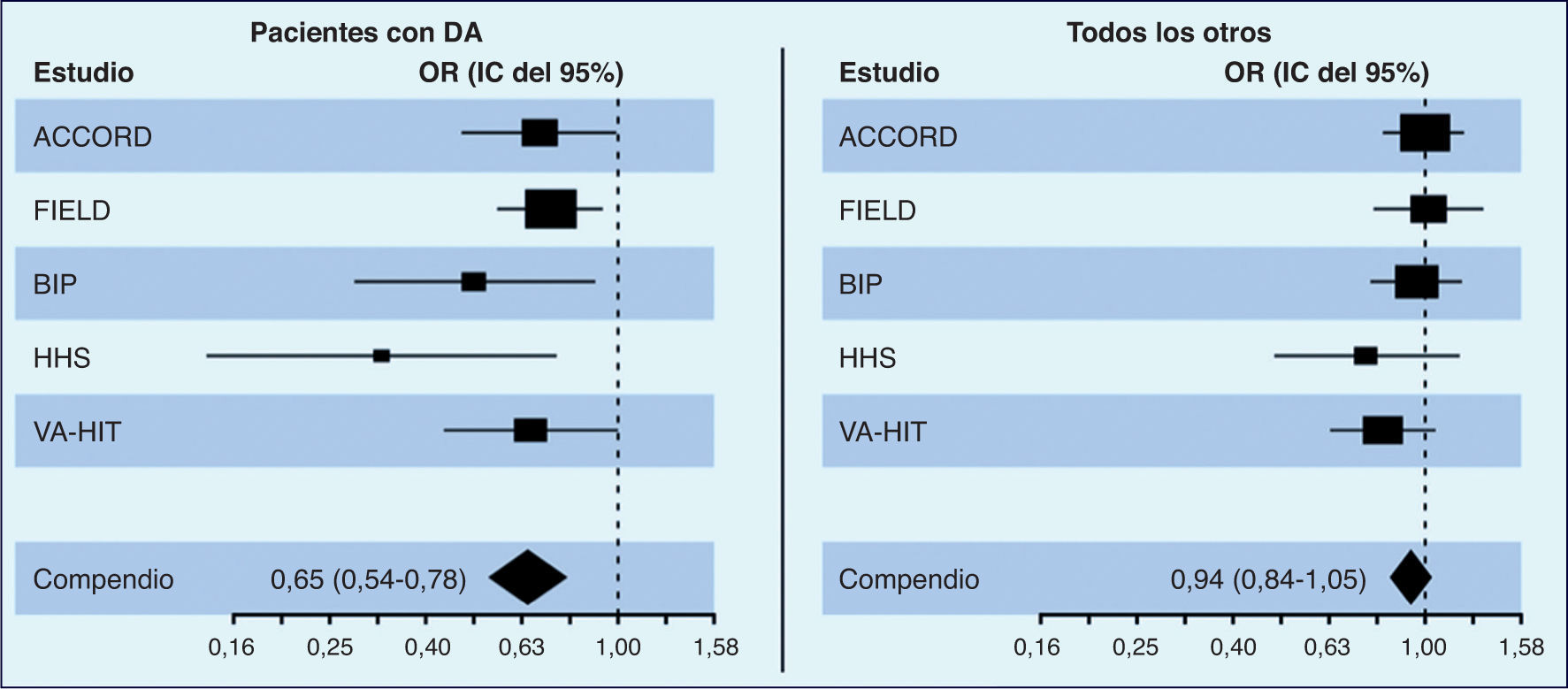
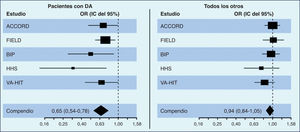
Los resultados del estudio ACCORD (Lipid-lowering Action to Control Cardiovascular Risk in Diabetes)1, que comparó el efecto de la combinación simvastatina-fenofibrato frente a simvastatina sola en una población de pacientes diabéticos, tras 4,7 años de seguimiento, no obtuvieron ninguna reducción del objetivo primario compuesto (infarto de miocardio no fatal, accidente cerebrovascular no fatal o muerte por causas cardiovasculares), a pesar de las mejoras en los valores de TG y de cHDL en el grupo de tratamiento combinado. Sin embargo, surgió un importante subgrupo en el que la combinación de fenofibrato-simvastatina resultó beneficiosa; aunque la cohorte general tuvo una RRR (reducción relativa del riesgo) significativa en el resultado primario del 8%, los pacientes con valores basales de TG > 204 mg/dl y de cHDL < 34 mg/dl mostraban una tendencia hacia una mayor RRR (–31%; p = 0,057). La revisión de los datos de los grandes ensayos que usaron un fibrato en monoterapia (FIELD2, HHS3, BIP4) traslucen resultados similares en los grupos con TG altos y cHDL bajo, experimentando el mayor grado de beneficio con el uso de los fibratos. Estos resultados han sido corroborados por 3 metaanálisis de dichos estudios5–7 empleando el subgrupo con valores de TG altos y cHDL bajos. En su conjunto, estas pruebas reafirman la eficacia de la asociación estatina más fibrato en la mejoría del pronóstico cardiovascular de los pacientes de alto riesgo con dislipemia aterogénica, pese a que en alguno de los estudios, como en el FIELD, la contaminación del grupo de control con la toma voluntaria de estatinas fue más del doble que en la rama del fenofibrato8.
Idealmente, el fibrato que demostrase una mayor reducción de los episodios cardiovasculares al asociarlo con las diversas estatinas, y cuya combinación tuviera una menor posibilidad de desarrollar efectos adversos indeseables, sería el de elección. Lamentablemente, no tenemos la información suficiente proveniente de los ensayos clínicos, ya que no se han hecho estudios comparativos valorando objetivos de morbimortalidad entre alguna de las posibles combinaciones de estatina y fibrato. Por tanto, nos vemos obligados a escoger entre los fibratos que tengan mayor potencia de reducir los TG y elevar el cHDL, y de estos el que tuviera menos probabilidad de inducir efectos secundarios, en particular el riesgo de miopatía.
La potencia de los diferentes fibratos sobre el control lipídico de los componentes de la dislipemia aterogénica viene expresada en la tabla 1, que está adaptada de una revisión sistemática1. Como se puede observar en ella, gemfibrocilo y fenofibrato ostentan los mejores resultados en disminución de TG y elevación del cHDL. Sin embargo, cuando se comparan los efectos adversos comunicados de ambos fármacos, el gemfibrocilo casi triplica la posibilidad de que acontezca una rabdomiólisis comparado con el fenofibrato2. La explicación de por qué ambas moléculas varían ampliamente en la posibilidad de producir efectos adversos si se toman concomitantemente con las estatinas o con otros fármacos, viene determinada por la forma en que son metabolizadas en el organismo. El gemfibrocilo se metaboliza por las isoenzimas de la enzima uridinadifosfato-glucuroniltransferasa, las 1A1 y 1A3, que son las mismas vías de eliminación que emplean algunas estatinas3, mientras que el fenofibrato tiene un escaso efecto sobre la glucuronidación de las estatinas y sobre el CYP3A4, que es una vía bastante común para la metabolización de diversos fármacos4. Esta posibilidad de mayor interacción del gemfibrocilo con las estatinas se plasmó en una revisión de la FDA (Food and Drug Administration) estadounidense5, que determinó que, comparativamente con el fenofibrato, el gemfibrocilo multiplicaba por 15 el número de casos de rabdomiólisis acontecidos tras su empleo junto con una estatina. Ello ha condicionado la contraindicación del gemfibrocilo en pacientes que ya toman una estatina, y se debe emplear el fenofibrato en caso de ser necesario mejorar la dislipemia aterogénica6.
Efectos clínicos de los fibratos
| TG (mg/dl) Δmax/min Media | cHDL (mg/dl) Δmax/min Media | cLDL (mg/dl) Δmax/min Media | |
|---|---|---|---|
| Fenofibrato | –120/–23,5 | +100/+0,4 | –75,3/+0,5 |
| –47,4 | +1,8 | –7,6 | |
| Benzafibrato | –99,5/–20,8 | +14,4/+0,4 | –24,3/+0,4 |
| –30,5 | +6,2 | –6,2 | |
| Gemfibrocilo | –103/–45,5 | +8,9/+2,0 | –28,2/0,0 |
| –63,6 | +3,4 | –12,2 |
Δmáx/min: variación máxima y mínima; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; TG: triglicéridos. Adaptada de Abourbih et al1.
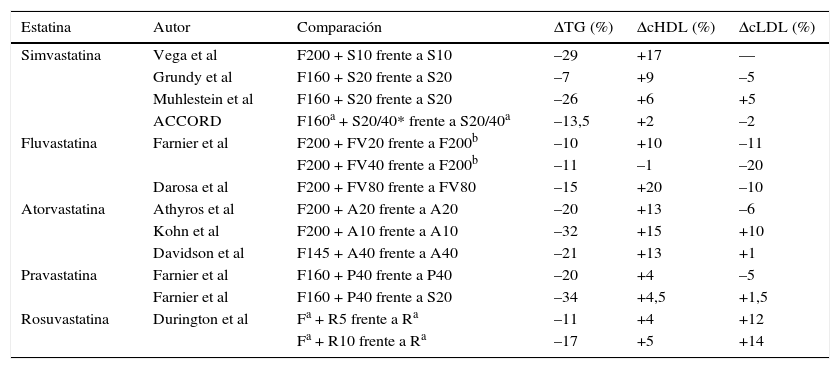
Varios ensayos han evaluado la eficacia del fenofibrato combinado con diversas estatinas en la modificación del perfil lipídico de pacientes con diabetes mellitus tipo 2 o con dislipemia mixta. Los resultados de los estudios más destacados se exponen en la (tabla 2)1.
Eficacia de la combinación fenofibrato y estatina
| Estatina | Autor | Comparación | ΔTG (%) | ΔcHDL (%) | ΔcLDL (%) |
|---|---|---|---|---|---|
| Simvastatina | Vega et al | F200 + S10 frente a S10 | –29 | +17 | — |
| Grundy et al | F160 + S20 frente a S20 | –7 | +9 | –5 | |
| Muhlestein et al | F160 + S20 frente a S20 | –26 | +6 | +5 | |
| ACCORD | F160a + S20/40* frente a S20/40a | –13,5 | +2 | –2 | |
| Fluvastatina | Farnier et al | F200 + FV20 frente a F200b | –10 | +10 | –11 |
| F200 + FV40 frente a F200b | –11 | –1 | –20 | ||
| Darosa et al | F200 + FV80 frente a FV80 | –15 | +20 | –10 | |
| Atorvastatina | Athyros et al | F200 + A20 frente a A20 | –20 | +13 | –6 |
| Kohn et al | F200 + A10 frente a A10 | –32 | +15 | +10 | |
| Davidson et al | F145 + A40 frente a A40 | –21 | +13 | +1 | |
| Pravastatina | Farnier et al | F160 + P40 frente a P40 | –20 | +4 | –5 |
| Farnier et al | F160 + P40 frente a S20 | –34 | +4,5 | +1,5 | |
| Rosuvastatina | Durington et al | Fa + R5 frente a Ra | –11 | +4 | +12 |
| Fa + R10 frente a Ra | –17 | +5 | +14 |
Δ: variación; A: atorvastatina; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; F: fenofibrato; FV: fluvastatina; P: pravastatina; R: rosuvastatina; S: simvastatina; TG: triglicéridos.
Tomada de A. Brea1.
Como puede apreciarse en ella, con el uso de fenofibrato los TG experimentan siempre una disminución complementaria a la lograda por la estatina, que varía entre el 7 y el 34%. La combinación hipotrigliceridemiante más potente se logra al agregar la pravastatina al fenofibrato. También acontece un incremento adicional del colesterol unido a lipoproteínas de alta densidad (cHDL), entre el 2 y el 20%. En este sentido, la fluvastatina es la que se muestra más eficaz en combinación con el fenofibrato. La influencia sobre el cLDL es variable, pudiendo elevar el valor conseguido por la estatina entre el 1,5 y el 14%, o disminuirlo del 2 al 20%. Algunos estudios han evaluado el cambio en los valores de colesterol no HDL. El poder reductor de la combinación fenofibrato-estatina sobre el colesterol no HDL es un 6-8% mayor que la estatina sola2. Este efecto sinérgico amplía también la disminución de los valores de colesterol no HDL lograda por el fenofibrato en monoterapia. Desde el punto de vista cualitativo, la combinación fenofibrato-estatina induce un marcado incremento en la proporción de subespecies LDL grandes/pequeñas en comparación con la monoterapia con estatinas3. Complementariamente al beneficio cardiovascular comentado anteriormente, que aconteció entre los pacientes con dislipemia aterogénica que usaban un fibrato o la combinación de fenofibrato y una estatina, en pacientes diabéticos, tanto en el estudio ACCORD como en el estudio FIELD, se observó un enlentecimiento de la progresión de la retinopatía, independientemente de su efecto sobre los lípidos4,5.
SeguridadTanto los fibratos como las estatinas pueden producir alteraciones musculares que varían desde la simple elevación asintomática de creatincinasa hasta la rabdomiólisis, pasando por estadios intermedios de debilidad muscular, dolor al presionar las masas musculares, mialgias y miositis. Dado que el fenofibrato tiene un escaso efecto sobre la glucuronidación de las estatinas y sobre el CYP3A4, se reduce la probabilidad de que en combinación con aquellas pueda producir estos efectos miopáticos indeseables. De hecho, en el estudio FIELD, unos 900 pacientes tratados con fenofibrato lo fueron también con estatinas y no se registró ningún caso de rabdomiólisis durante los 5 años de seguimiento5. Esta baja incidencia de alteraciones musculares se corroboró en el estudio ACCORD, donde más de 5.500 pacientes fueron tratados con simvastatina asociada a fenofibrato, o a placebo, durante 5 años y no se registró una mayor incidencia de miopatía entre los pacientes que recibieron conjuntamente los 2 fármacos que en la población de control4. Asimismo, los fibratos y las estatinas pueden producir, administrados en monoterapia, un aumento leve o moderado de las transaminasas, cuyo significado fisiopatológico no está bien definido6. En el estudio ACCORD, los aumentos de transaminasas que se documentaron fueron escasos, transitorios y cursaron de forma asintomática1. En los pacientes con insuficiencia hepática, de tener que utilizar estatinas habría de hacerse con precaución y evitar su combinación con cualquier fibrato. Tampoco se ha observado en el ACCORD ningún aumento en la incidencia de la enfermedad tromboembólica venosa, pancreatitis o mortalidad no cardiovascular. El fenofibrato puede aumentar la concentración de la creatinina sérica, con una disminución del aclaramiento de creatinina estimado por la tasa de filtración glomerular, sin tener ningún efecto sobre la proporción de albúmina en orina/creatinina sérica. La importancia clínica de estos efectos sigue siendo poco clara. Su administración junto a estatinas aumenta el riesgo relativo de incidencia de deterioro de la función renal y necesidad de trasplante en un 1,47 y un 1,29, respectivamente7. Se desaconseja su empleo con filtrados glomerulares < 30 ml/min. Un metaanálisis8 de 6 estudios que evaluaron la seguridad del empleo de fenofibrato con las estatinas en 1.628 pacientes con hiperlipemia mixta confirma que la combinación fenofibrato-estatinas es segura. De los múltiples conceptos estudiados: elevación de transaminasas más de 3 veces el límite normal, aumento del valor de creatincinasa en más de 5 veces el valor normal, cualquier efecto adverso, abandono de la medicación por efecto adverso, efecto adverso debido a segundo fármaco y efecto adverso grave, solo las transaminasas se vieron incrementadas por el empleo conjunto de ambos principios. No se comunicaron en ninguno de los 6 estudios casos de miopatía o rabdomiólisis.
¿Aporta valor añadido una combinación fija de pravastatina más fenofibrato?Las evidencias sobre la eficacia y seguridad de la asociación de pravastatina + fenofibrato son consistentes, especialmente cuando surjan problemas de tolerabilidad1.
El valor añadido de la combinación fija de pravastatina + fenofibrato en 1 cápsula viene determinado por una mayor consecución de los objetivos terapéuticos2, mejorar el cumplimiento terapéutico, la adherencia del paciente, simplificar el régimen terapéutico y contribuir a vencer la inercia clínica.
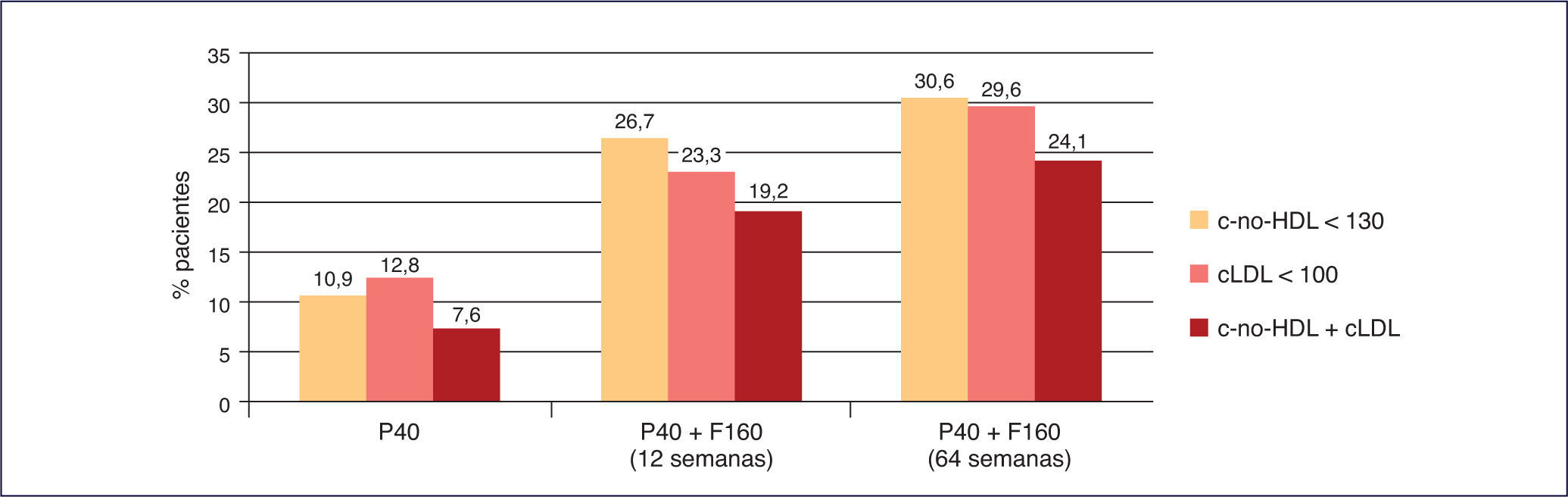
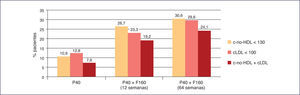
La mayor consecución de los objetivos terapéuticos en los pacientes con dislipemia aterogénica, como se ha observado en diferentes estudios que comparan la consecución de objetivos de cLDL y especialmente de colesterol no unido a lipoproteínas de alta densidad (colesterol no HDL) con pravastatina 40 mg en monoterapia frente a la combinación fija de pravastatina 40 mg + fenofibrato 160 mg34 (Figura 5).
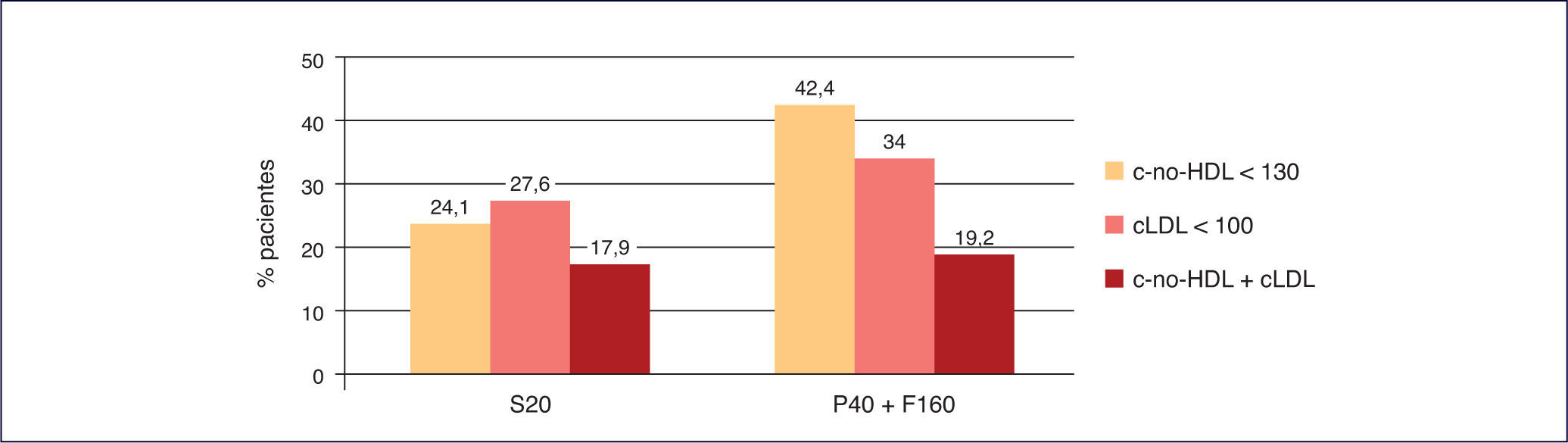
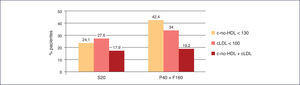
La combinación fija de pravastatina 40 mg + fenofibrato 160 mg ha logrado una mayor consecución de objetivos que la monoterapia con simvastatina 20 mg5 (Figura 6).
Consecución de objetivos terapéuticos de pravastatina+fenofibrato frente a simvastatina en monoterapia40. cLDL: colesterol unido a lipoproteínas de baja densidad; c-no HDL: colesterol no unido a lipoproteínas de alta densidad; F160: fenofibrato 160 mg; P40: pravastatina 40 mg; S20: simvastatina 20 mg.
La consecución de los objetivos se consigue mejorando el cumplimiento y la adherencia del paciente6–8. Las guías de práctica clínica abordan la importancia del cumplimiento para conseguir los objetivos9. La combinación a dosis fija de pravastatina y fenofibrato puede aumentar la adherencia, ya que simplifica el régimen medicamentoso reduciendo el número de la dosis diaria a la toma de 1 cápsula2,10. Varios trabajos muestran que la reducción en el número de dosis es la medida aislada más efectiva para conseguir aumentar la adherencia y, por tanto, mejorar la consecución de objetivos11,12. Esta combinación en 1 cápsula contribuye a simplificar la complejidad del tratamiento, la dificultad que tiene el paciente para realizar correctamente la toma de la medicación y facilita al médico la realización de la prescripción, lo que puede ayudar a los médicos a vencer la inercia terapéutica.
La buena eficacia y tolerabilidad, el coste de la combinación y la posibilidad de adecuar la administración al estilo de vida del paciente facilitan la consecución de los objetivos en esos pacientes de alto riesgo cardiovascular13.
Finalmente, se han detectado 2 efectos beneficiosos sinérgicos de la asociación fija de fenofibrato + pravastatina al margen de sus beneficios cardiovasculares: el primero de ellos se relaciona con una menor pérdida anual de la tasa de filtrado glomerular, especialmente en los casos de mayor hipertrigliceridemia14,15; el segundo hecho beneficioso es un potencial efecto favorable sobre el metabolismo hidrocarbonado, muy especialmente en los pacientes con síndrome metabólico16; como es conocido el efecto diabetogénico de las estatinas17, este efecto mitigador de la capacidad hiperglucemiante de la estatina se debería considerar como un beneficio adicional de la combinación fija de fenofibrato + pravastatina1.
Recomendación
Al margen de su eficacia y seguridad, el valor añadido de la combinación fija de pravastatina + fenofibrato en 1 cápsula está determinado por una mayor consecución de los objetivos terapéuticos, mejorar el cumplimiento terapéutico, la adherencia del paciente, simplificar el régimen terapéutico y contribuir a vencer la inercia clínica.