Se ha puesto en evidencia, en estudios clínicos realizados en humanos y en experimentación animal, la relación entre las concentraciones séricas de la hormona circadiana melatonina y la enfermedad arterial coronaria. En los últimos años se han descrito las interesantes funciones inmunomoduladoras que tiene la melatonina tanto en la vertiente celular como en la humoral. Se ha demostrado la interrelación de la melatonina en la enfermedad coronaria aguda con las diferentes moléculas inflamatorias que intervienen en la aterosclerosis coronaria. Además, se ha descrito que la melatonina podría tener un efecto protector contra las lesiones celulares inducidas por la formación de radicales libres, y así evita las lesiones producidas por la reperfusión en tejidos previamente isquémicos. Este artículo aborda una revisión sobre la biología de la melatonina, su relación con la aterosclerosis coronaria y su posible uso terapéutico.
Clinical studies in humans and experimental animal models have shown a relationship between serum melatonin levels and the presence of coronary artery disease. Moreover, in the past few years studies have highlighted the important immunomodulatory properties of melatonin at both cellular and humoral levels. In this context, it has been demonstrated that melatonin plays a modulatory role in acute coronary artery disease that affects the different inflammatory molecules that participate in the atherosclerotic process. It has been also suggested that melatonin might exert a protective effect against the cellular damage induced by free radicals during reperfusion injury. The present article reviews the biological properties of melatonin, and the relationship between this molecule and coronary atherosclerosis and potential therapeutic options with the use of melatonin.
La melatonina es una indolamina producida principalmente y de forma circadiana por la glándula pineal. Regula diversas funciones fisiológicas y neuroendocrinas, bien mediante receptores específicos, bien de forma directa en orgánulos subcelulares. Inicialmente se describieron sus acciones en relación con el eje neuroendocrino-reproductivo1,2. No obstante, numerosas observaciones realizadas posteriormente han puesto en evidencia sus múltiples funciones inmunomoduladoras, tanto en la vertiente celular como en la humoral3. De igual manera, especial interés suscita su actividad antioxidante, la cual ejerce por la capacidad que tiene para captar directamente especies reactivas de oxígeno —sustancias altamente tóxicas— actuando como recolector de radicales libres. Mediante esta actividad tiene la capacidad de proteger del daño oxidativo, sobre todo al ADN y las membranas celulares, por ciertos productos formados durante situaciones isquémicas3.
En este artículo planteamos una concisa revisión sobre la biología de la melatonina, su relación con la aterosclerosis coronaria y las opciones terapéuticas.
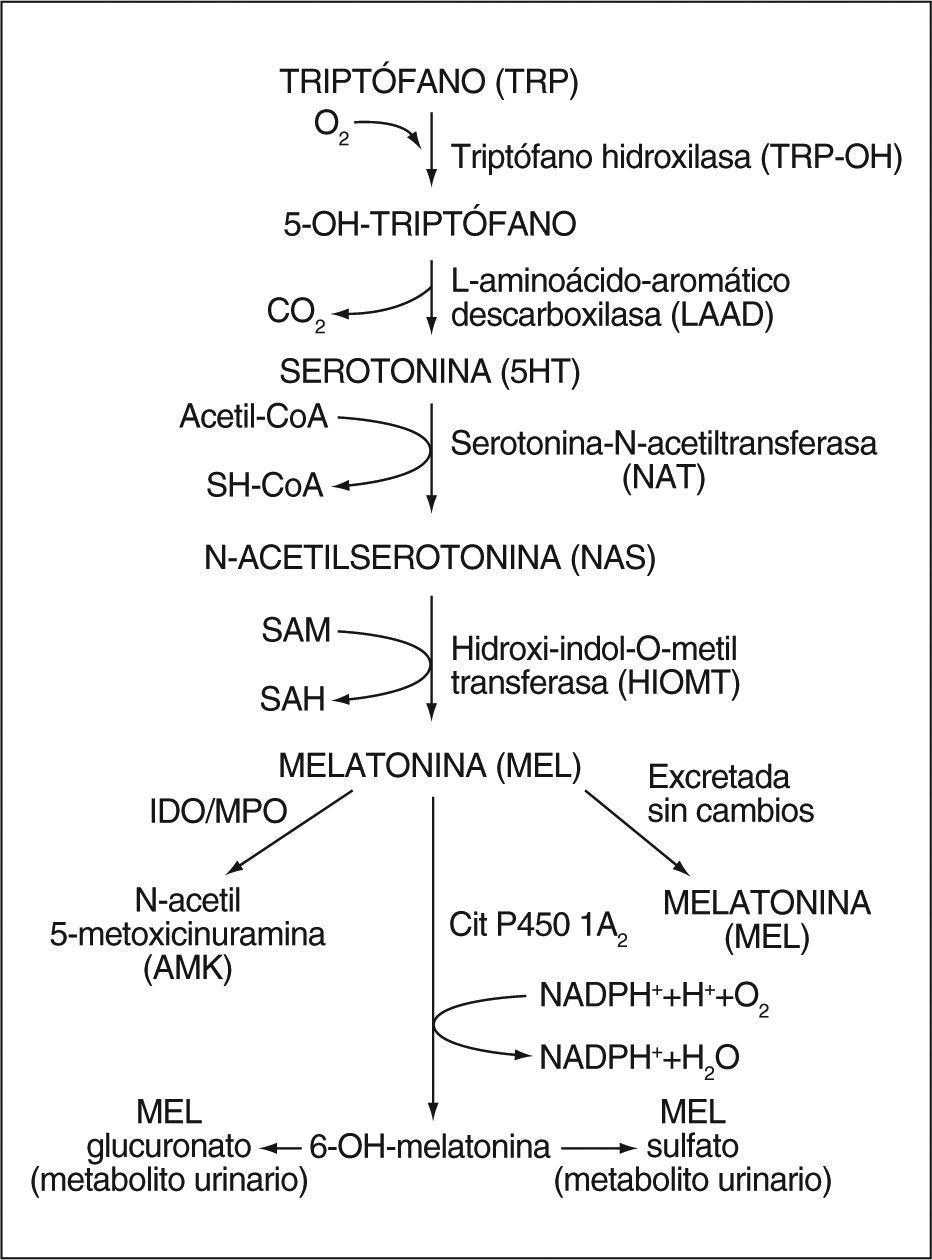
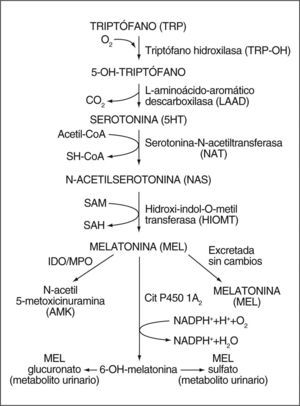
Biología de la melatoninaSíntesis de la melatoninaLa melatonina, un derivado del triptófano, se aisló e identificó estructuralmente por primera vez en 1958 a partir de extractos de glándula pineal bovina1. Su síntesis se realiza a partir del aminoácido triptófano que, por acción de una triptófano hidroxilasa, se convierte a 5-hidroxitriptófano y éste, por descarboxilación, a serotonina. La serotonina, a su vez, por acción de dos enzimas: arilalquilamina N-acetiltransferasa e hidroxiindol-O-metiltransferasa, se transforma en melatonina2,3 (fig. 1). A pesar de que ambas enzimas tienen un papel importante en la síntesis de la melatonina, parece que la enzima limitante es la arilalquilamina N-acetiltransferasa. Sin embargo, ciertos estudios en animales han demostrado que sólo un aumento en la actividad de la hidroxiindol-O-metiltransferasa, y no de la arilalquilamina N-acetiltransferasa, es capaz de estimular la síntesis de melatonina4,5.
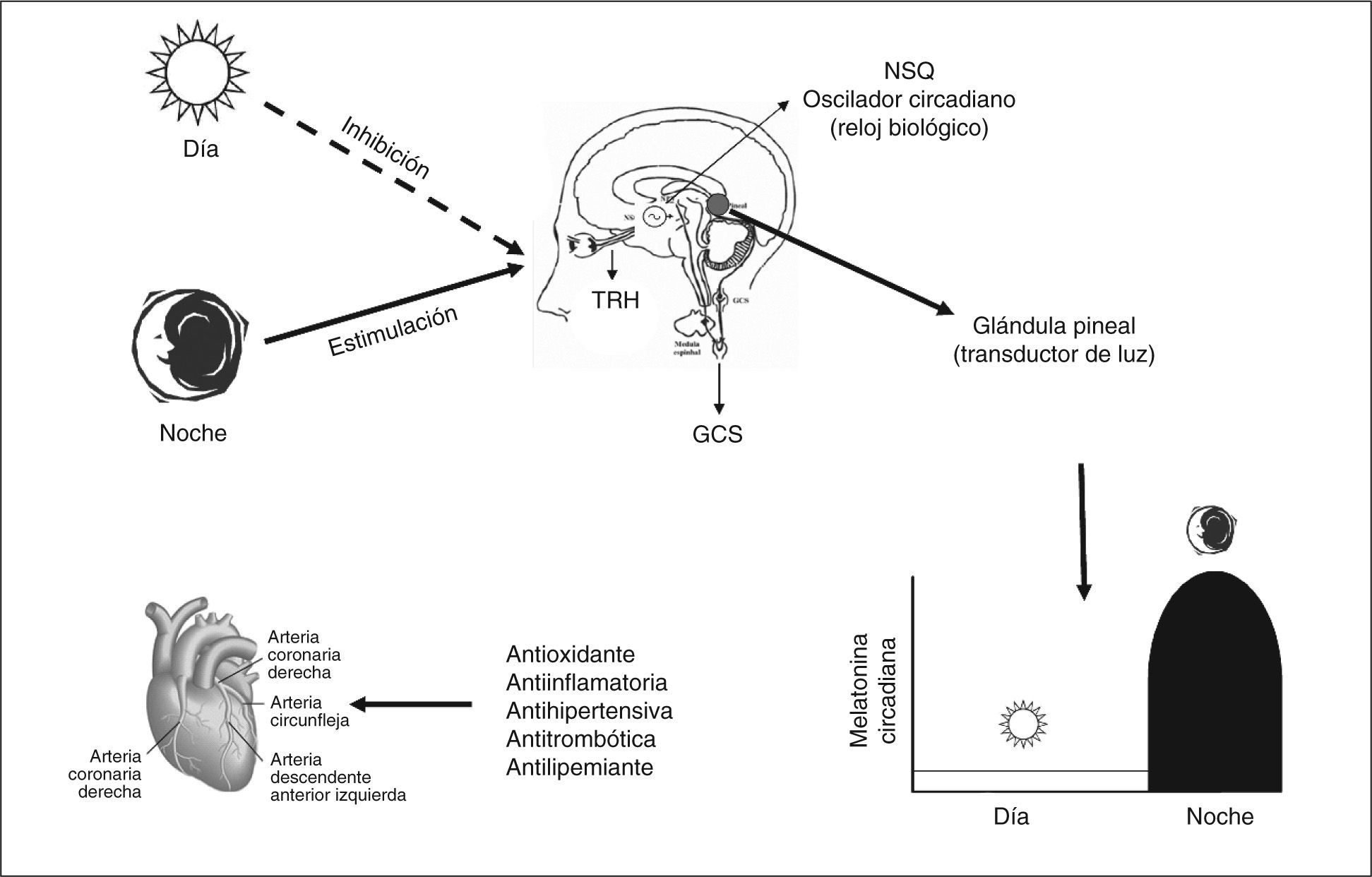
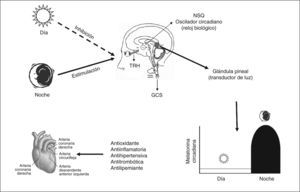
En la glándula pineal, tanto la síntesis como la secreción masiva de melatonina se producen durante la noche; la luz es el principal factor ambiental que regula la secreción de melatonina2. El estímulo lumínico procedente de la retina se transmite a través del tracto retinohipotalámico al núcleo supraquiasmático del hipotálamo (“reloj biológico”) y de allí al sistema nervioso simpático a través de fibras procedentes de los ganglios simpáticos cervicales. Los estímulos adrenérgicos (noradrenalina) alcanzan la glándula pineal y estimulan mayoritariamente receptores betaadrenérgicos en los pinealocitos. Esto inicia la producción de melatonina por un aumento intracelular del AMP cíclico. Estímulos adrenérgicos α1 también contribuyen, sinérgicamente, con los betaadrenérgicos y, por el aumento de los inositoles fosfatos, a aumentar su secreción3. La síntesis y la liberación se estimulan por la oscuridad y se inhiben por la luz siguiendo un ritmo circadiano. Durante las horas de luz las células fotorreceptoras retinianas están hiperpolarizadas, situación que inhibe la liberación de noradrenalina: el sistema retinohipotalámico pineal está quiescente. En la oscuridad, los fotorreceptores liberan noradrenalina, que activa el sistema, y se produce el aumento en la actividad glandular (fig. 2). La melatonina se libera, fundamentalmente, a la corriente sanguínea por difusión pasiva, a medida que aumenta su síntesis. Su liberación tiene lugar pronto tras el comienzo de la oscuridad; el pico de concentración sérica (60-200pg/ml) se produce en medio de la noche, entre las 2.00 y las 4.00. Posteriormente, desciende de forma gradual, y sus concentraciones séricas son menores durante el día (10-20pg/ml)3. La amplitud de las concentraciones séricas día/noche de melatonina varía considerablemente de acuerdo con los diferentes estadios de la edad de los individuos. La mayor parte de la melatonina se encuentra en plasma unida a proteínas, con una cuarta parte que circula de forma libre3.
Aparte de la glándula pineal, numerosos tejidos y órganos extrapineales tienen la capacidad de sintetizar melatonina en concentraciones muy diversas. Entre ellos se encuentran: retina6, cuerpo ciliar7, cristalino8, glándula de Harder9, cerebro10, timo11, epitelio respiratorio12, médula ósea13,14, intestino15,16, ovarios17, testículos18, placenta19, linfocitos20 y piel21. La síntesis extrapineal de la melatonina no sigue un ritmo luz/oscuridad y se especula con que sea consumida localmente por los tejidos, cumpliendo una función protectora contra el estrés oxidativo22. Aparte de consumirse, una parte probablemente también se una a proteínas para su almacenamiento23.
Metabolitos de la melatoninaLa melatonina se metaboliza principalmente en el hígado por acción del citocromo P450; se obtiene 6-hidroximelatonina que, a su vez, es conjugada a derivados sulfatados (70-80%) y glucuronizados (5%)24. Estos conjugados, una vez convertidos en moléculas polares, se eliminan en forma de 6-sulfatoximelatonina25.
El hígado no es el único órgano implicado en el metabolismo de la melatonina. Recientemente se ha demostrado que una parte de la 6-sulfatoximelatonina se produce en órganos extrahepáticos con altos valores de CYP1B126, como intestino, líquido cefalorraquídeo y piel.
Se han identificado otros metabolitos de la melatonina, entre los cuales tenemos:
- –
6-hidroximelatonina: metabolito que se forma por vía no enzimática por la interacción de la melatonina con especies reactivas de oxígeno y nitrógeno (radical hidroxilo y peroxinitrito)27–29.
- –
3-hidroximelatonina cíclica: se produce por interacción de la melatonina con el radical hidroxilo30 y el peroxinitrito28,31, y es un biomarcador fiable de las concentraciones endógenas de dichos radicales.
- –
N1-acetil-N2-formil-5-metoxicinuramina (AFMK) y N-acetil-5-metoxicinuramina (AMK): desde un punto de vista evolutivo, el AFMK apareció mucho antes que la 6-sulfatoximelatonina, por lo que se considera el metabolito original de la melatonina, si bien la 6-sulfatoximelatonina sigue siendo su principal metabolito urinario. El AFMK se puede producir vía enzimática o seudoenzimática, por radiación ultravioleta, así como por la interacción con especies reactivas de oxígeno32. En algunos tejidos, especialmente en el sistema nervioso central, constituye el principal metabolito de la melatonina. También leucocitos, pulmones, eritrocitos y piel son capaces de producirlo. En cuanto al campo celular, la mitocondria es su principal lugar de producción debido a sualto contenido en melatonina y citocromo C32. En situaciones de gran estrés oxidativo, sus concentraciones se ven incrementadas por la interacción directa de la melatonina con especies reactivas de oxígeno y nitrógeno. La excreción urinaria es limitada y no representa su producción real, ya que se trata de una molécula menos hidrófila que la 6-sulfatoximelatonina. Además, el AFMK se puede degradar a AMK y otras moléculas no cuantificables por los métodos disponibles en la actualidad. No obstante, se cree que la mayor parte de la melatonina es transformada en AFMK y sus derivados. Sin embargo, para demostrar este hecho en mamíferos aún se requieren más investigaciones.
En cuanto a las funciones de los principales metabolitos de la melatonina, tenemos:
- –
6-hidroximelatonina: protege contra el daño del ADN mediante su actividad antioxidante y de recolector directo de radicales libres, que comparte con la propia melatonina33–35.
- –
3-hidroximelatonina cíclica: sus funciones y distribución en el organismo no están claras. Su parecido estructural con un inhibidor de la colinesterasa (fisostigmina) hace pensar en su potencial utilidad clínica en el tratamiento de enfermedades relacionadas con una alteración de la transmisión colinérgica como, por ejemplo, la enfermedad de Alzheimer36. Su producción siempre se acompaña de la de AFMK; se mantiene un equilibrio entre ambas moléculas que depende de la concentración de oxidantes endógenos. De hecho, la 3-hidroximelatonina cíclica se convierte en AFMK, probablemente por su interacción y captación de especies reactivas de oxígeno y nitrógeno. Así, la relación 3-hidroximelatonina cíclica/AFMK probablemente sea un indicador del grado de estrés oxidativo de un sistema que los organismos podrían utilizar para modular su actividad antioxidante.
- –
AFMK y AMK: son los principales metabolitos de la melatonina. La capacidad antioxidante del AFMK es similar a la de la melatonina37, ya que reduce la peroxidación lipídica y el daño oxidativo del ADN y previene la lesión neuronal inducida por el peróxido de hidrógeno y el péptido betaamiloide38–41. El AMK, por su parte, presenta mayor eficacia antioxidante que el AFMK42, ya que inhibe la actividad de la sintetasa de óxido nítrico neuronal y reduce las concentraciones intracelulares de óxido nítrico43,44. Ambas moléculas presentan actividades antiinflamatorias e inmunorreguladoras: el AMK inhibe la biosíntesis de prostaglandinas45, el AFMK, la formación de factor de necrosis tumoral alfa e interleucina 8 en neutrófilos y células mononucleares de la sangre periférica, y ambos inhiben la expresión génica de la ciclooxigenasa 2 (COX-2), una enzima proinflamatoria46. En resumen, tanto el AFMK como el AMK tienen la capacidad de disminuir la actividad de enzimas prooxidantes y proinflamatorias, así como de llevar a cabo funciones “antirradicales libres”. El hecho de que la capacidad recolectora de radicales libres de la melatonina se extienda también a sus metabolitos la convierte en la biomolécula con mayor poder antioxidante, incluso a bajas concentraciones. El fenómeno por el cual la melatonina y sus metabolitos interactúan con especies reactivas de oxígeno y nitrógeno se conoce como la “reacción recolectora en cascada de la melatonina”.
La melatonina actúa por la unión a proteínas intracelulares y dos tipos de receptores de superficie: receptores nucleares específicos de la familia RZR/ ROR y receptores de membrana plasmática.
Entre las proteínas intracelulares, se ha demostrado que la melatonina interactúa con la calmodulina, implicada en la transducción de la señal a segundos mensajeros, antagonizando la unión del calcio a ésta47. Se postula que los efectos antiproliferativos de la melatonina en células cancerosas de mama puedan estar mediados por este mecanismo48.
En cuanto a los receptores nucleares, se distinguen tres subtipos en función del órgano en el que se expresan:
- –
RZR/RORα: expresado en varios órganos.
- –
RZR/RORβ: específico de cerebro y retina49.
- –
RZR/RORγ: localizado en el cromosoma 1 en humanos. Se expresa en varios tejidos, pero su mayor índice de expresión es en el músculo esquelético50.
Estos receptores nucleares parecen estar implicados, al menos parcialmente, en los efectos inmunomoduladores y circadianos de la melatonina51–53.
En cuanto a los receptores de membrana plasmática, de los cuales, hasta la fecha, se han clonado dos subtipos en mamíferos: MT1 (o Mel1a) y MT2 (o Mel1b)54, ambos se expresan de forma variable en múltiples órganos y tejidos humanos, sin que se conozca, en la mayoría de los casos, la función biológica que desempeñan. En el sistema cardiovascular, por ejemplo, su existencia ha sido demostrada en la pared ventricular, las arterias coronarias y la aorta; el significado de este hallazgo es incierto55–57. Sin embargo, recientemente, Dubocovich et al58 han señalado que la participación de ambos receptores de melatonina en las arterias de mamíferos presenta una relación antagónica. El receptor MT1 se comporta como vasoconstrictor arterial, mientras que la activación del receptor MT2 induce vasodilatación.
En relación con la genética de los receptores de la melatonina, dos estudios de Ebisawa et al59,60, realizados en sujetos con trastornos circadianos del ritmo del sueño, han identificado varios polimorfismos genéticos de los receptores MT1 y MT2, sin encontrar una asociación estadísticamente significativa entre los polimorfismos genéticos y los trastornos del sueño.
Melatonina y síndrome coronario agudoMelatonina, aterosclerosis e inflamaciónEn las últimas dos décadas, uno de los aspectos que ha suscitado mayor interés en el campo de la investigación cardiovascular es la relación entre aterosclerosis e inflamación61. Hoy día se considera la aterosclerosis una enfermedad inflamatoria en la que interviene tanto su componente celular como el humoral62. En ella concurren diversos tipos celulares: monocitos, macrófagos, linfocitos T y células musculares lisas, así como una gran variedad de factores humorales, citocinas y otros mediadores de la inflamación, entre los cuales se incluyen quimiocinas, moléculas de adhesión vascular e intercelular, selectinas, factores estimuladores del crecimiento de colonias de células inflamatorias, como granulocitos y macrófagos, e interleucinas moduladas en parte por partículas de lipoproteínas de baja densidad oxidadas (oxLDL)63.
En los últimos años se han descrito las interesantes funciones inmunomoduladoras que tiene la melatonina, tanto en la vertiente celular como en la humoral64,65. Se ha puesto de evidencia su capacidad para incrementar el número y la respuesta de las células productoras de anticuerpos, regular la expresión génica y la producción de múltiples mediadores de la inmunidad, aumentar la capacidad de los macrófagos de presentación de antígenos a las células T, incrementar la expresión de las moléculas del sistema mayor de histocompatibilidad de clase II, aumentar la producción de interleucina 1 y factor de necrosis tumoral alfa y regular al alza la expresión génica del factor estimulador de colonias de granulocitos y macrófagos, factor de necrosis tumoral alfa, factor transformador del crecimiento de tipo beta, así como interleucina 1β e interferón gamma, entre otras64,65.
Diversos estudios clínicos realizados en humanos han puesto en evidencia la relación entre las concentraciones séricas de melatonina y la enfermedad arterial coronaria66–69. La observación de que pacientes con enfermedad coronaria presentaban concentraciones nocturnas reducidas de melatonina y que en aquellos con infarto agudo de miocardio su concentración eran menores que en los sujetos controles70 ha llevado a indicar que esta disminución de los valores nocturnos de melatonina se deba, al menos en parte, a sus efectos antioxidantes, concretamente, a su capacidad para actuar como recolector de radicales libres (radical scavenger) generados en las primeras 24h del infarto agudo de miocardio. No obstante, hasta el momento se desconoce si este hallazgo es causa, efecto o incluso una característica relacionada con una función cardiovascular comprometida71.
Se han descrito dos posibles mecanismos que podrían explicar los efectos antioxidantes de la melatonina en los pacientes con infarto agudo de miocardio: a) por acción directa como recolector de radicales libres, desintoxicando especies reactivas de oxígeno y nitrógeno por vías no enzimáticas, que así resulta en la formación de otro potente antioxidante: AFMK39, y b) mediante un mecanismo de acción indirecta por la estimulación de varias enzimas antioxidantes y la estabilización de la fluidez de las membranas72.
La capacidad antioxidante de la melatonina tiene un papel fundamental en la progresión de la placa aterosclerótica formada por las lipoproteínas de baja densidad y otros productos lipídicos oxidados73. En un estudio realizado por Domínguez Rodríguez et al74 se demostró la relación independiente entre las concentraciones nocturnas de oxLDL y la melatonina en los pacientes con infarto agudo de miocardio. Los autores indican que las concentraciones nocturnas de melatonina en sangre pueden ser necesarias, junto con otros antioxidantes fisiológicos, para intentar mantener el estrés oxidativo lo más bajo posible.
El sustrato inflamatorio involucrado en los síndromes coronarios agudos es extremadamente complejo, con un gran número de factores implicados tanto en su activación como en su modulación75,76. Recientemente, trabajos de nuestro grupo han demostrado, en pacientes con síndrome coronario agudo, la variabilidad diurna en las concentraciones séricas de interleucina 677–79, proteína C reactiva80,81, metaloproteinasa 982,83 y molécula de adhesión intercelular 184; esto indica que, al menos en parte, podrían tener una regulación neuroendocrina central y, en particular, en relación con la melatonina.
Melatonina y daño por reperfusiónAl restaurar el flujo sanguíneo en corazones isquémicos, se producen radicales libres derivados de oxígeno, como el anión superóxido, los radicales hidroxilos y el peróxido de hidrógeno, que poseen la capacidad de dañar las membranas celulares85. La peroxidación lipídica de las membranas produce daño estructural y funcional, que condiciona un aumento en la permeabilidad de la membrana al calcio, lo que finalmente conlleva un incremento en el calcio intracelular86. Los tres mecanismos principales de daño por radicales libres son: la peroxidación de lípidos, la oxidación de las proteínas y la rotura/alteración del ADN. Hay dos vías mediante las cuales los radicales superóxido pueden generar radicales hidroxilo. Una de ellas involucra la participación del óxido nítrico por la formación de un compuesto denominado peroxinitrito, compuesto tóxico, inestable y altamente reactivo que causa peroxidación de lípidos y daño miocárdico86. Estudios durante la realización de angioplastia coronaria transluminal percutánea demuestran la presencia de marcadores indirectos de la producción de radicales libres en la sangre del seno coronario (malondialdehído, ácido úrico y glutatión oxidado)87.
Se han empleado diversos procedimientos para tratar, inhibir o contrarrestar el daño por reperfusión. La melatonina, por sus propiedades antioxidantes y antiinflamatorias71, ha demostrado resultados beneficiosos, con un efecto protector significativo en varios modelos experimentales de daño por reperfusión86.
Los primeros estudios analizaron el efecto de las concentraciones fisiológicas de melatonina71,88,89, y demostraron que las ratas pinealectomizadas, con concentraciones endógenas de melatonina muy bajas, presentaban mayores mortalidad y tamaño del área de necrosis de la zona infartada. Posteriormente, en varios estudios de experimentación animal71, se ha objetivado que la administración de melatonina durante el período de isquemia-reperfusión disminuye de manera muy significativa la duración de las arritmias de reperfusión, reestablece la función ventricular y disminuye el área de necrosis y la peroxidación lipídica90–92. Nuestro grupo ha demostrado recientemente que, en pacientes con infarto agudo de miocardio tratados con angioplastia primaria, las concentraciones circulantes de albúmina modificada por la isquemia (marcador muy sensible de isquemia)93 se correlacionan negativamente con la melatonina. Nuestros resultados confirman que la melatonina tiene un efecto beneficioso como recolector de radicales libres de oxígeno en un modelo humano de isquemia-reperfusión miocárdica94.
La melatonina ha demostrado su efecto cardioprotector mediante los siguientes mecanismos:
- 1.
Antioxidante.
- –
Acción directa (independiente del receptor): la melatonina y algunos de sus metabolitos (6-hidroximelatonina y AFMK) son recolectores muy efectivos de los radicales libres de oxígeno y nitrógeno39,95,96. En la misma línea, la melatonina reduce las concentraciones del radical peroxinitrito (ONOO°) mediante su propia reacción directa de nitración produciendo, entre otros metabolitos, la 1-nitromelatonina97.
- –
Acción indirecta (mediada por receptores de membrana o nucleares): la melatonina es capaz de estimular la actividad de diversas enzimas antioxidantes, como la superóxido dismutasa, la catalasa y la glutatión peroxidasa. La superóxido dismutasa transforma el anión superóxido en peróxido de hidrógeno que, a su vez, es metabolizado por la catalasa y la glutatión peroxidasa, de tal forma que disminuye la formación del radical hidroxilo98. Asimismo, se ha demostrado que aumenta los valores del glutatión, un importante antioxidante intracelular, mediante la estimulación de la enzima gammaglutamilcisteinsintetasa99.
- –
En la cadena respiratoria: disminuye la pérdida de electrones y, por lo tanto, la producción de radicales libres100-101.
- –
- 2.
Antiinflamatoria. Disminución de la actividad de la mieloperoxidasa, la concentración intracelular de calcio, el reclutamiento de leucocitos en los tejidos lesionados, la expresión de moléculas de adhesión y del factor de transcripción nuclear kappa B46,64,65,71.
La vía de administración de la melatonina en humanos es, fundamentalmente, la oral, aunque también se han empleado la sublingual, la transdérmica102 y la intravenosa103,104. Diversos estudios han analizado la farmacocinética de la melatonina por vía intravenosa, intentando reproducir su secreción nocturna en humanos. Según su perfil farmacocinético, la curva de eliminación de la melatonina por vía intravenosa es una exponencial negativa que presenta 2 pendientes, alfa y beta, con un t1/2α de 1,35min y un t1/2β de 28,4min, con aclarado sistémico de 966ml/min y volumen aparente de distribución de 35,1 l103–105.
En estudios realizados en humanos, donde el intervalo de utilización de la melatonina varía desde pocos miligramos (1-2) hasta dosis suprafisiológicas (1,6g), no se hace mención de efectos toxicológicos que pudieran ser lesivos para ellos106. Asimismo, Seabra et al107 realizaron un estudio con 40 voluntarios sanos, aleatorizado y a doble ciego, con melatonina (10mg/día, durante 28 días) y placebo. En este estudio, se realizaron análisis bioquímicos y hormonales a todos los sujetos para poder detectar posibles alteraciones en algunos de sus órganos; se concluyó que ésta carecía de toxicidad. A este respecto, otros autores han demostrado que la administración de melatonina por vía oral disminuye la presión arterial y el tono simpático de las arterias, sin modificar la frecuencia cardíaca108. Recientemente, Gitto et al109–111 realizaron un estudio en que administraron melatonina por vía intravenosa a recién nacidos con síndrome de disnea. El estudió evidenció: mejoría del estado oxidativo, disminución de los parámetros inflamatorios y mejora de la supervivencia.
La evidencia científica disponible en la actualidad acerca de la relación entre la melatonina y la enfermedad arterial coronaria ha llevado a nuestro grupo a realizar un ensayo clínico (estudio MARIA) en fase II, administrando melatonina intravenosa como tratamiento coadyuvante a la revascularización primaria en el infarto agudo de miocardio112. Este ensayo clínico trataría de demostrar que la melatonina inhibe el daño por reperfusión contrarrestándolo y, por lo tanto, produciría una disminución en el tamaño del área de necrosis y, por ende, mejoría de los acontecimientos cardiovasculares mayores. La melatonina es una molécula endógena, de escasos efectos secundarios y de un coste económico bajo.
ConclusionesLa evidencia en los últimos 10 años indica que la melatonina tiene influencia en el sistema cardiovascular humano. Numerosos estudios demuestran que pacientes con enfermedad arterial coronaria tienen una concentración sanguínea de melatonina disminuida. Su función antioxidante se basa en la capacidad neutralizadora de los radicales libres. Su naturaleza lipofílica le permite atravesar con extrema facilidad las membranas celulares y acceder a los compartimentos celulares, en los que se originan radicales libres producidos como consecuencia del metabolismo aeróbico. Por todo ello, se considera la melatonina como uno de los componentes esenciales del sistema de defensa antioxidante de los organismos, y quizá el mejor de todos los agentes antioxidantes conocidos. Su importante significado clínico y las posibilidades como agente terapéutico determinan que esta molécula asegure su relevancia clínica en los próximos años.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.