La fibulina-5 (FBLN5) es una proteína elastogénica implicada en el remodelado de la matriz extracelular (MEX), un proceso fundamental en el aneurisma de aorta abdominal (AAA). Sin embargo, no se ha determinado la posible contribución de la FBLN5 al AAA.
MétodosSe realizaron análisis por PCR a tiempo real, Western blot, transducción lentiviral, transfección transitoria e inmunoprecipitación de cromatina (ChIP) en aorta abdominal de pacientes con AAA o donantes y en células musculares lisas de aorta humana (CMLV).
ResultadosLa expresión vascular de la FBLN5 disminuye en la aorta abdominal de pacientes con AAA frente a donantes sanos. El nivel de ARNm y proteína de la FBLN5 y su secreción al espacio extracelular se redujeron en CMLV expuestas a estímulos inflamatorios. Este efecto se produce a través de un mecanismo transcripcional en el que está implicada una región proximal del promotor de la FBLN5 que contiene un elemento de respuesta a SOX. De hecho, la expresión de SOX9 se inhibe en CMLV tratadas con LPS y TNFα y disminuye en el AAA, en el que correlaciona con la de la FBLN5. Además, la sobreexpresión de SOX9 contrarrestó la disminución de la expresión y actividad transcripcional de la FBLN5 inducida por el TNFα. Finalmente, observamos que SOX9 interacciona con el promotor de la FBLN5 y que esta unión se reduce en respuesta a TNFα.
ConclusionesLa inhibición de la FBLN5 en el AAA humano podría contribuir al remodelado destructivo de la matriz extracelular inducido por el componente inflamatorio de la patología.
Fibulin-5 (FBLN5) is an elastogenic protein critically involved in extracellular matrix (ECM) remodelling, a key process in abdominal aortic aneurysm (AAA). However, the possible contribution of FBLN5 to AAA development has not been addressed.
MethodsExpression levels were determined by real-time PCR and Western blot in human abdominal aorta from patients with AAA or healthy donors, as well as in human aortic vascular smooth muscle cells (VSMC). Lentiviral transduction, transient transfections, and chromatin immunoprecipitation (ChIP) assays were also performed.
ResultsThe expression of FBLN5 in human AAA was significantly lower than in healthy donors. FBLN5 mRNA and protein levels and their secretion to the extracellular environment were down-regulated in VSMC exposed to inflammatory stimuli. Interestingly, FBLN5 transcriptional activity was inhibited by TNFα and lipopolysaccharide (LPS), and depends on a SOX response element. In fact, SOX9 expression was reduced in VMSC induced by inflammatory mediators and in human AAA, and correlated with that of FBLN5. Furthermore, SOX9 over-expression limited the reduction of FBLN5 expression induced by cytokines in VSMC. Finally, it was observed that SOX9 interacts with FBLN5 promoter, and that this binding was reduced upon TNFα exposure.
ConclusionsFBLN5 downregulation in human AAA could contribute to extracellular matrix remodelling induced by the inflammatory component of the disease.
El aneurisma de aorta abdominal (AAA) es una enfermedad degenerativa vascular que afecta a un 6-9% de los varones de más de 65 años. Se caracteriza por una dilatación progresiva de la aorta debida a la pérdida de la integridad vascular que puede conllevar la rotura súbita del vaso, la complicación más grave de esta enfermedad, asociada a una alta mortalidad1. La formación del AAA conlleva un proceso inflamatorio de la pared aórtica caracterizado por la inducción de vías proteolíticas, el incremento de la neovascularización y la muerte de las células musculares lisas de la pared vascular (CMLV) por apoptosis, lo que conduce a un remodelado destructivo del tejido conectivo. Actualmente, las opciones terapéuticas en esta patología se limitan a la intervención quirúrgica de aquellos aneurismas que presentan un alto riesgo de rotura, ya que no existen estrategias terapéuticas que dificulten la progresión del AAA2. La incidencia del AAA ha aumentado en los últimos años como consecuencia del incremento progresivo de la esperanza de vida, por lo que el desarrollo de estrategias terapéuticas que limiten el crecimiento y la rotura del AAA es un reto que requiere un mejor conocimiento de los mecanismos moleculares que subyacen a su desarrollo.
La fibulina-5 (FBLN5) es una glicoproteína matricelular que une integrinas, esencial en el ensamblaje de las fibras elásticas. La FBLN5 dirige la correcta organización de las fibras elásticas durante la elastogénesis y permite que los componentes de las fibras elásticas se mantengan en la proximidad de la superficie celular3,4. A diferencia de otros miembros de la familia de las fibulinas, la FBLN5 contiene una secuencia arginina-glicina-ácido aspártico (RGD) evolutivamente conservada que media la unión con integrinas de superficie y permite su participación en la comunicación célula-célula y célula-matriz5,6. De hecho, la FBLN5 promueve la adhesión de las células endoteliales, inhibe la proliferación y migración de las CMLV y las células endoteliales, participa en la respuesta de supervivencia de las células endoteliales a la hipoxia y muestra propiedades antiangiogénicas7-10. En la vasculatura, la FBLN5 contribuye al mantenimiento de la integridad de la pared vascular en respuesta a un daño y previene el remodelado anómalo7,11; sin embargo, se desconoce si la alteración en los niveles de FBLN5 podría participar en la patología aneurismática. Este estudio muestra la inhibición de la expresión de la FBLN5 en el AAA humano, establece su relación con el componente inflamatorio de la enfermedad y analiza los mecanismos moleculares que subyacen a este efecto, determinando la participación del factor de transcripción SOX9.
Material y métodosRecogida y procesamiento de muestras de pacientes con aneurisma de aorta abdominal y donantesSe obtuvieron muestras de aorta de pacientes con AAA sometidos a cirugía abierta (n=27; Hospital de la Santa Creu i Sant Pau[HSCSP], Barcelona, España) y aortas sanas (n=15) procedentes de donantes multiorgánicos12. Inmediatamente después de la cirugía, las muestras se dividieron y procesaron para estudios inmunohistoquímicos o bien se congelaron en N2 y se almacenaron a –80°C para la extracción de proteína o ARN. Los especímenes para inmunohistoquímica se fijaron durante toda la noche (4% paraformaldehído/0,1M tampón fosfato salino, pH 7,4), se seccionaron en bloques y se embebieron en parafina. La investigación se desarrolló con arreglo a la Declaración de Helsinki, fue aprobada por el Comité Ético de Investigación Clínica del HSCSP (12/031/1316) y se obtuvo un consentimiento informado de cada paciente.
Cultivo celularLas CMLV de aorta humana se obtuvieron mediante una modificación de la técnica de explantes a partir de aortas sin lesión aterosclerótica obtenidas en intervenciones de trasplante cardíaco realizadas en el HSCSP13. Estas células se cultivaron en medio M199 (Gibco, Carlsbad, CA, EE.UU.) suplementado con un 20% FCS, 2% de suero humano, 2mmol/l de L-glutamina y antibióticos. Se utilizaron células de al menos 4 donantes. Los estudios se realizaron con células entre los pases 3 a 6. La investigación se realizó conforme a la Declaración de Helsinki y fue aprobada por el Comité Ético del HSCSP.
Reacción en cadena de la polimerasa a tiempo realEl ARN total se aisló mediante Ultraspec™ (Biotecx, Houston, TX, EE.UU.) y se realizó una transcripción reversa mediante el kit High Capacity cDNA Reverse Transcription kit (Applied Biosystems, Thermo Fisher Scientific Inc., Waltham, MA, EE.UU.) en presencia de hexómeros al azar. La cuantificación de los niveles de ARNm se realizó usando el equipo ABI PRISM 7900HT sequence detection system y oligonucleótidos y sondas específicos proporcionados por el sistema TaqMan™ gene expression assays-on-demand (Applied Biosystems) o bien por el sistema PrimeTime®qPCR Assays (Integrated DNA Technologies, Inc., Coralville, IW, EE.UU.) para la amplificación de: FBLN5 humana (Hs00197064_m1) y SOX9 humano (Hs00165814_m1). La β-actina humana (Hs99999903_m1) y la TATA-binding protein humana (TBP; Hs99999910_m1) se usaron como controles endógenos. Cada muestra se amplificó por duplicado.
Generación de las construcciones del promotor de la fibulina-5 y mutagénesis dirigidaSe utilizaron vectores reporteros de luciferasa en pGL3 que contienen fragmentos seriados del promotor de la FBLN5 (pFBLN5-1650, pFBLN5-635 y pFBLN5-329)10. Los elementos de respuesta a SOX situados en la posición -304 y -251 del promotor de la FBLN5 se mutaron utilizando el sistema QuickChange II Site-directed mutagenesis kit (Agilent Technologies, Inc., Santa Clara, CA, EE.UU.) mediante las siguientes parejas de oligonucleótidos: SOX9-304mut, 5′-TTCATTTTCTAAGTATGTTAAACccTGCAAATGGGGCCTCAGTCTGG-3′ y 5′-CCAGACTGAGGCCCCATTTGCAggGTTTAACATACTTAGAAAATGAA-3′; SOX9-251mut; 5′-TCAGTAATTCAGCATTAAACCccTTGGAGGAGGAATGTTAAAAATGAACACT-3′ y 5′-AGTGTTCATTTTTAACATTCCTCCTCCAAggGGTTTAATGCTGAATTACTGA-3′ (se subraya el elemento putativo; los cambios se indican en letras minúsculas). Las mutaciones se confirmaron mediante secuenciación del ADN.
Transfección transitoria y análisis de actividad luciferasaPara la transfección transitoria de CMLV se utilizó Lipofectamine™ LTX y Plus™ Reagent (Life Technologies) tal y como se describió previamente14. Tras los tratamientos se determinó la actividad luciferasa (firefly y renilla) mediante el sistema Dual-Luciferase™ Reporter Assay System (Promega Biotech Ibérica).
Generación de lentivirus e infección de células musculares lisas vascularesEl ADNc correspondiente al SOX9 murino se obtuvo a partir del vector pWPXL-SOX9 (Addgene, Cambridge, MA, EE.UU.) y se clonó en el vector lentiviral pLVX-puro para generar el plásmido pLVX/SOX9. El plásmido vacío se utilizó como control. Las partículas virales se generaron según el protocolo del fabricante (Lenti-X™ Lentiviral Expression System; Clontech, Mountain View, CA, EE.UU.). Las CMLV infectadas se seleccionaron con puromicina durante 6 días.
Ensayo de inmunoprecipitación de cromatinaLa inmunoprecipitación de cromatina (ChIP) se realizó con anticuerpos contra SOX9 (ab3697, Abcam, Cambridge, Gran Bretaña) o una IgG de conejo como control de la unión inespecífica al ADN. Los inmunocomplejos se recuperaron con proteína A agarosa/ADN de esperma de salmón (#16-157; Merck Millipore, Darmstadt, Alemania) y tras varios lavados se extrajeron en tampón de elución (1% SDS, 100mM NaHCO3) a 65°C durante 15min. A continuación se revirtió el cross-link, y el ADN se purificó y concentró usando el sistema QIAquick PCR purification kit (Qiagen, Venlo, Holanda). El ADN se analizó mediante PCR a tiempo real con una pareja de oligonucleótidos diseñados para amplificar un fragmento del gen de la FBLN5 humana (posiciones -353 a -204bp relativas al ATG): oligonucleótido sentido, 5′- TTGGTGAGCGCTGTAATCT-3′ y oligonucleótido antisentido, 5′-AGAGGGCTAAGCAAAACCA-3′. La reacción de PCR a tiempo real se realizó por triplicado con el kit Quantifast™ SYBR Green PCR kit (Qiagen). La abundancia relativa de secuencias específicas en el ADN inmunoprecipitado se determinó mediante el método de ΔΔCt10,15.
Análisis por Western blotLas CMLV se lisaron con un tampón que contenía 10mM de Tris-HCl (pH 7,4), 1% de SDS y 1mM de ortovanadato. Los sobrenadantes de CMLV se concentraron con filtros Amicon Ultra 10K (Millipore Corp., Billerica, MA, EE.UU.) y se procesaron de manera análoga. Concretamente, las proteínas se separaron por SDS-PAGE y se transfirieron a membranas de difluoruro de polivinilideno (Immobilon, Millipore Corp.). Las membranas se incubaron con anticuerpos contra FBLN5 (ab66339; Abcam). La detección se realizó mediante el anticuerpo secundario adecuado y el sistema de detección Supersignal West Dura™ (Life Technologies, Thermo Fisher Scientific Inc.).
InmunohistoquímicaLas secciones se desparafinaron y rehidrataron y se trataron con un 10% de peróxido de hidrógeno. Tras el bloqueo con un 10% de suero, los portaobjetos se incubaron con anticuerpos contra FBLN5 (ab66339; Abcam) o SOX9 (sc-20095; Santa Cruz Biotechnology Inc., Heidelberg, Alemania) toda la noche a 4°C. Tras los lavados, las muestras se incubaron con un anticuerpo secundario biotinilado (Vector Laboratories Inc., Burlingame, CA, EE.UU.). A continuación, los portaobjetos se enjuagaron con PBS y se añadió el complejo avidina-biotina peroxidasa (Vector Laboratories Inc.). El color se desarrolló tras la adición de 3,3′-diaminobenzidina (DAB). En los controles negativos se omitió el anticuerpo primario.
Análisis estadísticosLos resultados se muestran como media±SEM. Las diferencias estadísticamente significativas se establecieron mediante t-test o ANOVA de un solo factor para medidas repetidas, según el número de grupos a comparar (GraphPad Instat V2.03; GraphPad Software Inc., La Jolla, CA, EE.UU.). En el último caso, cuando se encontraron diferencias significativas se aplicó el método de Student-Newman-Keuls. Cuando no se siguió una distribución normal se usó el test de Mann-Whitney para comparar 2 grupos y el Kruskal-Wallis para múltiples comparaciones. Para determinar la asociación entre variables, los resultados se transformaron en Log10 para normalizar su distribución y se aplicó la correlación de Pearson. Se consideraron significativas diferencias con p<0,05.
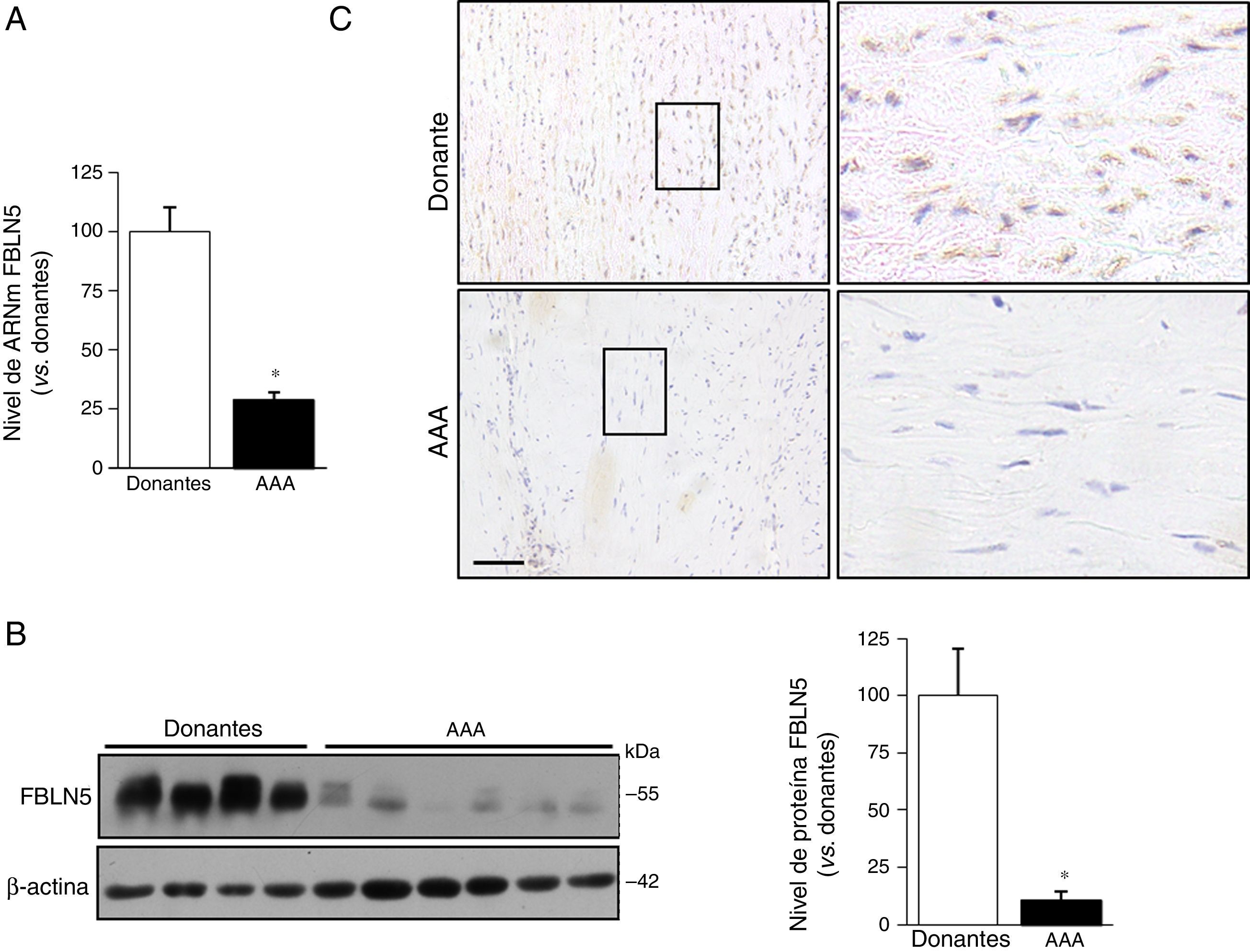
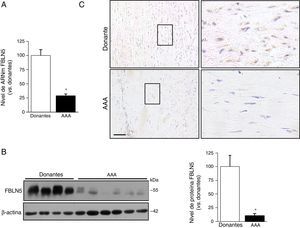
ResultadosLa expresión de la fibulina-5 disminuye en el aneurisma de aorta abdominal humanoLa expresión de la FBLN5 se analizó en muestras de aorta abdominal procedentes de pacientes con AAA y donantes multiorgánicos. Los niveles de ARNm y proteína de la FBLN5 fueron significativamente más bajos en muestras aneurismáticas frente a las de donantes (fig. 1A y B). Los análisis por Western blot mostraron la presencia de 2 bandas principales correspondientes a las formas nativa y proteolizada de la FBLN5, tal y como se describió previamente en biopsias de pulmón humano16. En los estudios inmunohistoquímicos, la FBLN5 se detectó en la media tanto en aortas aneurismáticas como en las de donantes, aunque la tinción fue menor en las muestras de AAA (fig. 1C).
La expresión de la FBLN5 se reduce en el AAA humano. A) Nivel de ARNm de la FBLN5 en muestras de AAA (n=27) y de aorta sana (donantes; n=15). Los resultados se expresan como media±SEM (* p<0,0001 vs. donantes). B) Los niveles de proteína de la FBLN5 se analizaron por Western blot en lisados de la pared vascular procedentes de aortas de pacientes con AAA y donantes. Se muestra un gel representativo y el gráfico de barras correspondiente a la cuantificación (donantes: n=7; AAA: n=12). Los resultados se expresan como la media±SEM (* p<0,0001 vs. donantes). C) Análisis inmunohistoquímico de la expresión de la FBLN5 en secciones de aorta de donantes o de pacientes con AAA contrateñidas con hematoxilina. Las éreas indicadas se muestran magnificadas (panel de la derecha). Barra: 100μm.
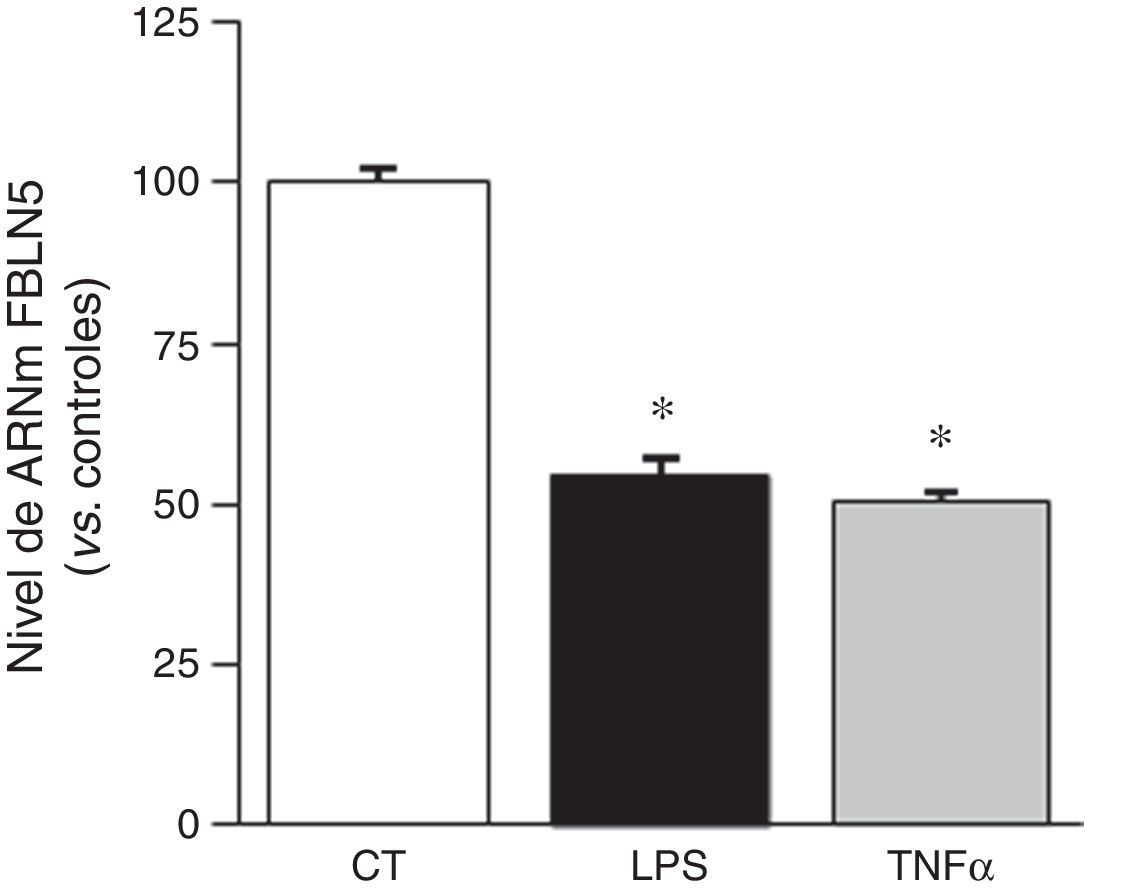
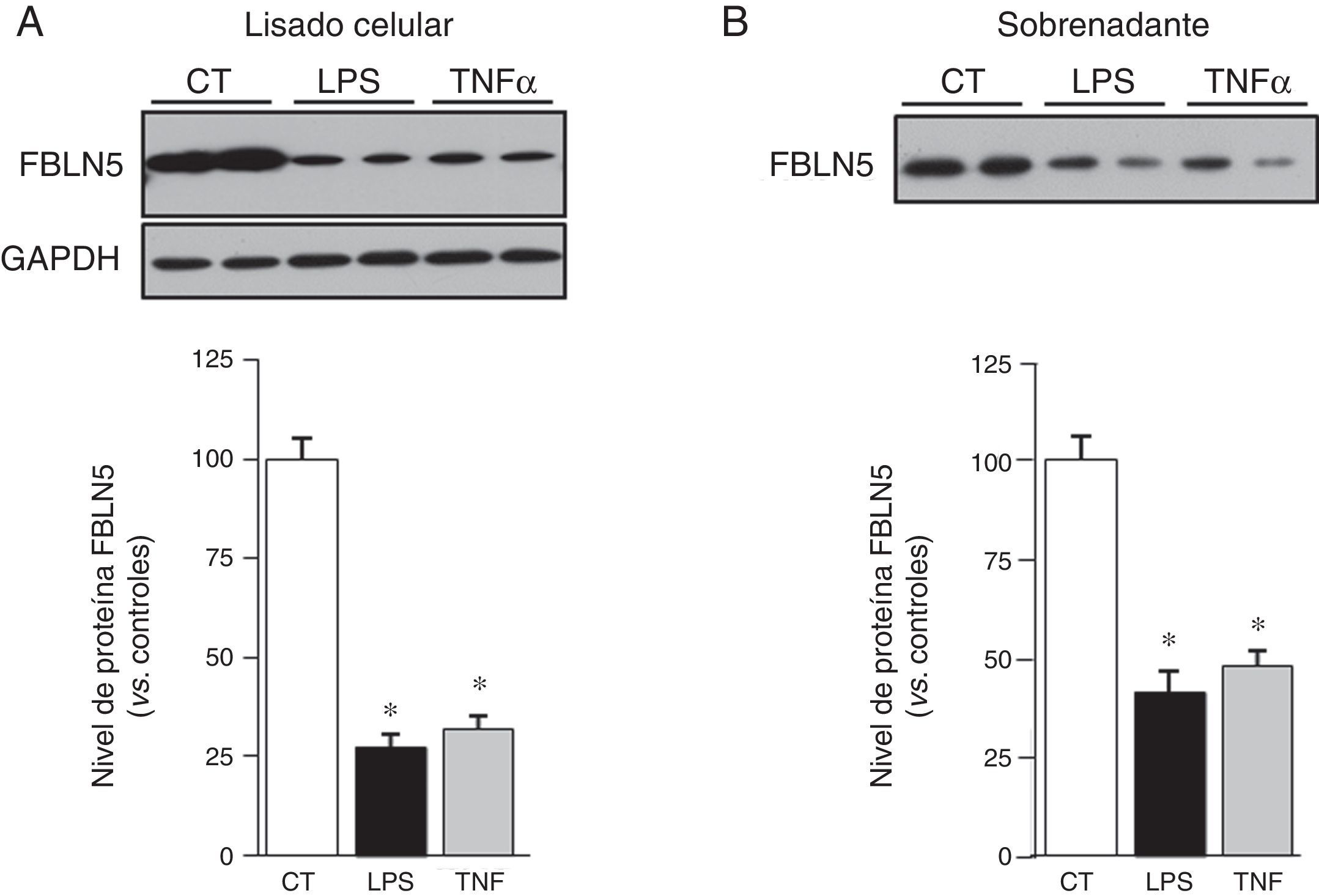
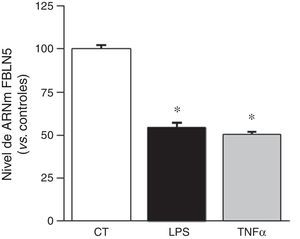
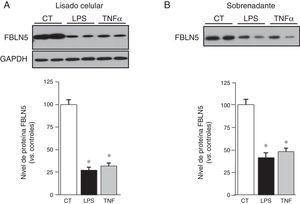
Debido a que la inflamación es un proceso fundamental en el AAA, quisimos determinar si la FBLN5 puede ser regulada por mediadores inflamatorios. Observamos que el tratamiento de CMLV de aorta humana con TNFα o LPS redujo significativamente el nivel de ARNm de la FBLN5 (fig. 2). Análogamente, estos mediadores disminuyeron el nivel de proteína y la secreción al medio de cultivo de la FBLN5 (fig. 3A y B).
La expresión vascular de la FBLN5 disminuye en presencia de estímulos inflamatorios. Las CMLV se expusieron a estímulos inflamatorios (LPS: 100ng/ml o TNFα: 50ng/ml) durante 24h. El nivel de ARNm de la FBLN5 se determinó por PCR a tiempo real. Los resultados se expresan como media±SEM (n=6; * p<0,0001 vs. controles).
El nivel de proteína FBLN5 y su secreción se reducen en CMLV expuestas a estímulos inflamatorios. Los niveles proteicos de la FBLN5 se evaluaron mediante Western blot en lisados celulares (A) y en medio condicionado (B) tras 48h de estimulación. Se muestra un autorradiograma representativo de 5 experimentos individuales realizados por duplicado. El histograma muestra el análisis densitométrico de las membranas (panel inferior). Los resultados se muestran como media±SEM. (* p<0,01 vs. controles).
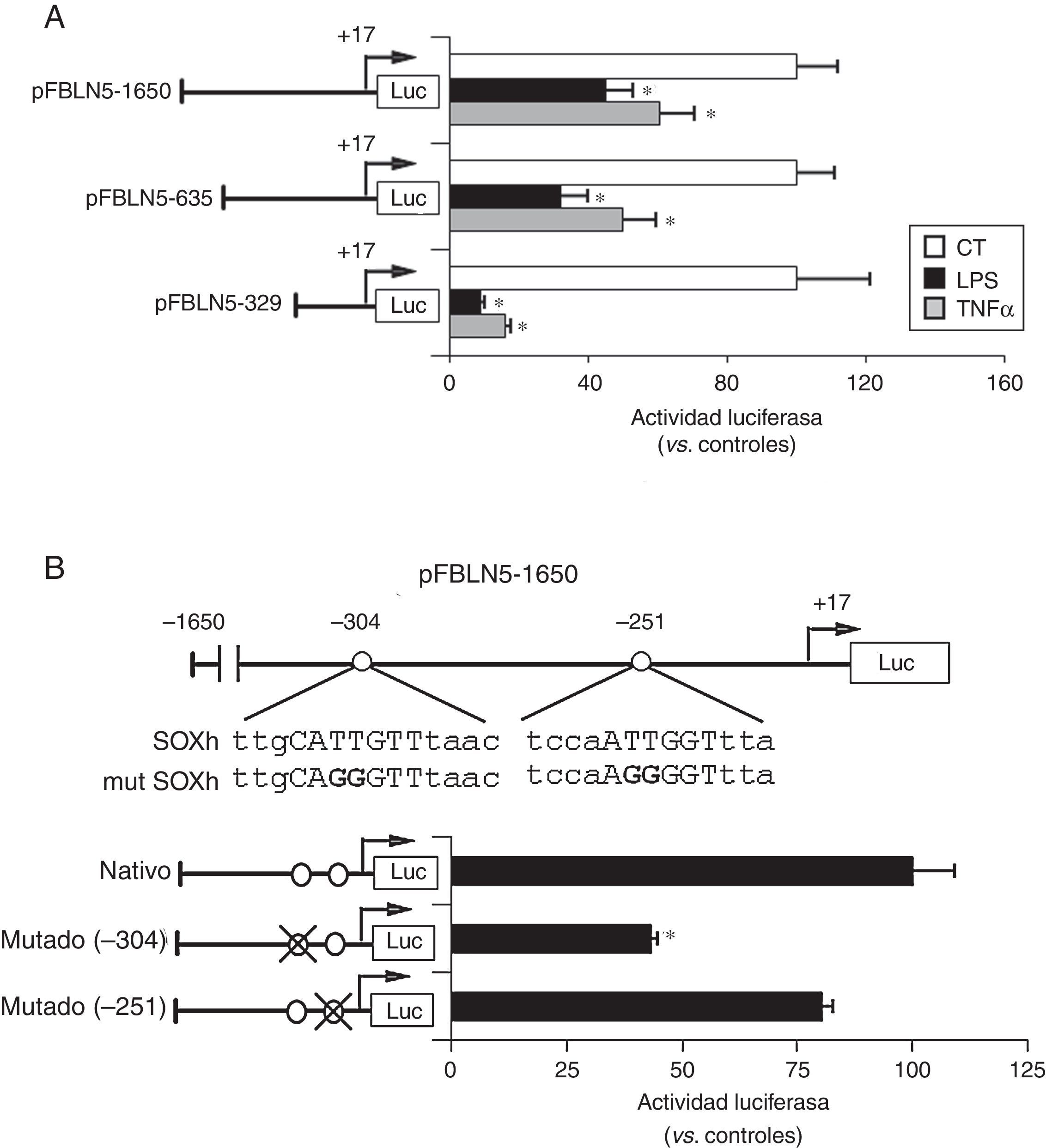
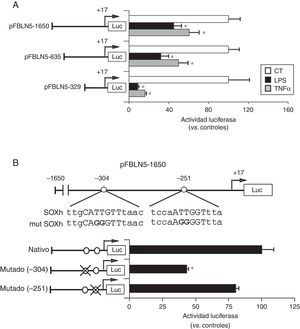
A continuación analizamos los mecanismos moleculares que subyacen a la inhibición de la FBLN5 por estímulos inflamatorios. La transfección de CMLV con un vector reportero de luciferasa bajo el control del promotor de la FBLN5 mostró que tanto el TNFα como el LPS inhibían la actividad transcripcional de esta proteína (fig. 4A). Los estudios de deleciones seriadas del promotor circunscribieron dicha regulación a una región proximal de 329pb (fig. 4A), en la que el análisis in silico identificó 2 elementos en cis (posiciones -304 y -251) con una elevada homología con la secuencia heptamérica consenso para SOX (Sry-related high-mobility group box; A/T A/T CAA A/T G). Como se muestra en la figura 4B, la mutación del elemento situado en -304 redujo de manera significativa la actividad transcripcional de la FBLN5, mientras que la mutación del elemento más proximal tuvo un efecto negligible.
Los mediadores inflamatorios inhiben la FBLN5 a través de un mecanismo transcripcional. A) Las CMLV se transfectaron con los vectores acoplados a luciferasa pFBLN5-1650, pFBLN5-635 o pFBLN5-329 y se expusieron a estímulos inflamatorios (LPS: 100ng/ml o TNFα: 50ng/ml) durante 24h. Se determinaron las actividades luciferasa de firefly y renilla. Los resultados (normalizados por renilla) se expresan como media±SEM (n=5; * p<0,05 vs. controles. B) Las CMLV se transfectaron con la construcción pFBLN5-1650 nativa o sus formas mutadas en los elementos putativos SOX. Los cambios introducidos por mutagénesis se resaltan en negrita. El histograma muestra la actividad luciferasa de la construcción nativa y de sus formas mutadas (círculos tachados). Los resultados se muestran como media±SEM (n=5; * p<0,001 vs. CMLV transfectadas con el vector pFBLN5-1650 nativo).
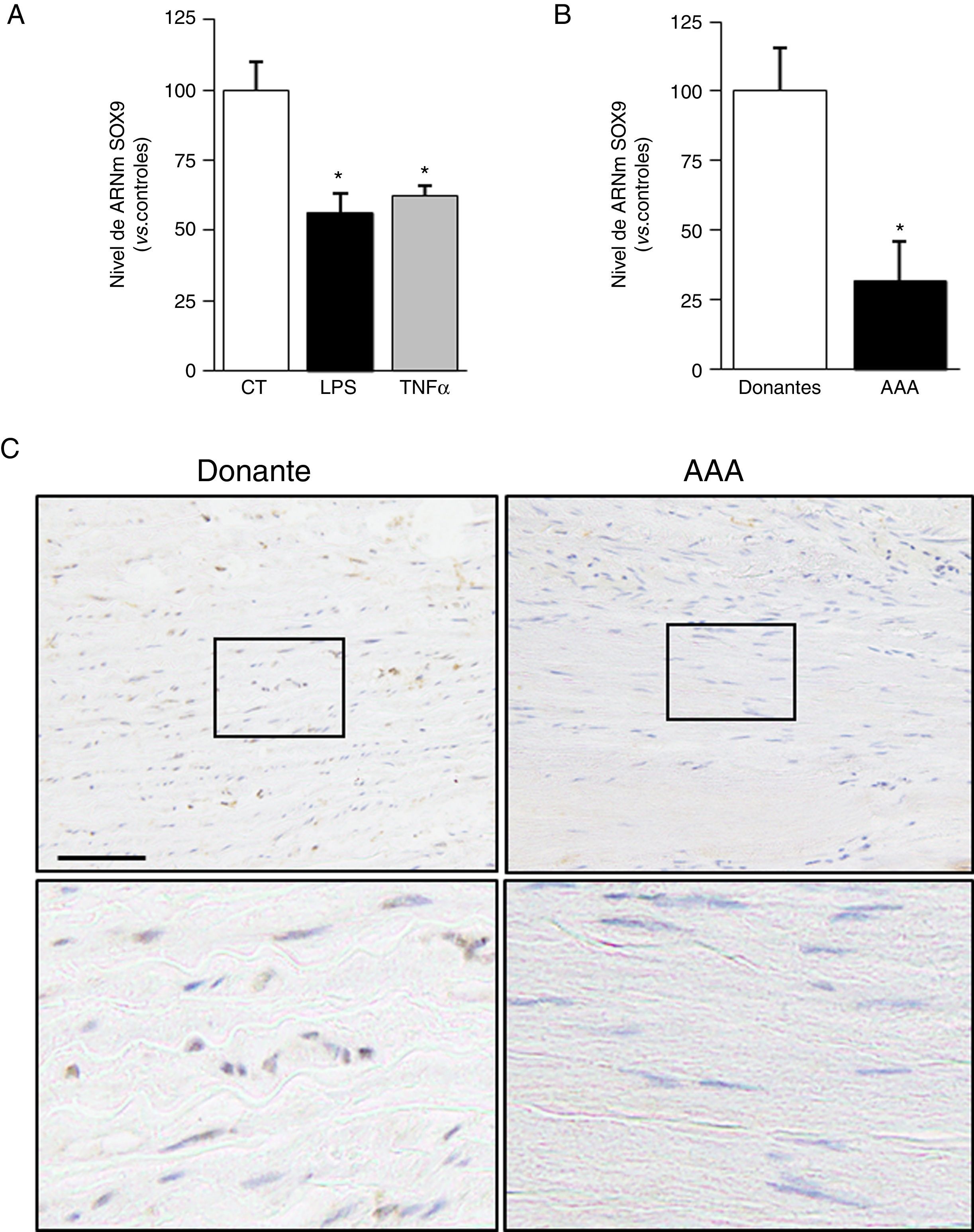
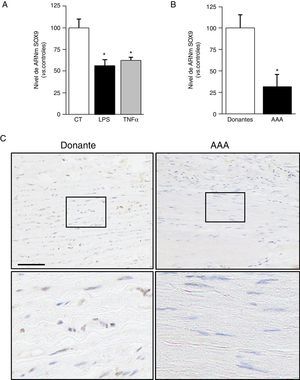
Entre los miembros de la familia SOX, SOX9 se ha implicado en el control de genes que participan en la síntesis y deposición de la matriz extracelular (MEX)17,18. La expresión de este factor de transcripción se redujo en CMLV estimuladas con LPS o TNFα (fig. 5A). Asimismo, observamos una disminución del nivel de ARNm de SOX9 en muestras de pacientes con AAA (fig. 5B) y una correlación significativa entre la expresión de SOX9 y de FBLN5 en estas muestras (r=0,6843; p<0,0001). En concordancia, se detectó una menor tinción para SOX9 en muestras de AAA frente a aortas de donantes (fig. 5C).
La expresión de SOX9 se inhibe en CMLV expuestas a estímulos inflamatorios y en el AAA humano. A) Las CMLV se expusieron a estímulos inflamatorios (LPS: 100ng/ml o TNFα: 50ng/ml; 24h) y se determinaron los niveles de ARNm de SOX9. Los resultados se muestran como media±SEM (n=6; * p<0,001 vs. controles). B) Nivel de ARNm de SOX9 ARNm analizado en aorta abdominal de pacientes aneurismáticos (n=17) y donantes sanos (n=15). Los resultados se muestran como media±SEM (* p<0,01 vs. donantes). C) Análisis inmunohistoquímico de la expresión de SOX9 en secciones de aorta contrateñidas con hematoxilina (Bar: 100μm).
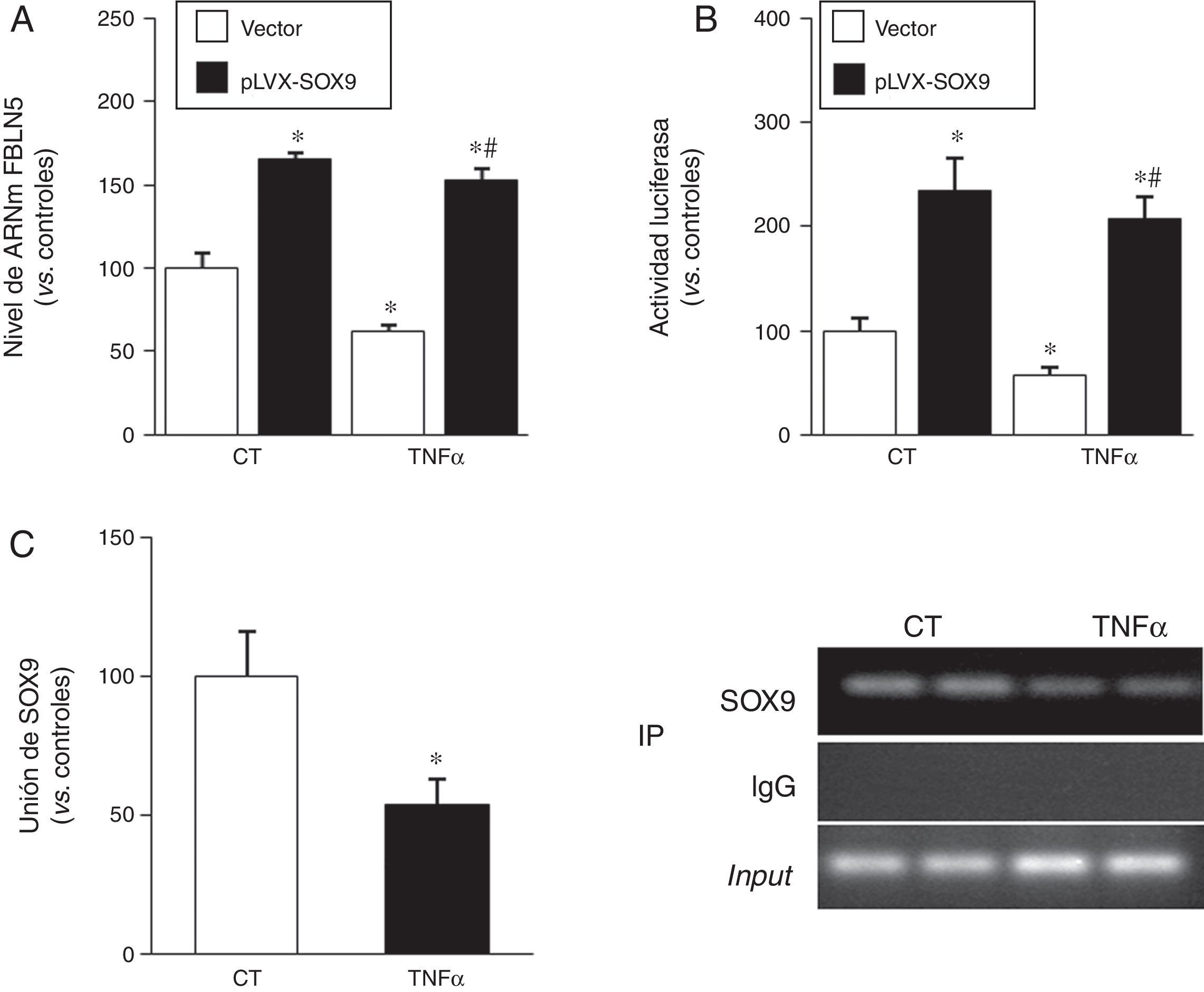
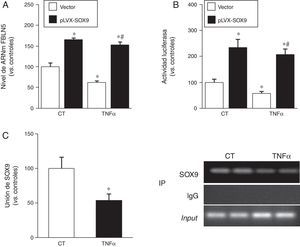
Los resultados descritos anteriormente sugieren que, bajo condiciones proinflamatorias, SOX9 podría regular la expresión de la FBLN5. Efectivamente, observamos que la sobreexpresión de SOX9 en CMLV mediante un sistema lentiviral aumentó tanto el nivel de ARNm como la actividad transcripcional de la FBLN5 (fig. 6A y B) y atenuó en ambos casos el efecto inhibitorio del TNFα. Finalmente, los ensayos de ChIP mostraron que el TNFα redujo la interacción de SOX9 con el promotor de la FBLN5 (fig. 6C).
SOX9 previene la inhibición de la expresión de la FBLN5 causada por el TNFα en CMLV humanas. A) Las CMLV se transdujeron con el vector lentiviral pLVX-SOX9 (barras negras) o con el plásmido vacío correspondiente (vector; barras blancas) y se estimularon o no con TNFα (50ng/ml, 24h). El nivel de ARNm de la FBLN5 se determinó por PCR a tiempo real y se expresó como media±SEM (n=6; p<0,001; * vs. CMLV transducidas con el vector vacío; # vs. CMLV transducidas con el vector vacío y tratadas con TNFα). B) Las CMLV se cotransfectaron con el vector acoplado a luciferasa pFBLN5-635 y el pLVX-SOX9 (barras negras) o el correspondiente vector vacío (vector; barras blancas) y se estimularon con TNFα (50ng/ml, 24h). La actividad luciferasa (normalizada por renilla) se expresa como media±SEM (n=5; * p<0,05 vs. células vector; # p<0,0001 vs. células vector tratadas con TNFα). C) Las CMLV se trataron con TNFα y se realizó un análisis por ChIP mediante un anticuerpo específico para SOX9 o una IgG inespecífica de conejo (IP). La unión de SOX9 al promotor de la FBLN5 se determinó mediante PCR a tiempo real usando oligonucleótidos específicos para el promotor de la FBLN5. Los resultados se representan como media±SEM (n=4; * p<0,05 vs. células controles). La imagen de la derecha muestra la electroforesis en gel de agarosa de los productos de PCR en la que se aprecia que no existían diferencias en la cantidad de ADN total inmunoprecipitado (input) en cada condición experimental.
Pese a los progresos en el estudio del AAA, actualmente no se dispone de herramientas farmacológicas que limiten la expansión del aneurisma y la única opción terapéutica en esta patología queda relegada a la intervención quirúrgica de aquellos aneurismas que presentan un elevado riesgo de rotura1,2. Con el objetivo de identificar nuevas dianas terapéuticas en el AAA, hemos centrado nuestro interés en la FBLN5, una proteína elastogénica esencial para el correcto ensamblaje de las fibras elásticas y que juega un papel clave en el desarrollo, el remodelado y la reparación tisular3-5,11. La alteración en la expresión de la FBLN5 se había vinculado con procesos patológicos como la enfermedad pulmonar obstructiva crónica16, la cutis laxa19, la degeneración macular20, el prolapso pélvico21 y la progresión tumoral22. Este estudio demuestra la reducción de la expresión de la FBLN5 en muestras aneurismáticas humanas, asocia esta inhibición al componente inflamatorio de la enfermedad y evidencia el papel fundamental de SOX9 en la regulación de la FBLN5.
La inhibición de la FBLN5 en la aorta aneurismática humana se confirmó mediante PCR a tiempo real, Western blot e inmunohistoquímica. A priori, este efecto podría deberse a la depleción del contenido en CMLV de la capa media que caracteriza al AAA humano. Sin embargo, los resultados de los estudios inmunohistoquímicos muestran una baja expresión de la FBLN5 en el aneurisma incluso en áreas ricas en CMLV. Además, los estudios en CMLV en cultivo confirman el papel esencial de la inflamación en la inhibición de la expresión vascular de la FBLN5.
Los estudios de transfección transitoria demostraron que la modulación de la FBLN5 por la inflamación se produce a través de mecanismos transcripcionales. Nuestros análisis delimitan esta regulación a una región proximal del promotor de la FBLN5 que contiene elementos imprescindibles para la expresión de la FBLN5, tal y como nosotros y otros grupos habían descrito10,23. En esta región identificamos 2 elementos putativos SOX. De hecho, la mutación del elemento situado en la posición -304 disminuyó significativamente la actividad transcripcional de la FBLN5, lo que sugiere la contribución de miembros de esta familia de factores de transcripción en su regulación.
La familia de factores de transcripción SOX comprende un grupo de proteínas versátil implicadas en el desarrollo embrionario y en procesos patológicos, que poseen un amplio abanico de funciones, entre ellas el control de la proliferación y la diferenciación celular17,24,25. En los últimos años se ha realizado un gran esfuerzo para identificar genes diana de la familia SOX19. De hecho, nuestro estudio ha identificado a la FBLN5 como un gen diana de SOX9 en CMLV. SOX9 regula múltiples proteínas de MEX y es fundamental en la condrogénesis19,18. Hemos observado una disminución de la expresión de SOX9 en muestras aneurismáticas humanas y su correlación con la expresión de la FBLN5. Puesto que la FBLN5 protege la integridad de la pared vascular en respuesta al daño11, y SOX9 es necesario para la correcta deposición de las proteínas de la MEX26, su inhibición conjunta podría contribuir al remodelado destructivo de la MEX en el AAA. Además, la inhibición de FBLN5 y SOX9 se ha relacionado con un incremento de la apoptosis en células vasculares y mesenquimales, respectivamente10,17,27. Nuestros datos muestran que en CMLV SOX9 se inhibe en presencia de estímulos inflamatorios, en consonancia con datos previos en otros tipos celulares28. El hecho de que que SOX9 revierta la inhibición de la FBLN5 por estímulos inflamatorios apoya la participación de este factor de transcripción en la regulación de la FBLN5, lo que se confirmó posteriormente en estudios de transfección transitoria y ChIP.
En definitiva, nuestros resultados proporcionan información relevante acerca de los mecanismos que subyacen al remodelado destructivo de la MEX en el AAA. Estos resultados sugieren la contribución de la inhibición de la FBLN5 en el AAA, su estrecha vinculación con el componente inflamatorio de la enfermedad y la implicación de SOX9 en este efecto. Este estudio sugiere que estrategias farmacológicas que preserven la expresión de la FBLN5 podrían ser útiles para prevenir la desestructuración de la MEX inducida por la inflamación en el AAA.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste estudio se ha financiado a través del Ministerio de Economía y Competitividad (MINECO)-Instituto de Salud Carlos III (ISCIII) (proyectos PI15/01016, PI12/01952, SAF2012-40127, SAF2013-46707-R y RD12/0042/0053). MG recibió una ayuda del programa Sara Borrell del ISCIII. El estudio ha sido cofinanciado por el Fondo Europeo de Desarrollo Regional (FEDER), Una Manera de Hacer Europa.
AutoríaCR y JMG diseñaron el estudio, llevaron a cabo la interpretación de los datos y escribieron el manuscrito. MO, SV, MG y SA realizaron los experimentos y el análisis de los datos y participaron en la elaboración del borrador del manuscrito. Todos los autores aprobaron la versión final del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen el apoyo técnico de Montserrat Gómez e Iris Rodríguez.
Una comunicación referente a esta línea de trabajo, titulada «Contribución de SOX-9 y de mecanismos epigenéticos en la inhibición de la Fibulina-5 por estímulos inflamatorios: implicación en el aneurisma de aorta abdominal», se presentó en el XXVIII Congreso Nacional de la SEA, celebrado el 2015 en Logroño, y fue galardonada con una mención especial.