Los estudios realizados hasta la fecha, sobre los mecanismos de acción de los compuestos fenólicos, indican que sus efectos podrían deberse no sólo a la eliminación de radicales libres, sino que modularían los procesos de señalización celular o actuarían por sí mismos como moléculas señal.
MétodosSe administraron 2 desayunos basados en aceite de oliva, uno de ellos con alto contenido en compuestos fenólicos (398ppm) y el otro con bajo contenido (70ppm), a 20 pacientes con síndrome metabólico, en un diseño aleatorio y cruzado. Se analizó la expresión génica postprandial en células mononucleares de sangre periférica, mediante microarrays.
ResultadosHemos observado que el desayuno que incluyó un aceite rico en compuestos fenólicos reprimió la expresión de 18 genes relacionados directamente con procesos de señalización, entre ellos 12 factores de transcripción implicados en proliferación y crecimiento celular.
ConclusionesNuestros resultados sugieren que el consumo de un desayuno con aceite de oliva virgen, rico en compuestos fenólicos, reduce los procesos de proliferación celular en células mononucleares, lo que podría ser un mecanismo de protección del desarrollo de arteriosclerosis.
It has been speculated that the potential beneficial effects of olive oil could be due to modulation of genes involved in proliferative, antioxidant and inflammatory pathways. Research on the acting and mechanisms of phenolic compounds indicates that the beneficial effects associated with these compounds may not only be due to the elimination of free radicals, but could also modulate cell signalling processes, or could themselves act as signaling molecules.
MethodsTwo virgin olive oil-based breakfasts with high (398ppm) and low (70ppm) content of phenolic compounds were administered to 20 patients with metabolic syndrome following a double-blinded random crossover design. Postprandial gene expression in peripheral blood mononuclear cells was analyzed at 4hours by gene expression microarrays.
ResultsWe observed that the phenolic compounds of olive oil repressed the expression of 18 genes directly related to signalling processes, including 12 transcription factors involved in proliferation and cell growth.
ConclusionsOur results suggest that consumption of olive oil rich in phenolic compounds reduces the processes of cell proliferation in mononuclear cells in the postprandial state, which could reduce development of atherosclerosis.
El síndrome metabólico (SM) se asocia a un elevado riesgo de enfermedad cardiovascular y de desarrollar diabetes mellitus tipo 2, proceso al que se considera por sí mismo un factor de riesgo cardiovascular. Las características clínicas de este síndrome ilustran la complejidad de la enfermedad, estando involucradas varias rutas metabólicas1.
Durante el estado postprandial tiene lugar una respuesta inflamatoria de bajo grado2, lo que es especialmente importante en pacientes con SM, patología que se asocia a un estado de inflamación de bajo grado. Los pacientes con SM son especialmente vulnerables en el postprandio, ya que durante dicha fase de la alimentación presentan una exacerbada hipertrigliceridemia3 junto a varias anormalidades en el metabolismo de las lipoproteínas4. Además, la trigliceridemia postprandial se ha relacionado con el estado pro-inflamatorio5.
Los efectos antiaterogénicos asociados al consumo de aceite de oliva, principal componente graso de la dieta mediterránea6, podrían contribuir a explicar la baja tasa de mortalidad cardiovascular en los países mediterráneos, a pesar de la alta prevalencia de factores de riesgo de enfermedad coronaria en dicha población7. Pero además, se ha propuesto que el efecto beneficioso del aceite de oliva virgen podría deberse no sólo a su alto contenido en ácido oleico, sino a la capacidad antioxidante y antiinflamatoria de sus componentes minoritarios, especialmente la fracción fenólica8. Estos fenómenos podrían explicarse por su capacidad para modular la expresión génica. Varios estudios en humanos y en modelos animales han abordado esta cuestión, utilizando plataformas de microarrays de expresión génica9, demostrando que el aceite de oliva es capaz de modificar la expresión de genes que codifican las proteínas que participan en los mecanismos de estrés oxidativo 10, metabolismo de los lípidos11 y relacionados con la aterosclerosis12,13. Sin embargo, no se sabe si estos cambios son debidos a la ingesta de ácido oleico o mediados por los compuestos minoritarios del aceite, como compuestos fenólicos, debido a su capacidad biológica, o por su interacción directa con receptores, enzimas o factores de transcripción.
Las células mononucleares de sangre periférica (CMSP) son un subconjunto de las células sanguíneas, constituido por linfocitos y monocitos/macrófagos. Son de relativamente fácil acceso en humanos comparado con otros tejidos y pueden ser utilizadas para evaluar las respuestas biológicas, siendo una fuente potencial para la identificación de nuevos biomarcadores de respuesta a exposiciones ambientales como la nutrición14–17. Además, se ha demostrado que la inflamación de bajo grado característica en individuos obesos está relacionada con la activación de estas células, y la pérdida de peso reduce la expresión por estas células de una variedad de citoquinas relacionadas con la inflamación y la respuesta inmune, tales como la interleuquina-6 y factor de necrosis tumoral-α18,19.
El objetivo principal de este estudio fue evaluar si los compuestos fenólicos del aceite de oliva virgen extra ejercen algún efecto en la expresión génica en células mononucleares de sangre periférica de pacientes con síndrome metabólico.
Materiales y métodosParticipantes en el estudioSe ha realizado un estudio de intervención dietética con veinte pacientes (56 años de edad, rango, 40-70) (9 hombres, 11 mujeres) de la Unidad de Lípidos y Aterosclerosis del Hospital Universitario Reina Sofía (Córdoba, España). Todos los pacientes cumplían tres o más de los criterios propuestos por «Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III)» para el síndrome metabólico. Los pacientes tenían un índice de masa corporal (IMC) promedio de 38,98 (27,95-44,42) kg·m−2, perímetro de cintura 132,2cm (103,0 a 137,0), presión arterial sistólica de 146±19mmHg, presión arterial diastólica 89±10mmHg, niveles plasmáticos de glucosa de 102,8±17,0mgdL-1, insulina 11,54±6,50 muL-1, colesterol total 201,7±27,1mgdlL-1, triacilglicéridos 184,9±78,0mg·mL-1, LDL-c 120,3±19,7mgdL-1 y HDL-c 50,7±11,8mgdL-1. Ningún sujeto mostraba evidencia de enfermedad crónica (hepática, renal, tiroides, corazón), tabaquismo, consumo de alcohol, o historia familiar de enfermedad cardiovascular precoz, ni tomaba medicamentos. El Comité de Ética de Investigación en Humanos del Hospital Universitario Reina Sofía aprobó este estudio y todos los participantes dieron su consentimiento informado antes de unirse al estudio.
Diseño del estudio y administración de los aceitesAntes de la ingesta de los aceites, los participantes siguieron un período de lavado de 6 semanas en las que no tomaron vitaminas, suplementos de soja, o cualquier medicamento. Para eliminar el efecto potencial que pudiera haber existido en sus hábitos alimenticios normales, todos los sujetos siguieron una dieta baja en grasa, rica en hidratos de carbono durante este período hasta el final del estudio. Después de un ayuno de 12 horas y siguiendo un diseño cruzado aleatorio secuencial con período de lavado de una semana, los participantes recibieron 2 desayunos: 60g de pan blanco, 40ml de aceite de olive virgen (CANOLIVA ®, Antonio Cano e Hijos™, Córdoba, España) con alto contenido (398ppm) o bajo (70ppm) en compuestos fenólicos, y 60.000 UI de vitamina A por cada m2 de superficie corporal. A lo largo de las 4 horas de duración del estudio, los sujetos no realizaron ninguna actividad física, ni consumieron nada más que agua.
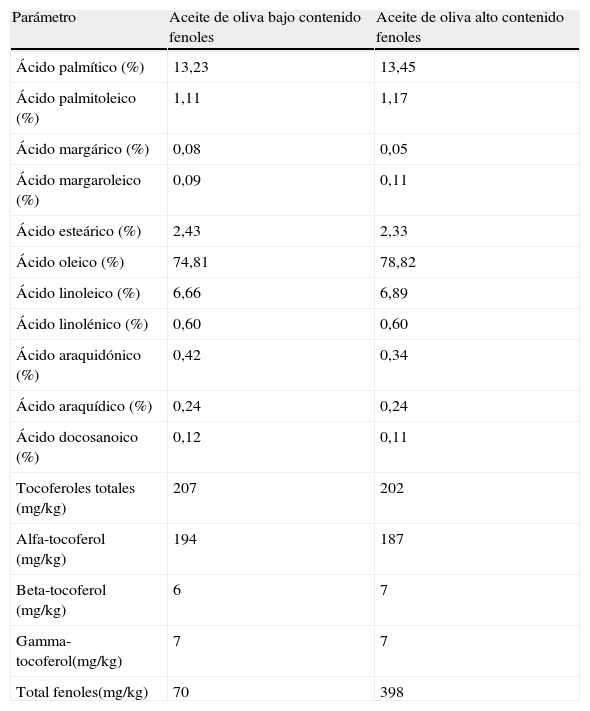
Contenido en compuestos fenólicos de los aceitesEl aceite de oliva con bajo contenido en compuestos fenólicos se obtuvo a partir de aceite de oliva virgen, que presenta un alto contenido en compuestos fenólicos, al que se le extrajeron los compuestos fenólicos mediante una extracción líquido-líquido. Los aceites fueron lavados en embudos de decantación con agua bidestilada, añadiendo en cada ocasión igual cantidad de aceite y de agua. Se agitaron durante 3 minutos y se dejaron decantar para facilitar la separación de fases (esta operación se llevó a cabo 7 veces a temperatura ambiente y en oscuridad a fin de proteger los aceites de procesos oxidativos). Después de los lavados, se determinó tanto en el aceite con alto como en el de bajo contenido en compuestos fenólicos la composición en ácidos grasos, contenido en tocoferoles y compuestos fenólicos. Sólo la fracción fenólica disminuyó tras los lavados (tabla 1). La composición de ácidos grasos de los aceites se determinó por cromatografía de gases en un Autosystem Perkin-Elmer (SGE Científico, Australia), según el Reglamento 2568/91 (CE, 1991). La composición de tocoferoles se analizó por HPLC en un HPLC Perkin-Elmer, aplicando el método IUPAC 2432 (IUPAC, 1992).
Composición de los aceites utilizados en el estudio
| Parámetro | Aceite de oliva bajo contenido fenoles | Aceite de oliva alto contenido fenoles |
| Ácido palmítico (%) | 13,23 | 13,45 |
| Ácido palmitoleico (%) | 1,11 | 1,17 |
| Ácido margárico (%) | 0,08 | 0,05 |
| Ácido margaroleico (%) | 0,09 | 0,11 |
| Ácido esteárico (%) | 2,43 | 2,33 |
| Ácido oleico (%) | 74,81 | 78,82 |
| Ácido linoleico (%) | 6,66 | 6,89 |
| Ácido linolénico (%) | 0,60 | 0,60 |
| Ácido araquidónico (%) | 0,42 | 0,34 |
| Ácido araquídico (%) | 0,24 | 0,24 |
| Ácido docosanoico (%) | 0,12 | 0,11 |
| Tocoferoles totales (mg/kg) | 207 | 202 |
| Alfa-tocoferol (mg/kg) | 194 | 187 |
| Beta-tocoferol (mg/kg) | 6 | 7 |
| Gamma-tocoferol(mg/kg) | 7 | 7 |
| Total fenoles(mg/kg) | 70 | 398 |
Las muestras de sangre venosa se obtuvieron en ayunas, antes de la ingesta del desayuno y 4 horas después. Las muestras de los estados de ayuno y postprandiales se recogieron en tubos que contenían EDTA 1g/L, evitando la exposición al aire y a la luz. Se separó el plasma de la sangre total por centrifugación a 1.500 x g durante 15min a 4°C.
Determinaciones bioquímicasLos parámetros lipídicos fueron determinados con el autoanalizador DDPPII modular Hitachi (Roche, Basilea, Suiza), utilizando reactivos específicos (Boehringer-Mannheim, Mannheim, Alemania). Las determinaciones colesterol total y los niveles de triglicéridos fueron realizadas por métodos enzimáticos colorimétricos20,21; las de HDL-c por ensayo colorimétrico22, las de LDL-c por la fórmula de Friedewald basada en la cantidad de colesterol total, triglicéridos y HDL-c23. Las concentraciones de glucosa en plasma fueron determinadas con un analizador Hitachi 917 (Boehringer Mannheim, Mannheim, Alemania) por el método de la glucosa oxidasa (GOD-PAP). Las concentraciones plasmáticas de insulina se midieron por inmunoensayo enzimático de micropartículas (Abbott Diagnostics, Matsudo-shi, Japón). Las concentraciones de ácidos grasos no esterificados se midieron mediante un ensayo enzimático colorimétrico (Roche Diagnostics, Penzberg, Alemania).
Aislamiento de células mononucleares de sangre periférica y extracción de ARNLas CMSP fueron aisladas de 30ml de sangre anticoagulada con EDTA tomadas 4h después del consumo de cada desayuno. Las capas leucocitarias se diluyeron 1:2 en PBS, y las células se separaron en gradiente de Ficoll (5ml, solución de aislamiento de linfocitos, Rafer) por centrifugación a 2.000 x g durante 30min. Las células mononucleares de sangre periférica se recogieron y se lavaron dos veces con PBS frío. Las CMSP aisladas se congelaron en nitrógeno líquido y se almacenaron a -80°C hasta la extracción del ARN. El ARN total fue extraído con reactivo TRI (Sigma-Aldrich, Inc., de St. Louis, MO, EE.UU.) y posteriormente limpiado con RNeasy MiniElute Cleaner Kit (Qiagen, Hilden, Alemania) y cuantificado con un Nanodrop ND-1000 v3.5.2 espectrofotómetro (Nanodrop Technology ®, Cambridge, Reino Unido). La integridad del ARN se evaluó en geles de agarosa al 1,6% en TBE, 1x. El ARN fue considerado viable para la hibridación sólo si las muestras mostraban intactas las bandas correspondiente al ARN ribosomal 18S y 28S.
Marcaje del ARN e hibridacionesLas muestras de ARN se marcaron con el kit comercial SuperScript Indirect RNA Amplification System (Invitrogen Inc., Carlsbad, CA, EE.UU.), de acuerdo con las instrucciones del fabricante. El rendimiento de marcaje se evaluó con un Nanodrop ® ND 1000 v3.5.2 (Tecnología Nanodrop ®, Cambridge, Reino Unido). La hibridación se llevó a cabo mediante el kit comercial Gene Expression Hybridization Kit (Agilent Technologies Inc., Santa Clara, CA, EE.UU.) siguiendo las instrucciones del fabricante. Las imágenes de los microarrays utilizados, 4x44k Whole Human Genome Oligo Microarray G4112A (Agilent Technologies Inc., Santa Clara, CA, EE.UU.), tras la hibridación y lavados se obtuvieron con un escáner Pix 4000B (Axon Instruments, Union City, CA, EE.UU.) y la cuantificación se realizó con el software Agilent Feature Extraction Software v9.5 (Agilent Technologies Inc., de Santa Clara, CA, EE.UU.).
Identificación de los genes diferencialmente expresadosEl análisis diferencial de expresión génica se realizó mediante el ajuste de modelos lineales racional para datos de microarrays con el paquete R Limma (GLP). Para considerar un gen como expresados diferencialmente, los criterios de filtrado que se utilizaron fueron la combinación del valor M (log2ratio señal) superior a 0,4 (sobreexpresado) o inferior a -0,4 (reprimido) (cambios en 1,32 y -1,32 veces, respectivamente), y la significación estadística (p) del modelo lineal ajustado de ≤ 0,01. Los resultados fueron ajustados por los efectos de intercambio de tinte y False Discovery Rate (FDR), utilizando el método Benjamini y Hochberg.
ResultadosLipemia postprandialNo se observaron diferencias significativas en ninguno de los parámetros lipídicos (glucosa, insulina, ácidos grasos libres, triglicéridos y colesterol total) después de la ingesta del desayuno preparado con aceite de oliva virgen rico en compuestos fenólicos, comparado con el aceite de oliva con un menor contenido de compuestos fenólicos (datos no mostrados).
Análisis de la expresión génica mediante microarraysSe emplearon microarrays de dos colores utilizando la plataforma de Agilent. Los cambios en la expresión génica se determinaron como log2 del ratio de los valores de intensidad de señal del transcriptoma cuatro horas después del consumo de aceite de oliva de alto contenido de fenoles dividida por los valores de intensidad de señal correspondiente al transcriptoma 4h después del consumo de aceite con bajo contenido en compuestos fenólicos. De las 15.308 sondas de alta calidad de señal, desde un log2 de ratio 1,89 hasta -1,79, la expresión de 98 genes se vio alterada por el consumo de aceite de olive virgen extra rico en compuestos fenólicos. La expresión de 19 genes aumentó y la de 79 disminuyó debido a la ingesta de aceite de oliva virgen rico en compuestos fenólicos en comparación con el aceite de oliva con un menor contenido de compuestos fenólicos.
Análisis de la función de los genes diferencialmente expresadosSe utilizó el software Ingenuity Pathway Analysis24 (Ingenuity Systems, Redwood City, CA, EE.UU.) para determinar la función de los 98 genes diferencialmente expresados. No obstante, dos transcritos (LOC284454, AF351612) no tenían entrada en la base de datos del programa, luego se analizaron los 96 restantes: 8 genes codificaban para citoquinas, 10 genes para enzimas, 2 para receptores acoplados a proteínas G, 2 para factores de crecimiento, 2 para canales iónicos, 3 para quinasas, 2 para receptores nucleares ligando dependiente, 1 para una peptidasa, 2 para fosfatasas, 13 para reguladores de la transcripción, 2 para receptores transmembrana, 2 para transportadores y 47 genes no tenían función asignada.
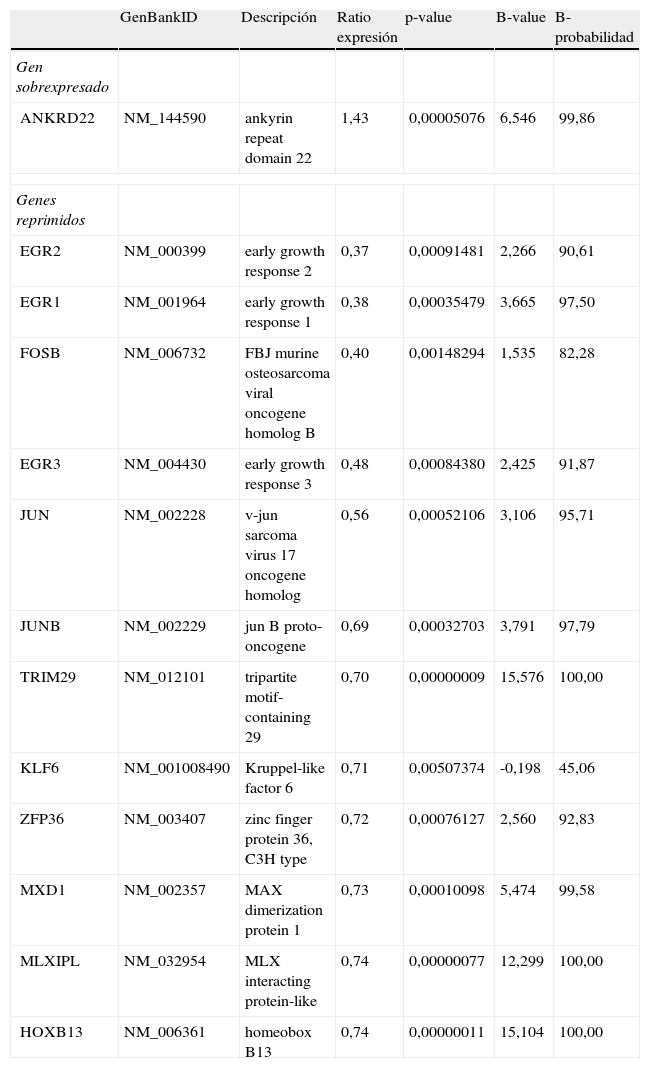
El grupo más abundante de genes, reguladores de la transcripción (tabla 2), fue seleccionado para ser estudiado en detalle en relación a las funciones biológicas en las que intervienen. El análisis de las redes de interacción de estos genes los encuadró en una única red con las siguientes funciones en términos celulares: crecimiento, proliferación y desarrollo celular. No obstante, desde el punto de vista patológico, los genes se asociaron principalmente a: cáncer de mama (p=1,36E-5; CDKN2A, EGR1, FOSB, JUN, JUNB, KLF6, ZFP36), alteraciones inflamatorias (p=2,12E-4; CDKN2A, EGR1, EGR2, EGR3, FOSB, JUN, JUNB, MXD1, ZFP36) y enfermedades genéticas (p=1,76E-3; CDKN2A, EGR1, EGR2, EGR3, HOXB13, FOSB, JUN, JUNB, KLF6, MLXIPL, MXD1, TRIM, ZFP36), incluyendo tanto los relacionados directamente con enfermedades genéticas, como son CDKN2A (asociado con cáncer de páncreas25), KLF6 (con cáncer de próstata26), MXD1 (con esclerosis múltiple27) y MLXIPL (con síndrome de Williams-Beuren28) o bien con una relación indirecta (genes cuya expresión está desregulada en enfermedades genéticas).
Descripción de los factores de transcripción diferencialmente expresados por efecto de los compuestos fenólicos del aceite de oliva
| GenBankID | Descripción | Ratio expresión | p-value | B-value | B-probabilidad | |
| Gen sobrexpresado | ||||||
| ANKRD22 | NM_144590 | ankyrin repeat domain 22 | 1,43 | 0,00005076 | 6,546 | 99,86 |
| Genes reprimidos | ||||||
| EGR2 | NM_000399 | early growth response 2 | 0,37 | 0,00091481 | 2,266 | 90,61 |
| EGR1 | NM_001964 | early growth response 1 | 0,38 | 0,00035479 | 3,665 | 97,50 |
| FOSB | NM_006732 | FBJ murine osteosarcoma viral oncogene homolog B | 0,40 | 0,00148294 | 1,535 | 82,28 |
| EGR3 | NM_004430 | early growth response 3 | 0,48 | 0,00084380 | 2,425 | 91,87 |
| JUN | NM_002228 | v-jun sarcoma virus 17 oncogene homolog | 0,56 | 0,00052106 | 3,106 | 95,71 |
| JUNB | NM_002229 | jun B proto-oncogene | 0,69 | 0,00032703 | 3,791 | 97,79 |
| TRIM29 | NM_012101 | tripartite motif-containing 29 | 0,70 | 0,00000009 | 15,576 | 100,00 |
| KLF6 | NM_001008490 | Kruppel-like factor 6 | 0,71 | 0,00507374 | -0,198 | 45,06 |
| ZFP36 | NM_003407 | zinc finger protein 36, C3H type | 0,72 | 0,00076127 | 2,560 | 92,83 |
| MXD1 | NM_002357 | MAX dimerization protein 1 | 0,73 | 0,00010098 | 5,474 | 99,58 |
| MLXIPL | NM_032954 | MLX interacting protein-like | 0,74 | 0,00000077 | 12,299 | 100,00 |
| HOXB13 | NM_006361 | homeobox B13 | 0,74 | 0,00000011 | 15,104 | 100,00 |
El ratio indica la expresión del gen cuando se consumió aceite de oliva con alto contenido en compuestos fenólicos dividido por la expresión del gen cuando se consumió aceite de oliva con bajo contenido en compuestos fenólicos.
En el presente estudio hemos observado que la ingesta de un desayuno con aceite de oliva virgen, rico en compuestos fenólicos, reprime la expresión de 18 genes relacionados directamente con procesos de señalización, entre ellos 12 factores de transcripción implicados en proliferación y crecimiento celular. Estudios experimentales han mostrado que los compuestos fenólicos del aceite de oliva mejoran los parámetros lipídicos, pero también disminuyen el estrés oxidativo29. No obstante, muchas de las propiedades asociadas a los compuestos fenólicos, tales como las antiinflamatorias, antitumorales y antiaterogénicas, no pueden ser explicadas únicamente en base a su capacidad antioxidante30. De hecho, varios estudios realizados hasta la fecha, sobre los mecanismos de acción de los polifenoles, indican que los efectos beneficiosos podrían no sólo deberse a la eliminación de radicales libres, sino que serían capaces de modular procesos de señalización celular o actuar por sí mismos como moléculas señal31.
Nuestro estudio mostró que de los 51 genes de función conocida, cuya expresión génica fue modificada por los compuestos fenólicos del aceite de oliva, 18 están relacionados directamente con procesos de señalización (12 factores de transcripción, 2 para receptores acoplados a proteínas G, 2 receptores nucleares ligando dependiente y 2 para receptores transmembrana). Por otra parte, nuestro estudio demostró que la expresión génica de los 3 miembros más importantes de la familia de factores de transcripción EGR (EGR-1, EGR-2 y EGR-3) es reprimida por los compuestos fenólicos del aceite de oliva. La familia de factores EGR juega un importante papel en el control de los programas celulares de diferenciación, proliferación y muerte celular32. Además, la expresión de los genes EGR es transitoria e inducida coordinadamente por la activación de los linfocitos T33, aunque también se expresa en otros tipos celulares como células linfoides y mieloides como timocitos, células B y en monocitos34, donde conduce la diferenciación a macrófagos de estos últimos35. Este resultado es relevante desde el punto de vista patológico en el sentido de que indica una menor activación postprandial de las células mononucleares, tras la ingesta del aceite rico en compuestos fenólicos. Por otro lado, la expresión génica de c-jun, JunB y FosB, integrantes del factor transcripcional AP-1, también fue reprimida tras la ingesta del aceite rico en compuestos fenólicos. El hecho de que este factor transcripcional, al igual que la familia de factores de transcripción EGR, parece controlar los procesos celulares de diferenciación, proliferación y muerte celular36, sugiere una interacción entre los compuestos fenólicos del aceite de oliva y las vías de señalización y/o control de estos procesos. Estos hallazgos son de gran interés, desde el punto de vista del desarrollo de aterosclerosis, ya que se ha demostrado que la progresión de esta patología se asocia con la expansión clonal de células T37. Así, nuestros resultados podrían sugerir que el consumo de aceite de oliva rico en compuestos fenólicos, al reducir este proceso, frenaría el desarrollo y progresión de esta enfermedad.
Nuestro estudio además mostró que la expresión de genes supresores de tumores (MXD1 y KLF6), la del gen TRIM19, relacionado con la proliferación en queratinocitos y la del gen MLXIPL, relacionado con la proliferación en hepatocitos38, fue también reprimida tras el consumo del aceite rico en compuestos fenólicos así como la de otros factores de transcripción, como HOXB13 y ZFP36 cuya función no está relacionada con procesos de diferenciación y proliferación. No obstante, los factores de transcripción desempeñan funciones diferentes en diferentes tejidos y la acción de co-activadores y co-represores es importante en la activación y/o represión de la transcripción que los factores de transcripción realizan39.
En conclusión, nuestros resultados sugieren que el consumo de aceite de oliva virgen, rico en compuestos fenólicos, reduce los procesos de proliferación celular en células mononucleares en estado postprandial, lo que podría reducir el desarrollo de aterosclerosis. Estos resultados proporcionan una base molecular que explicaría, al menos parcialmente, la reducida incidencia de enfermedad cardiovascular observada en los países mediterráneos, donde el aceite de oliva virgen representa la principal fuente de grasa en la dieta. No obstante, otros factores como el estilo de vida también pueden afectar al menor riesgo de enfermedad cardiovascular en estas regiones.
FinanciaciónEste trabajo ha sido financiado por la Consejería de Innovación, Ciencia y Empresa, Junta de Andalucía (AGR 922 para FP-J), Ministerio de Innovación, Ciencia y Empresa (SAF 2003-05770 a FP-J), Consejería de Salud, Junta de Andalucía (06/0129 de FP-J y 0040/07 a JR), Centro de Excelencia en Investigacion Sobre Aceite de Oliva y Salud (CEAS), Ministerio de Medio Ambiente y Medio Rural y Marino, Agencia para el Aceite de Oliva.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El CIBEROBN es una iniciativa del Instituto de Salud Carlos III, Madrid, España. Nuestro agradecimiento a los pacientes que participaron en este estudio. Extendemos nuestro agradecimiento a Canoliva (Antonio Cano e Hijos SA, Luque, Córdoba), quien generosamente donó el aceite de oliva.