Los inhibidores de la HMG-Coa-reductasa, conocidos como estatinas, son los agentes farmacológicos disponibles en el mercado que tienen un mayor efecto hipocolesterolemiante. Los ensayos clínicos y las evidencias experimentales han demostrado que las estatinas tienen un potente efecto antiaterosclerótico. Este efecto es, en parte, la consecuencia del descenso de lípidos, pero también se debe a ciertas acciones pleiotrópicas.
Los llamados efectos pleiotrópicos se refieren a distintos aspectos de la función celular: inflamación, coagulación y actividad vasomotora. Estos efectos son mediados, bien indirectamente a través de la reducción del cLDL, o bien por vía directa en las funciones celulares. Aunque muchas de las acciones pleiotrópicas de las estatinas pueden ser un efecto de clase, alguna de ellas puede ser exclusiva de ciertos fármacos y mostrar diferencias en su actividad farmacológica. Así, aunque las estatinas tienen un efecto común sobre los niveles de cLDL, las diferencias en la estructura química y en el perfil farmacocinética pueden motivar variaciones en los efectos pleiotrópicos.
En el presente artículo analizamos los efectos in vitro de diferentes estatinas sobre diferentes líneas celulares de células implicadas en el proceso aterogénico: células endoteliales, fibroblastos y células musculares de la pared vascular. En relación con nuestros resultados, comprobamos que los efectos de diferentes dosis de diferentes estatinas sobre las curvas de crecimiento de las diferentes líneas celulares producen diferentes efectos, con independencia de los efectos dependientes de la clase. En consecuencia, los efectos pleiotrópicos sobre el crecimiento celular y su reversibilidad con mevalonato son diferentes según la molécula y la dosis empleadas.
HMG-CoA-Reductase inhibitors, also known as statins, are currently the most powerful cholesterol-lowering drugs available on the market. Clinical trials and experimental evidence suggest that statins have heavy anti-atherosclerotic effects. These are in part consequence of lipid lowering but also result from pleiotropic actions of the drugs.
These so-called pleiotropic properties affect various aspects of cell function, inflammation, coagulation, and vasomotor activity. These effects are mediated either indirectly through LDL-c reduction or via a direct effect on cellular functions. Although many of the pleiotropic properties of statins may be a class effect, some may be unique to certain agents and account for differences in their pharmacological activity. So, although statins typically have similar effects on LDL-c levels, differences in chemical structure and pharmacokinetic profile can lead to variations in pleiotropic effects.
In this paper we analize the in vitro effects of different statins over different cell lines from cells implicated in atherosclerotic process: endothelial cells, fibroblasts, and vascular muscular cells. In relation with our results we can proof that the effects of different dosis of different statins provides singular effects over growth curves of different cellular lines, a despite of a class-dependent effects. So, pleiotropic effects and its reversibility with mevalonate are different according with the molecule and the dosis.
Las estatinas inhiben la biosíntesis intracelular de colesterol y son fármacos que soportan el peso del tratamiento hipocolesterolemiante en la actualidad. Por tanto, tienen un papel central en la prevención cardiovascular, hecho que ha sido constatado tanto en prevención primaria como en prevención secundaria1.
En los últimos años, diversas evidencias han sugerido que la reducción de la morbimortalidad cardiovascular producida por las estatinas podría ser consecuencia no solo de la reducción de las concentraciones plasmáticas de colesterol LDL (cLDL), sino también de otras acciones independientes atribuidas a tales fármacos. De hecho, algunos efectos protectores de la estatinas en modelos animales de hipercolesterolemia (reversión de la función endotelial) aparecen antes incluso que la reducción de los valores de cLDL2, y en algunos estudios de intervención farmacológica la estatina empleada ha sido capaz de reducir los episodios isquémicos a las 16semanas de tratamiento, un intervalo demasiado corto para que pueda atribuirse a cambios en los valores de las LDL3.
La información de que disponemos al respecto procede de los grandes estudios de intervención clínica, de los estudios de experimentación animal y de los estudios in vitro. Entre todos, se ha podido constatar que los efectos independientes de la reducción directa del colesterol son múltiples4,5. Todos los hallazgos han llevado al convencimiento de que las estatinas tienen acciones independientes de la simple reducción de las concentraciones plasmáticas de cLDL, y que se han venido conociendo como efectos pleiotrópicos6,7. Las principales acciones pleiotrópicas de las estatinas pueden estar relacionadas con influencias en algunos de los mecanismos patogénicos de la formación de la placa de ateroma: reversión de la disfunción endotelial, efecto antioxidante, antitrombótico, inmunomodulador o antiinflamatorio. Además, su valoración ha permitido conocer que las estatinas son capaces de modificar el comportamiento celular: proliferación, muerte celular programada, adhesividad, movilidad.
Los efectos pleiotrópicos de las estatinas pueden jugar un papel importante en la reducción de la morbimortalidad de origen cardiovascular, por cuanto pueden proporcionar un valor añadido al efecto hipocolesterolemiante del fármaco8, sobre todo si tenemos en consideración que algunos de tales efectos se relacionan con un mecanismo antiproliferativo y antiinflamatorio9 y también antitrombótico10. Otros efectos se relacionan directamente con la proliferación celular que tiene lugar en la pared arterial.
Los principales protagonistas celulares que participan en el proceso aterogénico y que proceden de la propia pared vascular son las células endoteliales, las células musculares lisas y los fibroblastos. Otras son células «inmigrantes»: mononucleares (fundamentalmente monocitos, pero también linfocitos), polinucleares (granulocitos) y plaquetas.
El objetivo del presente trabajo es conocer cómo diferentes dosis de diferentes estatinas son capaces de modificar la curva de crecimiento de las diferentes células implicadas en el proceso aterogénico, y en qué grado. Asimismo, hemos querido comprobar si tales efectos son reversibles con la adición de mevalonato, confirmando así que son debidos directamente a la acción del fármaco en cuestión.
Material y métodosCélulasLas líneas celulares establecidas han procedido de la American Type Culture Collection (ATCC), la European Collection of Cell Cultures (ECACC) y de líneas establecidas en nuestro laboratorio.
Cultivos primariosFibroblastos humanos. El cultivo primario de amígdalas recién extirpadas proporciona una buena cantidad de fibroblastos. Las células FA (fibroblastos amigdalares) son células normales procedentes del cultivo primario de amígdalas hipertróficas de una niña de 5 años de edad. Las amígdalas extirpadas se recogieron en solución salina equilibrada de Dulbecco, suplementada con 200UI/ml de penicilina, 200μg/ml de estreptomicina, 32μg/ml de gentamicina y 40UI/ml de nistatina.
Líneas celulares establecidasCélulas humanas de endotelio vascular (HMEC-1). Las células HMEC-1 fueron obtenidas en 1992 por Ades et al.11 a partir de endotelio vascular. Las transfectaron a un plásmido PBR-322 portador del código genético del virus del primate 40a (lo que confiere mayor supervivencia), de forma que hasta el pase 95 no aparecen signos de senescencia, mientras que en las células endoteliales normales aparecen al 8.°-10.° pase. Las HMEC-1 pueden crecer en ausencia de suero humano. Expresan y segregan factor de Von Willebrand. También expresan moléculas de superficie típicamente asociadas con las células endoteliales humanas, como es el caso de las moléculas CD31 y CD36, y moléculas de adhesión como las ICAM-1.
Células musculares lisas (T/GHA-VSMC). Fueron obtenidas en 1992 por Tilberg y Gifford12, de la Universidad de Pensilvania, y depositadas en la ATCC. En nuestro laboratorio se obtuvieron a partir de la ECACC. Proceden de la aorta humana de una niña de 11meses. Los autores utilizaron medio Ham's F12 con glutamina 2mM, aminoácidos no esenciales al 1%, Hepes 10mM, TES 10mM y ácido ascórbico 50μg/ml.
Soluciones y medios de cultivoLas soluciones empleadas para cultivos celulares han sido las habituales de un solo componente (cloruro de sodio isotónico, bicarbonato de sodio isotónico, hidróxido sódico 0,3N y ácido clorhídrico 0,3N). Se han empleado soluciones salinas isotónicas no amortiguadas: solución salina citratada, solución salina citratada concentrada (SSC10×), solución de glucosa, potasio y sodio, y concentrada (GKN10×). Asimismo, se han empleado para los cultivos soluciones salinas isotónicas isoosmóticas amortiguadas: solución salina de Dulbecco, solución salina de Hanks y solución de Hanks concentrada (Hanks10×)
Se ha empleado medios de cultivo para cultivos de tejidos de células eucariontes: medio esencial mínimo de Eagle MEM base en solución de Hanks con glutamina, medio de Ham F12 con L-glutamina, medio RPMI 1640 (Roswell Park Memorial Institute) y medio R5aI (Medio R5a de McCoy modificado por Iwakata). Se ha utilizado como medio químicamente definido sin suero el medio R5al de McCoy, suplementado con: insulina 5μg/ml, transferrina 5μg/ml, selenito sódico 5μg/ml, hidrocortisona 2,5μg/ml y β estradiol 1,35μg/ml, factor de crecimiento epidérmico 5μg/ml y antibióticos.
Técnica del subcultivoEl subcultivo consiste básicamente en distribuir las células que han llegado a cubrir la superficie del recipiente de cultivo en nuevos frascos. Esta maniobra ha de realizarse antes de que las células se aprieten excesivamente, para evitar que se produzcan situaciones de inhibición del crecimiento y sufrimiento celular. El desprendimiento de las monocapas puede realizarse con distintos procedimientos, dependiendo en cada caso de las características de la línea celular a subcultivar. Para ello se pueden desprender mecánicamente utilizando espátulas con punta de goma, soluciones quelantes13 o bien soluciones enzimáticas14-21.
Inhibidores de la 3-hidroximetil-glutaril-coenzima-A-reductasa (HMG-CoA-R) (estatinas)Se han ensayado la atorvastatina, la simvastatina, la lovastatina, la pravastatina y la cerivastatina.
Preparación de las soluciones concentradas de estatinasSe han solubilizado los principios activos a partir de la presentación en comprimidos. Se molturan los comprimidos; las estatinas liposolubles se solubilizan inicialmente en dimetil sulfóxido, añadiendo posteriormente agua a partes iguales; las hidrosolubles se solubilizan primero en agua con adición posterior de dimetil sulfóxido, también a partes iguales. Las soluciones se preparan ajustadas a una concentración final de 2mg/ml de la estatina, y la solución de uso se realiza por dilución en medio de cultivo, utilizando como controles los solventes de la solución madre con el mismo factor de dilución.
MevalonatoSe ha utilizado lactona del ácido mevalónico de la casa SIGMA. Este compuesto es un importante precursor en la síntesis del colesterol. Su lactona es muy soluble en agua y en solventes orgánicos polares. En cultivo de tejidos concentraciones entre 100 y 400μg/ml mejora el crecimiento de todas las líneas celulares que hemos estudiado.
Estimación preliminar de las dosis a ensayarLa valoración inicial de los efectos biológicos en cultivos de tejidos de un compuesto que no ha sido ensayado exige un ensayo preliminar para aproximarnos a las dosis que produzcan efectos tóxicos o inhiban la proliferación en las células que se quieren estudiar. Esta aproximación a la dosis se realizan a partir de los datos conocidos en la práctica clínica, de manera que si la dosis habitual de una estatina es, por ejemplo, de 20mg/día, la relación peso dosis/peso del paciente sería, para una persona tipo de 60kg, 20×106ng/60×103g=333,3ng/g. A efectos prácticos, en los cultivos consideramos ng/g como ng/ml. Sin otro tipo de consideraciones farmacológicas ensayamos sobre las células y por duplicado varias concentraciones de factor4, por encima y por debajo. El estudio lo realizamos utilizando los procedimientos para la determinación de la dosis inhibitoria 50 (DI50) que se describen a continuación.
Determinación de la dosis inhibitoria (DI50)Para valorar los efectos de un compuesto se ha empleado la dosis inhibitoria 50 (DI50). La DI50 es la dosis de un compuesto necesaria para producir la inhibición o muerte del 50% de las células.
Utilizamos 2 tipos de procedimientos, según la técnica descrita por Álvarez-Rodríguez22. Según la misma, la determinación puede hacerse en placas de 24 o de 96 pocillos.
Procedimiento para placas de 24 pocillos. Se siembran los 24 pocillos con 1ml de suspensión celular conteniendo 1.000células/ml en medio R5a de McCoy modificado por Iwakata con los suplementos y en las condiciones ya descritas. Se reservan 6 pocillos para controles de crecimiento, y en los 16 pocillos restantes se añaden 4 concentraciones de 4 compuestos a estudiar y se dejan actuar 120h. Se eliminan los compuestos y se incuban de nuevo las placas con medio fresco durante 6-8días a 37°C en atmósfera de CO2 al 5% en aire saturado de humedad. Transcurrido este tiempo se procede a la fijación, tinción y lectura. La determinación de la DI50 se realiza por recuento de número de clones y/o por elución y valoración del colorante utilizando un colorímetro multicanal. Todas las determinaciones se realizan por triplicado.
Procedimiento para placas de 96 pocillos (fig. 1). Cuando las células tienen un gran ritmo de crecimiento se siembran 200células por pocillo; si las células tienen un ritmo de crecimiento menor, se siembran 500células por pocillo. Para expresar la proporción en células por mm2, como la superficie de cada pocillo es de 32,17mm2, 200células en 32,17mm2 corresponden a 6,2células/mm2, y 500células en 32,17mm2 corresponden a 15,5células/mm2.
En el procedimiento empleado se utilizan 2 placas: una para la siembra y otra para preparar las diluciones. Partiendo de la solución madre 2mg/ml (2.000μg en 1ml; en 98,82μg estarán en × ml). Se ponen 400λ en cada pocillo de la máxima concentración. En el resto, 300λ del medio de cultivo. Se cogen 100λ de la más concentrada y se pasan a la hilera siguiente, y así sucesivamente. Finalmente se decanta el medio que contiene la placa con las células y se transfieren 200λ por pocillo de cada dilución, empezando de menor a mayor concentración.
Curvas de crecimientoExisten diversos procedimientos23-27, de los cuales se han utilizado los siguientes.
Recuentos directos. En contraste de fases sobre el mismo frasco de cultivo en campos previamente localizados. Dibujar un retículo en la superficie externa del frasco con lápiz de diamante de manera que se puedan localizar los campos elegidos en días sucesivos. Sembrar en las condiciones requeridas para cada línea celular. Los frascos se mantienen en la estufa en las condiciones habituales y solo se retiran en el momento de los recuentos. Los recuentos se realizan en el interior de una cámara de incubación adaptada al microscopio invertido, manteniendo la temperatura de 37°C durante el recuento.
Recuentos por cinefotovideomicrografía. Las células sembradas en las condiciones elegidas se disponen en el interior de la cámara de incubación del equipo de registro, en recipientes de buena visibilidad. Con el equipo y en las condiciones que se detallan en el apartado correspondiente, se realiza la grabación o filmación. El análisis de las películas permite obtener la curva de crecimiento, disponiendo en este caso no solo de los datos sobre el número de células, sino también del momento en que se produce cada una de las mitosis y de su duración.
ResultadosLas principales características de las células estudiadas son las siguientes:
Fibroblastos (fig. 2): proceden de amígdala humana; se preparan y crecen en subcultivos cada 7días; tienen un potencial de crecimiento de aproximadamente 40pases, y su tiempo medio de mitosis son unos 23min (intervalo de 9 a 50min).
Células endoteliales (fig. 3): proceden de endotelio de vasos capilares; se preparan y crecen en subcultivos cada 3-4días; alcanzan un potencial de crecimiento de unos 95pases, y su tiempo de mitosis es de unos 22min (intervalo de 11 a 39min).
Células musculares lisas (fig. 4): proceden de músculo liso de aorta; crecen en subcultivos cada 10días; alcanzan un potencial de crecimiento de unos 35pases, y el tiempo de mitosis es de unos 20min (intervalo entre 12 y 34min).
En la figura 5a,b se muestran ejemplos de las placas de pocillos con los estudios de viabilidad y sensibilidad a las estatinas. Con ello se ilustran los experimentos de viabilidad en presencia de estatinas y cuando se adiciona al medio mevalonato para superar el efecto inhibitorio de la síntesis de colesterol intracelular.
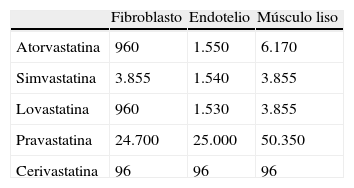
Las curvas de crecimiento espontáneo de las diferentes células, en cultivo aislado, cuando no están sometidas a ningún tipo de intervención experimental, se muestran en la figura 6 (fibroblastos, músculo liso y endotelio). De acuerdo con los resultados obtenidos en la determinación de dicha DI50, y en función de tales resultados para las distintas estirpes celulares y las diferentes estatinas empleadas, los resultados que se obtuvieron se muestran en la tabla 1.
Como ya se ha señalado, los resultados se referirán a la influencia de las estatinas en las curvas de crecimiento de los 3 tipos celulares y al efecto que produce la adición de mevalonato. De esta forma se pueden comprobar las curvas de crecimiento celular a distintas concentraciones de estatinas, valorado dicho crecimiento antes y después de la adición del mevalonato: fibroblastos en presencia de estatinas sin/con mevalonato (fig. 7a y b, respectivamente), células endoteliales en presencia de estatinas sin/con mevalonato (fig. 8a y b, respectivamente), y células musculares lisas en presencia de estatinas sin/con mevalonato (fig. 9a y b, respectivamente).
La aterosclerosis es el resultado de una interacción compleja entre dislipidemia, oxidación de lipoproteínas, disfunción endotelial, inflamación vascular, proliferación celular y fenómenos trombóticos por activación y agregación plaquetaria (BJCP). Estos factores se encuentran interrelacionados de tal forma que la dislipidemia se acompaña de disfunción endotelial, migración y proliferación celular, y estado proinflamatorio28.
Algunos de los conocidos como efectos pleiotrópicos de las estatinas, es decir, los que pueden no estar directamente relacionados con las modificaciones del colesterol intracelular y que pueden resultar beneficiosos para el proceso aterogénico, son: la mejoría de la disfunción endotelial, la mejoría del fenómeno inflamatorio vascular, la disminución de la oxidabilidad de las lipoproteínas, la mejoría de parámetros relacionados con la coagulación, la disminución de la proliferación celular y —en gran medida como consecuencia de tales cambios— la estabilización de la placa de ateroma.
Por tanto, los efectos pleiotrópicos podemos encontrarlos en distintos puntos de la cascada de acontecimientos que conduce a la formación de una placa de ateroma, hasta el punto de que podrían explicar una parte del beneficio cardiovascular encontrado en los pacientes que son tratados con estatinas. Quizás un mecanismo clave y central podría ser la inhibición de las proteínas preniladas, que, como es conocido, se puede acompañar de cambios en la vasodilatación, el estrés oxidativo, la inflamación y la trombogenicidad4,8,29-35.
Teniendo en consideración todos estos posibles cambios, quizás los más caracterizados hasta este momento son los que tienen lugar sobre la pared vascular. Sin embargo, seguramente, detrás de algunos cambios se puede encontrar modificaciones de las características morfodinámicas como consecuencia de la modificación de la conducta y del comportamiento en las células que tienen un mayor protagonismo en el proceso aterogénico, fenómenos que hemos constatado en el presente trabajo. De esta forma, las estatinas podrían ser capaces de provocar modificaciones celulares que condicionen los cambios en la tasa de proliferación, en la muerte celular programada (apoptosis) o en su movilidad y adherencia. Y estos fenómenos pueden ser especialmente trascendentes cuando afecten al endotelio, a la fibra muscular lisa o al fibroblasto, toda vez que son células directamente implicadas en el inicio y el desarrollo de la aterosclerosis. En consecuencia, si las estatinas afectan de manera diferente al comportamiento celular de las distintas células implicadas en la formación de la placa de ateroma, estas diferencias podrían aclarar algunos de los efectos que las estatinas tienen sobre distintos aspectos que controlan la aterogénesis.
A pesar de todo ello, son necesarios más estudios a largo plazo para dilucidar de forma fehaciente si estos efectos pleiotrópicos ejercidos por las estatinas pueden tener influencia significativa en la morbimortalidad de origen cardiovascular, sobre todo en los pacientes con alto riesgo de enfermedad. Con todo, en el momento actual parece que se configura como más trascendente el beneficio cuantitativo del efecto hipocolesterolemiante que el beneficio cualitativo de los efectos extralipídicos de las estatinas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.