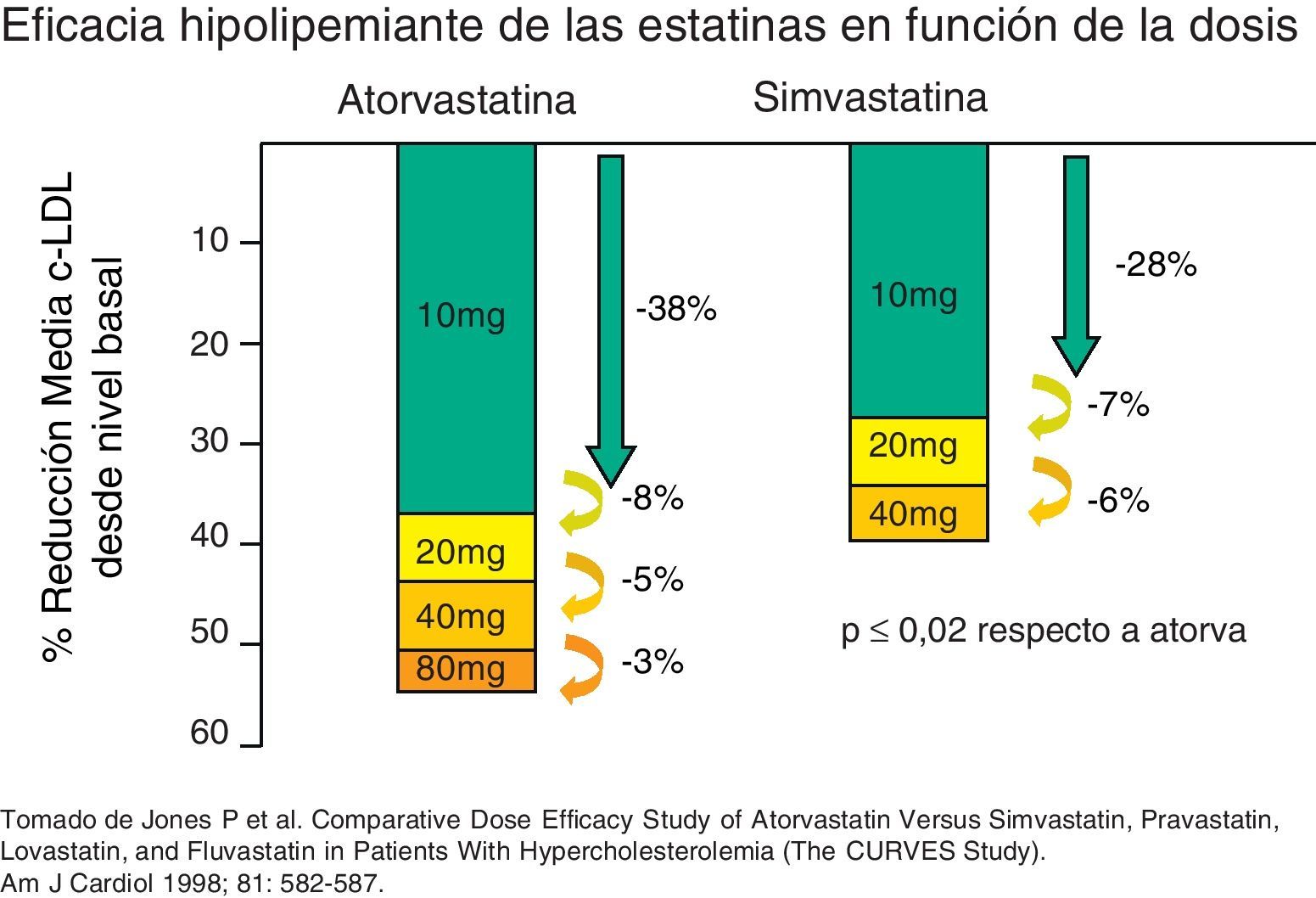
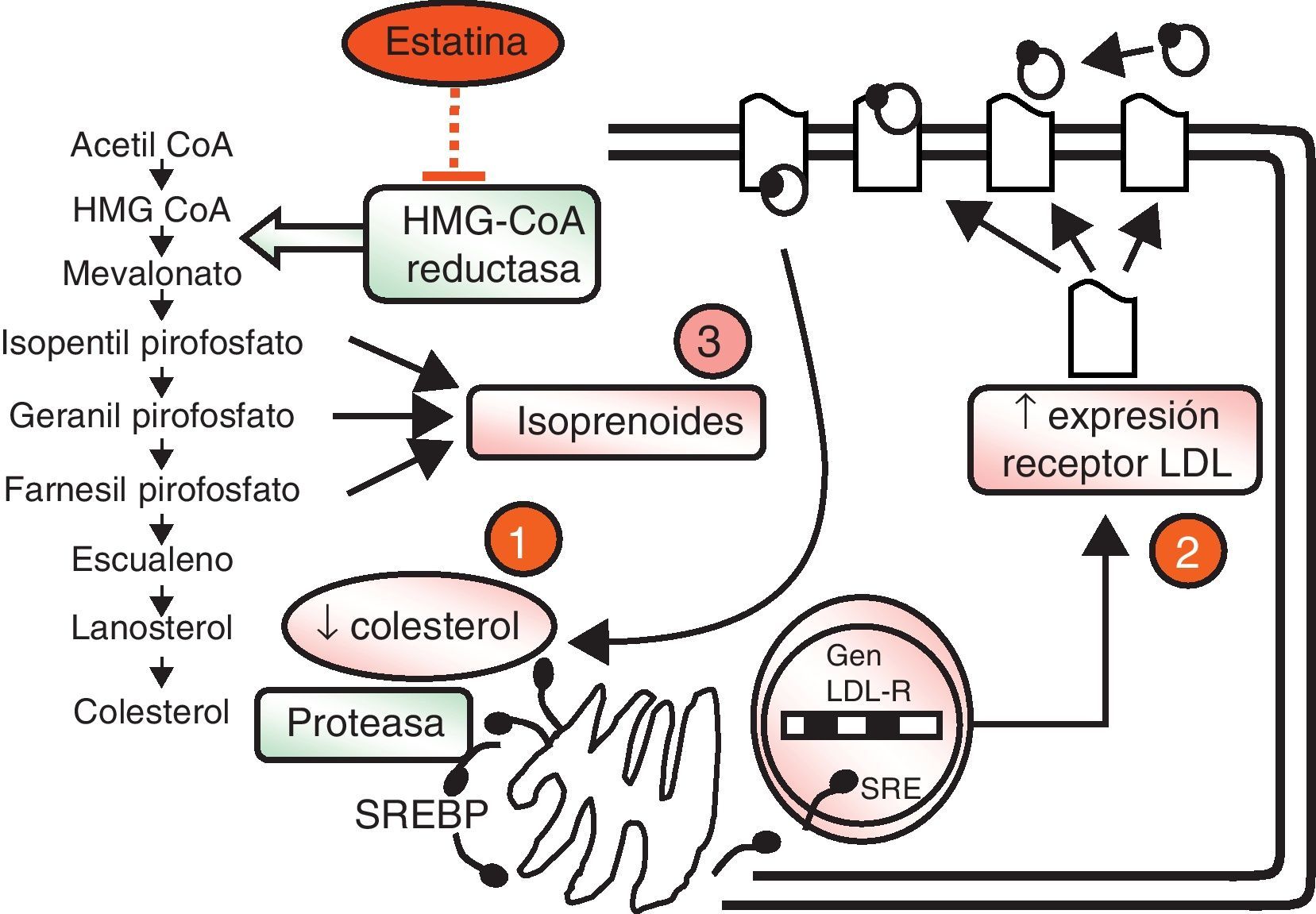
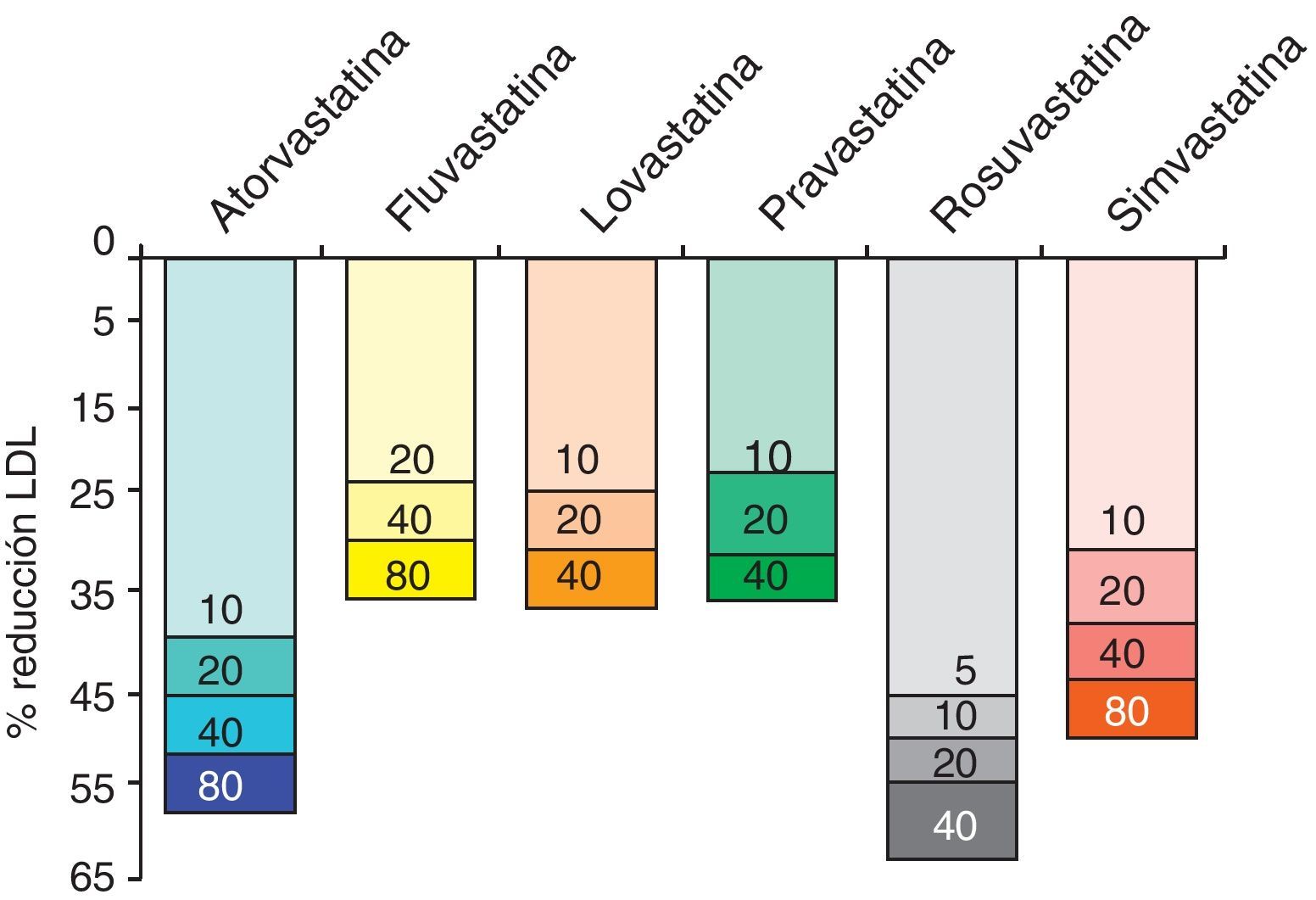
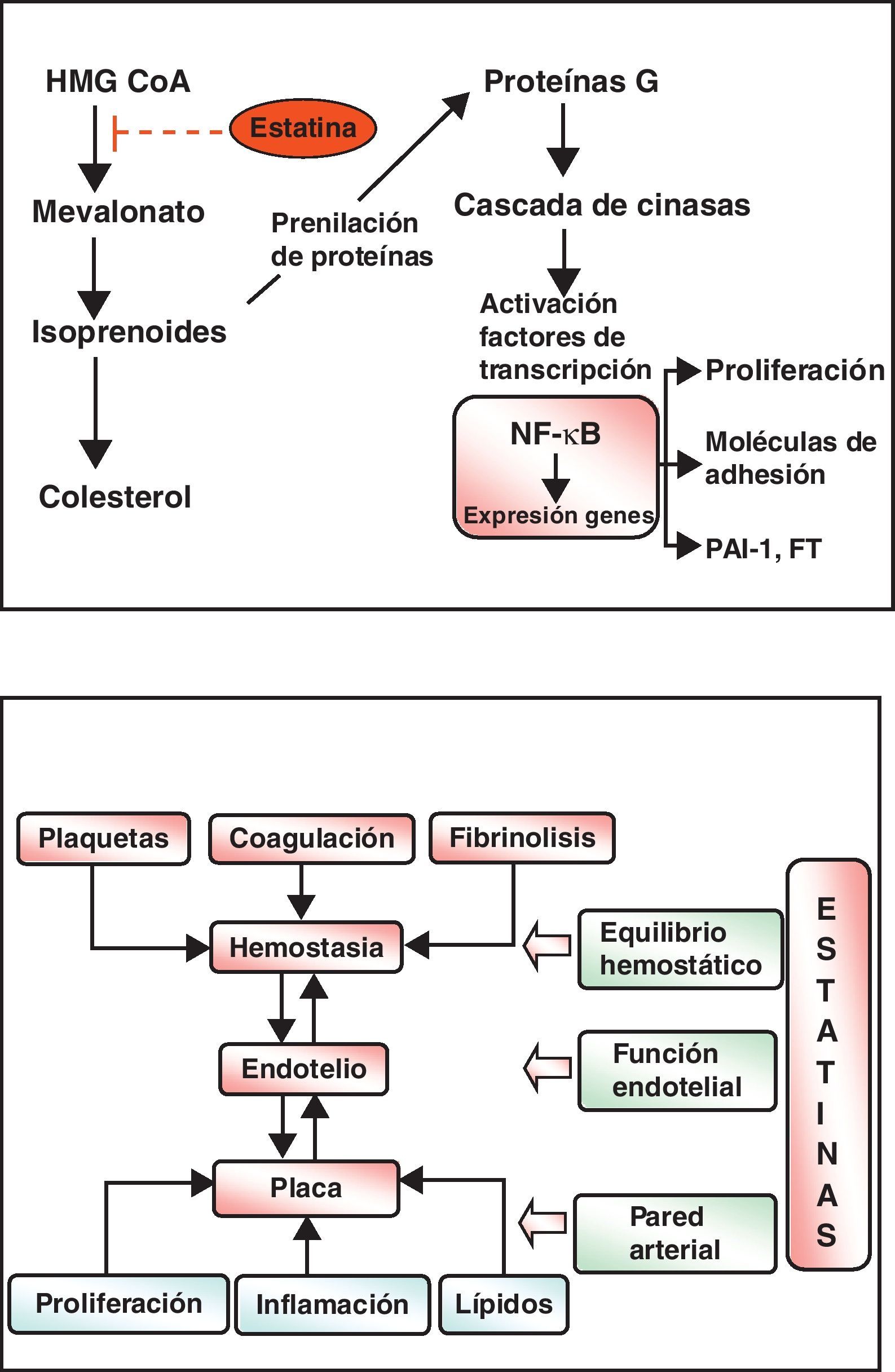
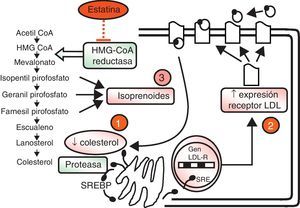
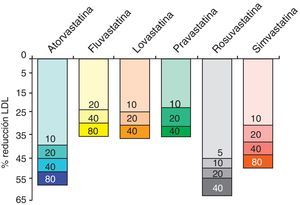
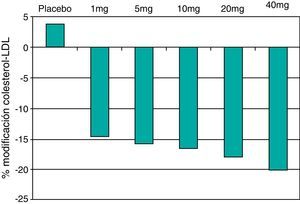
Las estatinas son una familia de fármacos que se aplican en terapéutica por su potente efecto reductor del colesterol ligado a lipoproteínas de baja densidad o LDL (c-LDL) (fig. 1). Su mecanismo de acción principal es la inhibición competitiva, parcial y reversible de la enzima hidroximetilglutaril-coenzima A reductasa (HMG-CoA reductasa), enzima limitante en la cadena de síntesis del colesterol en el hígado y otros tejidos (fig. 2). Como consecuencia, aumenta la expresión de los receptores que metabolizan las LDL. En respuesta a la reducción del colesterol libre en los hepatocitos se activa un grupo de proteínas reguladoras que se conocen como fijadoras del elemento regulador de los esteroles (SREBP), que también aumentan la transcripción de los receptores de LDL. El resultado es la reducción de la concentración de las LDL de entre el 25 y el 55%, dependiendo de la estatina y de las dosis utilizadas (fig. 3), que comienza a las 2semanas del tratamiento y es casi máxima a las 4semanas.
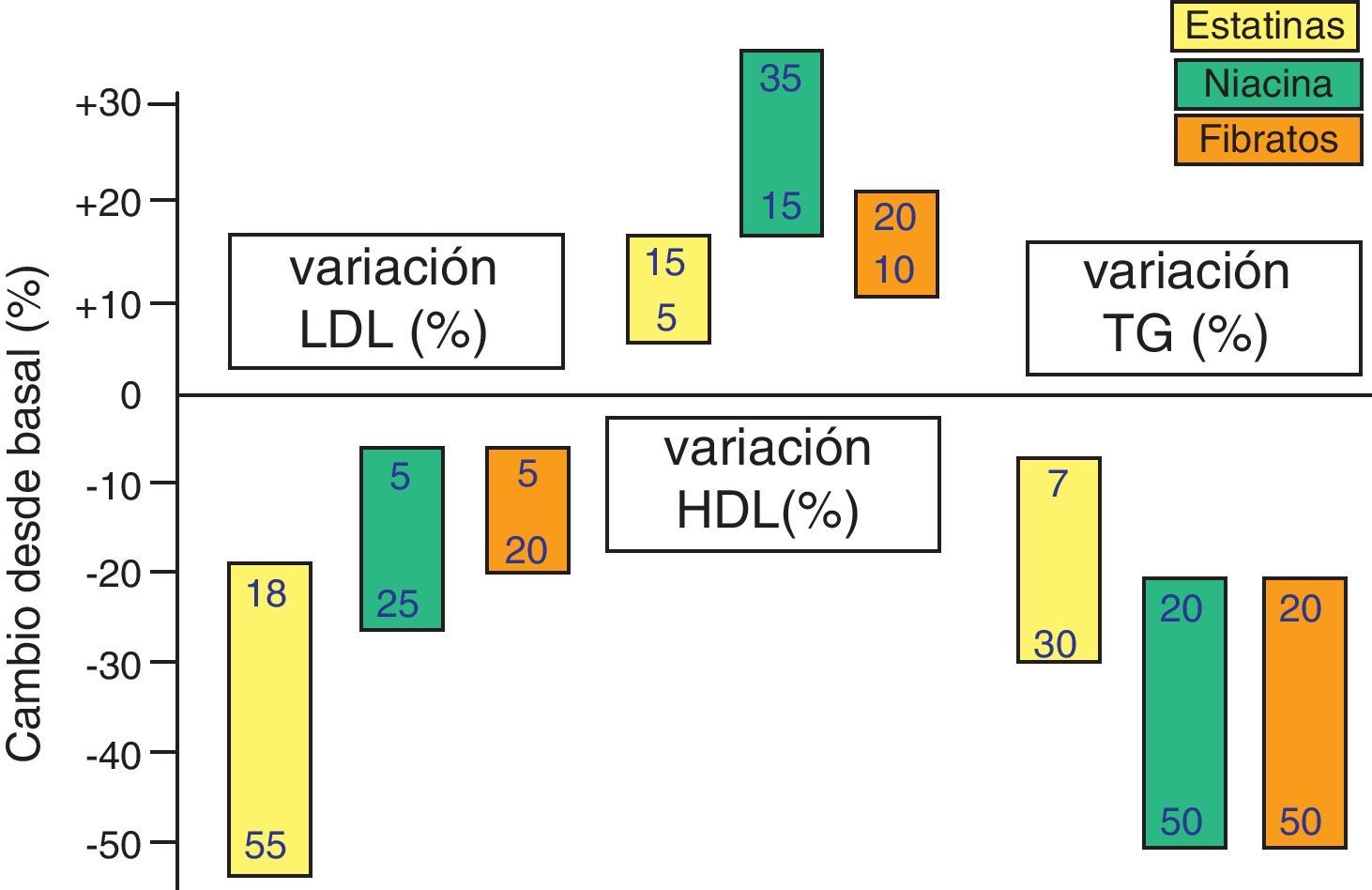
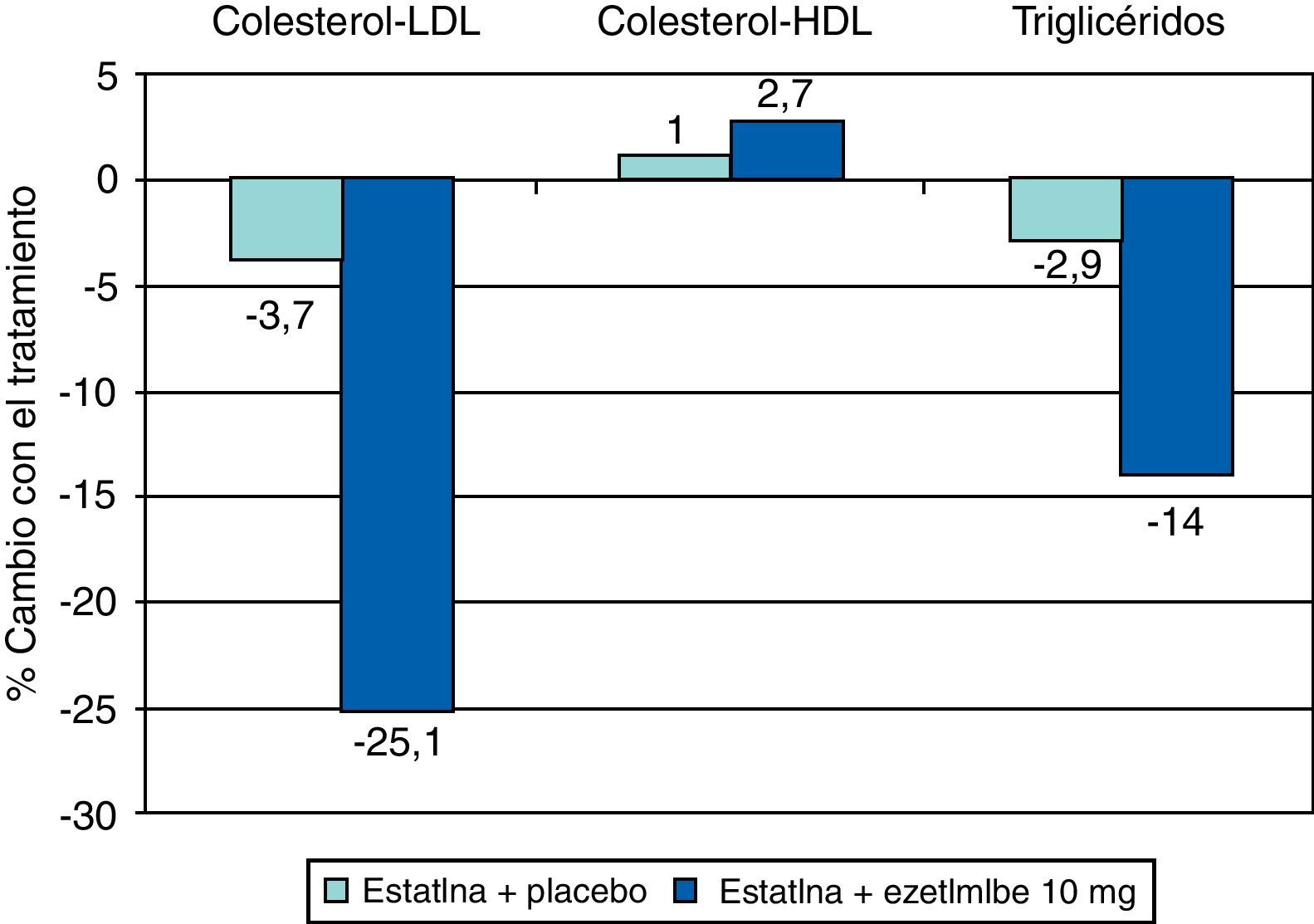
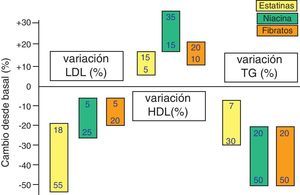
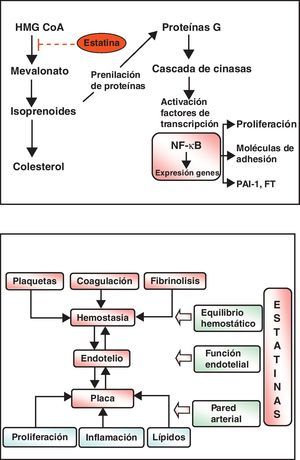
También hay reducciones de menor entidad de los triglicéridos (TG) —debidas a la inhibición de la síntesis hepática del colesterol, con lo que disminuye la síntesis de las lipoproteínas de muy baja densidad (VLDL)— y elevaciones discretas del colesterol ligado a lipoproteínas de alta densidad o HDL (c-HDL) (fig. 4). Las estatinas tienen otros efectos relativamente independientes de la reducción del colesterol, que se basan en otras propiedades que se han dado en llamar «pleotrópicas» y que se relacionan principalmente con la inflamación, la función endotelial y la trombosis. En la figura 5 se resumen algunas de ellas y sus mecanismos, que no parecen desempeñar un cometido demasiado relevante en los efectos clínicos demostrados de estos fármacos, pero sí han abierto la posibilidad de emplear estos fármacos en otras indicaciones como demencias, tumores, bacteriemia, fibrilación auricular, osteoporosis, enfermedades autoinmunes, etc.
Los numerosos ensayos clínicos realizados con las estatinas en prevención primaria y secundaria concuerdan en que la disminución de las LDL que consiguen estos fármacos se acompaña de disminución de la mortalidad y de la incidencia de complicaciones cardiovasculares. Puede estimarse que el tratamiento con estatinas reduce el riesgo de complicaciones cardiovasculares, en especial de enfermedad coronaria, en un 30-40%. Estos efectos son concordantes en todos los escenarios clínicos analizados conjuntamente o por separado (mujeres, ancianos, diabetes, prevención secundaria del ictus, pacientes trasplantados).
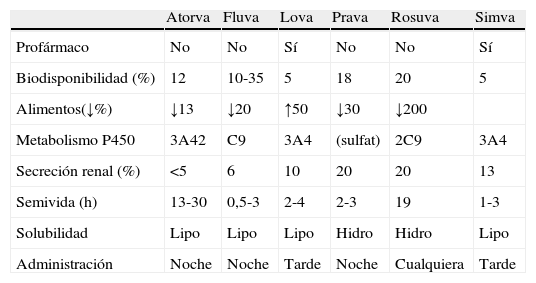
FarmacocinéticaLos fármacos que componen la familia de las estatinas tienen diferencias farmacocinéticas relevantes que pueden influir sobre su aplicación clínica (tabla 1).
Propiedades farmacocinéticas de las diferentes estatinas
| Atorva | Fluva | Lova | Prava | Rosuva | Simva | |
| Profármaco | No | No | Sí | No | No | Sí |
| Biodisponibilidad (%) | 12 | 10-35 | 5 | 18 | 20 | 5 |
| Alimentos(↓%) | ↓13 | ↓20 | ↑50 | ↓30 | ↓200 | |
| Metabolismo P450 | 3A42 | C9 | 3A4 | (sulfat) | 2C9 | 3A4 |
| Secreción renal (%) | <5 | 6 | 10 | 20 | 20 | 13 |
| Semivida (h) | 13-30 | 0,5-3 | 2-4 | 2-3 | 19 | 1-3 |
| Solubilidad | Lipo | Lipo | Lipo | Hidro | Hidro | Lipo |
| Administración | Noche | Noche | Tarde | Noche | Cualquiera | Tarde |
En general, las estatinas son fármacos bien tolerados y seguros. Aparte de algunas molestias gastrointestinales, cefalea, exantema, mareo e insomnio —poco frecuentes—, los efectos más relevantes se relacionan con toxicidad hepática y muscular. Son complicaciones poco frecuentes pero en ocasiones pueden obligar a suspender el tratamiento.
Toxicidad hepáticaLas estatinas pueden dar lugar a elevación de las transaminasas a los pocos meses del tratamiento en el 0,5-2% de los casos, efecto dependiente de la dosis; no queda claro si esta elevación constituye una auténtica hepatotoxicidad, pues la progresión a insuficiencia hepática es excepcional. Se recomienda analizar las transaminasas antes de iniciar el tratamiento y a las 12semanas; si la elevación es superior a 3veces el valor normal, se debe suspender el tratamiento durante al menos 3semanas y comenzar de nuevo con dosis más bajas o cambiar a otro fármaco.
Toxicidad muscularLos efectos de las estatinas sobre el músculo pueden ser desde leves hasta muy graves. El dolor muscular inespecífico aparece en el 5% de los pacientes. La miositis asintomática (elevación de la enzima muscular creatincinasa [CK] más de 10 veces el valor normal, sin síntomas musculares) puede ser un signo de toxicidad muscular importante y aconseja retirar el tratamiento. Por último, la rabdomiólisis (necrosis muscular con mialgias, elevación de la CK y afectación metabólica sistémica) es un cuadro grave potencialmente mortal pero muy infrecuente (menos del 0,1%). El riesgo de miopatía está aumentado en pacientes mayores de 80 años, mujeres delgadas, enfermedades multisistémicas, postoperatorio de cirugías importantes y tratamientos concomitantes con gemfibrozilo, ciclosporina, macrólidos, antimicóticos orales y amiodarona.
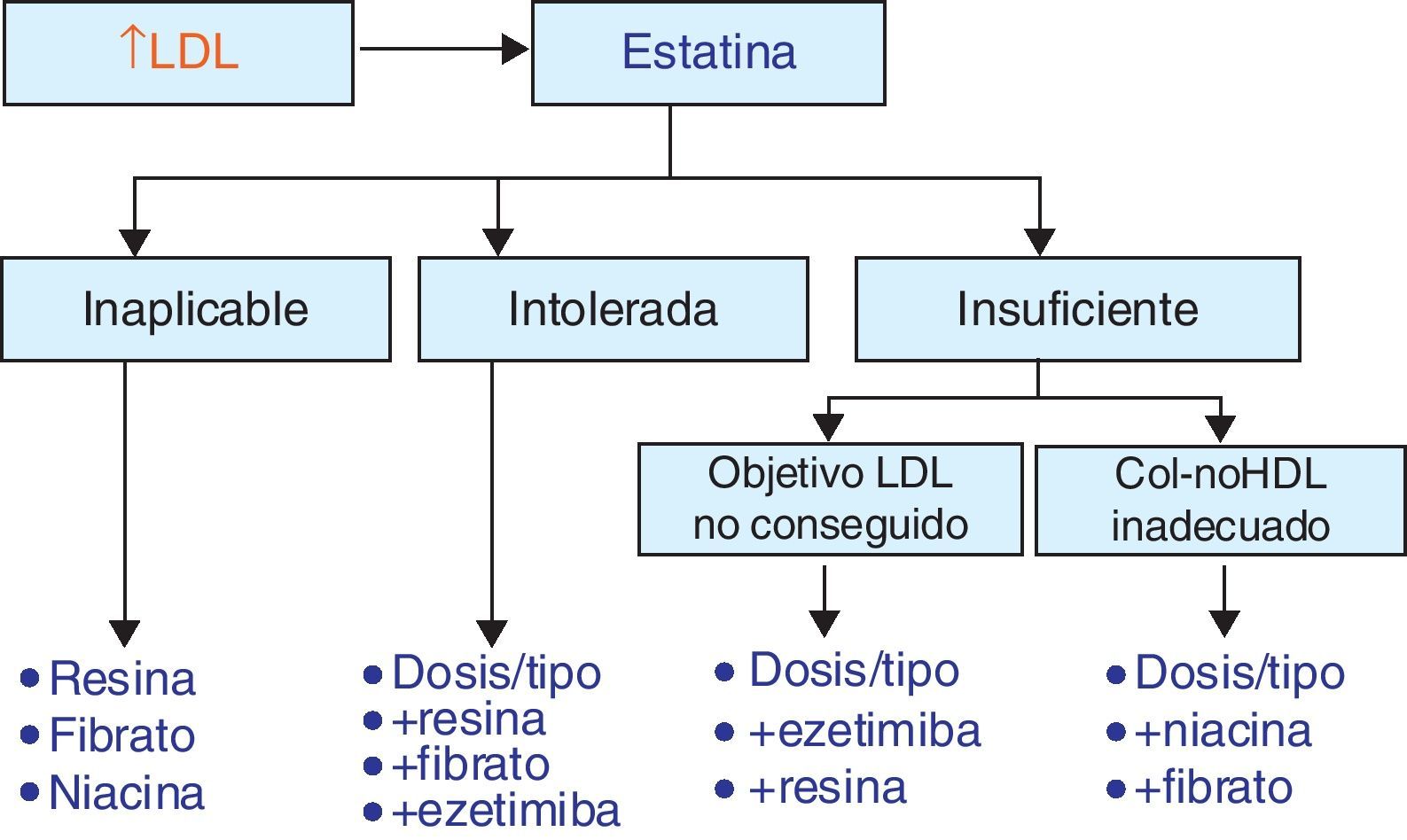
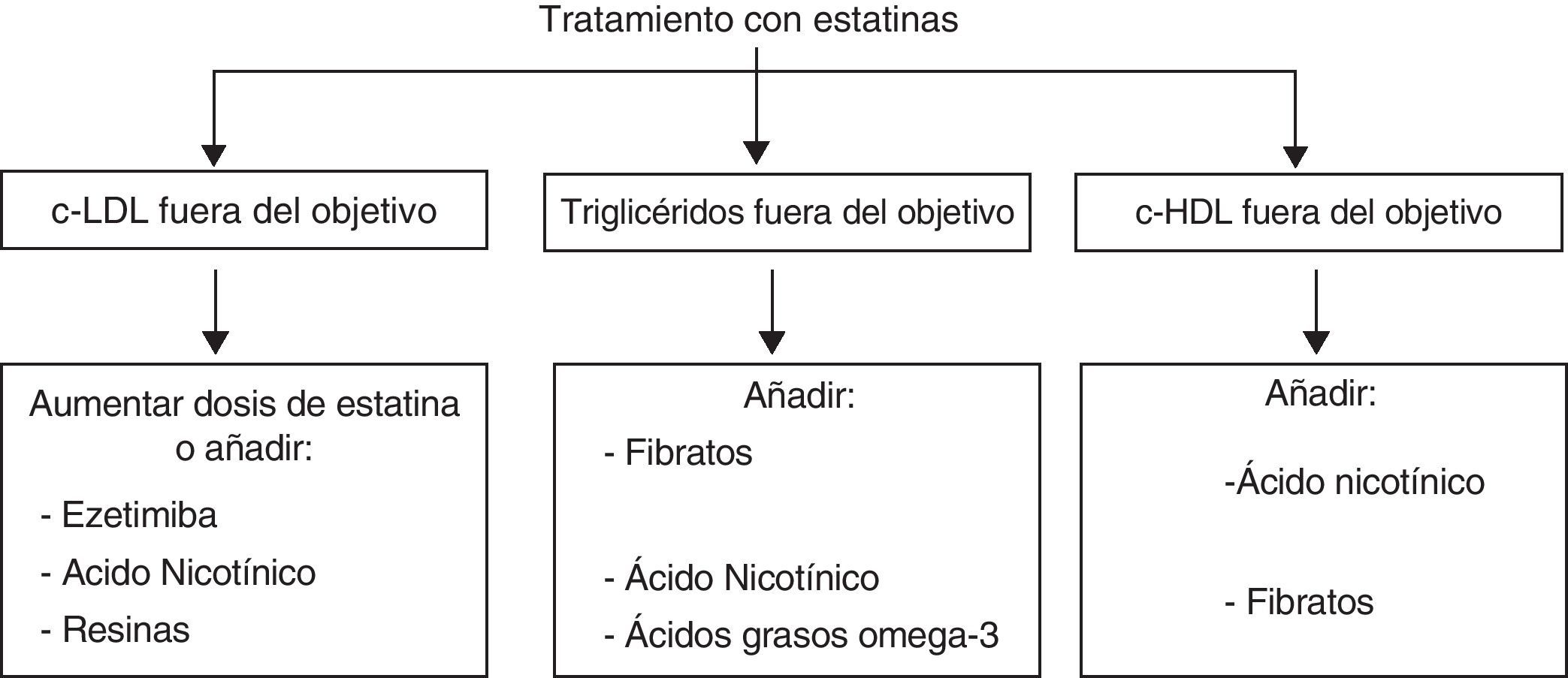
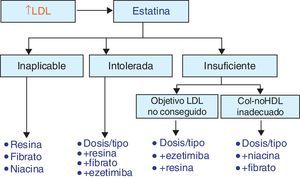
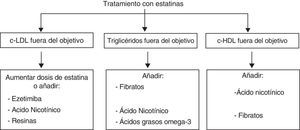
Tratamientos combinadosEs evidente que el perfil de eficacia y seguridad de las estatinas es muy favorable. La limitación principal de las estatinas reside en el bajo porcentaje de pacientes que alcanza los objetivos de control de las LDL, definidos en función del su riesgo cardiovascular (tabla 2), mediante estatinas en monoterapia (en general menor del 50%, y en especial en la población de más riesgo). Por tanto, será necesario un tratamiento adicional para lograr descensos mayores de las LDL o abordar alteraciones de las HDL o de los TG, sobre las cuales el efecto de las estatinas es escaso. En la figura 6 se representan las posibilidades de asociación de otros fármacos hipolipemiantes en función de que se precisen para potenciar el efecto reductor de las LDL o tratar alteraciones lipídicas concomitantes, como las HDL, los TG o la lipoproteína(a). Sin embargo, se debe considerar la posibilidad del aumento de interacciones y de efectos adversos con el tratamiento combinado.
En resumen, las estatinas son en la actualidad la base del tratamiento hipolipemiante y fármacos esenciales en la prevención de la enfermedad cardiovascular. Sin embargo, la necesidad de un mejor control del colesterol total y del c-LDL y su discreto efecto sobre los TG y el c-HDL hacen necesarios con frecuencia tratamientos adicionales que, unidos a la estatina, mejoren el control de los lípidos y la prevención de las complicaciones cardiovasculares.
Resinas de intercambio iónicoMecanismo de acción, eficacia e indicacionesLas resinas de intercambio iónico (o secuestradores de ácidos biliares) se unen a los ácidos biliares en el intestino, interrumpiendo el ciclo enterohepático. Las resinas no se absorben, sino que se unen a los ácidos biliares, disminuyen su absorción y aumentan su eliminación fecal. Esto produce un aumento en la expresión de receptores de LDL en el hígado, lo que reduce la concentración de colesterol plasmático. Puede aumentar la concentración de TG por aumento compensador de la síntesis hepática de VLDL.
Las resinas disminuyen el c-LDL entre el 15 y el 30% (dependiendo de la dosis), elevan el c-HDL entre el 3 y el 5% y no modifican los TG o los aumentan discretamente (10%).
En la actualidad, el colesevelam presenta mejor tolerancia que las resinas más antiguas, y se han publicado descensos de c-LDL del 15 al 19%, aumentando su eficacia al asociarlo a estatinas, ezetimiba o fenofibrato. Además, el colesevelam disminuye un 0,5% la hemoglobina glucosilada en diabéticos tipo 2.
La eficacia en prevención cardiovascular de las resinas de intercambio iónico ha sido probada en numerosos estudios, como el Lipid Research Clinic Primary Prevention Trial, el Familiar Atheroclerosis Treatment Study (FAST) y el 4-year Cholesterol Lowering Atherosclerosis Study (CLAS), que obtiene menos progresión de lesiones arterioscleróticas en coronarias
IndicacionesLas principales indicaciones de las resinas de intercambio iónico son las siguientes:
- -
Hipercolesterolemia familiar en la infancia.
- -
Hipercolesterolemia familiar.
- -
Tratamiento combinado: es la utilización más frecuente en la clínica, asociado a estatinas, fibratos, niacina o ezetimba.
Los efectos adversos más importantes de las resinas de intercambio iónico son los gastrointestinales; la tolerancia no es buena, por lo que el cumplimiento es bajo. Los síntomas más frecuentes, que llegan a afectar al 30% de los casos, son dolor abdominal, flatulencia, estreñimiento, esteatorrea y diarrea.
Reducen la absorción de vitaminas liposolubles y vitamina D, por lo que en niños hay que considerar la administración de suplementos de vitaminas y ácido fólico.
Además, interaccionan con diversos fármacos y alteran su absorción (fenobarbital, betabloqueadores, tetraciclinas, hierro, digoxina, tiroxina, warfarina, diuréticos tiazídicos, ácido fólico y estatinas, entre otros). Por ello es importante explicar al paciente cómo realizar la toma: deben prescribirse los fármacos 1-2h antes de la resina o 4-6h después.
Pueden aumentar las transaminasas y la fosfatasa alcalina.
En ocasiones, al comenzar el tratamiento con resinas se da una elevación de los TG —de aproximadamente el 10%—, sobre todo en pacientes que presentan basalmente TG elevados.
LimitacionesNo deben utilizarse en pacientes con cifras de TG>400mg/dl, y se recomienda individualizar con cifras entre 200 y 400mg/dl. Es preciso valorar la indicación en personas que refieren historia de estreñimiento importante. Asimismo debe evitarse su empleo en casos de hiperlipidemia tipo III.
AdministraciónExisten comercializados:
- -
Colestipol oral 5g granulado. Dosis recomendada; niños: 5-20g/día; adultos: 5-30g/día, repartido en 1-2 tomas.
- -
Colestiramina oral 4g. Dosis en niños: 4-8g/día; adultos: 4-16g/día repartidos en 2-4 tomas.
- -
Colesevelam 625mg oral. Dosis: 2 comprimidos con cada comida (máximo 7comprimidos/día). No utilizar en niños ni adolescentes, ya que no existen estudios en estos grupos de edad.
Siempre se debe comenzar con dosis bajas de resinas 15min antes de la cena, aumentado la dosis lentamente y valorando la aparición de efectos adversos hasta conseguir la dosis máxima El colesevelam solo existe en comprimidos y se administra con cada comida
Pueden utilizase en pacientes con insuficiencia hepática y renal.
Hay que explicar al paciente cómo debe tomar la medicación, sobre todo las resinas más antiguas: mezclarla con líquido, disolverla bien y tomarla antes de las comidas. En ocasiones es necesario el uso de laxantes.
En general la tasa de abandonos de las resinas es la más alta dentro de los tratamientos hipolipemiantes, y se considera que el grado de cumplimiento solo alcanza al 40% de los casos. Por ello, su utilización más frecuente es en tratamiento combinado, para así alcanzar los objetivos del perfil lipídico en cada paciente.
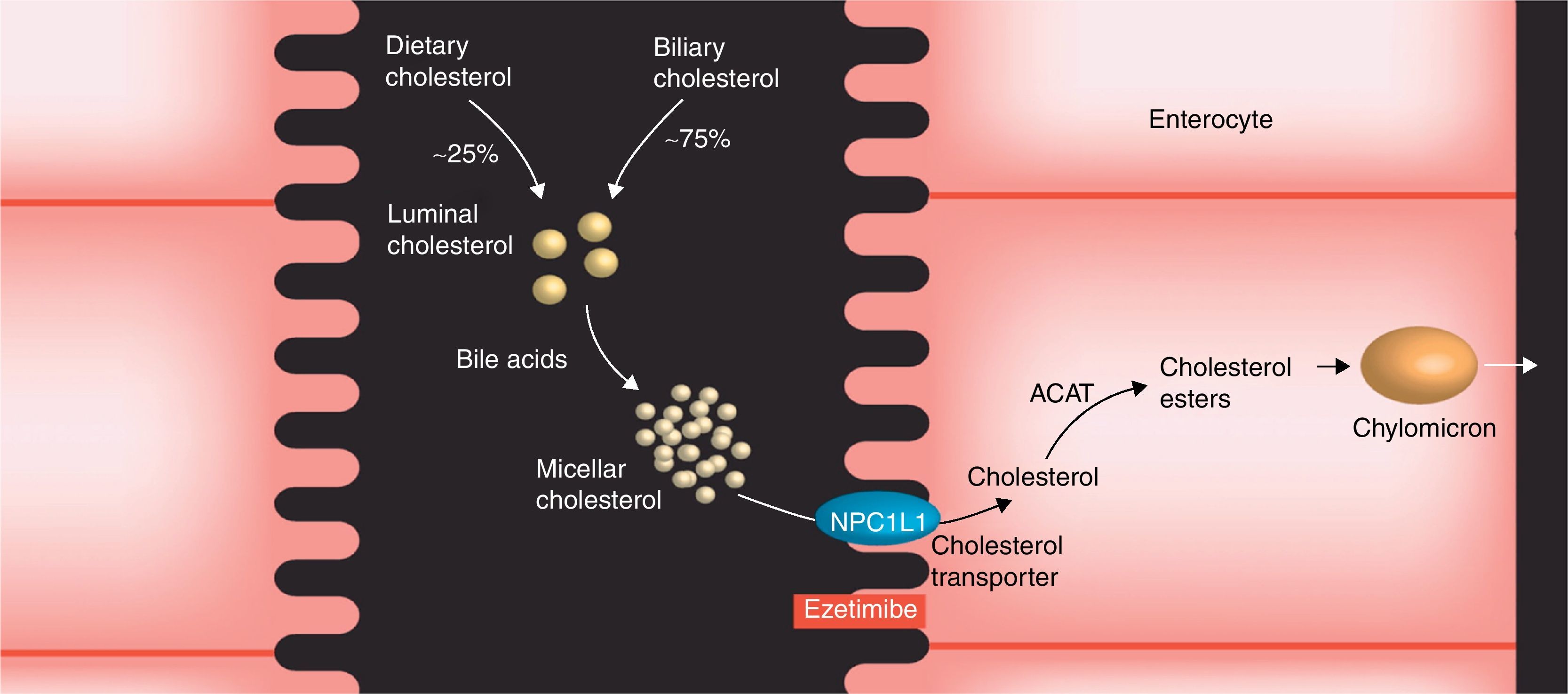
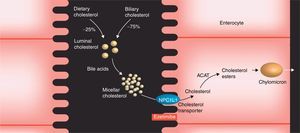
Inhibidores selectivos de la absorción intestinal de colesterol: ezetimibaMecanismo de acción y eficaciaLa ezetimiba es un inhibidor específico de la absorción de colesterol, e interacciona con el transportador de esteroles (proteína transportadora NP1C1) situado en las células epiteliales intestinales, interfiriendo con la absorción del colesterol procedente de la dieta (aproximadamente el 25%) y del procedente de los ácidos biliares (aproximadamente el 75%) (fig. 7). Todo ello se traduce en una menor incorporación de colesterol a los quilomicrones y en un menor aporte hepático de colesterol intestinal, lo que conlleva un aumento de la expresión de receptores de partículas de LDL y el subsiguiente descenso del colesterol plasmático.
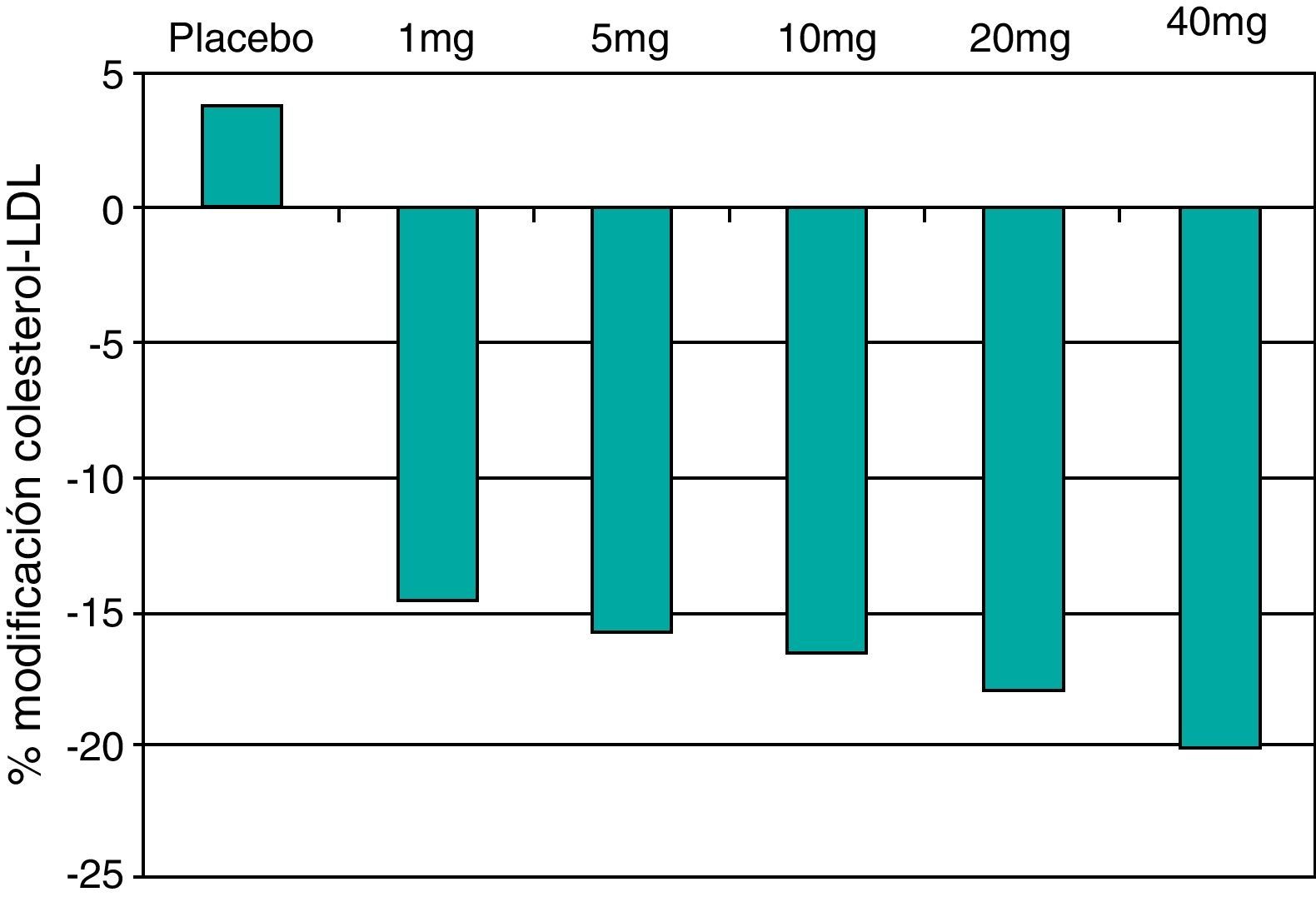
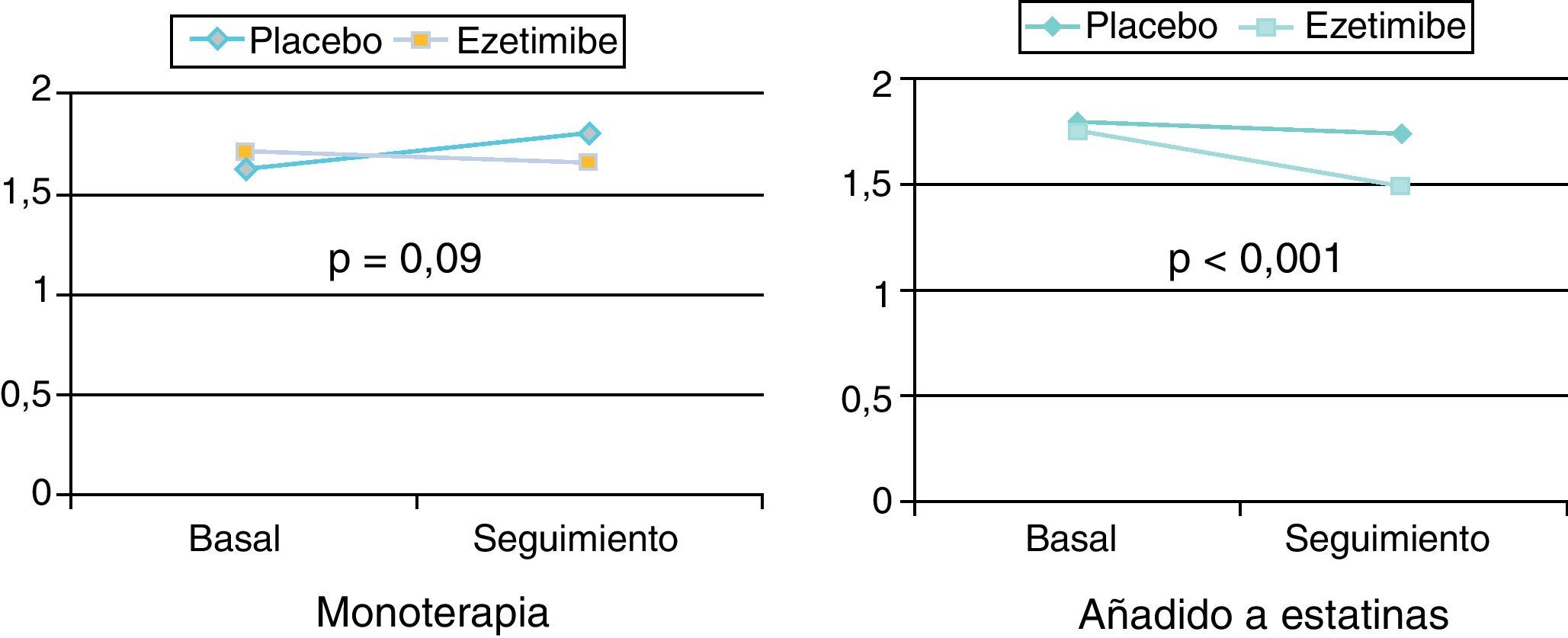
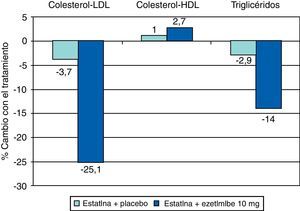
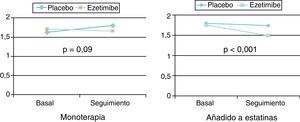
La ezetimiba reduce el c-LDL entre el 15 y el 25%. Si bien la reducción del colesterol es dependiente de la dosis, la mayor parte de la eficacia se alcanza con 10mg, por lo que ésta es la dosis recomendada (fig. 8). La reducción porcentual del c-LDL es similar en monoterapia o asociada a estatinas, y el efecto sobre los TG y sobre el c-HDL es moderado o nulo (fig. 9).
La ezetimiba no modifica la concentración de lipoproteína(a), y su efecto sobre la proteína C reactiva (PCR) es variable. En un reciente metaanálisis, la concentración de PCR se redujo en un 6% al administrarse en monoterapia (no significativo) y en un 10% adicional al asociarse al tratamiento con estatinas (p<0,001) (fig. 10).
La ezetimiba estaría indicada para el tratamiento de la hipercolesterolemia en pacientes que no alcancen objetivos de c-LDL, tanto si se ha alcanzado o no la dosis máxima de estatina. En los pacientes que no toleren dosis altas de estatinas, la asociación de ezetimiba podría estar indicada para alcanzar objetivos terapéuticos. En monoterapia únicamente debería utilizarse si existiera contraindicación al tratamiento con estatinas.
No existen estudios que hayan demostrado que la ezetimiba es eficaz para reducir la progresión de la arteriosclerosis o para reducir la tasa de complicaciones cardiovasculares. El estudio ENHANCE evaluó la eficacia de la simvastatina asociado a la ezetimiba frente a la simvastatina sola en la progresión de la arteriosclerosis carotídea subclínica en 720pacientes con hipercolesterolemia familiar. Después de 2años de tratamiento, y a pesar de un mayor descenso del c-LDL en el grupo de combinación, no se observaron diferencias en la progresión del grosor íntima-media carotídeo entre ambos grupos. Este trabajo, sin embargo, ha sido criticado en relación al tipo de tratamiento hipolipemiante empleado antes del estudio y al escaso grosor íntima-media de la población evaluada. En cualquier caso, la eficacia de este fármaco en términos de morbilidad y mortalidad cardiovascular se está evaluando en el IMPROVE-IT, un estudio realizado en pacientes con síndrome coronario agudo que son aleatorizados a recibir simvastatina 40mg frente a simvastatina 40mg asociada a 10mg de ezetimiba. Los resultados se esperan para el año 2012.
Efectos adversos y seguridad de la ezetimibaLa ezetimiba es un fármaco seguro y bien tolerado. No modifica la absorción de otros fármacos, y su adición a estatinas no incrementa la tasa de efectos adversos de éstas. En la mayoría de estudios, la tasa de efectos adversos con el fármaco no difiere de la del placebo.
LimitacionesSe puede considerar como una limitación de la ezetimiba la ausencia de datos que demuestren su eficacia para reducir la tasa de complicaciones cardiovasculares, aunque el beneficio siempre se relaciona con un mayor descenso del c-LDL
FibratosMecanismo de acción y eficaciaLos fibratos actúan mediante la activación de factores trascripcionales, fundamentalmente los PPAR-alfa. La activación de estos receptores aumenta la expresión de ciertos genes relacionados con el metabolismo lipídico. Dos son sus efectos fundamentales: por una parte, aumentan la actividad de la lipoproteinlipasa, aumentando así el catabolismo de las VLDL y disminuyendo consecuentemente la cifra de TG. Por otra, aumentan la producción de partículas apoA-I y elevan el c-HDL. Adicionalmente tienen un discreto efecto reductor de las LDL.
Los fibratos son los fármacos más eficaces para reducir los TG. Por ello es frecuente su utilización en pacientes con hipertrigliceridemias (sobre todo si las cifras de TG son muy elevadas), así como en los casos de hiperlipidemias mixtas, empleados en terapia combinada, habitualmente junto a una estatina.
Los beneficios clínicos del empleo de fibratos son superiores en los enfermos con dislipidemia mixta, con criterios de síndrome metabólico o con diabetes mellitus tipo 2 (estas últimas situaciones se acompañan frecuentemente de hipertrigliceridemia y/o síndrome de HDL bajo). Los enfermos con diabetes mellitus habitualmente presentan una dislipidemia mixta (aumento de TG y c-HDL bajo), generalmente con cifras normales o solo ligeramente elevadas de c-LDL. Además, se encuentra un aumento de apoB y un fenotipo de particulas de LDL especialmente aterogénico: LDL pequeñas y densas, ricas en apoB y con menor cuantía de lípidos. Estas anomalías lipídicas se acompañan de un riesgo cardiovascular aumentado, independientemente de los niveles de c-LDL, e incluso en pacientes tratados con estatinas y con c-LDL bajo control.
Estudios de morbilidad y mortalidad cardiovascularLos fibratos disminuyen la concentración plasmática de TG en un 20-30% y elevan la de c-HDL en un 5-10%. Tales efectos dependen de la cifra basal, de tal forma que cuando la dislipidemia es mayor el beneficio es, asimismo, superior. El fenofibrato, pero no el gemfibrocilo, también disminuye ligeramente el c-LDL.
Los análisis de los estudios clínicos han evidenciado que los fibratos son eficaces en la reducción del riesgo cardiovascular cuando este está parcialmente condicionado por la hipertrigliceridemia o el descenso del c-HDL. Por lo tanto, en pacientes con dislipidemia mixta, así como en aquellas situaciones en las que esta dislipidemia es común —caso del síndrome metabólico o de la diabetes mellitus tipo 2—, se consigue un beneficio clínico utilizando fibratos. Es el caso del estudio VA-HIT, del Helsinki Heart Study (HHS) y, más recientemente, del estudio FIELD. Los resultados acumulados de 8ensayos clínicos muestran que el tratamiento con fibratos reduce el riesgo de episodios de enfermedad coronaria en torno al 25%, aunque no las muertes por cardiopatía isquémica o por otra causa, de forma tan clara como ocurre con las estatinas. En un estudio reciente (ACCORD) el beneficio del fenofibrato solo se mostraba en el grupo de pacientes con dislipidemia aterogénica.
Recientemente, el fenofibrato ha demostrado que, de forma adicional al beneficio sobre la aparición de accidentes macrovasculares, logra mejorar significativamente las complicaciones microvasculares en el paciente diabético (retinopatía, neuropatía y nefropatía).
Algunos estudios han demostrado mediante angiografía que los fibratos pueden disminuir la progresión de la aterosclerosis coronaria (estudio DAIS).
Efectos adversos, seguridad de los fibratos y limitaciones de su usoEn general los fibratos son bien tolerados. Su complicación más importante es la posibilidad de miositis, sobre todo en pacientes con alteración de la función renal. La asociación de fibratos con estatinas, especialmente simvastatina, atorvastatina y lovastatina, aumenta el riesgo de toxicidad muscular por compartir estos fármacos por vía metabólica. La asociación de fenofibrato con fluvastatina, pravastatina o rosuvastatina puede ser la más segura cuando sea preciso utilizar una terapia combinada
Las limitaciones de los fibratos se resumen, pues, en dos aspectos:
- -
Eficacia: limitada capacidad para disminuir el c-LDL o aumentar el c-HDL.
- -
Seguridad (en los pacientes tratados con estatinas): aumentan el riesgo de desarrollar toxicidad muscular. En particular no se aconseja el empleo de gemfibrocilo asociado a una estatina.
La niacina o ácido nicotínico es la vitamina B3. El organismo requiere diariamente una ingesta de 15-20mg para satisfacer sus necesidades, cantidad que puede obtenerse fácilmente de la dieta, y su déficit causa pelagra. Sin embargo, en dosis elevadas (1 o 2g) la niacina produce una modificación muy favorable de los lípidos plasmáticos, disminuyendo la concentración de las lipoproteínas aterógenas (lipoproteínas con apoB) y aumentando las que protegen frente al desarrollo de aterosclerosis (lipoproteínas con apoA). Es el hipolipemiante más antiguo de los actualmente disponibles en el mercado.
En la actualidad existen tres formulaciones de niacina:
- -
Niacina de liberación inmediata o cristalina de vida media corta. Es la formulación original, muy mal tolerada por la elevada incidencia de efectos adversos cutaneos (flushing o rubefacción; véase más adelante, en efectos adversos).
- -
Niacina de liberación lenta, de larga vida media. Si bien presenta menos problemas de tolerabilidad por disminuir mucho la incidencia de rubefacción, tiene problemas de toxicidad hepática.
- -
Niacina de liberación extendida o prolongada, con una vida media intermedia. Su acción se sitúa entre las dos anteriores, presenta menos rubefacción y no tiene problemas de hepatotoxicidad. Esta formulación de liberación extendida es la más utilizada en la actualidad.
El mecanismo de acción de la niacina es complejo, y los principales mecanismos hipolipemiantes pueden resumirse en:
- -
Disminuye por diversos mecanismos la síntesis hepática de TG y de VLDL, y entre estos se encuentra el incremento de la degradación intracelular de apoB. También disminuye la actividad de la enzima diacilglicerol acyltransferasa2 (DGAT-2) hepática, que es clave en la síntesis de TG. Un tercer mecanismo es la disminución del aporte de ácidos grasos al hígado. La disminución plasmática de ácidos grasos libres es una consecuencia de la acción de la niacina, que al unirse al receptor GPR109A del adipocito inhibe la adenilato ciclasa (activada por adrenalina) y produce una inhibición transitoria de la lipasa hormono-sensible, y por ello de la lipólisis; así no se liberan ácidos grasos libres al torrente sanguíneo, y con ello disminuye la producción de TG y de partículas VLDL. Mediante estos mecanismos, la niacina disminuye la síntesis de TG y la formación de lipoproteínas VLDL, con lo que disminuye el número de partículas plasmáticas de VLDL y de su trasformación en LDL. Así la niacina disminuye los TG, el c-LDL y, en concreto, el número de partículas LDL pequeñas y densas (que son muy aterógenas).
- -
Aumenta las HDL por varios mecanismos. Por un lado se ha demostrado un aumento de la síntesis de apoA1, y por otro, una menor captación hepática de las HDL. Así, la vida media de la partícula HDL y de la apoA-1 aumenta, y mejora el transporte inverso del colesterol. Además, recientemente se ha demostrado un aumento de la actividad ABCA1 en los macrófagos, lo que facilita la salida de colesterol desde el interior celular hacia las HDL.
La niacina produce un cambio en el perfil de los lípidos muy favorable, con: aumento del c-HDL del 15 al 35% —actualmente es el fármaco más eficaz para elevar el c-HDL—; descenso de los TG en el 20 al 50%, dependiendo de la dosis utilizada; descenso del c-LDL del 5 al 25%, con disminución de la concentración de partículas LDL pequeñas y densas, muy características de los pacientes diabéticos, y disminución en un 20% de la concentración de lipoproteína(a), que es una partícula con gran poder aterogénico.
El efecto sobre los lípidos inducido por la niacina es dependiente de la dosis. En el caso de la niacina de liberación extendida (formulación más utilizada), la dosis ideal para modificar los lípidos es de 2g/día, si bien la dosis de 1g/día, al modificar los tres lípidos, tiene un impacto global que puede ser evaluado en un 50% de su efecto. Puede unirse a resinas y estatinas. En algunos estudios, la asociación de niacina LP (2g/día) y simvastatina (40mg/día) ha producido elevaciones del c-HDL del 30%, descensos de c-LDL (43%), de los TG (44%) y de la lipoproteína(a) del 15%.
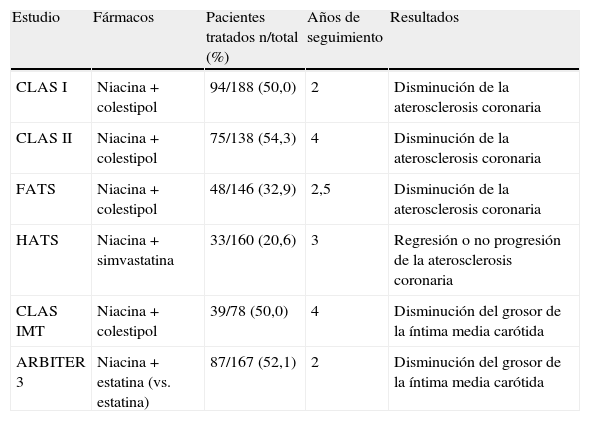
Estudios de morbilidad y mortalidad cardiovascularSe dispone de varios estudios de imagen que muestran que la niacina, en monoterapia o en combinación con otros agentes hipolipemiantes, puede disminuir la progresión de la arteriosclerosis coronaria y carotídea o incluso inducir la regresión de las lesiones. La tabla 3 muestra un resumen de estos estudios. Como puede observarse, el tratamiento con niacina, en general añadido a una estatina o a una resina, frena la evolución de la aterosclerosis e incluso revierte las lesiones.
Estudios que han evaluado el efecto de niacina sobre las lesiones ateroscleróticas (estudios de imagen)
| Estudio | Fármacos | Pacientes tratados n/total (%) | Años de seguimiento | Resultados |
| CLAS I | Niacina+colestipol | 94/188 (50,0) | 2 | Disminución de la aterosclerosis coronaria |
| CLAS II | Niacina+colestipol | 75/138 (54,3) | 4 | Disminución de la aterosclerosis coronaria |
| FATS | Niacina+colestipol | 48/146 (32,9) | 2,5 | Disminución de la aterosclerosis coronaria |
| HATS | Niacina+simvastatina | 33/160 (20,6) | 3 | Regresión o no progresión de la aterosclerosis coronaria |
| CLAS IMT | Niacina+colestipol | 39/78 (50,0) | 4 | Disminución del grosor de la íntima media carótida |
| ARBITER 3 | Niacina+estatina (vs. estatina) | 87/167 (52,1) | 2 | Disminución del grosor de la íntima media carótida |
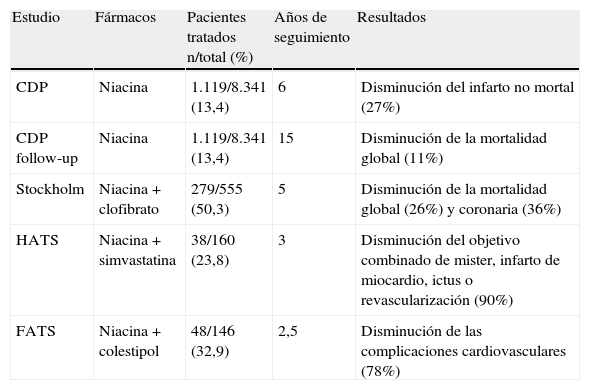
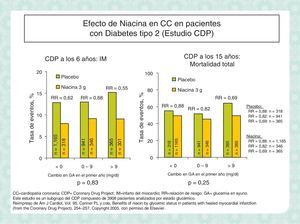
Se dispone también de datos del efecto de la niacina sobre la morbimortalidad cardiovascular, tanto en monoterapia como en combinación con otros fármacos (tabla 4). En el estudio Coronary Drug Project (CDP) la niacina en monoterapia redujo un 27% los infartos de miocardio no mortales, y la mortalidad total. Otros ensayos clínicos con menor número de pacientes han descrito que la niacina en adición a estatinas o resinas disminuye las complicaciones cardiovasculares. Por ejemplo, en los estudios FATS (niacina más colestipol) y HATS (niacina más simvastatina) la reducción de las complicaciones cardiovasculares fue del 78 y del 90%, respectivamente, reducciones superiores a las observadas habitualmente con las estatinas en monoterapia y que podrían estar relacionadas con la modificación global del perfil de los lípidos que consiguen estas combinaciones de fármacos. Por otra parte, los beneficios de la combinación de estatinas y niacina quedaron patentes en el análisis de un subgrupo del HDL-Atherosclerosis Treatment Study, donde se observó una reducción del 40% en los accidentes coronarios en sujetos con tolerancia anormal a la glucosa. En conjunto, todos estos datos apoyan la combinación de la niacina LP con estatinas para el tratamiento de la dislipidemia diabética en pacientes de alto riesgo. Estudios recientes de imagen con RM han demostrado una reducción significativa de las placas de ateroma.
Estudios que han evaluado el efecto de niacina sobre las complicaciones cardiovasculares
| Estudio | Fármacos | Pacientes tratados n/total (%) | Años de seguimiento | Resultados |
| CDP | Niacina | 1.119/8.341 (13,4) | 6 | Disminución del infarto no mortal (27%) |
| CDP follow-up | Niacina | 1.119/8.341 (13,4) | 15 | Disminución de la mortalidad global (11%) |
| Stockholm | Niacina+clofibrato | 279/555 (50,3) | 5 | Disminución de la mortalidad global (26%) y coronaria (36%) |
| HATS | Niacina+simvastatina | 38/160 (23,8) | 3 | Disminución del objetivo combinado de mister, infarto de miocardio, ictus o revascularización (90%) |
| FATS | Niacina+colestipol | 48/146 (32,9) | 2,5 | Disminución de las complicaciones cardiovasculares (78%) |
En conclusión, los estudios realizados con niacina en monoterapia o en combinación con otros fármacos (resinas o estatinas) han dado como resultado una reducción de la incidencia de complicaciones cardiovasculares de gran magnitud, aunque algunos de ellos son estudios de pequeño tamaño. Un importante estudio prospectivo en fase III (HPS2-THRIVE) está valorando si la niacina LP/Laropiprant combinada con simvastatina es superior a la simvastatina y placebo para reducir la morbimortalidad cardiovascular en aproximadamente 25.000 pacientes (de ellos unos 7.000 diabéticos) con enfermedad vascular (infarto de miocardio, ictus o enfermedad arterial periférica) y niveles de c-LDL optimizados con estatinas. Sus resultados estarán disponibles en 2012.
Tolerabilidad de la niacina. Rubefacción o flushingSi bien la niacina parece un fármaco excelente para modificar los lípidos y reducir el riesgo cardiovascular, su uso no se ha extendido mucho por la escasa tolerancia de las dosis altas de niacina debido a la alta incidencia de rubefacción o flushing, que consiste en el enrojecimiento de la piel acompañado en ocasiones de sensación de calor y picor; se inicia en la cara y puede extenderse a los brazos y al cuerpo. Empieza entre 30 y 120min después de la administración del fármaco y su duración es de aproximadamente media hora. Aunque no aparece en todas las tomas y no siempre es grave, hasta el 80% de pacientes la padecen, lo que condiciona tanto abandonos de tratamiento como que la dosis tolerada por el paciente con una alta frecuencia no sea la óptima.
La rubefacción se produce por vasodilatación local de los vasos de la piel. En la piel se localizan las células de Langerhans que tienen el receptor GPR109A, el descrito anteriormente en los adipocitos, y tras la unión a la niacina, estas células liberan prostaglandinas (en especial de la clase D2). Estas PGD2 se unen a receptores específicos DP1 y producen una vasodilatación de los vasos cutáneos que es la responsable de la rubefacción. Para disminuir la rubefacción se han utilizado inhibidores de las prostaglandinas, con escaso resultado. Actualmente, la asociación de la niacina de liberación extendida con un bloqueador específico del receptor DP1, receptor de la PGD2, el laropiprant, disminuye la incidencia y el grado de rubefacción y mejora la tolerabilidad al fármaco.
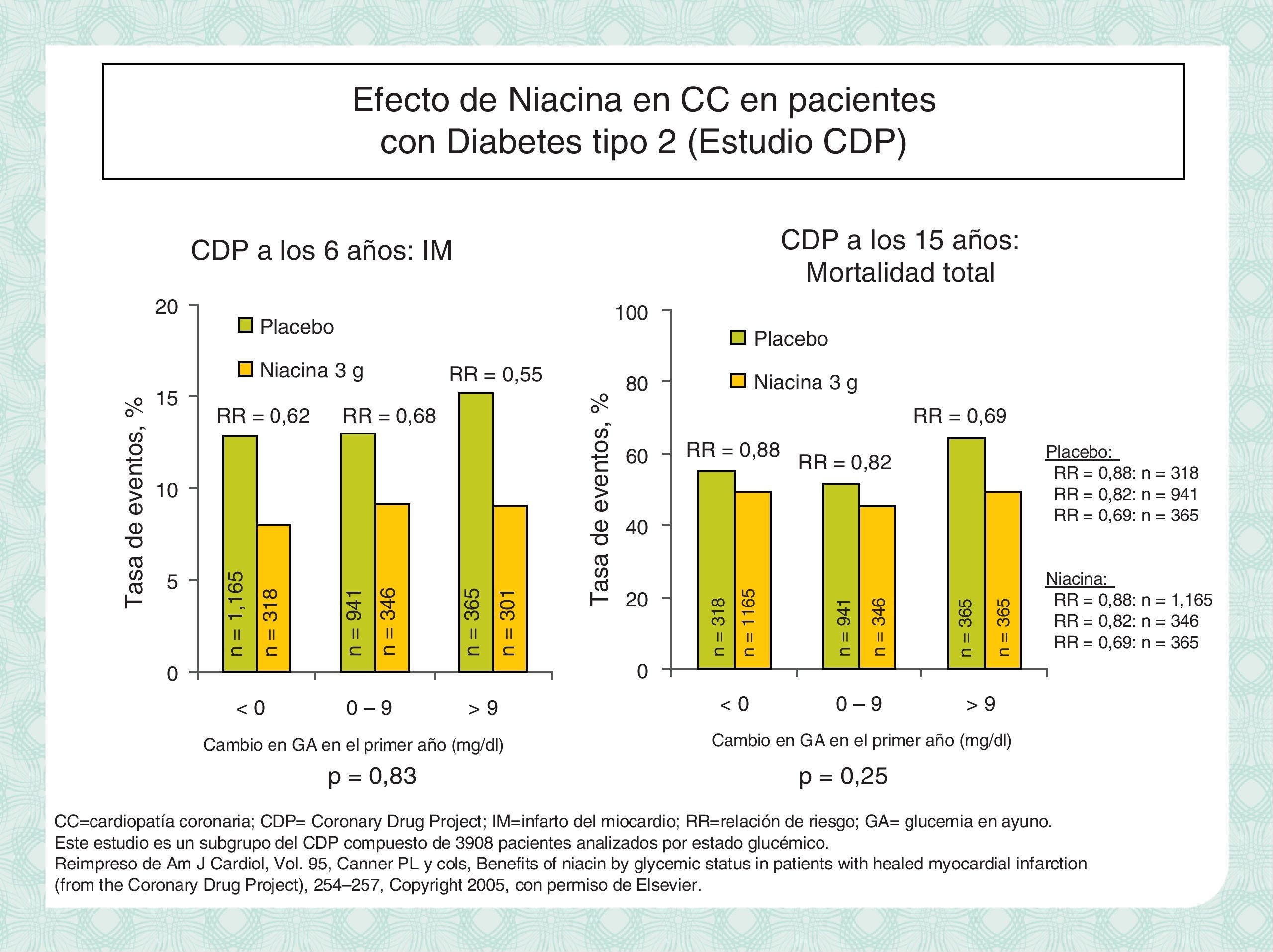
Seguridad de la niacinaLa niacina LP (acción intermedia) es un fármaco seguro. Su único efecto adverso conocido con potencial relevancia clínica es la elevación de la glucemia, en especial en pacientes diabéticos. En ensayos clínicos se han descrito elevaciones discretas de la glucemia basal de 4-5mg/dl y de la hemoglobina glicada de menos del 0,3%. Estos cambios, que son completamente reversibles, en algunos casos (menos del 15%) hacen necesario ajustar la dosis de los hipoglucemiantes. Además, el patrón de modificación de los lípidos inducido por la niacina se ajusta perfectamente a la dislipidemia del diabético (HDL bajo, TG elevados, LDL pequeñas y densas) y puede ser un complemento ideal a la estatina en estos pacientes. De hecho, en el estudio CDP los pacientes diabéticos fueron los que obtuvieron el mayor beneficio del tratamiento con niacina desde el punto de vista cardiovascular (figura 11).
En sujetos diabéticos tipo 2, el empleo combinado de estatinas y niacina LP/laropiprant ha mostrado efectos beneficiosos sobre el perfil lipídico. Un reciente estudio doble ciego, aleatorizado, de 36semanas de duración, ha valorado el efecto de añadir niacina LP/laropiprant (2g/40mg/día) o placebo a más de 700diabéticos tipo 2 que estaban siendo tratados con estatinas y otros hipolipemiantes. El punto de corte de la hemoglobina glucosilada (HbA1c) para entrar en el estudio fue <8,5%. El grupo tratado con niacina LP/laropiprant mostró una elevación del c-HDL del 25%, aumento de ApoA-I del 9%, descenso de ApoB y c-LDL del 15%, descenso de TG del 22% y descenso de lipoproteína(a) del 25%. Con respecto al metabolismo hidrocarbonado, estos sujetos elevaron la HbA1c 0,18% comparado con placebo, y el 9% de ellos necesitaron aumentar la dosis de antidiabéticos orales o insulina. Debe destacarse que los diabéticos mejor controlados al inicio del estudio no mostraron cambios significativos de la glucemia basal ni elevación de la HbA1c.
Otros efectos adversosPuesto que la niacina se utiliza principalmente asociada a las estatinas, dada la toxicidad de estas es importante valorar su perfil de seguridad a nivel hepático y muscular. La mayoría de los problemas de toxicidad hepática se han visto en pacientes tratados con niacina de liberación lenta y en dosis superiores a 1-1,5g/día. La forma de liberación extendida es segura desde el punto de vista hepático y no se ha observado aumento de la incidencia de problemas hepáticos en monoterapia o cuando se combina con estatinas. La niacina no tiene efectos a nivel muscular y no aumenta la toxicidad muscular cuando se usa añadida a estatinas.
En los pacientes tratados con niacina a dosis de 2g/día con frecuencia se observa una discreta elevación del ácido úrico, por lo que debe tenerse en cuenta en los pacientes con gota, en los que el fármaco está desaconsejado. También se han observado pequeños descensos en el recuento de plaquetas clínicamente no significativos.
Abordaje integral bajo terapia combinadaLa asociación de fármacos hipolipemiantes permite, por un lado, alcanzar los objetivos terapéuticos en los casos que no se conseguiría con la monoterapia y, por otro, lograr un control global de las alteraciones del metabolismo lipídico en los pacientes con hipercolesterolemia asociada a hipertrigliceridemia o a un déficit de c-HDL. Así, existen tres situaciones principales en las que es necesario el tratamiento combinado: la hipercolesterolemia grave o de los pacientes de alto riesgo cardiovascular, la hipercolesterolemia acompañada de un exceso de TG o de un déficit de c-HDL y, por último, la hipertrigliceridemia severa.
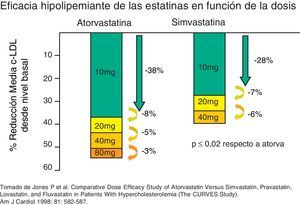
Hipercolesterolemia grave o de los pacientes de alto riesgo cardiovascularEn estos pacientes suele ser necesario disminuir el c-LDL por encima del 40-50%, un efecto que con frecuencia no se logra con estatinas en monoterapia, porque la duplicación de dosis solo aporta aproximadamente una reducción adicional del 6%. Las alternativas para potenciar el efecto de las estatinas son su asociación, en primer lugar con ezetimiba, y en segundo lugar con resinas, esteroles vegetales o ácido nicotínico (tabla 5). Las tres primeras opciones actúan inhibiendo la absorción de colesterol o de ácidos biliares en el intestino, la cual está incrementada como respuesta al tratamiento con estatinas. La ezetimiba a dosis de 10mg/día disminuye el c-LDL alrededor del 20 al 25% más de lo que se logra con estatinas en monoterapia, y los TG disminuyen entre un 7 y un 13%. El c-HDL aumenta poco o no se modifica significativamente. La tolerancia y los efectos secundarios de la combinación de estatinas y ezetimiba son similares a los de las estatinas en monoterapia. Actualmente están en curso distintos estudios encaminados a valorar el efecto de esta combinación sobre el riesgo cardiovascular.
Principales asociaciones de dos fármacos hipolipemiantes para el tratamiento de las dislipidemias
| Hipercolesterolemia aislada (exceso de c-LDL) |
| 1. Estatinas y ezetimiba |
| 2. Estatinas y resinasa |
| 3. Estatinas y ácido nicotínicob |
| 4. Estatinas y esteroles vegetales |
| Hiperlipemia mixta (hipercolesterolemia con hipertrigliceridemia) |
| 1. Estatinas y fibratosc |
| 2. Estatinas y ácido nicotínicob |
| 3. Estatinas y ácidos grasos omega-3d |
| Hipercolesterolemia asociada a un déficit de c-HDL (con o sin hipertrigliceridemia) |
| 1. Estatinas y ácido nicotínicob |
| 2. Estatinas y Fibratosc |
| Hipertrigliceridemia |
| 1. Fibratos y ácido nicotínico |
| 2. Fibratos y ácidos grasos omega-3 |
| 3. Ácido nicotínico y ácidos grasos omega-3 |
El ácido nicotínico produce con frecuencia sofocaciones, pero este efecto es menos habitual si se asocia a laropiprant un inhibidor del receptor de la prostaglandina D2.
En los pacientes en los que no pueda utilizarse la ezetimiba, la combinación de estatinas con resinas, por ejemplo la colestiramina a dosis de 5-10g/día, logra un descenso del c-LDL solo algo inferior a la combinación de estatinas y ezetimiba. Las resinas tienen el inconveniente de aumentar las concentraciones de TG en los pacientes con hipertrigliceridemia previa y de ser de posología más compleja, pero carecen de toxicidad sistémica y su combinación con estatinas ha disminuido la incidencia de enfermedad cardiovascular en estudios de prevención secundaria. Una tercera opción es asociar estatinas con esteroles vegetales en forma de una ración diaria (una bebida), lo cual añade un descenso del c-LDL de alrededor del 8%.
La cuarta opción es asociar estatinas y ácido nicotínico a dosis de 1-2g/día, con lo que se consigue un descenso adicional del c-LDL del 15 al 20%, con la ventaja sobre las tres opciones anteriores de que además se produce un acusado descenso de los TG, que puede ser superior al 30% en los pacientes con hipertrigliceridemia, y un aumento del c-HDL superior al 20%. Por ello, el ácido nicotínico es una alternativa de particular interés en los pacientes con dislipidemia mixta o con un déficit de c-HDL. El ácido nicotínico tiene el inconveniente de provocar sofocaciones en un alto porcentaje de pacientes, problema que se ha reducido de forma muy acusada al asociarle un inhibidor de los receptores de la prostaglandinaD2, el laropiprant. El efecto preventivo de la combinación de ácido nicotínico con estatinas sobre el riesgo cardiovascular ha sido demostrado en distintos ensayos clínicos. La combinación de fibratos con estatinas suele lograr un descenso del c-LDL escasamente superior a la monoterapia con estatinas, por lo que no suele emplearse para la hipercolesterolemia aislada.
En los pacientes con un insuficiente control de la hipercolesterolemia a pesar de ser tratados con dos fármacos, puede utilizarse la triple terapia con estatinas y ezetimiba asociadas a resinas o a niacina, o con estatinas, resinas y niacina. La cuádruple terapia con estatinas, ezetimiba, resinas y ácido nicotínico se ha utilizado en algunos casos de muy difícil control, pero no tenemos suficientes datos de ensayos clínicos que permitan establecer recomendaciones sobre ella.
Hipercolesterolemia asociada a un exceso de triglicéridos (hiperlipidemia mixta) o a un déficit de c-HDLEn esta situación el objetivo prioritario es disminuir el c-LDL y el colesterol no HDL (colesterol total menos el c-HDL), en general con una estatina. En segundo lugar, sobre todo en los pacientes de alto riesgo, como los isquémicos, los diabéticos y los afectados de síndrome metabólico o hiperlipidemia familiar combinada, deberemos normalizar los TG y el c-HDL (fig. 12). Aunque las estatinas disminuyen los TG en ocasiones alrededor de un 30% y aumentan el c-HDL entre el 5 y el 10%, es frecuente que con ellas no se alcance un control global de la dislipidemia.
La combinación de estatinas y ácido nicotínico es una opción de primera elección para aumentar el c-HDL en los pacientes que presentan un déficit de éste a pesar del tratamiento con estatinas, y una buena opción para disminuir los TG. En los pacientes con hipertrigliceridemia que no se corrige con estatinas puede emplearse con preferencia la combinación de estatinas con fibratos, o estatinas con ácido nicotínico. Esta última combinación se ha comentado en el apartado anterior. Los fibratos disminuyen los TG de forma proporcional a la magnitud de la hipertrigliceridemia, y cuando esta es importante el descenso puede superar el 50%. El c-HDL aumenta en general entre el 10 y el 15%, también en mayor proporción en los que presentan un mayor déficit de c-HDL. Por ello, la combinación de fibratos y estatinas es una buena alternativa para lograr un control global de la dislipidemia. Dicha combinación tiene un mayor riesgo de efectos secundarios, en particular de miopatía, y requiere una monitorización más estrecha del paciente. En los pacientes con síntomas musculares y un aumento de las enzimas de más de 10 veces el valor máximo de referencia hay que interrumpir el tratamiento, por el riesgo de rabdomiólisis con insuficiencia renal. Conviene evitar la asociación de estatinas y fibratos en la insuficiencia renal, los fármacos que interactúen con las estatinas o los fibratos, y considerar los aspectos que se muestran en la tabla 6. Los fármacos que se metabolizan por la isoenzima 3A4 del citocromo P450, lovastatina, simvastatina y atorvastatina, tienen un mayor número de interacciones que la pravastatina, la rosuvastatina y la fluvastatina. El gemfibrocilo no debe asociarse a estatinas porque tiene un perfil de interacciones con las estatinas muy superior al del fenofibrato o bezafibrato. Si se tienen en cuenta estas precauciones, el riesgo de miopatía es muy bajo. Actualmente están pendientes de publicación los resultados del estudio Accord, dirigido a valorar el efecto de la asociación de simvastatina y fenofibrato respecto de la monoterapia con simvastatina sobre la aparición de enfermedad cardiovascular en la población diabética. Tanto la asociación de estatinas con ácido nicotínico como la asociación con fibratos tienen otros efectos favorables, más allá de las concentraciones de lípidos séricos, en particular el hecho de disminuir las partículas remanentes de las lipoproteínas ricas en TG, y la proporción de partículas LDL pequeñas y densas, todas ellas de alto potencial aterogénico. Una tercera opción para tratar la hipertrigliceridemia que persiste después del tratamiento con estatinas es asociar una dosis de 2 a 4g/día de ácidos grasos omega-3, lo que disminuye los TG alrededor de un 30% adicional. Los ácidos grasos omega-3 apenas modifican el c-HDL y el c-LDL, pero tienen un escaso perfil de interacciones y efectos secundarios y disminuyen el riesgo trombótico y de arritmias cardiacas. En el estudio Jelis se observó el efecto preventivo frente al riesgo cardiovascular de añadir dosis medias de ácidos grasos omega-3 a los individuos tratados con estatinas.
Prevención de la miopatía secundaria al tratamiento con estatinas y fibratos
| - Verificar la función renal y tiroidea |
| - Evitar interacciones con otros fármacos |
| - Usar dosis medias o bajas de estatinas |
| - Usar fenofibrato o bezafibrato y evitar el gemfibrocilo |
| - Instruir al paciente sobre los síntomas de miopatía y monitorizar la creatincinasa y los síntomas musculares |
En los pacientes en los que, después de alcanzar los objetivos del c-LDL con estatinas y ezetimiba, persiste un déficit de c-HDL o un exceso de TG, la triple terapia mediante la adición de un fibrato puede contribuir al control global de la dislipidemia. En un ensayo clínico con más de 600pacientes tratados con simvastatina, ezetimiba y fenofibrato el colesterol no HDL disminuyó un 51%, los TG un 50% y el c-HDL aumentó un 19%, porcentajes superiores a los observados con la combinación de simvastatina y ezetimiba. Sin embargo, la asociación de fibratos y ezetimiba no está autorizada formalmente en nuestro país. Otra opción de triple terapia es la combinación de estatinas, ezetimiba y ácido nicotínico. En un ensayo clínico con esta asociación se logró un descenso del c-LDL y de los TG del 58 y del 42%, respectivamente, y un aumento del c-HDL del 30%.
Hipertrigliceridemia graveEn los pacientes con una concentración de TG mayor de 500mg/dl (5,6 mmol/l) que persiste tras la modificación de los hábitos de vida y la monoterapia con fibratos, ácido nicotínico o ácidos grasos omega-3, puede emplearse la asociación de dos de estos fármacos con la finalidad de prevenir la pancreatitis. Esta combinación también puede utilizarse cuando los TG superan los 200mg/dl en los pacientes de alto riesgo cardiovascular. La adición de una estatina, en forma de doble o triple terapia, también podría ser de utilidad cuando los TG se mantienen elevados después de utilizar los fármacos antes mencionados, aunque la respuesta es más variable.
En síntesis, las combinaciones de fármacos hipolipemiantes son eficaces y seguras cuando se utilizan adecuadamente para alcanzar los objetivos terapéuticos en los pacientes de alto riesgo cardiovascular o de pancreatitis, cuya dislipidemia no se controla con monoterapia. La opción más eficaz para lograr los objetivos del c-LDL es combinar estatinas con ezetimiba. La combinación de estatinas con fibratos o ácido nicotínico es la mejor opción para los pacientes con hipercolesterolemia asociada a hipertrigliceridemia o a un déficit de c-HDL. Para tratar la hipertrigliceridemia severa es útil asociar fibratos con ácido nicotínico o con ácidos grasos omega-3, o ácido nicotínico con ácidos grasos omega-3.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.