La aparición de metástasis hepáticas durante el seguimiento de un paciente con melanoma cutáneo se ha considerado clásicamente un signo de muy mal pronóstico. Las opciones terapéuticas son escasas ya que habitualmente estas lesiones son irresecables y forman parte de una enfermedad diseminada en varios órganos.
En ciertos casos, en los que la enfermedad está restringida al hígado o acompañada de enfermedad extrahepática resecable, la hepatectomía puede ser útil, obteniendo supervivencias aceptables, cercanas al 25% a los 5 años, aunque la recidiva hepática o cutánea suele ser temprana.
El escaso número de casos publicados, la ausencia de estudios aleatorizados y la heterogeneidad de las series no permiten extraer unas conclusiones para poder recomendar qué pacientes se benefician de la resección hepática con un nivel de evidencia científica aceptable, y así definir su utilidad real. Tampoco están definidas las pautas de actuación de cuándo y qué tipo de terapia adyuvante debemos emplear.
The appearance of liver metastases during the follow-up of a patient with a skin melanoma has classically been considered a sign of a very poor prognosis. There are limited therapeutic options, since these lesions are non-resectable and form part of a disseminated disease in several organs.
In certain cases, in those where the disease is restricted to the liver or accompanied by a resectable extra-hepatic disease, hepatectomy can be useful, obtaining acceptable survivals of about 25% at 5 years, although hepatic or skin recurrence is usually early.
The limited number of patient cases published, the absence of randomised studies, and the heterogeneity of the series, makes it difficult to reach conclusions to be able to recommend which patients may benefit from liver resection, with an acceptable level of scientific evidence, and thus define its real usefulness. There are also no action plans defined as to when and what type of adjuvant therapy we should use.
El melanoma maligno (MM) puede metastastizar vía hematógena a cualquier órgano1–3. Un 30% de los pacientes con MM desarrollan metástasis a distancia y presentan una supervivencia aproximadamente del 6% a los 5 años3–10. El hígado es el tercer órgano sólido más frecuentemente afecto por metástasis de MM tras pulmón y cerebro. Cuando las metástasis a distancia se localizan en el hígado se clasifican como estadio iv (M1c)11. La tasa de metástasis hepáticas (MH) causadas por el MM se pensaba que era baja, ya que solo un 10-20% de pacientes con MM metástasico presentan MH, tasa muy inferior a la causada por otros tumores como el de colon, que es cercana al 50%. Estudios realizados en autopsias de pacientes con MM metástasico elevan la cifra de MH de melanoma (MHM) a un 55-75%1,4–6,8,12. Tras el diagnóstico de MHM, el pronóstico a corto plazo es malo, ya que habitualmente hay afectación bilobar y frecuentemente se asocia a otros focos metastásicos. La supervivencia media en estos pacientes oscila entre 4 y 6 meses1,3–8,13.
La detección de las metástasis a distancia del MM se efectúa mediante estudios periódicos que incluyen determinación sérica de LDH, TAC toracoabdominopélvica, resonancia magnética cerebral y/o PET9,14,15. El PET-TAC presenta una sensibilidad del 85%, una especificidad del 100% y un valor predictivo del 98%14,15.
La existencia de MHM suele causar síntomas inespecíficos. Hay un reducido número de pacientes que han cursado con fallo hepático fulminante debido a afectación bilobar extensa por MHM2. Existen 3 casos descritos de rotura de una MHM que requirió cirugía hepática urgente12,16.
En la actualidad, se utilizan varios tratamientos en las MHM: médicos (quimioterapia, inmunoterapia y agentes biológicos), ablativos (radiofrecuencia, infusión arterial, quimioembolización) o de cirugía hepática3,5–7,11–13. La guía NCCN de MM oferta varias opciones terapéuticas en enfermedad metastásica limitada resecable: resección, observación, o tratamiento sistémico y reevaluación9. Los resultados obtenidos con cualquier tratamiento son mediocres y no existen estudios aleatorizados que comparen las opciones terapéuticas8,11,12,17.
La quimioterapia tiene una eficacia limitada en el MM metastásico con tasas de respuesta inferiores al 20%4,9,11. Los fármacos más comúnmente empleados son: ipilimumab, vemurafenib, dacarbazina, temozolamida y paclitaxel con/sin cispalatino o carboplatino9. La dacarbazina, en pacientes con MM estadio iv, obtiene una tasa de respuesta entre el 12 y el 28% con una supervivencia de 4 a 12 meses11. La bioquimioterapia o combinación de quimioterapia y agentes biológicos (interleucina 2, interferón y quimioterapia), obtiene ocasionalmente (15-20%) una respuesta clínica completa6,9.
La resección quirúrgica de las metástasis de MM puede ser útil ya que supone la reducción de factores inmunosupresivos tumorales, permite confirmar histológicamente si hay presentes mutaciones tipo RAF y proporciona una respuesta clínica del 25% a 5 años8,12,18. Si nos referimos exclusivamente a las MHM, la aplicabilidad de la resección hepática es habitualmente baja ya que, con frecuencia, estos pacientes presentan MH múltiples no resecables técnicamente o asociadas a múltiples focos metastásicos.
La indicación de resección en pacientes con MH de tumores no colorrectales no neuroendocrinos (NCNN), entre las que se incluyen las pacientes con MHM, todavía es una indicación no plenamente aceptada en la comunidad médica, y el número de pacientes intervenidos es reducido, pese a obtenerse en las series publicadas una supervivencia media del 5-25% a los 5 años18–25.
Los datos existentes sobre resección de MHM se encuentran en 2 tipos de artículos: series sobre MH de tumores NCNN en los que se incluyen MH de diversos tipos de tumores, y entre ellos MHM19,22,25, y un número muy reducido de artículos dedicados exclusivamente a MHM donde frecuentemente se mezclan pacientes con melanoma cutáneo y ocular5,11,12,19–25.
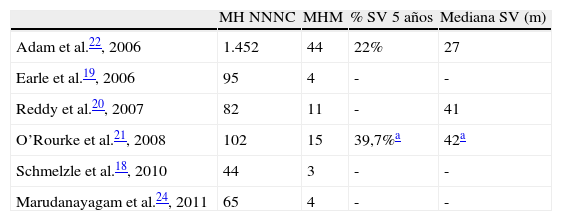
Entre las series de MH de NCNN que incluyen MHM (tabla 1), destaca el multicéntrico francés de Adam et al. que incluye 148 MHM (104 MM coroideos y 44 MM cutáneos) de 1.452 MH NCNN donde la resección de MHM obtuvo una supervivencia a 5 años del 21% en MM coroideo y el 22% en MM cutáneo, con una supervivencia media de 27 meses22. Adam et al. observaron que los MM coroideos presentan más frecuentemente tumores intrahepáticos múltiples y los MM cutáneos se asocian más a enfermedad extrahepática22. Reddy et al. publican 11 MHM con una mediana de 41 meses, pero solo 5 meses libres de enfermedad20. O’Rourke presenta un total de 20 melanomas (15 MM cutáneos y 5 oculares)21 y, Earle et al., 4 MHM sin especificar origen19. En todas las series sobre MH NCNN, se destaca que la resección hepática en estos pacientes debe ser entendida como una parte integrante del tratamiento oncológico (quimioterapia, radioterapia y cirugía) y con carácter citorreductor, no curativo20. El principal problema para evaluar estos artículos es que su objetivo principal es evaluar el resultado de la resección de MH NCNN en global, no de las MHM, por lo que la información que se puede obtener es escasa18–26.
Serie de metástasis hepáticas no colorrectales no neuroendocrinas
| MH NNNC | MHM | % SV 5 años | Mediana SV (m) | |
| Adam et al.22, 2006 | 1.452 | 44 | 22% | 27 |
| Earle et al.19, 2006 | 95 | 4 | - | - |
| Reddy et al.20, 2007 | 82 | 11 | - | 41 |
| O’Rourke et al.21, 2008 | 102 | 15 | 39,7%a | 42a |
| Schmelzle et al.18, 2010 | 44 | 3 | - | - |
| Marudanayagam et al.24, 2011 | 65 | 4 | - | - |
MH: metástasis hepáticas; MHM: metástasis hepáticas de melanoma; SV: supervivencia.
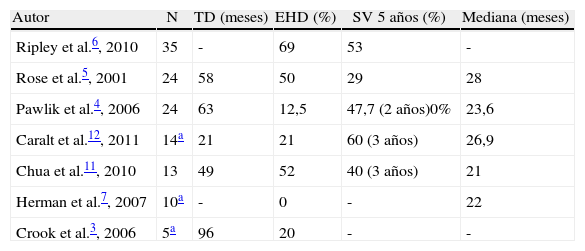
Las series publicadas dedicadas exclusivamente a MHM son muy escasas y habitualmente tratan conjuntamente todo tipo de melanomas (ocular y cutáneo), lo que complica poder extraer conclusiones (tabla 2). Destacamos algunas series.
Serie de metástasis hepáticas de melanomas cutáneos
| Autor | N | TD (meses) | EHD (%) | SV 5 años (%) | Mediana (meses) |
| Ripley et al.6, 2010 | 35 | - | 69 | 53 | - |
| Rose et al.5, 2001 | 24 | 58 | 50 | 29 | 28 |
| Pawlik et al.4, 2006 | 24 | 63 | 12,5 | 47,7 (2 años)0% | 23,6 |
| Caralt et al.12, 2011 | 14a | 21 | 21 | 60 (3 años) | 26,9 |
| Chua et al.11, 2010 | 13 | 49 | 52 | 40 (3 años) | 21 |
| Herman et al.7, 2007 | 10a | - | 0 | - | 22 |
| Crook et al.3, 2006 | 5a | 96 | 20 | - | - |
EHD: enfermedad extrahepática concomitante; SV: supervivencia; TD: tiempo entre diagnóstico de melanoma y metástasis hepáticas de melanoma.
Ripley et al. presentan una serie de 35 pacientes (29 MM cutáneos) tratados mediante una terapia mixta de cirugía, quimioterapia, radioterapia y terapia con linfocitos obtenidos del tumor (TIL). El 43% de los pacientes presentaban MHM únicas. El 69% presentaba enfermedad extrahepática. La supervivencia a 3 años es del 53% con una mediana de 36 meses, que se eleva hasta un 80% en los pacientes con toda la enfermedad resecada. Los factores pronósticos positivos en el análisis univariante fueron margen negativo en la resección hepática, MH única y ausencia de enfermedad extrahepática6. Su recomendación es que los pacientes con MH única sin enfermedad extrahepática deben ser valorados para resección. En los pacientes con enfermedad residual tras cirugía, los resultados obtenidos con la combinación de cirugía más TIL son espectaculares (supervivencia del 65% a los 3 años) y sin TIL, muy malos6.
Pawlik et al. realizan un estudio multicéntrico de 40 pacientes intervenidos de MHM (24 de MM cutáneo y 16 de MM ocular). La edad de los pacientes con MM cutáneo es inferior (40 años) a la presentada por los de MM ocular. El tiempo entre la aparición del MM y la MHM fue 63 meses. Un 67% eran MHM únicas. En el 60% se efectuó una hepatectomía mayor. Los pacientes recibieron múltiples y variadas terapias adyuvantes. La recidiva se produjo en el 75% de los pacientes, y ocurrió de forma precoz (5 meses tras la resección hepática), siendo la recidiva cutánea la más frecuente, o en otra localización extrahepática, pero no a nivel hepático. Las características clinicopatológicas del MM no tuvieron valor pronóstico. Los pacientes con MH unilobares y menores de 5cm tuvieron menor tasa de recidiva. Aquellos con MHM diagnosticadas simultáneamente a la lesión cutánea, o si presentaban enfermedad extrahepática, tuvieron mayor índice de recidiva. La supervivencia fue de 23 meses, alcanzando el 47% a los 2 años y el 0% a los 5 años. Aquellos pacientes tratados con algún tipo de terapia adyuvante obtuvieron mejor supervivencia que aquellos a los que se les realizó exclusivamente cirugía. Pawlik et al. recomiendan no realizar resección hepática si existe enfermedad extrahepática, tratar con alguna línea de quimioterapia y ver la evolución clínica4.
La serie de Rose et al., exclusivamente dedicada a MM cutáneo, incluye 1.750 pacientes con MM, de los cuales a 34 (2% del total) se les interviene para efectuar resección de MHM. El 75% presentaban una única MHM. En 10 casos, existía enfermedad intraabdominal extensa y solo se efectuó laparotomía exploradora. A los 24 restantes, que representan el 1,4% del total de pacientes con MM, se les realizó hepatectomía, y en 18 se pudo conseguir una resección tumoral completa (hepática y extrahepática), ya que un 50% presentaban enfermedad extrahepática asociada. En los 24 resecados, la supervivencia media fue de 28 meses frente a los 4 meses de aquellos a los que se les realizó únicamente laparotomía exploradora. La supervivencia a 5 años fue del 29%. El 72% presentó recidiva y el hígado fue el sitio más frecuente. A 2 pacientes se les pudo efectuar una segunda resección hepática de la recidiva. Los pacientes con margen histológico hepático negativo (R0) y a los que se les efectuó la resección de todos los focos de metastásis presentes obtuvieron mejor supervivencia5.
Chua et al. presentan una serie de 23 pacientes con MM que presentan MHM y gastrointestinales, de los cuales 17 son MM cutáneos. Solo intervienen a 15, 13 de ellos con MHM, y descartan a 8 por considerarlos irresecables. El 52% tenían otros focos metastásicos además de las lesiones hepáticas. En 12 de 13 pacientes se efectuaron resecciones hepáticas mayores. La supervivencia a 3 años fue del 30%. Los factores de mal pronóstico fueron la existencia de más de un foco metastásico y la no resección. El periodo libre de enfermedad previo a la aparición de las MHM (> 2 años) no es estadísticamente significativo por el tamaño muestral pero la diferencia es muy marcada (37 vs 9 meses)11.
Herman et al. proponen unos criterios para resecar una MHM: enfermedad hepática resecable, ausencia de enfermedad extrahepática comprobada mediante PET, ausencia de comorbilidades médicas graves y un intervalo de 24 meses entre el diagnóstico del MM y las MHM7. Crook et al. no consiguen identificar factores de riesgo que sirvan para decidir qué pacientes se benefician de una hepatectomía; postulan que el número de MH no importa, pero sí la presencia de enfermedad extrahepática. Efectúan una revisión de la literatura (1978-2000) que incluye un total de 60 casos publicados, observando que la mediana de supervivencia oscila entre 10 y 51 meses, y la supervivencia a 5 años entre el 0 y el 33%2.
Otras opciones terapéuticas de las MHM cuando la cirugía no es técnicamente factible son: quimioembolización a través de la arteria hepática, que puede ofrecer mejores resultados que la quimioterapia sistémica, aunque solo consigue una estabilización de la enfermedad ya que la respuesta clínica parcial o completa es excepcional1. Se ha demostrado que un patrón nodular en la angiografía se asocia a una mayor supervivencia1; o la infusión arterial de quimioterapia, que consigue algún tipo de remisión solo en un tercio de los pacientes11,27–29; la radiofrecuencia puede ser otra opción terapéutica7.
Como conclusión y resumen de las series publicadas de resección hepática de MHM, podemos decir que su aplicabilidad es muy reducida porque cuando hay afectación hepática metastásica por MM es habitualmente irresecable y forma parte de una enfermedad diseminada en varios órganos.
Las series publicadas son muy hetereogéneas y difícilmente comparables, y frecuentemente, combinan pacientes con MM ocular y cutáneo. El tiempo entre el diagnóstico del MM y la MHM suele ser elevado (49 a 96 meses), la tasa de enfermedad extrahepática es muy variable (0 a 69%), la tasa de hepatectomías mayores es alta (50-60%), la morbimortalidad de la hepatectomía por MHM es prácticamente nula, los tratamientos adyuvantes empleados son múltiples y los resultados de supervivencia a 5 años obtenidos son muy variables (0 a 53%). La recidiva suele ser temprana, en algunas series de localización hepática y en otras, cutánea. La ausencia de enfermedad extrahepática o su resección completa, un margen histológico hepático negativo, un tiempo entre MM y MHM largo y la MHM única han sido identificados como factores pronósticos positivos4–7,11.
El escaso número de casos publicados, la ausencia de estudios aleatorizados y la heterogeneidad de las series no permiten extraer recomendaciones sobre qué pacientes se benefician de la resección quirúrgica y qué terapias adyuvantes se deben emplear con un nivel de evidencia científica aceptable. Unas recomendaciones generales son:
- -
El PET-TC tiene una alta sensibilidad en el diagnóstico de enfermedad extrahepática y debería ser realizado si se plantea llevar a cabo una hepatectomía por MHM.
- -
La hepatectomía para MHM está indicada si la enfermedad está restringida al hígado o, para algunos autores, es aceptable si la enfermedad extrahepática es resecable. El número de MHM no es un factor determinante pero si la MHM es única obtiene mejores resultados. La resección debe ser R0.
Ya que la recidiva suele ser precoz, se debería emplear tratamiento adyuvante posresección de las MHM pero actualmente no está definido cuál es el mejor régimen.Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.