La eventración subxifoidea tiene características que la diferencian del resto y le dan entidad propia. El hecho de tener su saco muy próximo a los relieves costales óseos y esternón condiciona mucha tensión en los márgenes; la reparación, tanto por vía abierta como laparoscópica, no ha demostrado buenos resultados a pesar del uso generalizado de prótesis. Son poco frecuentes y se presentan en pacientes con comorbilidad importante (cardiópatas severos, trasplantados, inmunodeprimidos), tras intervenciones del área hepato-bilio-pancreática con incisiones transversales, esternotomías ampliadas por debajo del xifoides o laparotomías medias muy altas para cirugía gastro-esofágica.
Material y métodoEn nuestra Unidad hemos desarrollado una nueva técnica, basada en el uso de doble prótesis y adaptada a las características anatomo-fisiológicas de la región, para la reparación de estas eventraciones. La serie consta de 35 pacientes intervenidos de forma consecutiva entre 2004 y 2010, siguiendo protocolo quirúrgico y de manejo consensuado.
ResultadosNo hubo complicaciones importantes –la más frecuente es el seroma, 17,4%-, excepto un caso de infección de la herida por isquemia de piel en un paciente multioperado y trasplantado. El seguimiento postoperatorio hasta el día de hoy (entre 4 y 80 meses) no ha demostrado recidivas de la eventración y no se refieren molestias locales importantes.
ConclusionesLa técnica «doble malla ajustada» consigue en nuestro medio unos buenos resultados, tanto desde el punto de vista del cirujano (reproducibilidad, recidiva), como del paciente, con mínimas molestias y recuperación de la calidad de vida.
Subxiphoid incisional hernia has characteristics that differentiate it from the rest and make it a distinctive entity. The fact that it has its sac very near the rib cage and sternum determines the pressure in the margins. The repair, by open or by laparoscopic approach, has not demonstrated good results despite the generalised use of a prosthesis. They are uncommon, and have a significant comorbidity in patients (severe heart diseases, transplants, immunosuppressed), after surgery of the hepato-bilio-pancreatic area with transverse incisions, or very high mid-laparotomies for gastro-oesophageal surgery.
Material and methodsA new technique has been developed in our Unit, based on a double mesh and adapted to the anatomical and physiological characteristics of the region. The series consisted of 35 consecutive patients operated on between 2004 and 2010, following an agreed surgical and management protocol.
ResultsThere were no significant complications -the most frequent (17.4%) was a seroma- except one case of a wound infection due to skin ischaemia in one patient who had had multiple operations and a transplant. During the post-surgical follow up to the present (between 4 and 80 months), there has been no recurrence of the incisional hernia and no significant local discomfort has been reported.
ConclusionsThe «adjusted double mesh» technique achieved good results in our hands, from the surgical point of view (reproducibility, recurrence), and for the patient, with minimal discomfort and recovery of quality of life.
La eventración es una complicación quirúrgica muy frecuente1, con incidencia de hasta el 30%. La consideración de la eventración subxifoidea como una entidad con características propias se reconoce en la actual clasificación de la EHS2. Aparecen como defecto proximal de laparotomías medias muy altas -frecuentemente asociadas a exéresis xifoidea-, tras incisiones transversas o esternotomías amplias para cirugía cardíaca, en pacientes con gran comorbilidad (inmunosupresión, anticoagulación, quimioterapia).
Como recuerdo anatómico3, el xifoides está compuesto por cartílago hialino e incompletamente osificado. La región peri- o subxifoidea por la que protruye el saco eventrado es punto de inserción de varios músculos: el recto anterior del abdomen, su vaina y la línea alba se insertan en la porción anterior del xifoides, que se extiende caudalmente hasta la pared posterior de la vaina. Hay además otros 3 sistemas de unión: el ligamento costo-xifoideo, desde el 7.° cartílago costal a los laterales del xifoides; el músculo transverso del tórax, desde la 6.ª costilla al xifoides, y la porción esternal del diafragma, que se inserta en la superficie posterior xifoidea. La zona está irrigada por la arteria xifoidea, rama de la torácica interna, o por las ramas superiores de la arteria epigástrica. La destrucción de este enmarañado tejido, que en condiciones normales soporta la presión toraco-abdominal, condiciona la hernia incisional.
La incidencia de eventración tras esternotomía media por cirugía cardíaca está entre el 1 y el 4,2%4,5, cifra probablemente infraestimada porque suelen ser pequeñas y asintomáticas puesto que el hígado previene la incarceración intestinal; en la mayoría de series, la reparación ha sido electiva6 y la incarceración es la excepción.
Los factores de riesgo identificados en su aparición son la obesidad, la necesidad de transfusión durante la cirugía cardíaca, el antecedente de trasplante-inmunosupresión y la infección de la herida quirúrgica primaria6.
Conocemos que las eventraciones cuyo saco está próximo a relieves óseos tienen difícil solución; debido a los pobres resultados de la reparación directa, la implantación de prótesis se ha convertido en el procedimiento estándar7 aunque con índice de recidiva considerable6. La vía laparoscópica no ha conseguido mejorar los resultados porque la fijación de la malla, que siempre debe ser alejada del defecto, es compleja en este caso debido a la anatomía de la región con la membrana pericárdica o el diafragma tan próximos.
El objetivo del presente estudio es analizar nuestra experiencia personal en la reparación de las eventraciones subxifoideas mediante la técnica «doble malla ajustada», tras 6 años de experiencia y una serie representativa.
Material y métodoSe realiza un estudio prospectivo longitudinal, en el que se incluyen todos los pacientes a los que hemos realizado le técnica «doble malla ajustada» desde enero de 2004 hasta octubre de 2010.
Selección de pacientesLos que presentaban eventración subxifoidea pura, aquella cuyo saco está inmediatamente bajo el xifoides y los rebordes costales. No consideramos las eventraciones medias altas ni las epigástricas, a las que damos un tratamiento diferente.
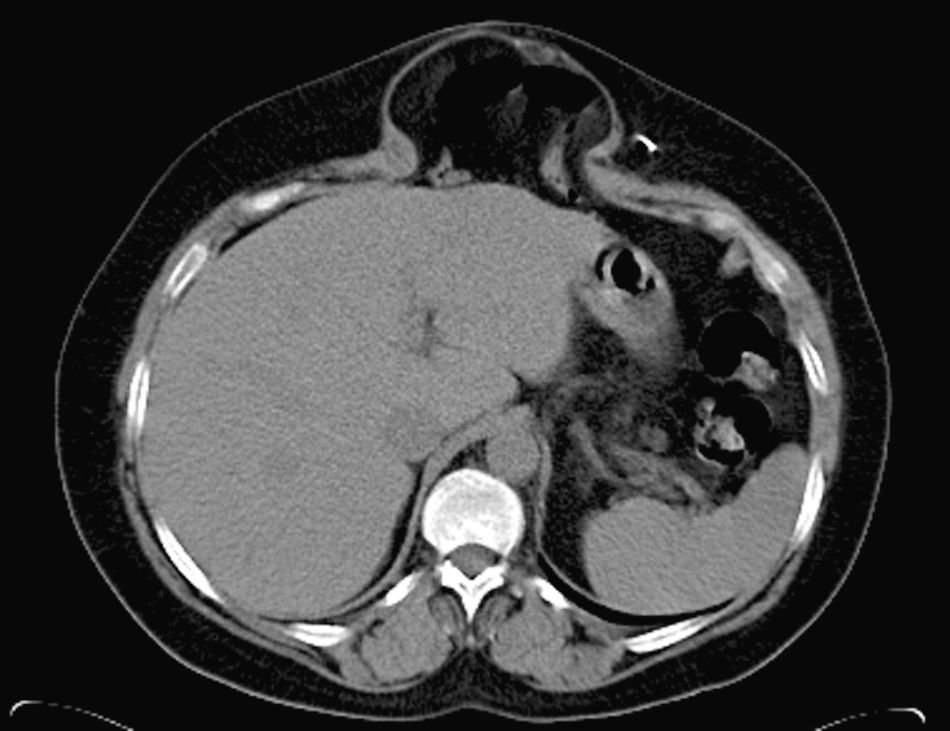
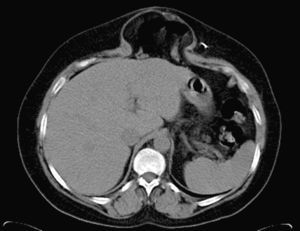
Preparación preoperatoria y protocolo de tratamientoTodos los pacientes han sido estudiados mediante TAC dinámica de la región (fig. 1) practicada con maniobra de Valsalva, para valorar diámetros y volumen del defecto, sus relaciones y el contenido del saco8; este detalle técnico ofrece valiosa información.
Junto al preoperatorio rutinario, incluimos pruebas respiratorias; además, prescribimos fisioterapia respiratoria con ayuda de un especialista. Conociendo que la obesidad es un factor de riesgo6 de aparición y recidiva de eventraciones, hacemos perder peso a los pacientes con sobrepeso. La enfermedad de base debe estar controlada (no interrumpimos el tratamiento inmunosupresor en los trasplantados); los enfermos oncológicos están libres de enfermedad.
Las intervenciones se realizaron bajo anestesia general. Hicimos profilaxis antibiótica con amoxicilina-clavulánico 2g iv antes de la inducción anestésica (400mg de ciprofloxacino iv en alérgicos) y profilaxis antitrombótica con HBPM. No hemos necesitado en la serie la práctica de neumoperitoneo previo.
El postoperatorio transcurrió en sala de hospitalización; ningún caso precisó vigilancia intensiva. Tras el alta, realizamos controles los meses 1.°, 6.° y 12.°; luego anual.
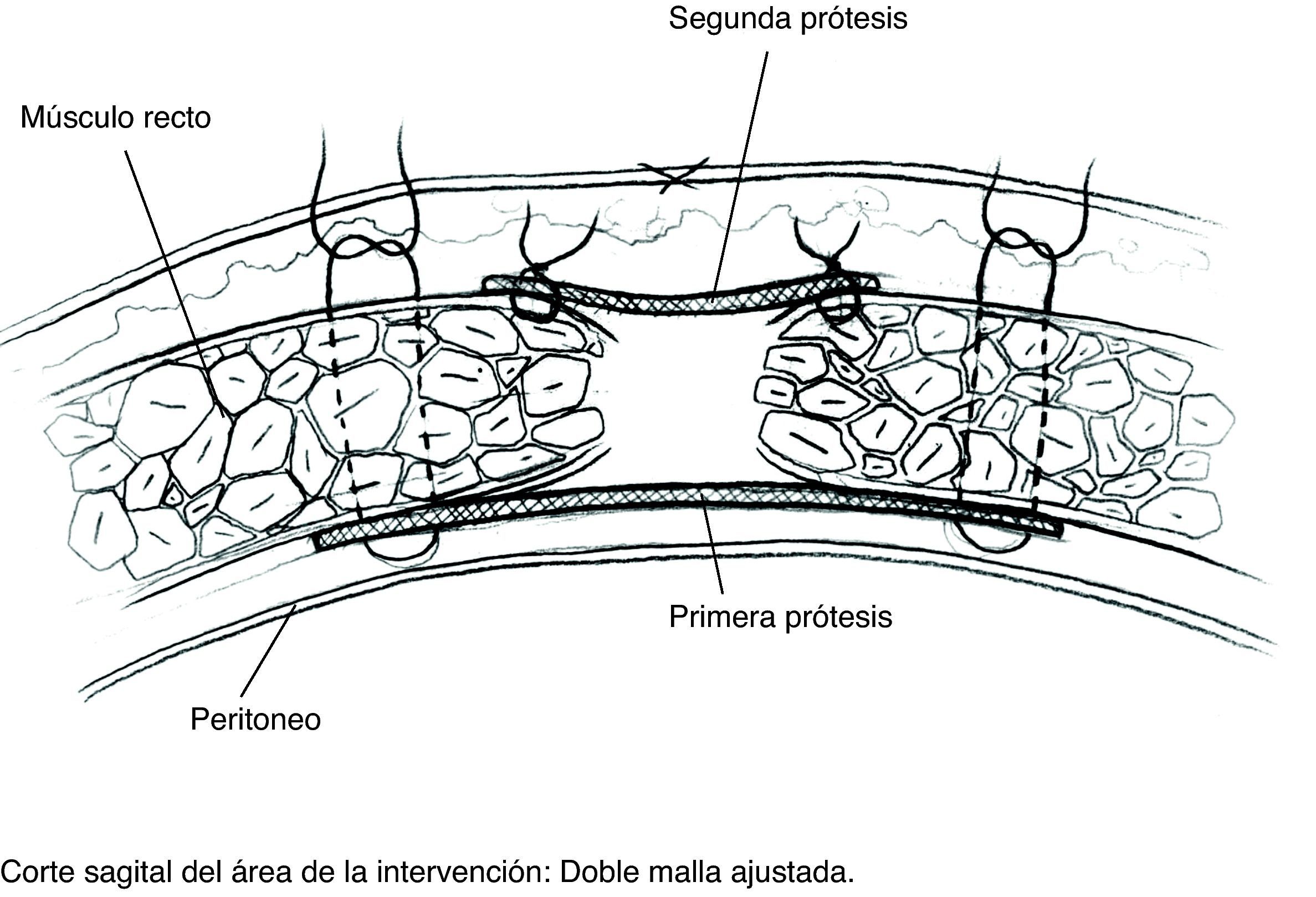
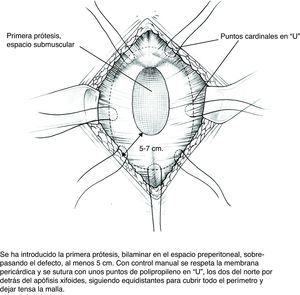
Descripción de la técnica (figs. 2–5)- 1)
Incisión de piel sobre la previa, extirpando la cicatriz.
- 2)
Disección de tejido celular subcutáneo hasta la aponeurosis, que queda expuesta unos diez cm alrededor del defecto herniario. Retirada de malla previa si la hay.
- 3)
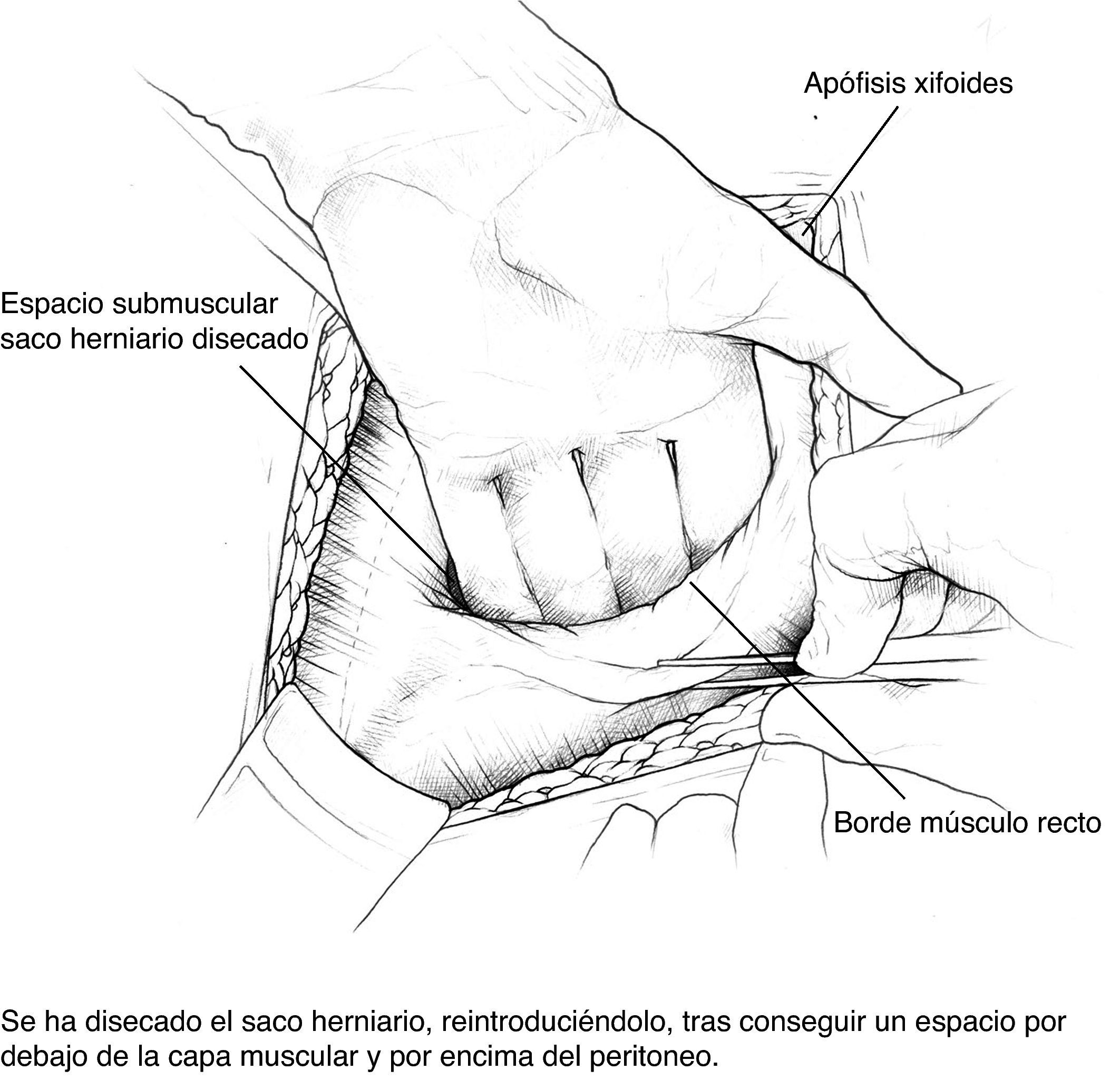
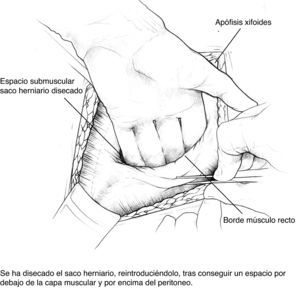
Disección del saco hasta su cuello y disección del plano preperitoneal. Conseguimos un plano amplio que aísla el peritoneo de sus conexiones a la fascia alternando disección roma con bisturí eléctrico. En la porción proximal, apertura de la vaina posterior de los rectos y disección cefálica; conseguimos así espacio suficiente para la ubicación de la prótesis. Accidentalmente se producen ventanas en el peritoneo: podemos cerrarlas con puntos u obviarlas si son pequeñas puesto que la prótesis que colocaremos en ese espacio es apta para el contacto con vísceras.
- 4)
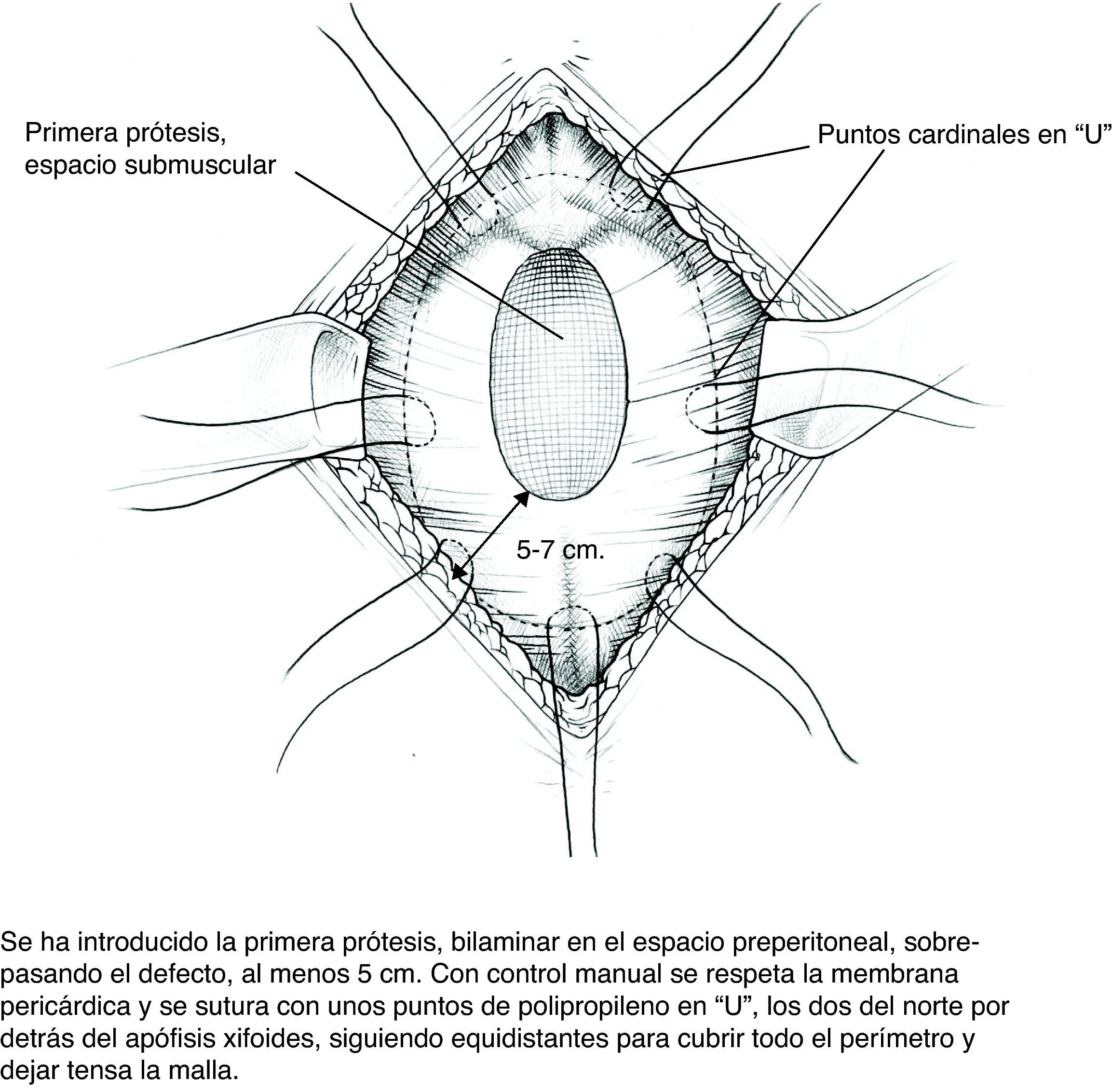
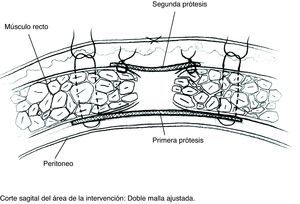
Colocación de la primera prótesis preperitoneal. Medida del defecto antes de cortar la prótesis -bien de PPL (polipropileno), bien compuesta- cuyo tamaño debe sobrepasarlo al menos en 5cm. Fijación mediante puntos en «U» transmusculares incluyendo la prótesis, que no anudaremos y que sirven para ir colocándola; una vez ubicada, tracción suave de las suturas para la completa extensión de la malla en el espacio submuscular y anudado progresivo. Utilizamos suturas de PPL monofilamento 2-0 con aguja cilíndrica atraumática grande, aunque podemos usar agujas de Reverdin o atrapahilos de los utilizados en cirugía laparoscópica. No creemos que este detalle tenga importancia para el resultado final.
- 5)
En este plano podemos aplicar adhesivo de fibrina9 (fibrina heteróloga Tissucol® o autóloga Vivostat®) que fijará la prótesis a los tejidos y evitará espacios muertos.
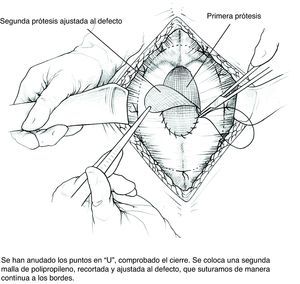
- 6)
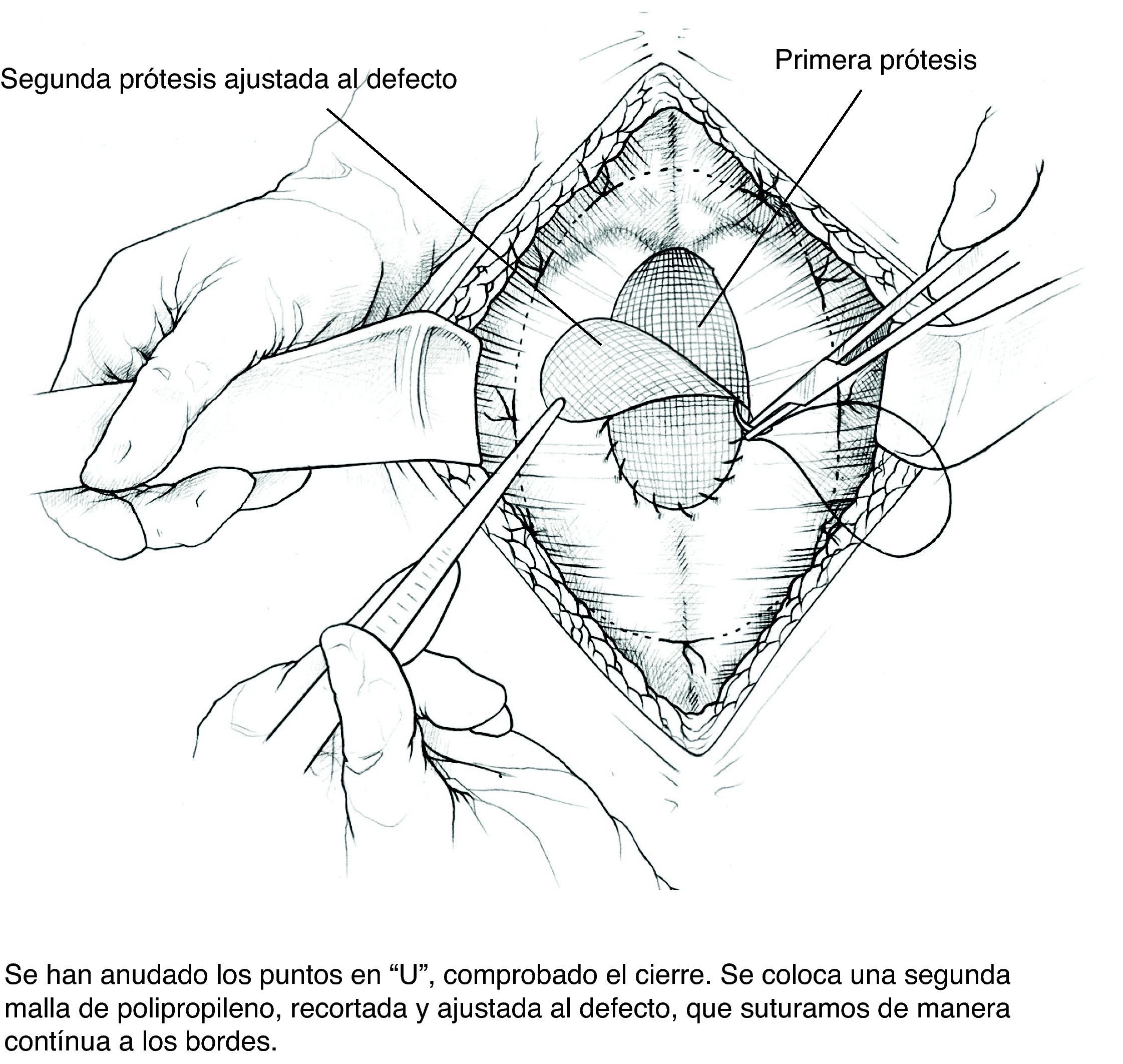
Colocación de la segunda malla ajustada al defecto. Puesto que el cierre de la brecha originaría tensión y arrugaría la prótesis, utilizamos una segunda malla plana de PPL de sustitución que ajustamos con sutura continua de PPL monofilamento a los bordes del defecto. Podemos rociar espray de fibrina sobre esta malla; por ser fenestrada y de poro amplio dejará pasar el producto.
- 7)
Hemostasia rigurosa del espacio subcutáneo. Cierre del tejido celular subcutáneo y de piel.
Para el estudio de nuestra serie se diseñó una base de datos; se determinaron variables preoperatorias e intraoperatorias: edad, sexo, comorbilidad, presencia de obesidad (peso-talla-IMC), hábito tabáquico, cirugía previa (causa, tipo de incisión, complicaciones postoperatorias relacionadas), tratamiento médico asociado, clasificación de riesgo anestésico ASA, eventración (plazo de aparición, tamaño, contenido), intervención quirúrgica (detalles técnicos, tiempo quirúrgico, técnicas asociadas), complicaciones postoperatorias inmediatas y tardías, estancia media hospitalaria y aparición de recidiva. Asimismo, se realizo análisis univariante de riesgo de los factores involucrados en prolongar la estancia media hospitalaria.
El análisis estadístico se realizó mediante programa de software comercial (SPSS versión 15). Las variables continuas se contrastaron mediante el test de t de Student, considerando el nivel de significación estadística en p<0,05. Las variables dicotómicas se analizaron mediante el test de Chi-cuadrado y el test de Fisher cuando fue necesario.
ResultadosEntre enero de 2004 y octubre de 2010, intervinimos en nuestra Unidad 35 pacientes de reparación protésica por eventración subxifoidea, con edad media de 59,1 (DE 13,6) años.
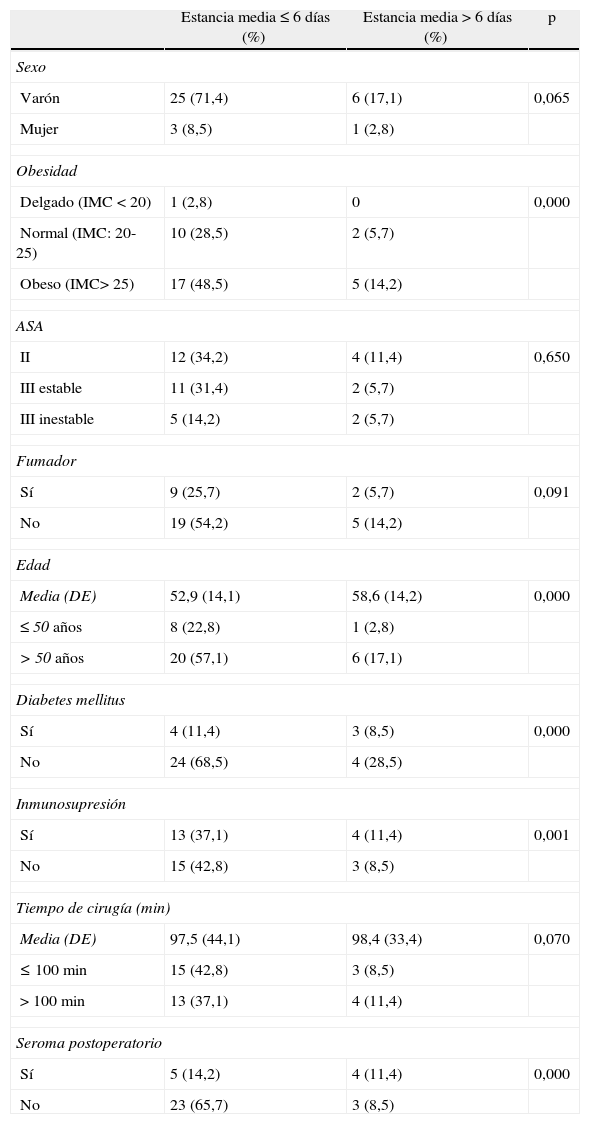
Las características demográficas de la serie se exponen en la tabla 1.
Datos demográficos y análisis univariante de factores involucrados en la prolongación de la estancia postoperatoria hospitalaria
| Estancia media ≤ 6 días (%) | Estancia media > 6 días (%) | p | |
| Sexo | |||
| Varón | 25 (71,4) | 6 (17,1) | 0,065 |
| Mujer | 3 (8,5) | 1 (2,8) | |
| Obesidad | |||
| Delgado (IMC<20) | 1 (2,8) | 0 | 0,000 |
| Normal (IMC: 20-25) | 10 (28,5) | 2 (5,7) | |
| Obeso (IMC> 25) | 17 (48,5) | 5 (14,2) | |
| ASA | |||
| II | 12 (34,2) | 4 (11,4) | 0,650 |
| III estable | 11 (31,4) | 2 (5,7) | |
| III inestable | 5 (14,2) | 2 (5,7) | |
| Fumador | |||
| Sí | 9 (25,7) | 2 (5,7) | 0,091 |
| No | 19 (54,2) | 5 (14,2) | |
| Edad | |||
| Media (DE) | 52,9 (14,1) | 58,6 (14,2) | 0,000 |
| ≤ 50 años | 8 (22,8) | 1 (2,8) | |
| > 50 años | 20 (57,1) | 6 (17,1) | |
| Diabetes mellitus | |||
| Sí | 4 (11,4) | 3 (8,5) | 0,000 |
| No | 24 (68,5) | 4 (28,5) | |
| Inmunosupresión | |||
| Sí | 13 (37,1) | 4 (11,4) | 0,001 |
| No | 15 (42,8) | 3 (8,5) | |
| Tiempo de cirugía (min) | |||
| Media (DE) | 97,5 (44,1) | 98,4 (33,4) | 0,070 |
| ≤ 100 min | 15 (42,8) | 3 (8,5) | |
| > 100 min | 13 (37,1) | 4 (11,4) | |
| Seroma postoperatorio | |||
| Sí | 5 (14,2) | 4 (11,4) | 0,000 |
| No | 23 (65,7) | 3 (8,5) | |
La cirugía previa más frecuente fue la laparotomía subcostal bilateral para el trasplante hepático (13 casos, 37,1%), seguido de 2 casos de cirugía del quiste hidatídico y otras 2 de yatrogenia biliar; hay 10 casos de esternotomías, 4 por trasplante cardíaco (11,4%), 5 por recambio valvular (14,2%) y un caso de tetralogía de Fallot. Finalmente, 8 casos de laparotomía media supraumbilical ampliada cefálicamente por cirugía urgente de oclusión de colon (Hartmann), adrenalectomía, hemicolectomía y técnicas antirreflujo. Cinco de los casos eran recidivados (sutura simple 3 casos, prótesis supraaponeurótica, 2 casos).
La mayoría de las hernias se desarrollaron antes de los 2 años de la intervención previa (media 15 meses, DE 6). Los factores de riesgo asociados con su aparición fueron la infección de la herida quirúrgica (25,5%) y la obesidad (43,3%); 17 casos (50%) son trasplantados.
La mayoría de las eventraciones, con diámetro entre 2 y 5cm eran asintomáticas10. Todos los pacientes operados fueron ASA II y III.
Realizamos técnica de doble malla ajustada en 32 pacientes (85%); en 3 (15%) pacientes se realizo además SAC modificado11 por asociar eventración subcostal. En todas las reparaciones se utilizó malla de PPL en el plano superficial; para el espacio retromuscular se usó prótesis dual en 12 casos.
El tiempo quirúrgico medio fue de 98,1 minutos (DE: 36,2), sin relación significativa con la prolongación de la estancia media postoperatoria, que fue de 5,5 (DE 4) días (tabla 1).
Observamos un caso de infección de herida por isquemia de piel en un paciente multioperado y trasplantado; se solventó con limpieza y revisión quirúrgica.
Se evidenció seroma postoperatorio en el 17,4% de los pacientes (9 casos), que se resolvieron sin necesidad de drenado. Ni el antecedente quirúrgico previo, ni el tamaño del defecto o su contenido, ni el tipo de malla utilizada influyeron en la aparición de seroma o infección postoperatoria. Sí fue relevante la utilización de fibrina en los resultados postoperatorios: se usó en 23 pacientes (72%), relacionándose con un menor porcentaje de seroma postoperatorio; así, únicamente observamos 3 casos de seroma tras la aplicación de fibrina frente a 6 sin el producto (p<0,001).
El análisis univariante de riesgo muestra que los factores asociados a prolongación de estancia hospitalaria (p<0,001) son: edad superior a 50 años, diabetes mellitus, inmunosupresión, IMC superior a 26 y aparición de seroma postoperatorio (tabla 1).
Mantenemos controlados a todos los pacientes de nuestra serie, sin pérdidas, y no hemos evidenciado recidivas ni casos de dolor crónico.
DiscusiónA diferencia de las series publicadas, en la mayoría de nuestros pacientes la cirugía previa es abdominal. Aunque con frecuencia los cirujanos ampliamos cefálicamente la incisión media, las eventraciones subxifoideas son infrecuentes tras cirugía abdominal. Se cree3 que los ligamentos costo-xifoideos y el músculo transverso del tórax resisten la tracción hacia atrás de las fibras diafragmáticas insertadas centralmente y que la esternotomía amplia con división del xifoides aumentaría las fuerzas laterales de los ligamentos y músculos, incrementando la tensión en relación con la respiración y la tos, con la consiguiente dehiscencia. Además, los bordes fasciales son difíciles de identificar en el cierre de la línea alba. El cierre empieza a fallar en final xifoideo de la incisión porque la división de la parte baja del esternón y del xifoides lo favorecen10; se sugiere que evitar el xifoides bífido y cerrar la línea alba con material irreabsorbible prevendría la eventración.
El 50% de nuestros pacientes son trasplantados, inmunosuprimidos por tanto, y con problemas añadidos de cicatrización12; el uso de prednisona o sirolimus parece implicado en los problemas de pared abdominal de estos pacientes13,14.
Revisada la literatura, hay pocos trabajos que analicen monográficamente la eventración subxifoidea y menos su tratamiento. La naturaleza retrospectiva de las series, de tamaño pequeño, población heterogénea y seguimiento breve, hacen difícil concluir cuál es el mejor manejo de estas eventraciones y ello crea controversia.
La reparación del defecto mediante sutura primaria implica tensión en los bordes; aunque este cierre está asociado a altas tasas3,6 de recurrencia, entre 43 y 80%, algunos cirujanos no ven indicación de utilización de prótesis en esta zona14. En cambio, se propone una técnica de esternotomía modificada15 a paraxifoidea izquierda, evitando la división o la resección del xifoides, que reduciría la tasa de eventraciones. Asimismo, se recomienda11 mejorar el cierre del esternón distal, reforzarlo al final de la incisión xifoidea y cerrar la línea alba con sutura no reabsorbible.
En 1985, Cohen y Starling3 publican con buenos resultados una técnica de reparación de eventración subxifoidea utilizando prótesis de PPL de alta densidad fijada con puntos sueltos; esta técnica parece ir asociada a tasas inferiores de recurrencia3,5,6,16, entre 0 y 32%. La prótesis puede ser anclada a la vaina posterior de los rectos y luego dejada expuesta en el TCS3 o cubierta con la aponeurosis del oblicuo externo, relajado mediante múltiples incisiones y aproximado a la línea media16, también conocido como método Clotteau.
Como el extremo superior del defecto es cartílago y hay problemas técnicos para la fijación de la prótesis, se propugna la resección parcial o total del xifoides para optimizar la exposición. Tiras de malla alrededor del arco costal sería un anclaje satisfactorio para la prótesis, aunque son dolorosas17 y debería ser evitado18 porque el pericondrio costal está muy inervado y su atrapamiento causa dolor persistente.
La literatura sustenta como ideal la ubicación retromuscular de prótesis, que parece relacionada con reducción significativa de tasas de recurrencia7. En esta posición, la fuerza de la presión abdominal sujeta la prótesis fuertemente contra la superficie profunda del músculo.
Es premisa fundamental en el uso de prótesis tener en cuenta su retracción, por eso se recomienda solapamiento circunferencial mínimo de 5cm o uso de prótesis 20% más grandes que el defecto19,20; esto resulta difícil si el defecto fascial está cerca de estructuras óseas o cartilaginosas. La reparación preperitoneal en esta zona requiere un solapamiento craneal adecuado; la inserción de la vaina posterior del recto al xifoides actúa como una barrera dificultando la ubicación de la malla, pero18 con disección adecuada puede separarse del lado dorsal del xifoides, abriendo el espacio retroxifoideo y permitiendo insertar la malla retromuscular-retroxifoidea con márgenes adecuados.
Si no conseguimos este espacio, la alternativa es la reparación supraaponeurótica, que resulta más fácil y reproducible: es sencillo colocar la prótesis en el plano subcutáneo, porque hay buena visibilidad y se consiguen solapamientos de 5cm o más. Sin embargo, conlleva mayor riesgo de recurrencia y la literatura21 sugiere que las prótesis suprafasciales están asociadas a incremento de formación de seroma y riesgo de infección, que no puede ser eliminada totalmente con antibióticos y drenaje profiláctico.
La introducción de técnicas laparoscópicas añade otra posibilidad de manejo, aunque no disponemos de series amplias o con resultados a largo plazo que avalen sus ventajas. Comenzó en 200022, mediante prótesis bilaminar colocada contra la superficie interna del defecto utilizando cuatro puntos transmurales en las esquinas y anclada a la vaina posterior del recto alrededor de los márgenes herniarios.
Análogo sistema de fijación se usó en dos series posteriores, que refieren tasas de recurrencia del 10%23 y 33%6 respectivamente, mientras otra24 breve serie de 4 pacientes, refiere estancia media postoperatoria 6,5 días y 0% recidiva a los 6 meses.
Se recomienda fijación mixta25 con grapas helicoidales alrededor de los bordes de la prótesis asociada a puntos transmurales abdominales cada 3-6cm, porque las grapas solo penetran 2cm tras la prótesis y la fuerza tensil que soportan es menor26 que con la técnica combinada. Se considera suficiente fijar la prótesis por debajo del arco costal. Insertar grapas justo bajo las costillas, a través de la unión condrocostal del esternón o en el xifoides mejoraría el cierre, pero crea dolor crónico severo. Además, la colocación de grapas más allá del margen condral costal podría originar complicaciones muy graves27 como pericarditis o taponamiento cardíaco agudo.
La experiencia con este método aún es limitada y no ofrece suficientes datos sobre la influencia del material protésico anclado en el diafragma en la fisiología respiratoria; en hernias proximales, la fijación de la prótesis solapando 5cm el defecto necesitaría de sutura trasdiafragmática-paraesternal, lo que alteraría la movilidad diafragmática18. En general, se acepta la no-fijación24 de la porción cefálica de la prótesis porque la presión abdominal extiende y fija la malla, añadiendo fuerza a la reparación; además, el lóbulo izquierdo hepático y el estómago mantienen esta región relativamente protegida.
Nuestra Unidad considera la eventración subxifoidea como una entidad diferente2 y ha protocolizado su reparación con la técnica descrita, original hasta donde conocemos. En reuniones y cursos hemos comunicado nuestra técnica sin encontrar experiencias similares; nuestro hospital, con Unidades de trasplante hepático y cardíaco, genera estas eventraciones. Negativamente, el hecho de ser grupo de referencia implica asumir pacientes con domicilios muy distantes, lo cual impide las altas precoces o el manejo mediante Unidades de Hospitalización Domiciliaria, que acortarían nuestras estancias.
Cuando concebimos el procedimiento quisimos combinar varios principios que nos parecieron fundamentales.
- 1)
El cierre debe practicarse sin tensión28 en la línea de sutura; es conocida la relación de esta circunstancia con la recidiva por fallo de los bordes, isquémicos por la tracción. Con tensión es mejor no cerrar sino sustituir el defecto con una prótesis.
- 2)
Colocación profunda de la prótesis, en el espacio preperitoneal; esta opción es defendida por diversos autores7,29,30, atribuyéndosele mejores resultados en el tratamiento de otras eventraciones.
- 3)
Uso de doble prótesis. Premisa descrita por Condon31: si los bordes no se pueden aproximar porque hay tensión, se disecan los planos al menos 6cm alrededor del margen del defecto, y se coloca una pieza de material sintético en cada plano, preperitoneal y supraaponeurótico. Las prótesis permiten la reparación sin modificar los tejidos locales, evitando plastias y desdoblamientos musculoaponeuróticos (tiempo, complicaciones), evitan tensión y disminuyen las recidivas; una revisión32 concluye que la recidiva disminuye si hay doble malla.
La técnica se ha desarrollado tanto en la vía abierta33,34 como combinada35 (laparoscopia y anterior).
- 4)
Finalmente, según los hallazgos de Amid36, con la cicatrización la prótesis de PPL puede retraerse hasta un 20%. De ello inferimos que ajustando la malla de sustitución al defecto, que no cerramos para evitar la tensión, la invasión fibroblástica cicatricial menguaría la prótesis, cerrando progresivamente el defecto y proporcionando un cierre firme, como un fuerte tapón. Además, la prótesis inferior no debe quedar excesivamente tensa, para evitar tiranteces y sensación de «coraza».
Nuestro objetivo final es dar a conocer en Cirugía Española una técnica que en nuestras manos tiene excelentes resultados tanto de nuestro punto de vista (facilidad de ejecución y reproducibilidad) como de los pacientes (comodidad, alta precoz, reincorporación a la vida diaria), con bajo índice de complicaciones a pesar de ser pacientes con comorbilidad. No hay recidivas hasta la actualidad, aunque somos conscientes de que esta afirmación siempre debe ser cautelosa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.