Introducción. Entre las estructuras que conforman la pared posterior del canal inguinal que puedan impedir la formación de hernias, y de una manera especial las hernias de tipo directo, se encuentra la fascia transversalis. En estudios previos demostramos la existencia en muestras in vivo de un aumento en la expresión de metaloproteinasa 2 (MMP-2). El objetivo del presente trabajo ha sido investigar, a través de cultivos de fibroblastos tomados de fascia transversalis, la expresión de algunas MMP con el fin de comprobar si las modificaciones encontradas en tejido se mantenían en condiciones de cultivo.
Pacientes y métodos. La fascia transversalis fue obtenida de pacientes portadores de hernias indirectas y directas, siempre de una misma zona situada en la pared posterior del canal inguinal. Las muestras control se obtuvieron de pacientes donantes en el transcurso de extracciones multiorgánicas destinadas a trasplante. Se establecieron los siguientes grupos de estudio: control (n = 10), pacientes con hernia directa (n = 32), pacientes con hernia indirecta (n = 36). Las edades de los pacientes oscilaron entre 20 y 60 años (media, 39,8 años). Atendiendo a este parámetro, se diseñaron dos subgrupos de estudio, I: 20-40 años y II: 41-60 años. Las muestras de fascia transversalis fueron procesadas para estudio en cultivo y obtención de fibroblastos. La expresión celular y de los medios de cultivo para MMP-2 y MMP-9 fueron analizada por inmunohistoquímica, ELISA, immunobloting y zimografía. El análisis estadístico fue realizado empleando un test no paramétrico (test de la U de Mann-Whitney).
Resultados. La sobreexpresión de MMP-2 fue siempre detectada en los fibroblastos procedentes de pacientes con hernia inguinal directa del subgrupo I. No fue detectada actividad de MMP-9. La cuantificación de MMP-2 por ELISA en los medios de cultivo puso de manifiesto un incremento significativo de esta enzima en el subgrupo I e
Introduction. Fascia transversalis (FT) is among the structures comprising the posterior wall of the inguinal canal that can impede hernia formation, particularly that of direct hernias. In previous studies using in vivo samples, we demonstrated the presence of increased metalloproteinase-2 (MMP-2) expression. The objective of the present report was to investigate the expression of certain MMPs in cultured FT fibroblasts for the purpose of determining whether the changes observed in tissue persisted in cell cultures.
Patients and methods. FT was obtained from patients with indirect or direct hernias, always from the same region situated in the posterior wall of the inguinal canal. Control samples were obtained from multiorgan transplant donors during harvesting. The following study groups were established: controls (n = 10), patients with direct hernias (n = 32) and patients with indirect hernias (n = 36). Patient age ranged between 20 and 60 years (mean: 39.8 years). This parameter was used to define two study subgroups: I, 20 to 40 years of age, and II, 41 to 60 years of age. The FT samples were processed for culture study and to obtain fibroblasts. MMP-2 and MMP-9 expression in cells and culture media was analyzed by immunohistochemistry, ELISA, immunoblotting and zymography. A nonparametric test (the Mann-Whitney U test) was employed for the statistical analysis.
Results. MMP-2 overexpression was always detected in fibroblasts from patients with indirect inguinal hernias belonging to subgroup I. MMP-9 activity was not found. ELISA studies in the culture media revealed a significant increase in MMP-2 expression in subgroup I direct hernia patients when compared with those with indirect hernia and controls of the same age (p < 0.05). In subgroup II, the amount of MMP-2 secreted into the culture media was lower in patients with direct hernia than in controls and indirect hernia patients of the same age (p < 0.05). When the two age groups were compared, significant differences were observed only among direct hernia patients (p < 0.05). Zymography disclosed a significant rise in MMP-2 expression in subgroup I when compared with controls of the same age. The level of active enzyme in subgroup II showed a pattern similar to that observed with ELISA, there being a significant decrease in patients with direct hernia in comparison with controls and patients with indirect hernia (p < 0.05).
Conclusions. Fibroblasts from FT of young patients with direct inguinal hernia show a greater MMP-2 expression. This enzyme may be implicated in the process of degradation of the extracellular matrix of FT in patients with this type of hernia.
Introducción
Los procedimientos de reparación herniaria siguen siendo los más frecuentes dentro de la práctica quirúrgica actual. En los EE.UU. se realizan unas 700.000 herniorrafias anualmente por esta afección. No menos importante es la recidiva postoperatoria, que sigue alcanzando cifras del 10-15%, aunque mediante algunas técnicas que emplean biomateriales las cifras han disminuido al 1-3%1.
El riesgo de recurrencia está relacionado con el tipo de hernia, siendo cinco veces mayor en hernias directas que en hernias indirectas2.
Desde el punto de vista etiopatogénico, la aparición de los diferentes tipos de hernias, a pesar de la existencia de factores de tipo anatómico (persistencia del conducto peritoneo-vaginal, inserción alta del arco del transverso), y factores asociados a otras enfermedades (obesidad, enfermedad pulmonar obstructiva crónica, estreñimiento), debería tener un sustrato biológico. De hecho, algunas enfermedades, como los síndromes de Marfan y Ehlers-Danlos, la osteogénesis imperfecta3 o la luxación congénita de cadera4 se asocian con más frecuencia a procesos herniarios que a la población normal.
Entre las estructuras que conforman la pared posterior del canal inguinal, que pueden impedir la formación de hernias y de una manera especial las hernias de tipo directo, se encuentra la fascia transversalis (FT).
Se han efectuado estudios de muestras de tejido de la vaina de los músculos rectos anteriores del abdomen5, cremáster, sacos herniarios6, e incluso de la piel7 de pacientes con hernias. Se han estudiado la expresión de ciertos tipos de colágeno8 y algunas disregulaciones enzimáticas9. Apenas existen estudios sobre alteraciones de la FT. Nuestro grupo, preocupado por la etiopatogenia de las hernias, comenzó estudiando muestras de tejido procedentes de biopsias de FT en pacientes con hernias. Correlacionamos aspectos ultraestructurales con actividad de colágeno, así como degradación del mismo a través del estudio de algunas metaloproteinasas (MMPs). Objetivamos un aumento de la expresión de la metaloproteinasa 2 (MMP-2) en tejido procedente de la FT, de pacientes portadores de hernias directas10. Esta enzima degrada e interviene en el turnover de la matriz extracelular en relación con ciertos tipos de colágenos y elastina. Su expresión se encuentra aumentada en procesos como prolapsos genitourinarios11 y aneurismas aórticos12,13. En esta última afección se ha detectado que los pacientes tienen mayor incidencia de hernias14,15. Esto nos llevó a profundizar y a plantearnos una posible hipótesis del comportamiento observado con la MMP-2 en las biopsias de FT de pacientes con hernias. Posiblemente podría existir un mecanismo similar que explicara por qué, en algunos casos, la pared posterior del canal inguinal constituida por la FT permanece inalterable y, en otros, presenta fallos que ocasionan defectos herniarios.
Para ello diseñamos un estudio in vitro en el que hemos investigado, a través de cultivos de células tomadas de FT, la expresión de MMP con el objetivo de comprobar si las modificaciones encontradas en el tejido se mantenían en condiciones de cultivo. Esto podría, en caso de confirmarse, sugerir la existencia de algún factor genético como inductor de esta afección. De ser así, los tipos herniarios en los que se demostrara alguna alteración estructural de base en la FT podrían ser subsidiarios de reparación primaria con un material protésico.
Pacientes y métodos
Las muestras de FT control fueron obtenidas de pacientes donantes en el transcurso de extracciones multiorgánicas destinadas a trasplante. Las otras muestras de FT procedieron de pacientes intervenidos de hernia inguinal. En todos los casos, la biopsia se efectuó siempre en la misma zona central de la pared posterior del canal inguinal. Todas las muestras fueron tomadas de pacientes con hernias primarias.
Se establecieron los siguientes grupos de estudio: grupo control (n = 10), grupo de pacientes con hernia indirecta (n = 36) y grupo de pacientes con hernia directa (n = 32).
Las edades de los pacientes, todos ellos varones, oscilaron entre 20 y 60 años (media, 39,8 años). Atendiendo a este parámetro, los pacientes fueron subdivididos en dos subgrupos: I, 20-40 años y II, 41-60 años.
Inmediatamente después de la cirugía, las muestras fueron introducidas en un medio de cultivo estéril Minimun Essential Medium (MEM) (Gibco BRL, Life Technologie, Barcelona-España) suplementado con 100 U penicilina/100 µg, y streptomicina (Gibco BRL), para su transporte al laboratorio. A continuación fueron sometidas a congelación (20 °C) para su procesamiento y estudio bioquímico posterior.
Cultivo de fibroblastos
Las muestras de FT fueron procesadas en condiciones estériles en una campana de flujo laminar clase II (Telstar AV 30/70 Telstar S.A., España).
La FT fue separada del tejido graso asociado mediante disección con hoja de bisturí y a continuación cortada en pequeños fragmentos de aproximadamente 1 mm2. Una vez obtenidos los explantos, fueron colocados sobre la superficie de cultivo de frascos Roux de 25 cm2 de superficie (Nuclon-Intermed, Nunc A/S, Roskildo, Dinamarca) a los que previamente se añadieron 0,5 ml de medio BIO-AMF 2 (Biological Industries, Kubbutz Beit Haemek, Israel) para mantener humedecida la superficie de cultivo y permitir una mejor adherencia de los explantos.
Terminado este proceso, los frascos de cultivo fueron incubados, en posición vertical, a 37 °C en presencia de un 5% de CO2, en estufa de cultivo (Forma Scientific Inc., Ohio, EE.UU.) durante 2 h. Transcurrido este tiempo, se añadieron 2,5 ml/frasco de medio BIO-AMF 2 y se incubaron en posición horizontal bajo las mismas condiciones anteriores, teniendo especial cuidado de no provocar movimientos bruscos para evitar el despegamiento de los explantos. El medio de cultivo fue renovado cuidadosamente dos veces por semana.
ELISA
Alcanzada la subconfluencia celular, los medios de cultivo fueron recogidos y centrifugados a 200 g durante 7 min. El sobrenadante fue almacenado a 70 °C hasta su procesamiento. Los fibroblastos fueron desprendidos de la superficie de cultivo mediante tripsinización y se realizó el recuento de los mismos en una cámara de Neubauer (Weber Scientific International Ltd., Alemania). Los valores de MMP fueron detectados en los medios de cultivo mediante la utilización de un equipo ELISA frente a MMP-2 y MMP-9 (The Binding Site, Birmingham, Reino Unido).
Las microplacas fueron incubadas durante 1 h a temperatura ambiente con 100 µl/pocillo de cada una de las muestras. A continuación, se lavaron todos los pocillos tres veces con 250-300 µl de solución de lavado y se añadieron 100 µl/pocillo de anticuerpo biotinado. Tras 1 h de incubación a temperatura ambiente, se retiró el exceso de anticuerpo y cada uno de los pocillos se lavó tres veces. Se añadieron 100 µl/pocillo de estreptoavidina-peroxidasa y se incubaron a temperatura ambiente durante 30 min. Transcurrido este tiempo se lavaron siguiendo los pasos anteriores y se añadieron 100 µl/pocillo de sustrato cromogénico (TMB). Las muestras se incubaron a temperatura ambiente durante 10 min. Las placas fueron leídas a una densidad óptica de 450 nm, en un contador de microplaca ELX 800 (Bio-Tek Instruments Inc., Izasa, Barcelona, España). Los resultados fueron expresados en enzima/106 células.
Estudio inmunohistoquímico
Las células fueron fijadas en formol al 10%, lavadas en PBS (pH, 7,4) y procesadas para detección de MMP-2 y MMP-9 usando dos anticuerpos monoclonales (Binding Site, Birmingham, Reino Unido). La reacción antígeno-anticuerpo fue detectada por una técnica de peroxidasa-antiperoxidasa (PAP). El sustrato cromogénico empleado fue el 3 amino-9 etil-carbazol en N,N-dimetilformamida. Los cultivos se examinaron en un microscopio (Zeiss, Alemania).
Análisis por immunoblot para MMP-2 y MMP-9
Cada muestra fue diluida al 50% en solución tampón (0,12 Tris-baser pH 6,8, con un 20% de glicerol, un 0,04% de azul de bromofenol, un 6% de dodecil sulfato sódico en presencia o ausencia de un 10% de 2-mercaptoetanol). A continuación, las muestras fueron cargadas en un gel de poliacrilamida para electroforesis, con el 6% de dodecil sulfato sódico (SDS-PAGE), de acuerdo con el método modificado por Laemmli16. Finalizada la electroforesis, los geles fueron transferidos a membranas de nitrocelulosa (BioRad, Hercules, California, EE.UU.) según el método descrito por Towbin et al17. El exceso de sitios de unión a proteínas fue saturado con TBS (20 mmol/l de Tris-base y 137 mmol/l de NaCl, pH 7,6). Las membranas transferidas fueron incubadas durante 1 h a temperatura ambiente, con anticuerpo anti-MMP-2 y anti-MMP-9 para humanos (dilución 1:1.000 en TBS). La reacción inmunohistoquímica fue revelada con IgG de conejo conjugada con peroxidasa (Southern Biotechnology Associates, Inc., Birmingham, EE.UU.) (dilución 1:1.000 en TBS) y analizada por luminiscencia18.
Actividad gelatinolítica
El medio condicionado procedente de los cultivos de fibroblastos fue diluido en proporción 1:1 en solución tampón (0,12 Tris-base pH 6,8, con un 20% de glicerol, un 0,04% de azul de bromofenol y un 6% dodecil sulfato sódico). Las muestras fueron analizadas por técnicas de zimografía usando un 10% de SDS-PAGE con un 0,1% (W/v) de gelatina (SIGMA, Chemical, España) como sustrato. Cada carril del gel fue cargado con 3 µg de proteína total. La electroforesis fue realizada en condiciones de 25 mA/gel a 4 °C de temperatura. A continuación, los geles fueron lavados dos veces en Tris (50 mmol/l), pH 7,4, que contenía un 2,5% (v/v) de Tritón X-100, durante un tiempo total de 1 h. Este proceso fue seguido por 2 lavados de 10 min con Tris (50 mmol/l), pH 7,4. Después se retiró el SDS y se incubaron los geles en agitación durante toda la noche a 37 °C en Tris (50 mmol/l), pH 7,5, con 10 mmol/l de CaCl2, 0,15 mmol/l de NaCl, un 0,1% (v/v) de Tritón X-100 y un 0,02% de azida sódica. Transcurrido este tiempo, los geles fueron teñidos con un 0,25% de azul brillante de Coomasie R-250 (SIGMA Chemical, España) y posteriormente lavados en una solución acuosa compuesta por un 7,5% de ácido acético y un 20% de metanol. Tras la realización de la zimografía, las bandas aparecen de color blanco sobre un fondo azul. La actividad degradati va de MMP-2 y MMP-9 fue valorada por técnicas semicuantitativas de densitometría óptica.
Análisis estadístico
Fue llevado a cabo empleando el test no paramétrico de la U de Mann-Whitney.
Resultados
La expresión de MMP-2 en fibroblastos se detectó en todos los grupos de estudio. La presencia de MMP-2 fue mayor en los fibroblastos de pacientes con hernia directa pertenecientes al subgrupo 1 (20-40 años). Los fibroblastos de la población del subgrupo II presentaron una menor intensidad en el marcaje que los procedentes del subgrupo I. No se detectó MMP-9 en ninguno de los grupos estudiados.
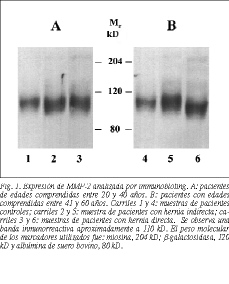
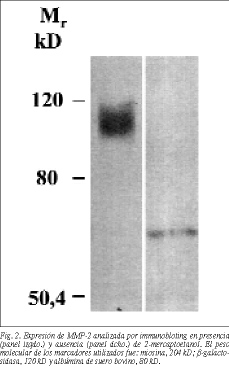
Todas las muestras estudiadas procedentes de los medios de cultivo por immunobloting, tanto de la población control como de la población patológica, independientemente de la edad, demuestran la presencia de MMP-2 (fig. 1A y B), y no de MMP-9. En presencia de agentes reductores (2-mercaptoetanol), la banda característica de la MMP-2 (aproximadamente 110 kD) (fig. 2A) es sustituida por una banda cuyo peso molecular está en torno a 67 kD (fig. 2B).
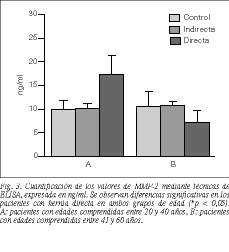
La cuantificación de MMP-2 por ELISA en los medios de cultivo (fig. 3) pone de manifiesto un incremento significativo de los valores de esta enzima en la población patológica herniaria de tipo directo entre 20 y 40 años, con respecto a pacientes controles de la misma edad y pacientes portadores de hernia indirecta (p < 0,05). Sin embargo, en el grupo de 40-60 años, la cantidad de MMP-2 secretada al medio en pacientes portadores de hernias directas es significativamente menor que en los grupos control y el grupo de hernia indirecta (p < 0,05). En la comparación entre grupos de edades, solamente se han detectado diferencias significativas entre los pacientes portadores de hernia directa (p < 0,05).
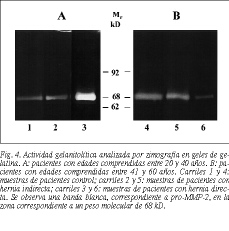
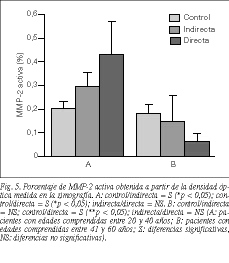
La actividad gelatinolítica de la MMP-2 activa se expone en las figuras 4A y B. La cuantificación de la misma (fig. 5) evidenció un incremento significativo en el grupo de hernias perteneciente a la población del subgrupo I (20-40 años) con respecto a los controles de la misma edad. La cantidad de enzima activa mostraba un patrón similar al observado para el ELISA en la población del subgrupo II (41-60 años), manteniéndose una disminución significativa en los pacientes portadores de hernia directa en relación con controles y pacientes con hernia indirecta (p < 0,05).
Discusión
El balance entre la síntesis y la degradación de la matriz extracelular es un factor importante para la integridad tisular. Cambios o defectos en la matriz pueden provocar alteraciones en la arquitectura de la misma, que pueden ocasionar modificaciones importantes en las propiedades mecánicas de los tejidos. Profundizando en esta idea, habíamos estudiado el papel de la MMP-2 en tejido procedente de FT, encontrando un incremento de esta enzima degradativa en pacientes portadores de hernias de tipo directo.
En el presente trabajo nos planteamos comprobar si esta modificación podría ser debida a factores ambientales o bien hubiese un componente más estable que indujera modificaciones permanentes en los fibroblastos de la FT afectada por la patología herniaria. Esto nos llevó a realizar cultivos de fibroblastos con el fin de que todas las células estuvieran en las mismas condiciones ambientales y poder determinar si las modificaciones encontradas en el tejido persistían en las condiciones de cultivo.
En la valoración de las metaloproteinasas (MMP-2) pro cedentes de sobrenadantes de cultivos de fibroblastos de pacientes normales y portadores de hernias, hemos encontrado cambios significativos en la expresión de la MMP-2. Por immunobloting hemos detectado en todos los casos la presencia de una banda próxima a 110 kD. Sin embargo, en presencia de un agente reductor, como el mercaptoetanol, esta banda desaparece siendo sustituida por una banda en el entorno de 67 kD. Estos hallazgos parecen sugerir la presencia de MMP-2 en forma de dímeros.
Para poder cuantificar la cantidad de MMP-2 expresada en medio de cultivo realizamos un análisis mediante ELISA. Objetivamos que la cantidad de MMP-2 secretada por los fibroblastos de pacientes portadores de hernias directas era significativamente mayor en el subgrupo I (20-40 años). Cuando analizamos la cantidad de MMP-2 en la población del subgrupo II (41-60 años), sólo encontramos variaciones significativas en pacientes portadores de hernia directa. Si tenemos en cuenta el factor edad, observamos una fuerte reducción de secreción de MMP-2 en los pacientes con hernia directa del subgrupo II. Todo esto nos induce a pensar que existe una relación entre la existencia del proceso patológico herniario y la secreción de MMP-2. Además, el incremento significativo en pacientes jóvenes portadores de hernia directa podría concordar con las características macroscópicas de debilidad que presenta la FT en estos pacientes.
Este análisis no sería concluyente si no valoramos la cantidad de MMP-2 en forma activa que sería la que realmente tendría capacidad para degradar la matriz extracelular. Para ello realizamos un análisis semicuantitativo de la actividad gelatinolítica, encontrando en la zimografía valores estadísticamente significativos en el caso de pacientes jóvenes portadores de hernias. Esto corrobora en parte los datos anteriores, ya que confirma que en la población de pacientes jóvenes con hernia directa no sólo hay una mayor expresión de la enzima MMP-2, sino también de su forma activa. Este hecho resulta muy interesante dada la poca frecuencia de aparición de este tipo de hernias en pacientes jóvenes.
Otro hecho importante a reseñar es la coincidencia de la sobreexpresividad de esta enzima en otros tipos de afecciones, como los aneurismas12,13 y los prolapsos genitourinarios11. Esto podría indicar la existencia de un disbalance entre la síntesis y degradación en la matriz extracelular en todas estas afecciones.
En cuanto a la MMP-9, enzima secretada fundamentalmente por neutrófilos, macrófagos y otras células que participan en la respuesta inflamatoria, no fue hallada, como cabría esperar, en nuestros medios de cultivo analizados, corroborando así que la actividad MMP-9 encontrada en los tejidos podría ser debida a estirpes celulares diferentes a la fibroblástica19.
De nuestros estudios podemos concluir afirmando que los fibroblastos procedentes de FT de pacientes jóvenes portadores de hernias directas demuestran una mayor expresión de la MMP-2 activa, por lo que esta enzima puede estar íntimamente implicada en el proceso degradativo de la matriz extracelular. La persistencia de dicha modificación a través de los cultivos parece sugerir la idea de un defecto genético, o bien de una transformación posterior de dicho material, descartando como causa principal los factores ambientales, aunque éstos podrían contribuir como factores secundarios. Desde el punto de vista de la aplicabilidad clínica, estos hallazgos sugerirían la conveniencia de colocar un material protésico en todos aquellos pacientes portadores de una hernia inguinal directa, a fin de reforzar la pared posterior del canal inguinal.
Agradecimiento
A la Unidad de Trasplante Hepático del Hospital Universitario Ramón y Cajal (Dr. E. Vicente López), por habernos permitido la obtención de las muestras control y poder llevar a buen término este trabajo.