Evaluar las complicaciones, la mortalidad y la calidad de vida tras la reconstrucción esofágica diferida en pacientes que han precisado desconexión esofágica (esofagostomía cervical) por causas de etiología benigna.
Pacientes y métodosDurante el periodo 2002 a 2011, a 20 de 24 pacientes con una exclusión esofágica por patología benigna, se les realizó la reconstrucción diferida. Se analizaron las complicaciones de la reconstrucción y se evaluó la calidad de vida mediante el Cuestionario de la Salud SF-36 antes y después de la cirugía.
ResultadosSe intervinieron 20 pacientes (16 varones y 4 mujeres) con una edad media de 54,5±10,5 años. Las causas de desconexión esofágica fueron: 10 por ingesta de cáusticos, 3 perforaciones iatrogénicas, 4 dehiscencia de anastomosis y 3 casos con síndrome de Boerhaave. Se realizaron 14 coloplastias (60%) y 6 interposiciones gástricas (25%) en un tiempo medio de 212,2±23,5 días tras la desconexión esofágica. Las complicaciones postoperatorias más frecuentes fueron las respiratorias (55% de los pacientes) y según la clasificación modificada de Clavien se dividieron en: grado 1 (10%), grado 2 (15%), grado 3a (40%), grado 3b (10%) y grado 4a (10%). La mortalidad (grado 5) a los 30 días de la serie fue del 10%. La calidad de vida tras la reconstrucción mejoró de forma significativa en todos los dominios analizados del cuestionario SF-36.
ConclusionesLa reconstrucción esofágica en un segundo tiempo se asocia a una elevada morbilidad, con una mortalidad del 10%. Tras la reconstrucción, la calidad de vida mejora en todos los parámetros evaluados.
To assess morbidity, mortality and quality of life after oesophageal reconstruction in patients with oesophageal exclusion for benign diseases.
Patients and methodsFrom 2002 to 2011, 20 of 24 patients with esophageal exclusion due to benign disease underwent a delayed reconstruction. We analyzed morbidity, mortality and health-related quality of life using the SF-36 questionnaire, before and after reconstruction.
ResultsTwenty patients were operated (16 men and 4 women) with an average age of 54.5±10.5 years. Main causes of oesophageal disconnection were: 10 cases of caustics ingestion, 3 iatrogenic perforations, 4 anastomotic leaks and 3 cases with Boerhaave syndrome. Fourteen (60%) coloplasties and 6 (25%) gastric interpositions were performed with an average time of 212,2±23.5 days after oesophageal exclusion. Pulmonary complications were the most common postoperative complications (55% patients) and according to the modified Clavien classification were divided into: grade 1 (10%), grade 2 (15%), grade 3a (40%), grade 3b (10%), and grade 4a (10%). The 30-day mortality (grade 5) of the series was 10%. Quality of life after reconstruction improved significantly in all analyzed domains of the SF-36 questionnaire.
ConclusionsDeferred oesophageal reconstruction is associated with a high morbidity and a mortality rate of 10%. After reconstruction, the quality of life improved in all the parameters evaluated.
El tratamiento quirúrgico urgente de los traumatismos del esófago o de las complicaciones postoperatorias relacionadas con la cirugía del esófago se asocia a una elevada morbilidad y mortalidad. En general, el tratamiento dependerá de la localización y tamaño de la lesión, del tiempo transcurrido, del estado general del paciente y de la experiencia del cirujano1–8. La mayoría de las complicaciones urgentes del esófago se resuelven, hoy en día, con sutura simple o colocación de prótesis recubiertas. Sin embargo, en ocasiones puede ser necesario realizar una desconexión del tránsito digestivo alto mediante una exclusión del esófago y, en el peor de los casos, si existe necrosis de los tejidos puede ser necesaria una esofagogastrectomía total.
Tras la desconexión esofágica, es necesaria otra intervención para reconstruir el tránsito digestivo con el objetivo de mejorar el estado nutricional del paciente y su calidad de vida. Se dispone de pocos artículos que analicen este problema, en especial en lo que se refiere al órgano utilizado para su sustitución (estómago, colon, yeyuno), así como sobre la vía de acceso más recomendable en esos pacientes.
El objetivo de este trabajo es analizar las complicaciones, la mortalidad y los resultados de calidad de vida tras la reconstrucción esofágica diferida en una serie de pacientes que precisaron una desconexión esofágica (esofagostomía cervical) por causas de etiología benigna.
Pacientes y métodosDesde enero de 2002 hasta diciembre de 2011, 24 pacientes fueron intervenidos en nuestro hospital por diferentes patologías urgentes del esófago: 12 casos por ingesta de cáusticos, 2 perforaciones iatrogénicas tras una endoscopia diagnóstica con toma de biopsia (descartar displasia de alto grado en esófago de Barrett), 2 perforaciones iatrogénicas por endoscopia con fines terapéuticos (dilatación esofágica por estenosis péptica), 4 dehiscencias anastomóticas y 4 casos con síndrome de Boerhaave. Todos los casos de perforación iatrogénica se diagnosticaron pasadas las 24h y por ello, en presencia de contaminación y sepsis, se decidió la exclusión. Una vez excluidos 4 pacientes que fallecieron en el período postoperatorio, se analizaron los resultados de 20 pacientes a los que se les planteó la reconstrucción y constituyen el grupo de estudio.
En el periodo preoperatorio, antes de la reconstrucción, se realizó a todos los pacientes una colonoscopia, tomografía computarizada (TC) toracoabdominal, pruebas funcionales respiratorias, valoración cardiológica, nutricional y de anestesia.
Técnica quirúrgicaUtilizamos como técnica de primera elección la interposición de estómago (gastroplastia) según la técnica de Akiyama sin acondicionamiento vascular previo, y la coloplastia transversa en aquellos casos en los que el estómago no estaba disponible; ambas por vía retroesternal. En ningún caso fue necesario resecar parcialmente el manubrio esternal.
Para la gastroplastia, se disecó la curvatura mayor respetando los vasos gastroepiplóicos derechos y se ligaron los vasos cortos del estómago. Posteriormente, se ligó la arteria gástrica izquierda y se abrió la membrana frenoesofágica para disecar el esófago. La tubulización se realizó con 3-4 disparos de una grapadora 75mm (carga azul) dejando una anchura de unos 4-5cm. En todos los casos se reforzó la línea de grapado con sutura continua irreabsorbible y se realizó piloroplastia (Heineke-Mikulicz).
Cuando optamos por una interposición de colon, se procedió a la movilización de todo el colon respetando la vascularización de la arteria cólica media y se seccionó el ángulo hepático y esplénico del colon (coloplastia transversa). Posteriormente se realizó anastomosis colocólica, anastomosis del extremo distal de la plastia a un asa de yeyuno en «Y» de Roux y yeyuno-yeyunostomía.
La disección del esófago cervical se realizó por vía laterocervical izquierda y la plastia se ascendió por vía retroesternal. La anastomosis esofagogástrica y esofagocólica se realizó en todos los pacientes de manera término-terminal, isoperistáltica, con puntos sueltos de seda 2-0. En ningún caso se utilizó grapadora lineal ni circular.
Evaluación de las complicaciones y de la calidad de vidaLas complicaciones postoperatorias se clasificaron según los grados propuestos por Clavien9. El estado de salud general antes y después de la reconstrucción esofágica se evaluó mediante la versión española del SF-36 Health Survey, el Cuestionario de Salud SF-3610,11. Se trata de un instrumento genérico que contiene 36 ítems que cubren 8 dimensiones del estado de salud y proporcionan un perfil del mismo. Para cada dimensión, los ítems se codifican, agregan y transforman en una escala que tiene un recorrido desde 0 (el peor estado de salud para esa dimensión) hasta 100 (el mejor estado de salud).
Análisis estadísticoEl análisis de calidad de vida se realizó en todos los pacientes. Se obtuvo la puntuación de cada paciente para cada una de las 8 dimensiones del estado de salud. Para realizar el análisis comparativo de las diferentes dimensiones del estado de salud pre y postoperatorio se usó el test comparativo de Wilcoxon para muestras relacionadas. Se consideró estadísticamente significativo para todas las variables un valor p<0,05. Para ello se utilizó el paquete estadístico SPSS (SPSS para Windows, version 15.0; SPSS Inc).
ResultadosEn la tabla 1 se resume la técnica realizada a los 20 pacientes durante la urgencia (los equipos quirúrgicos fueron diferentes para esta primera cirugía).
La edad media (16 varones y 4 mujeres) fue de 54,5±0,5 años. Las causas de desconexión esofágica fueron: 10 por ingesta de cáusticos, 3 perforaciones iatrogénicas, 4 por dehiscencia de anastomosis y 3 casos con síndrome de Boerhaave. Para la reconstrucción se realizaron 14 coloplastias transversas (60%) y 6 gastroplastias tubulizadas (25%) a través del mediastino anterior. El tiempo medio transcurrido entre la desconexión esofágica y la reconstrucción fue de 212,2±23,5 días (media). Seis pacientes precisaron transfusión sanguínea durante la misma.
La clasificación de las complicaciones según la escala de Clavien-Dindo fue la siguiente: grado 1 (10%), grado 2 (15%), grado 3a (40%), grado 3b (10%), grado 4a (10%) y grado 5 (10%).
Las complicaciones postoperatorias más frecuentes fueron las respiratorias (tabla 2). En el periodo postoperatorio, 2 pacientes precisaron drenaje torácico por derrame pleural con repercusión clínica (fiebre y/o dificultad respiratoria). Respecto a los 5 pacientes que presentaron atelectasias con clínica respiratoria, todos se solucionaron mediante fibrobroncoscopia y fisioterapia. Cinco pacientes presentaron neumonía y precisaron tratamiento antibiótico para su resolución. Los 7 casos de fístula cervical se manejaron de forma conservadora.
Causas de morbilidad en la reconstrucción diferida
| Complicaciones de la cirugía en un segundo tiempo | n (%) |
| Respiratorias | |
| Derrame pleural | 10 (50) |
| Atelectasias | 8 (40) |
| Neumonía | 5 (25) |
| Fallo respiratorio (distrés) | 3 (15) |
| Complicaciones de la anastomosis cervical | |
| Fistula cervical | |
| Gastroplastia | 5 (25) |
| Coloplastia | 2 (10) |
| Estenosis | |
| Gastroplastia | 5 (25) |
| Coloplastia | 0 |
| Reoperaciones | |
| Hemoperitoneo: esplenectomía | 1 (5) |
| Sepsis abdominal | 1 (5) |
| Complicaciones menores | |
| Disfonía transitoria | 2 (10) |
La ingesta se inició en un tiempo medio de 5,2 días y esta se indicó cuando el paciente presentaba tránsito positivo. Todos los pacientes recibieron nutrición parenteral postoperatoria hasta que se inició la tolerancia líquida amplia sin complicaciones. En 11 casos fue necesario ampliar el periodo de nutrición por complicaciones (3 neumonías, 6 fístulas cervicales y los pacientes reintervenidos: hemoperitoneo secundario a desgarro de cápsula esplénica y sepsis por dehiscencia de anastomosis intraabdominal). Cuatro pacientes precisaron ingreso en UCI (3 casos por distrés respiratorio y otro por neumonía) con una estancia media de 18 días.
La estancia media hospitalaria tras la reconstrucción diferida fue de 16,4±4,2 días. La mortalidad a los 30 días fue del 10%. Dos pacientes fallecieron tras la cirugía con el uso de plastia gástrica: uno por insuficiencia respiratoria y otro por sepsis de origen respiratorio secundario a neumonía grave.
La incidencia de estenosis diagnosticada por endoscopia fue del 25% y en todos los casos fue necesaria la dilatación posterior al mes de la cirugía; 2 pacientes precisaron más de 2 sesiones.
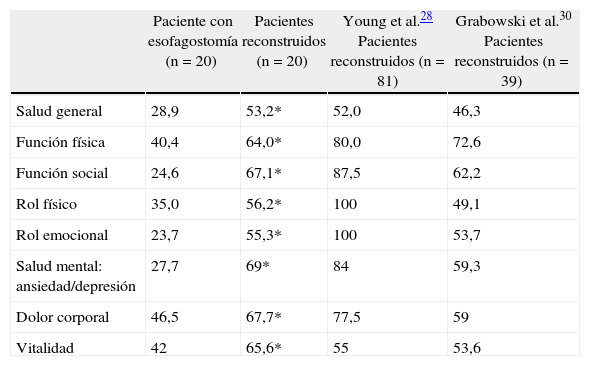
Todos los pacientes participaron rellenando el cuestionario SF-36 antes y después de la reconstrucción diferida. Se objetivó una mejoría significativa en cada uno de los dominios de la escala SF-36 de calidad de vida (tabla 3): percepción de salud general, función física, función social, rol físico, rol emocional, estado salud mental: ansiedad/depresión, dolor corporal y vitalidad.
Evaluación de la calidad de vida después de la reconstrucción esofágica
| Paciente con esofagostomía (n=20) | Pacientes reconstruidos (n=20) | Young et al.28 Pacientes reconstruidos (n=81) | Grabowski et al.30 Pacientes reconstruidos (n=39) | |
| Salud general | 28,9 | 53,2* | 52,0 | 46,3 |
| Función física | 40,4 | 64,0* | 80,0 | 72,6 |
| Función social | 24,6 | 67,1* | 87,5 | 62,2 |
| Rol físico | 35,0 | 56,2* | 100 | 49,1 |
| Rol emocional | 23,7 | 55,3* | 100 | 53,7 |
| Salud mental: ansiedad/depresión | 27,7 | 69* | 84 | 59,3 |
| Dolor corporal | 46,5 | 67,7* | 77,5 | 59 |
| Vitalidad | 42 | 65,6* | 55 | 53,6 |
*Se compararon los diferentes parámetros del cuestionario de calidad de vida SF-36 en los pacientes con esofagostomia cervical y yeyunostomia antes y después de la reconstrucción del tránsito digestivo. Asimismo, se comparan nuestros resultados con los de otras series similares.
Se dispone de varias alternativas para reconstruir el tránsito esofágico en un segundo tiempo. Estas varían en función del tipo de plastia, la vía de reconstrucción y localización de las anastomosis12. La decisión sobre qué tipo de plastia utilizar se debe basar en una serie de factores como la longitud de plastia que se requiere, su vascularización, las condiciones anatómicas y la plastia que está disponible13.
La gastroplastia es la alternativa más fisiológica y se considera la técnica de elección por la mayoría de cirujanos; aporta sencillez por la rapidez de la movilización del estómago y necesidad de una sola anastomosis. Con la plastia gástrica se piensa que existe una menor incidencia de necrosis, aunque algunos estudios han concluido que la tasa de isquemia es similar a la plastia cólica14. Su principal problema es la isquemia parcial del fundus15, que se asocia a un 20-25% de dehiscencias y estenosis anastomóticas. Además, la gastroplastia puede facilitar la aparición de reflujo gastroesofágico, esófago de Barrett y adenocarcinoma16.
La coloplastia como alternativa principal presenta varias opciones dependiendo de la vía de ascenso y sección utilizada. No existen criterios científicos sobre qué lado del colon elegir, y la mayoría de las veces se basa en la experiencia y costumbres del cirujano. Bothereau et al.17 defienden la coloplastia derecha por 4 razones: prevención del reflujo por la preservación de la válvula ileocecal, congruencia del esófago y del íleon a nivel cervical, facilidad de la anastomosis ileocólica en comparación con la colocólica de la coloplastia izquierda a nivel abdominal, y la posibilidad de usar el colon izquierdo como plastia de rescate en caso de necrosis del colon derecho. Rice et al.18, sin embargo, consideran que la presencia de la válvula ileocecal a nivel cervical puede ser perjudicial para la deglución.
Autores como Jiang et al.19 y Thomas et al.20 defienden la utilización de la interposición de colon izquierdo por la escasa variabilidad de la arteria cólica izquierda y con ello una menor posibilidad de isquemia.
Nosotros hemos utilizado la coloplastia trasversa, por la buena vascularización que recibe de la arteria cólica media y la presencia de numerosas colaterales, lo cual relacionamos con la ausencia de casos de necrosis en nuestra serie. Pensamos que es una gran alternativa dado que: 1) su longitud permite un transporte eficaz de alimentos y permite una anastomosis libre de tensión, 2) se reduce el riesgo de presentar reflujo, esofagitis y esófago de Barrett16, con la consiguiente mejora en resultados funcionales y calidad de vida, 3) la circulación colateral entre la cólica media y la izquierda es más constante y persistente, en cambio entre la arteria cólica media y la derecha o la ileocecoapendicular hay mayor variabilidad; y 4) la amplia luz de la anastomosis asegura, tal como sugiere Jiang et al.19, una deglución suave, evita las aspiraciones y el desarrollo de estenosis. No obstante, esta técnica precisa una movilización quirúrgica mayor, 3 anastomosis y un mayor tiempo quirúrgico21.
Un tema debatido entre cirujanos es qué hacer con el esófago que ha sido excluido en la primera cirugía. Si el esófago es abandonado pueden aparecer complicaciones debido a las secreciones retenidas (mucocele, infecciones en el mediastino…). Además, existe la posibilidad de malignización del segmento abandonado (1-5% de los casos)16,19. Por otra parte, la disección extensa que se necesita para resecarlo, sobre todo en los casos con periesofagitis relacionada con la primera cirugía, expone al paciente a mayores complicaciones, aumentado las tasas de morbilidad y mortalidad. Thomas et al.20 proponen la resección a pesar de la morbilidad y mortalidad añadidas mientras Jiang et al.19 no describen en su serie problemas con el esófago intratorácico excluido; aunque recomiendan un seguimiento periódico. En nuestra serie, no hemos objetivado ninguna complicación postoperatoria relacionada con el abandono del esófago. El seguimiento de este lo hacemos mediante TC torácica anual hasta el tercer año y después cada 3 años.
Hoy en día, el uso de la arteriografía para la evaluación de la vascularización es controvertido. Nosotros nos guiamos por la transiluminación del mesenterio, palpación de pulsos y al observar hemorragia cuando seccionamos los extremos cólicos. Chang22 recomienda ocluir con clamp la arteria cólica media para valorar la circulación colateral por la arcada de Drummond, y Thomas et al.20 solo usan la arteriografía preoperatoria en casos seleccionados de pacientes con claudicación intermitente, aneurismas aórticos o cirugías previas con posible daño de la vascularización cólica. Es probable que la TC de última generación, que permite hacer estudios vasculares, sustituya a la arteriografía como método menos invasivo.
En cuanto al ascenso de la plastia, este puede hacerse a través de una vía anterior o posterior, y en la literatura existen controversias sobre cuál es la ideal. La vía posterior es considerada clásicamente una vía más corta que la anterior20. Coral et al.23 estudiaron 50 cadáveres en los que tomaron como punto distal de medida el eje celiaco, y concluyeron que la vía anterior era 5,31cm más larga que la vía posterior. Sin embargo, Chen et al.24 estudiaron intraoperatoriamente la distancia de ambas vías en 60 pacientes, seleccionando como punto distal el anillo pilórico y encontraron que las distancias de la vía anterior y de la posterior eran de 32,7cm y 35,5cm respectivamente (p<0,001), concluyendo que la vía anterior es más corta que la vía posterior. Hu et al.25 llevaron a cabo otro estudio en 20 cadáveres y concluyeron que la vía posterior es más corta si el punto de medida distal considerado es el eje celiaco, lo cual es clínicamente irrelevante; pero si se considera la arteria gastroduodenal o el anillo pilórico como punto distal, la vía anterior es más corta que la posterior. Por otro lado, Thomas et al.20 en un análisis multivariable identificaron que la posición de la plastia en el mediastino posterior es el único predictor independiente de un buen resultado funcional. Nosotros utilizamos la vía anterior, ya que la anatomía del mediastino anterior no está modificada, no presenta fibrosis ni adherencias propias de una cirugía previa y nos permite una disección y técnica más precisas. Otras ventajas incluyen la facilidad y eficacia del drenaje en caso de fugas anastomóticas y la facilidad de reintervención en caso de estenosis no resueltas con dilataciones. Por último, el metanalisis de Urshel analizó los resultados en función del tipo de vía de reconstrucción y concluyó que los resultados postoperatorios en cuanto a las tasas de morbilidad y mortalidad no estaban significativamente asociados con la vía elegida, por lo que no existe superioridad de una sobre la otra26.
En cuanto a la morbilidad postoperatoria en este tipo de cirugía, destacamos tanto en nuestra serie como otras la alta incidencia de complicaciones respiratorias que, en su mayoría, se resolvieron con tratamiento médico (grado 1 y 2 de Clavien-Dindo)9,24. La necrosis de la plastia, considerada la complicación más grave, llega a ser del 9% en las series publicadas, destacando que en nuestra serie no tuvimos ningún caso. Posiblemente el uso mayoritario de la coloplastia junto a una vía de ascenso retroesternal ha podido influir en estos resultados.
Las principales complicaciones de esta cirugía a largo plazo son la disfagia, el reflujo, la aspiración y el retraso en el vaciamiento gástrico. Todas ellas alteran la calidad de vida de los pacientes. Young et al.27 valoraron la función digestiva de forma subjetiva con un cuestionario y de forma objetiva con el MOS SF-3610,11,28 en las reconstrucciones esofágicas de enfermedades benignas llegando a la conclusión de que los pacientes se mantienen libres de síntomas graves durante una media de 10 años y que el tipo de reconstrucción no afecta al resultado funcional ni a la calidad de vida. Grabowski et al.29 utilizando injertos de intestino delgado para reconstruir patología benigna de esófago encontraron hallazgos similares. Nuestros resultados son similares y la mayoría de nuestros pacientes aprenden a convivir con pequeños trastornos en la deglución que no les impiden hacer una vida normal.
Un aspecto negativo del estudio, que debe ser mencionado, es el limitado número de casos que en la práctica quirúrgica moderna se tratan con un manejo similar al expuesto: exclusión esofágica bipolar y reconstrucción diferida. Esto es debido, en parte, a que la mayoría de las complicaciones urgentes del esófago se resuelven con sutura simple o colocación de prótesis recubiertas y, salvo en los casos en que existe necrosis, esta situación es poco frecuente.
En conclusión, la reconstrucción esofágica diferida tras una cirugía urgente tiene una morbilidad importante con una mortalidad no despreciable. La coloplastia transversa, la vía retroesternal y la posibilidad de diferir la cirugía en espera de la mejoría del paciente permitieron obtener unos resultados similares al de otras series con plastia gástrica, incluso con acondicionamiento vascular previo. La dificultad técnica de esta cirugía y la elevada morbilidad postoperatoria de estos pacientes recomiendan su realización en centros altamente especializados, con especial dedicación y medios terapéuticos para tratar las complicaciones más frecuentes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.