La hernia incisional es una patología muy común cuya incidencia se estima en torno al 15-20% de todas las laparotomías. La evisceración es otro problema importante, con una incidencia menor (2,5-3%) pero con graves consecuencias para el paciente. Por todo ello, la prevención de ambas complicaciones surge como un objetivo fundamental para el tratamiento correcto de los pacientes, por la mejora de la calidad de vida y por el ahorro de costes que supondría.
Esta revisión narrativa pretende realizar una puesta al día en la prevención de la hernia incisional y la evisceración. Se analizan los criterios actuales para el cierre correcto de la pared abdominal, seguido de la posibilidad de añadir refuerzos protésicos en aquellos pacientes o casos que así lo requieran. Eventraciones especiales, como las originadas tras la inserción de trócares de laparoscopia o las secundarias a la realización de un estoma, se incluyen también en este trabajo.
Incisional hernias are a very common problem, with an estimated incidence around 15-20% of all laparotomies. Evisceration is another important problem, with a lower rate (2.5-3%) but severe consequences for patients. Prevention of both complications is an essential objective of correct patient treatment due to the improved quality of life and cost savings.
This narrative review intends to provide an update on incisional hernia and evisceration prevention. We analyze the current criteria for proper abdominal wall closure and the possibility to add prosthetic reinforcement in certain cases requiring it. Parastomal, trocar-site hernias and hernias developed after stoma closure are included in this review.
La hernia incisional (HI) es una de las patologías más comunes que se intervienen en un Servicio de Cirugía General. La incidencia de HI se sitúa en torno al 15-20%, pudiendo llegar al 50% en algunos contextos1. Esto supone un gran número de pacientes a tratar, con el elevado consumo de recursos correspondiente. Por ejemplo, en Estados Unidos se realizan dos millones de laparotomías cada año2, y se intervienen más de 100.000 hernias incisionales. Además, un porcentaje no despreciable pueden presentar complicaciones graves, como la incarceración, la estrangulación o la obstrucción intestinal que precisarán cirugía urgente. La evisceración es otro problema grave que puede surgir tras una laparotomía, con una incidencia aproximada del 2,5-3%3 pero con una mortalidad del 45% y una morbilidad elevadísima, cercana al 75%.
Todas las incisiones que se realizan para acceder a la cavidad abdominal, ya sean laparotomías medias o incisiones de introducción de trócares en los abordajes laparoscópicos, pueden potencialmente desarrollar una HI. Además, existen unos factores de riesgo bien conocidos4 que aumentan las posibilidades de que el paciente presente una HI, como son la obesidad, la cirugía urgente, el tabaquismo, los aneurismas de aorta abdominal o la aparición de infección de herida postoperatoria. Por todo ello, la prevención del desarrollo de la HI surge como un objetivo fundamental para el tratamiento correcto de los pacientes, por la mejora de la calidad de vida y por el ahorro de costes que supondría.
El objetivo de este trabajo es realizar una revisión narrativa de la prevención de la HI y de la evisceración. Primero se describen los aspectos relacionados con el cierre correcto de la pared abdominal seguido de la posibilidad de añadir refuerzos protésicos en aquellos pacientes o casos que así lo requieran. Eventraciones especiales, como las originadas tras la inserción de trócares de laparoscopia o las secundarias a la realización de un estoma, están también contempladas en este trabajo.
Cierre correcto de la pared abdominalLa tasa de HI en una laparotomía media se estima en torno al 15-20% (50% en algunos grupos de riesgo) y la tasa de evisceración en torno al 3%, por lo que supone un problema de primera magnitud1,3. En los últimos 20años se han publicado estudios clínicos, experimentales y metaanálisis para determinar cuáles eran los mejores materiales y métodos para el cierre de la pared abdominal1,5.
Las recomendaciones elaboradas a partir de estos estudios establecían que el cierre correcto debía realizarse con sutura continua, en un solo plano y con material de absorción lenta1,5. Además, otros estudios clínicos y experimentales6,7 han demostrado que para mayor efectividad de una sutura continua esta se debe realizar con una relación longitud de la sutura/longitud de la incisión (LS/LI) de 4:1 o superior, tal y como describió Jenkins6 y que se conoce en la literatura como «regla 4:1».
La relación LS/LI menor de 4:1 se ha mostrado como uno de los principales factores técnicos asociados a la aparición de HI, e incluso algunos autores recomiendan rehacer la sutura si no se cumple la proporción sutura/incisión adecuada7,8. Esta «regla» es sencilla de aplicar: solo se necesita una cinta métrica y unos cálculos muy simples8.
La siguiente evolución en el cierre de pared abdominal fue el cambio del calibre de la sutura y de la distancia entre sí de los puntos. En los estudios previos el cierre se realizaba con suturas de calibre grueso (0/1), separando los puntos entre sí 1cm y con una distancia al borde aponeurótico también de 1cm (llamada técnica de puntos o «bocados grandes» (large stitches o large bites), consiguiendo de esta manera la relación LS/LI mayor de 4:17. El grupo de Israelsson describe la realización del cierre con puntos más pequeños, separados entre sí 5mm y con una distancia al borde de 5-8mm, empleando un calibre de sutura menor (2/0) con aguja pequeña9. Con este cambio se asegura la consecución de la relación 4:1 o superior, y además se demuestra una menor incidencia de HI y una menor tasa de infección de herida que con la técnica de puntos grandes9. Esta técnica se ha denominado de «puntos pequeños» (short stitches) o de «pequeños bocados» (small bites).
Los resultados de este primer estudio9 se han confirmado en el ensayo STITCH10, en el que se compara el cierre con polidioxanona de lazo (loop) de calibre1 montado en aguja de 48mm, usando la técnica de puntos grandes, con polidioxanona de calibre 2/0 montada en aguja de 31mm siguiendo la técnica de puntos pequeños, encontrando una tasa significativamente menor de HI con esta última.
La European Hernia Society (EHS) ha elaborado unas Guías clínicas sobre el cierre de las incisiones en pared abdominal11 basadas en la metodología GRADE12. Las recomendaciones que aparecen en dichas guías son: 1)emplear incisiones fuera de la línea media (evidencia moderada y recomendación fuerte); 2)cierre de laparotomía media con sutura continua (evidencia baja y recomendación fuerte); 3)evitar el material de rápida absorción (evidencia moderada, recomendación fuerte); 4)uso de material monofilamento de absorción lenta (evidencia baja, recomendación débil); 5)sutura en una única capa, sin cerrar el peritoneo (evidencia baja y recomendación débil), y 6)utilizar la técnica de puntos pequeños (evidencia moderada, recomendación débil) con una LS/LI al menos de 4:1 (evidencia baja y recomendación débil)11.
A pesar de todo lo expuesto, existen aún interrogantes en la manera de proceder con el cierre de las incisiones en la pared abdominal, como son el cierre de la laparotomía en situaciones de urgencia, en ambientes contaminados, cómo cerrar las laparotomías fuera de la línea media, o el cierre en situaciones difíciles o en pacientes de riesgo.
En resumen, en el cierre de la pared abdominal tras una laparotomía media debe medirse la cantidad de hilo utilizado y su relación con la longitud de la incisión, asegurando como mínimo una relación de 4:18,11. Debería ser obligado comprobarlo y registrarlo en las hojas operatorias. La técnica de puntos pequeños con sutura continua monofilamento en un solo plano aponeurótico puede ser aconsejable en el cierre de la laparotomía media electiva11.
Empleo de mallas profilácticas de refuerzo en la prevención de hernias incisionalesA pesar de un cierre correcto de la pared abdominal siguiendo las recomendaciones antes expuestas, se ha publicado una revisión sistemática en la que se describe una tasa de HI del 12,8% con un seguimiento medio de casi 2años13. En pacientes con factores de riesgo y seguimientos más largos esta incidencia es aún mayor14. Dichos factores de riesgo incluyen habitualmente: obesidad, infección de herida quirúrgica, aneurisma de aorta y cirugía oncológica. Un estudio prospectivo realizado en Canadá en pacientes intervenidos de aneurisma de aorta abdominal mediante laparotomía media demostró una incidencia de HI del 69% tras un seguimiento de 5años15. En estudios realizados en pacientes operados de cáncer colorrectal se ha detectado una incidencia de hernias incisionales superior al 40% al analizar las exploraciones radiológicas (TAC) de seguimiento16,17.
Para evitar las altas tasas de HI, pese al apropiado cierre de la incisión, y sobre todo en pacientes de alto riesgo, se ha descrito el refuerzo del cierre de la pared abdominal con una prótesis11. Un factor muy importante de resistencia a la adopción generalizada de esta medida preventiva es el temor a la aparición de infecciones o de otras complicaciones relacionadas con el uso de prótesis18.
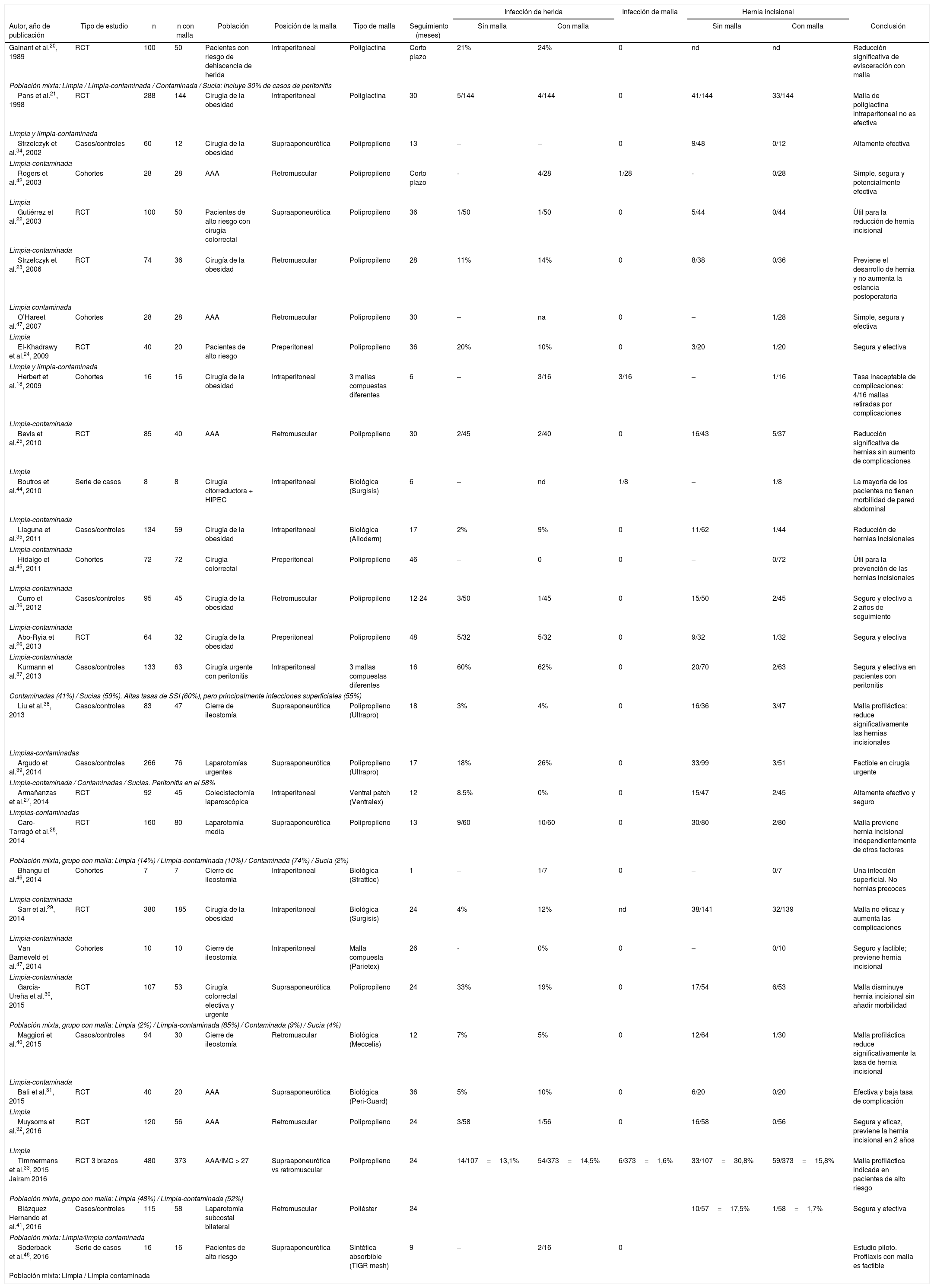
Métodos. Se ha revisado la evidencia publicada sobre el empleo de mallas profilácticas en diversos tipos de laparotomías (excluyendo las mallas profilácticas en hernia paraestomal) y la incidencia de complicaciones para los diferentes grados de contaminación de la herida quirúrgica según la clasificación de los Centers for Disease Control and Prevention (CDC)19. Para ello se realizó una búsqueda bibliográfica en las bases de datos Medline (PubMed), Scopus, Web Of Science (WOS) y Embase de los trabajos publicados hasta enero de 2017, con las palabras clave «prevención de hernia incisional», «profilaxis de hernia incisional», «malla profiláctica», «malla de refuerzo», «cierre de laparotomía», «infección de herida» y «malla infectada», utilizando los términos en lengua inglesa. En total se identificaron 30 estudios, incluyendo 14 ensayos clínicos aleatorizados20-33, 8 estudios de casos y controles34-41 y 8 estudios de cohortes o series de casos18,42-48.
En la tabla 1 se presenta un resumen de todos los datos disponibles relacionados específicamente con la incidencia de infecciones de herida y de complicaciones relacionadas con la prótesis. Además, se han extraído los resultados globales de tasa de HI. En los estudios analizados se han empleado mallas profilácticas diversas (sintética permanente, sintética absorbible o biológica), y la posición en la que se colocan también es variable (supraaponeurótica o retromuscular).
Resumen de la evidencia de la revisión de la literatura para estudios sobre mallas profilácticas de refuerzo
| Infección de herida | Infección de malla | Hernia incisional | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Autor, año de publicación | Tipo de estudio | n | n con malla | Población | Posición de la malla | Tipo de malla | Seguimiento (meses) | Sin malla | Con malla | Sin malla | Con malla | Conclusión | |
| Gainant et al.20, 1989 | RCT | 100 | 50 | Pacientes con riesgo de dehiscencia de herida | Intraperitoneal | Poliglactina | Corto plazo | 21% | 24% | 0 | nd | nd | Reducción significativa de evisceración con malla |
| Población mixta: Limpia / Limpia-contaminada / Contaminada / Sucia: incluye 30% de casos de peritonitis | |||||||||||||
| Pans et al.21, 1998 | RCT | 288 | 144 | Cirugía de la obesidad | Intraperitoneal | Poliglactina | 30 | 5/144 | 4/144 | 0 | 41/144 | 33/144 | Malla de poliglactina intraperitoneal no es efectiva |
| Limpia y limpia-contaminada | |||||||||||||
| Strzelczyk et al.34, 2002 | Casos/controles | 60 | 12 | Cirugía de la obesidad | Supraaponeurótica | Polipropileno | 13 | – | – | 0 | 9/48 | 0/12 | Altamente efectiva |
| Limpia-contaminada | |||||||||||||
| Rogers et al.42, 2003 | Cohortes | 28 | 28 | AAA | Retromuscular | Polipropileno | Corto plazo | - | 4/28 | 1/28 | - | 0/28 | Simple, segura y potencialmente efectiva |
| Limpia | |||||||||||||
| Gutiérrez et al.22, 2003 | RCT | 100 | 50 | Pacientes de alto riesgo con cirugía colorrectal | Supraaponeurótica | Polipropileno | 36 | 1/50 | 1/50 | 0 | 5/44 | 0/44 | Útil para la reducción de hernia incisional |
| Limpia-contaminada | |||||||||||||
| Strzelczyk et al.23, 2006 | RCT | 74 | 36 | Cirugía de la obesidad | Retromuscular | Polipropileno | 28 | 11% | 14% | 0 | 8/38 | 0/36 | Previene el desarrollo de hernia y no aumenta la estancia postoperatoria |
| Limpia contaminada | |||||||||||||
| O’Hareet al.47, 2007 | Cohortes | 28 | 28 | AAA | Retromuscular | Polipropileno | 30 | – | na | 0 | – | 1/28 | Simple, segura y efectiva |
| Limpia | |||||||||||||
| El-Khadrawy et al.24, 2009 | RCT | 40 | 20 | Pacientes de alto riesgo | Preperitoneal | Polipropileno | 36 | 20% | 10% | 0 | 3/20 | 1/20 | Segura y efectiva |
| Limpia y limpia-contaminada | |||||||||||||
| Herbert et al.18, 2009 | Cohortes | 16 | 16 | Cirugía de la obesidad | Intraperitoneal | 3 mallas compuestas diferentes | 6 | – | 3/16 | 3/16 | – | 1/16 | Tasa inaceptable de complicaciones: 4/16 mallas retiradas por complicaciones |
| Limpia-contaminada | |||||||||||||
| Bevis et al.25, 2010 | RCT | 85 | 40 | AAA | Retromuscular | Polipropileno | 30 | 2/45 | 2/40 | 0 | 16/43 | 5/37 | Reducción significativa de hernias sin aumento de complicaciones |
| Limpia | |||||||||||||
| Boutros et al.44, 2010 | Serie de casos | 8 | 8 | Cirugía citorreductora + HIPEC | Intraperitoneal | Biológica (Surgisis) | 6 | – | nd | 1/8 | – | 1/8 | La mayoría de los pacientes no tienen morbilidad de pared abdominal |
| Limpia-contaminada | |||||||||||||
| Llaguna et al.35, 2011 | Casos/controles | 134 | 59 | Cirugía de la obesidad | Intraperitoneal | Biológica (Alloderm) | 17 | 2% | 9% | 0 | 11/62 | 1/44 | Reducción de hernias incisionales |
| Limpia-contaminada | |||||||||||||
| Hidalgo et al.45, 2011 | Cohortes | 72 | 72 | Cirugía colorrectal | Preperitoneal | Polipropileno | 46 | – | 0 | 0 | – | 0/72 | Útil para la prevención de las hernias incisionales |
| Limpia-contaminada | |||||||||||||
| Curro et al.36, 2012 | Casos/controles | 95 | 45 | Cirugía de la obesidad | Retromuscular | Polipropileno | 12-24 | 3/50 | 1/45 | 0 | 15/50 | 2/45 | Seguro y efectivo a 2 años de seguimiento |
| Limpia-contaminada | |||||||||||||
| Abo-Ryia et al.26, 2013 | RCT | 64 | 32 | Cirugía de la obesidad | Preperitoneal | Polipropileno | 48 | 5/32 | 5/32 | 0 | 9/32 | 1/32 | Segura y efectiva |
| Limpia-contaminada | |||||||||||||
| Kurmann et al.37, 2013 | Casos/controles | 133 | 63 | Cirugía urgente con peritonitis | Intraperitoneal | 3 mallas compuestas diferentes | 16 | 60% | 62% | 0 | 20/70 | 2/63 | Segura y efectiva en pacientes con peritonitis |
| Contaminadas (41%) / Sucias (59%). Altas tasas de SSI (60%), pero principalmente infecciones superficiales (55%) | |||||||||||||
| Liu et al.38, 2013 | Casos/controles | 83 | 47 | Cierre de ileostomía | Supraaponeurótica | Polipropileno (Ultrapro) | 18 | 3% | 4% | 0 | 16/36 | 3/47 | Malla profiláctica: reduce significativamente las hernias incisionales |
| Limpias-contaminadas | |||||||||||||
| Argudo et al.39, 2014 | Casos/controles | 266 | 76 | Laparotomías urgentes | Supraaponeurótica | Polipropileno (Ultrapro) | 17 | 18% | 26% | 0 | 33/99 | 3/51 | Factible en cirugía urgente |
| Limpia-contaminada / Contaminadas / Sucias. Peritonitis en el 58% | |||||||||||||
| Armañanzas et al.27, 2014 | RCT | 92 | 45 | Colecistectomía laparoscópica | Intraperitoneal | Ventral patch (Ventralex) | 12 | 8.5% | 0% | 0 | 15/47 | 2/45 | Altamente efectivo y seguro |
| Limpias-contaminadas | |||||||||||||
| Caro-Tarragó et al.28, 2014 | RCT | 160 | 80 | Laparotomía media | Supraaponeurótica | Polipropileno | 13 | 9/60 | 10/60 | 0 | 30/80 | 2/80 | Malla previene hernia incisional independientemente de otros factores |
| Población mixta, grupo con malla: Limpia (14%) / Limpia-contaminada (10%) / Contaminada (74%) / Sucia (2%) | |||||||||||||
| Bhangu et al.46, 2014 | Cohortes | 7 | 7 | Cierre de ileostomía | Intraperitoneal | Biológica (Strattice) | 1 | – | 1/7 | 0 | – | 0/7 | Una infección superficial. No hernias precoces |
| Limpia-contaminada | |||||||||||||
| Sarr et al.29, 2014 | RCT | 380 | 185 | Cirugía de la obesidad | Intraperitoneal | Biológica (Surgisis) | 24 | 4% | 12% | nd | 38/141 | 32/139 | Malla no eficaz y aumenta las complicaciones |
| Limpia-contaminada | |||||||||||||
| Van Barneveld et al.47, 2014 | Cohortes | 10 | 10 | Cierre de ileostomía | Intraperitoneal | Malla compuesta (Parietex) | 26 | - | 0% | 0 | – | 0/10 | Seguro y factible; previene hernia incisional |
| Limpia-contaminada | |||||||||||||
| García-Ureña et al.30, 2015 | RCT | 107 | 53 | Cirugía colorrectal electiva y urgente | Supraaponeurótica | Polipropileno | 24 | 33% | 19% | 0 | 17/54 | 6/53 | Malla disminuye hernia incisional sin añadir morbilidad |
| Población mixta, grupo con malla: Limpia (2%) / Limpia-contaminada (85%) / Contaminada (9%) / Sucia (4%) | |||||||||||||
| Maggiori et al.40, 2015 | Casos/controles | 94 | 30 | Cierre de ileostomía | Retromuscular | Biológica (Meccelis) | 12 | 7% | 5% | 0 | 12/64 | 1/30 | Malla profiláctica reduce significativamente la tasa de hernia incisional |
| Limpia-contaminada | |||||||||||||
| Bali et al.31, 2015 | RCT | 40 | 20 | AAA | Supraaponeurótica | Biológica (Peri-Guard) | 36 | 5% | 10% | 0 | 6/20 | 0/20 | Efectiva y baja tasa de complicación |
| Limpia | |||||||||||||
| Muysoms et al.32, 2016 | RCT | 120 | 56 | AAA | Retromuscular | Polipropileno | 24 | 3/58 | 1/56 | 0 | 16/58 | 0/56 | Segura y eficaz, previene la hernia incisional en 2 años |
| Limpia | |||||||||||||
| Timmermans et al.33, 2015 Jairam 2016 | RCT 3 brazos | 480 | 373 | AAA/IMC > 27 | Supraaponeurótica vs retromuscular | Polipropileno | 24 | 14/107=13,1% | 54/373=14,5% | 6/373=1,6% | 33/107=30,8% | 59/373=15,8% | Malla profiláctica indicada en pacientes de alto riesgo |
| Población mixta, grupo con malla: Limpia (48%) / Limpia-contaminada (52%) | |||||||||||||
| Blázquez Hernando et al.41, 2016 | Casos/controles | 115 | 58 | Laparotomía subcostal bilateral | Retromuscular | Poliéster | 24 | 10/57=17,5% | 1/58=1,7% | Segura y efectiva | |||
| Población mixta: Limpia/limpia contaminada | |||||||||||||
| Soderback et al.48, 2016 | Serie de casos | 16 | 16 | Pacientes de alto riesgo | Supraaponeurótica | Sintética absorbible (TIGR mesh) | 9 | – | 2/16 | 0 | Estudio piloto. Profilaxis con malla es factible | ||
| Población mixta: Limpia / Limpia contaminada | |||||||||||||
AAA: aneurisma de aorta abdominal; HIPEC: hypertermic intraperitoneal chemotherapy; nd: no disponible; RCT: randomized controlled trial (ensayo clínico aleatorizado).
En el análisis global, el uso de malla profiláctica de refuerzo para prevenir las HI se ha reportado en 1.759 pacientes, con una tasa global de infección de herida del 12% y una tasa de infección de malla del 0,6%. La evidencia analizada indica que el procedimiento puede ser seguro y efectivo tanto en cirugía limpia como en limpia-contaminada. No hay suficiente evidencia disponible sobre su seguridad en cirugías contaminadas o sucias.
La limitación fundamental de este análisis es la calidad de los estudios incluidos, que es muy variable, ya que abarca desde grandes estudios multicéntricos aleatorizados a pequeñas series de casos, así como la diversidad de mallas empleadas y su posición de colocación. A pesar de las limitaciones de esta revisión, parece que las mallas profilácticas podrían potencialmente emplearse para prevenir HI en cirugía limpia y limpia-contaminada. La mayoría de los trabajos han empleado mallas sintéticas permanentes y algunos estudios han utilizado mallas biológicas o sintéticas absorbibles20,29,31,35,40,44,46,48. También hay que tener en cuenta que una malla sintética permanente es más barata que las sintéticas absorbibles o las biológicas49. Con respecto a la posición de la malla profiláctica, tanto la posición supraaponeurótica como la retromuscular parecen igualmente seguras y efectivas. Probablemente, la posición de la malla dependerá de la preferencia de cada cirujano.
Para identificar en qué grupo de pacientes de riesgo debe recomendarse una malla profiláctica son necesarios más estudios. Fischer et al.50 describen un modelo de riesgo preoperatorio que puede utilizarse para hacer una profilaxis dirigida, basado en una gran base de datos de pacientes, a partir de lo cual se calcula un score de riesgo que estratifica a los pacientes desde riesgo bajo a riesgo extremo. Estos modelos de riesgo podrían permitir la identificación de pacientes que pudieran beneficiarse más del empleo de malla profiláctica de refuerzo.
Prevención con prótesis de la hernia paraestomalLa incidencia de una hernia paraestomal (HP) en pacientes con un estoma intestinal puede oscilar dependiendo del tipo de estoma del que se trate. La HP asociada a una colostomía terminal puede fluctuar entre cifras del 4 hasta el 93%, según el diagnóstico sea clínico51 o radiológico52. Las cifras de HP asociadas a una ileostomía terminal se han descrito entre el 2 y el 28%53, y los porcentajes asociados a una ureteroileostomía (Bricker) pueden ser de hasta el 29%54. Algunos autores consideran la HP como la consecuencia «natural» de la realización de un estoma53. Las HP generan problemas importantes en la calidad de vida de los pacientes55, y en algunos casos necesitan cirugía urgente por complicaciones de las mismas. Además, la reparación de las HP se asocia con una alta tasa de recurrencia56.
Tras analizar la literatura existente sobre el empleo de mallas profilácticas en la construcción de los estomas para prevenir la HP57 y en relación a la colostomía terminal, la mayoría de los estudios publicados son observacionales y en ellos la técnica utilizada para la prevención de una HP tiene una serie de características comunes: a)el abordaje quirúrgico abierto con una técnica retromuscular de posicionamiento de la malla es el más común58-62; b)la mayoría de estudios realizan un orificio en el centro de la malla (keyhole) a través del cual se exterioriza el intestino59-61,63, y c)la mayoría utiliza una malla sintética plana no absorbible58-63. En todos estos estudios observacionales los resultados son positivos a favor del uso de una malla para prevenir una HP.
Por otro lado, en los ensayos clínicos aleatorizados (ECA) publicados el abordaje quirúrgico abierto con una técnica retromuscular de posicionamiento de la malla es el más utilizado64,65, y casi todos los estudios utilizan una malla sintética plana no absorbible64,65; la mayoría confeccionan un orificio en el centro de la misma (keyhole)63-65. También en los ECA los resultados son favorables al uso de una malla con indicación preventiva.
Se han publicado también varias revisiones sistemáticas o metaanálisis, algunas muy recientes, que concluyen de manera uniforme que una malla sintética no absorbible en posición retromuscular reduce la incidencia de HP sin un aumento en la morbilidad relacionada con la presencia de la prótesis66-68. El último metaanálisis publicado69 incluye una nueva metodología (trial sequential analysis) que controla el error tipo1 y calcula el tamaño de la información requerida para alcanzar conclusiones válidas. Los resultados muestran que la malla profiláctica reduce la incidencia de HP sin aumento de complicaciones, y puesto que se ha alcanzado el tamaño muestral requerido para demostrar el efecto de la intervención, puede que no se necesiten más ECA en este contexto.
En relación con la ileostomía terminal, hasta ahora no existen datos primarios en la literatura procedentes de trabajos específicamente diseñados para evaluar la eficacia de una malla en la prevención de una HP. Tan solo hay datos indirectos provenientes de estudios en los que se han incluido fundamentalmente pacientes con colostomías y unos pocos con ileostomía terminal70. Por ello no se puede extraer ninguna conclusión práctica sobre el valor de una estrategia preventiva con malla en estos casos.
Referente a la ureteroileostomía (Bricker), es muy poca la información de que se dispone en la literatura y solo se han encontrado dos estudios observacionales con escaso número de pacientes donde parece que la colocación de una malla con objetivo preventivo de una HP puede ser posible y segura71,72. Por ello no se pueden hacer recomendaciones prácticas en prevención en este tipo de estomas definitivos.
En resumen, existe evidencia de que la eficacia de una malla sintética no absorbible en posición retromuscular utilizando un abordaje abierto es útil en la prevención de una HP, durante la construcción de una colostomía terminal. Pero se necesitan más datos en la literatura que avalen de forma definitiva la utilidad de una malla preventiva con un abordaje laparoscópico, con el uso de otras mallas diferentes a las sintéticas no absorbibles y cuál es el perfil del paciente más adecuado o si es útil en las ileostomías terminales o en las ureteroileostomías (Bricker).
Prevención de hernias en los orificios de los trócaresActualmente, en el registro nacional de hernias incisionales (EVEREG) el 16% de los procedimientos registrados son hernias de trócar (HT)73. La incidencia de HT publicada se encuentra entre el 0,14 y el 22%, según las series74,75. La oscilación de esa incidencia puede obedecer a que muchas HT pueden permanecer asintomáticas, a que se desarrollen a largo plazo o simplemente a que no sean reportadas.
Con cifras altas de HT, su prevención es importante. Por ello, deben considerarse una serie de aspectos:
- a)
¿Es necesario cerrar todos los orificios de trócar? Según revisiones publicadas75, la recomendación es que se deben cerrar todos los orificios de trócares de 10mm o mayores, y en niños, incluso los de 5mm. Otra recomendación sería reducir al máximo el diámetro de los trócares que se utilizan, evitando el uso de trócares de más de 5mm, cosa que no siempre es posible, empleando trócares de 3mm y miniinstrumentos.
- b)
Acceso umbilical: Algún autor76 refiere que hasta el 18% de los pacientes intervenidos por laparoscopia presentan una hernia umbilical asociada. La recomendación es realizar la introducción del trócar a través del defecto herniario y repararlo con malla al finalizar la intervención.
- c)
Cirugía bariátrica. En estos pacientes inciden dos factores de riesgo: la propia obesidad y el uso de trócares de más de 10mm, por lo que su cierre debiera ser obligatorio. Algún estudio77 muestra que la incidencia de HT es muy baja con seguimientos a largo plazo, por lo que si se colocan los trócares de forma oblicua no sería necesario cerrarlos posteriormente. En cualquier caso, una recomendación prudente sería cerrar todos los orificios de trócar en la cirugía bariátrica, y de forma imprescindible cerrar aquellos orificios que se amplían para la extracción de pieza en la gastrectomía tubular.
- d)
¿Como debemos cerrar? Se han empleado multitud de dispositivos para facilitar el cierre de los orificios de trócar. Todos los estudios resaltan la necesidad de incluir la aponeurosis en el cierre78, pero no está establecida la importancia de incluir o no el peritoneo. A día de hoy, no está establecido el tipo de sutura más adecuado (i.e., sutura absorbible de larga duración o sutura irreabsorbible).
- e)
Uso de mallas profilácticas. Series cortas79 publican la experiencia inicial en colecistectomía laparoscópica, con una malla profiláctica de polipropileno titanizado introducida a través del trócar y fijada con cianoacrilato. Tras un seguimiento mínimo de 6meses no se identificaron HT. Otro autor80 describe una serie de pacientes en los que se utiliza un dispositivo bioabsorbible en el cierre del trócar umbilical, sin complicaciones y sin aparición de HT en el seguimiento a un año. Finalmente, un ECA con casi 50 pacientes en cada brazo que comparaba el cierre de trócar umbilical con sutura irreabsorbible con la colocación de una malla compuesta de polipropileno y ácido omega-3, en posición intraperitoneal, obtiene un 31,9% de HT en el grupo control y un 4,4% con el uso de malla, tras un año de seguimiento27. Los trabajos previos parecen indicar que el uso de mallas profilácticas puede disminuir la incidencia de HT, aunque se necesita más investigación en este campo.
La cirugía de puerto único parece tener una mayor incidencia de HT81, pero no se han publicado estudios específicos sobre cómo deben cerrarse estas incisiones o si se deben emplear prótesis preventivas en estos casos.
Prevención de la hernia incisional tras el cierre de un estoma temporalExisten diversas circunstancias que requieren el cierre de un estoma temporal: reconstrucción del tránsito intestinal tras un estoma de protección (ileostomía o colostomía) realizado en pacientes con anastomosis colorrectales bajas, restablecimiento de la continuidad intestinal tras una colostomía terminal ejecutada en situación urgente (por ejemplo, tras una diverticulitis aguda perforada) o reconstrucción tras ileostomía terminal en pacientes con enfermedad inflamatoria intestinal. La cirugía del cierre de estomas conlleva una elevada morbilidad, fundamentalmente derivada de los problemas anastomóticos, sobre todo dehiscencias, obstrucción intestinal, infección de herida o evisceración. Otra complicación, a menudo infraestimada, es el desarrollo de una HI en la cicatriz del cierre del estoma. En un metaanálisis reciente82, que incluye 34 estudios con 2.729 cierres de estoma, la incidencia global de hernia es del 7,4%, aunque con un amplio rango entre los estudios (0-48%). La heterogeneidad de los estudios, la duración del seguimiento y el tipo del mismo (clínico o radiológico) hacen difícil la interpretación y la aplicabilidad de los resultados. Así, si se eligen solo los estudios de mayor calidad en los que el objetivo de estudio es la incidencia de HI, ya sea detectada clínicamente o con métodos radiológicos, dicha incidencia alcanza el 30%. Esta revisión demuestra que la incidencia clínica de HI tras el cierre de un estoma es mayor de lo esperable y puede ser tan alta como para afectar a uno de cada tres pacientes. Otra revisión sistemática reciente83, que incluye 16 estudios y 1.613 pacientes, confirma estas conclusiones. Si además se utilizan métodos de diagnóstico por imagen, la incidencia es aún mayor52, llegando casi al 50%.
Cierre correcto de la pared abdominal tras una estoma temporalAsí como hay evidencia científica sobre cómo se debe cerrar una laparotomía media, no existe consenso84 sobre cuál es el mejor método de cierre de la pared tras la reversión de una estoma temporal: en dos planos fasciales o en un solo plano, sutura continua o puntos sueltos, sutura irreabsorbible o reabsorbible de larga duración. No existe un «patrón oro» al respecto, y cada cirujano realiza un cierre «personal» según su tradición quirúrgica. Solo existe consenso en cuanto al cierre cutáneo, y se considera que el cierre en bolsa de tabaco proporciona una menor incidencia de infección de herida85. Con esta ausencia de evidencias no pueden establecerse recomendaciones sobre cuál es el mejor método de cierre en este tipo de incisión. El sentido común nos hace pensar que si el cierre con sutura continua con material absorbible de larga duración o irreabsorbible siguiendo la regla 4:1 es el estándar oro actual en el cierre de la laparotomía media, podría ser también el estándar en el cierre de este tipo de incisiones.
Mallas profilácticas en el cierre de un estoma temporalLiu et al.38 publicaron en 2013 una revisión retrospectiva de 83 pacientes consecutivos no aleatorizados con cierre de ileostomía temporal mediante el cierre fascial primario con puntos sueltos de material reabsorbible de larga duración en todos los casos, y en 47 de ellos malla de polipropileno de refuerzo en posición supraaponeurótica. Tras una mediana de seguimiento de 18meses, con exploración física y TAC abdominal, la incidencia de HI en el grupo de malla fue del 6,4% y en el sin malla, del 36,1%, sin diferencias en la incidencia de infección de herida y sin necesidad de explante de malla en ningún caso.
Van Barneveld et al.47 publican un estudio sobre seguridad de la técnica en 10 pacientes con ileostomía de protección en cirugía de cáncer de recto, a los que se coloca una malla sintética (poliéster más colágeno, que permite el uso en contacto con las vísceras) en posición intraabdominal en el momento de la construcción del estoma, que se exterioriza a través de la misma. En la reversión del estoma, el defecto de la fascia y la malla se cierra con sutura continua de polipropileno o de PDS1. Tras una mediana de 26meses de seguimiento no se registraron HI tanto con exploración física como con ecografía.
Uno de los estudios más importantes (en fase de reclutamiento en la actualidad) es el estudio Reinforcement of Closure of Stoma Site (ROCSS)86 (ClinicalTrials.gov NCT02238964). Es un estudio aleatorizado multicéntrico, prospectivo, faseiii, que incluye 790 pacientes en dos grupos; en el grupo experimental se emplea una malla biológica (colágeno porcino sin cross-linking) en posición intraperitoneal fijada con suturas transfasciales, y tras ello se cierra la fascia por encima de la malla con sutura continua reabsorbible a largo plazo46. En el grupo control se permite el cierre de la incisión de la manera estándar habitual de cada cirujano, con el requisito obligatorio de no utilizar sutura reabsorbible de corta duración en el cierre de la fascia. El seguimiento tiene una duración prevista de 2años, con una evaluación clínica y con TAC al año y solo evaluación clínica a los 2años. Los resultados se esperan para finales de 2017.
Maggiori et al.40 publicaron en 2015 un estudio de casos y controles dirigido a evaluar la factibilidad y los potenciales beneficios de la colocación de una malla profiláctica de colágeno porcino en el cierre de una ileostomía temporal después de una cirugía de cáncer de recto. En el grupo de casos se incluyeron 30 pacientes consecutivos programados para cierre de ileostomía temporal y se seleccionaron 64 controles de la base de datos prospectiva del centro, apareados según edad, sexo, enfermedades asociadas, radioterapia y demora entre la cirugía inicial y el cierre del estoma. El cierre en todos los pacientes se realizó en dos planos: fascia posterior y anterior del músculo con sutura continua de poliglactina. En el grupo de la malla se colocó una malla de colágeno porcino sin cross-linking de 10×10cm en posición retromuscular, fijada con sutura de polipropileno. La piel se aproximó en todos los casos con una sutura en bolsa de tabaco. En el seguimiento a corto plazo no hubo diferencias en la incidencia de infección de herida (7% vs 5%). En el seguimiento a un año con TAC de control la incidencia de HI en el grupo con malla fue del 3%, y en el grupo control, del 16%.
Este estudio se ha utilizado como base en el diseño de un estudio aleatorizado de ámbito nacional en Francia (ClinicalTrials.gov NCT02576184)87 en el que el objetivo es evaluar a largo plazo la incidencia de HI después del cierre de una ileostomía temporal tras cirugía por cáncer de recto. Los pacientes se aleatorizan en tres grupos: sin malla, con malla sintética y con malla biológica. Las mallas se colocan en posición retromuscular, como en el estudio de casos y controles reseñado más arriba40. El estudio se inició en diciembre de 2015 y se esperan los resultados para diciembre de 2018.
Otro estudio en marcha es el ILEOCLOSE (ClinicalTrials.gov (NCT02226887), que tiene como objetivo evaluar la eficacia de la colocación de una malla absorbible (Gore-Bio A) a modo de sándwich durante el cierre de la ileostomía para prevenir el desarrollo de una HI88. El estudio está aún en fase de reclutamiento, por lo que no se pueden extraer resultados.
En conclusión, y en base a los pocos casos publicados, una prótesis preventiva en este contexto puede disminuir la incidencia de HI. El tipo de malla y en qué posición colocarla deberán esperar a los resultados que se publiquen cuando los ensayos clínicos activos concluyan.
ConclusiónEl gesto más importante en la prevención de la HI en las laparotomías medias es el cierre correcto de la pared abdominal, siguiendo la regla 4:1, utilizando una sutura de 2/0 de material absorbible de larga duración con la técnica de puntos pequeños o small bites. Las mallas profilácticas empleadas en pacientes de riesgo con laparotomías pueden disminuir la incidencia de HI de forma drástica, aunque el tipo de malla a emplear y su posición de colocación aún no están bien establecidos. En cuanto a las hernias paraestomales, el empleo de una malla profiláctica durante la creación del estoma puede disminuir la incidencia de HP y la mayoría de los estudios coinciden en el uso de mallas sintéticas permanentes colocadas en posición retromuscular. Para prevenir las hernias de trócar es necesario cerrar todos los orificios de trócares de 10mm o más, y parece que el empleo de mallas profilácticas en pacientes de riesgo puede disminuir la incidencia de HT. En cuanto a la prevención de las hernias desarrolladas tras la reversión de estomas temporales, parece que el uso de mallas profilácticas podría disminuir su incidencia, aunque los estudios actualmente en marcha nos podrán dar la respuesta próximamente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.