Introducción
Actualmente se emplean varias técnicas en el manejo del hiperparatiroidismo renal descompensado desde las propuestas de Ogg1: paratiroidectomia subtotal (STPT)2, paratiroidectomía total (TPT)3, TPT con autotrasplante cervical, TPT con autotrasplante muscular antebraquial4, TPT con autotrasplante subcutáneo-cutáneo en antebrazo5, abdominal6 o preesternal7,8 y TPT sin trasplante para pacientes de diálisis no candidatos para el trasplante renal3,9. Cada uno de estos procedimientos viene grabado por problemas evolutivos, tales como: disfunción, recidiva y sus riesgos reoperatorios10. No obstante, y para evitar estos problemas, el trasplante subcutáneo ha sido realizado en varios hospitales hasta ahora8,11. Se han descrito casos de recidiva antebraquial con infiltración muscular antebraquial que han requerido cirugía iterativa y con consecuencias graves en la función motriz antebraquial. La series publicadas hasta el momento actual son muy pequeñas y de corto seguimiento para poder extraer conclusiones determinantes10. Estos injertos se han realizado de forma subcutánea en el antebrazo y el abdomen o preesternal, aunque las dudas sobre la viabilidad del tejido trasplantado persisten. En un estudio previo hemos demostrado que este injerto subcutáneo paratiroideo es funcionalmente activo y la quinta semana es el momento adecuado para la comprobación de esta función11.
El presente estudio se propone demostrar si la secreción de paratirina intacta (iPTH) en el trasplante subcutáneo preesternal puede compararse favorablemente con los resultados informados para otras técnicas quirúrgicas utilizadas en el tratamiento del hiperparatiroidismo renal descompensado en pacientes en diálisis.
Las glándulas paratiroideas están rodeadas normalmente (entera o parcialmente) por tejido adiposo. Los injertos subcutáneos paratiroideos están así localizados en un ambiente normal. Por lo tanto, postulamos que los resultados a largo plazo del implante subcutáneo paratiroideo en pacientes urémicos debe ser, por lo menos, tan adecuado como su colocación intramuscular y sin el riesgo de las complicaciones evolutivas que éstos presentan.
Pacientes y metodo
Diseño ciego, abierto y prospectivo de una cohorte de pacientes en diálisis con indicación quirúrgica por hiperparatiroidismo renal descompensado en un centro universitario de referencia con unidad de cirugía endocrina, unidad especializada de bioquímica y unidad de diálisis. Entre enero de 2002 y diciembre de 2005, 35 pacientes (19 mujeres y 16 varones), con una edad media ± desviación estándar de 54,3 ± 7,4 años, atendidos en el Departamento de Nefrología del Hospital Donostia con el diagnóstico de RHP secundario a enfermedad renal crónica fueron incluidos en el estudio. Ningún paciente se ha perdido en el seguimiento. Un paciente falleció a los 16 meses por un infarto de miocardio.
Las concentraciones medias de calcio plasmático fueron levemente más altas que las normales en este grupo de pacientes. Se trató a los pacientes con el protocolo habitual de colecalciferol y medicación fijadora de fosfato. No recibieron compuestos con aluminio. Ninguno de los pacientes tenía diabetes. Todos los pacientes presentaban hiperparatiroidismo renal severo (iPTH > 500 pg/ml). Los criterios del laboratorio para el diagnóstico de RHP en estos pacientes fueron: hipercalcemia (10,76 ± 0,52 mg/dl; normal, 8,1-10,2 mg/dl) y concentraciones aumentadas de paratirina (1.245 ± 367,9 pg/ml) (rango, 493-2.160). Las concentraciones de creatinina preoperatoria fueron de 3,61 ± 2,34 (normal, 0,5-1,1) mg/dl. Excluimos a los pacientes en diálisis incluidos en programa de trasplante renal. El aumento de tamaño glandular fue comprobado mediante ultrasonografía en todos los casos y, de forma no sistemática, mediante gammagrafía con 99Tc-sestamibi o tomografía computarizada, datos no incluidos en el estudio.
La cirugía se realizó cuando el tratamiento profiláctico con suplementos de calcio y colecalciferol no resultó efectivo: hipercalcemia o concentraciones elevadas de fósforo en plasma. Los pacientes fueron sometidos a extirpación de todas las glándulas paratiroideas visibles e implantación subcutánea en región preesternal, tercio medio. El número exacto de glándulas extirpadas durante el procedimiento fue determinado por examen histopatológico. Aquellas que presentaban aspecto macroscópico de hiperplasia difusa se utilizaron de manera preferencial para ser injertadas. Se incluyó a todos los pacientes en un control aprobado por el Comité de Ética del Hospital y firmaron un consentimiento para el procedimiento. Los métodos implicados en el estudio no incrementaron la morbilidad ni el tiempo quirúrgico del procedimiento.
Todas las intervenciones fueron realizadas por el mismo equipo quirúrgico. Los pacientes ingresaron en el hospital el mismo día de la operación o el día antes. La cirugía se llevó a cabo con anestesia general e intubación orotraqueal. Se realizó una incisión de Kocher de 8 a 10 cm de largo a nivel cervical, 2 cm por encima de la horquilla esternal. Se resecaron las cuatro glándulas así como el timo. La determinación de iPTH intraoperatoria se empleó como indicador de la exéresis completa de tejido paratiroideo12, según criterios de descenso establecidos anteriormente13,14. En el Servicio de Anatomía Patológica se estudió, mediante congelación, tres glándulas y media, para demostrar su naturaleza, y después se las conservó en nitrógeno líquido para su uso eventual en el futuro. Tan pronto se notificó de los resultados, se obtuvo 20 fragmentos de 1 mm3 de la media glándula preservada.
La muestras de iPTH se obtuvieron de una vena periférica y se registró según el siguiente protocolo: primero, en la admisión al hospital y, tras cirugía, a las 24 h y al cabo de 1, 3, 5, 15, 30, 60, 100, 150 y 200 semanas después de la operación en los casos de mayor seguimiento. El seguimiento medio de la serie es de 1 año y 3 meses. De cada muestra se determinaron la iPTH, el calcio, el fósforo, el magnesio, la fosfatasa alcalina, las proteínas y la albúmina aunque no se los considera en el estudio actual. Los valores de iPTH fueron obtenidos en todos los pacientes mediante una técnica inmunorradiométrica, electroquimioluminiscente Elecsys® (In Roche). Para albúmina, proteínas, calcio, magnesio y fosfatasa alcalina se utilizó un analizador Corning (NY, Estados Unidos). La vida media de la iPTH es de unos 3-5 min15-17 y se observó una disminución a valores indetectables en todos casos a las 24 h18,19. Los valores de referencia para la PTH en nuestro laboratorio fueron de 20-65 pg/ml.
Los estudios histológicos fueron realizados por el mismo patólogo. Las características histológicas de las glándulas fueron definidas según los criterios establecidos por Akerström.
Se utilizó un análisis estadístico de regresión lineal para estudiar la relación entre los valores de iPTH en suero y la demora después de la operación. Los valores del análisis de datos de cada método se determinaron en cada intervalo de tiempo establecido y por lo tanto son dependientes del tiempo.
Resultados
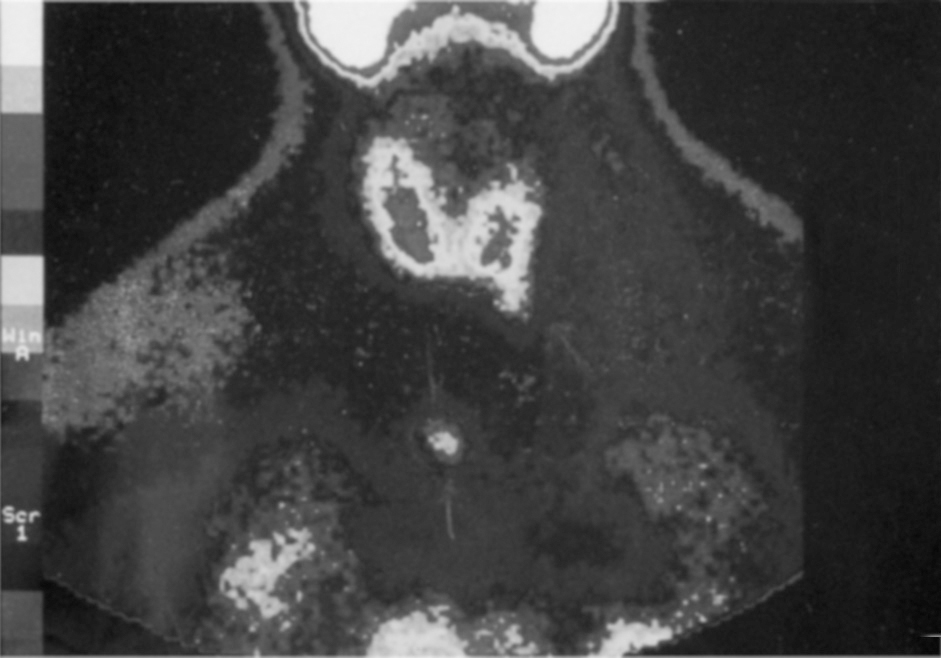
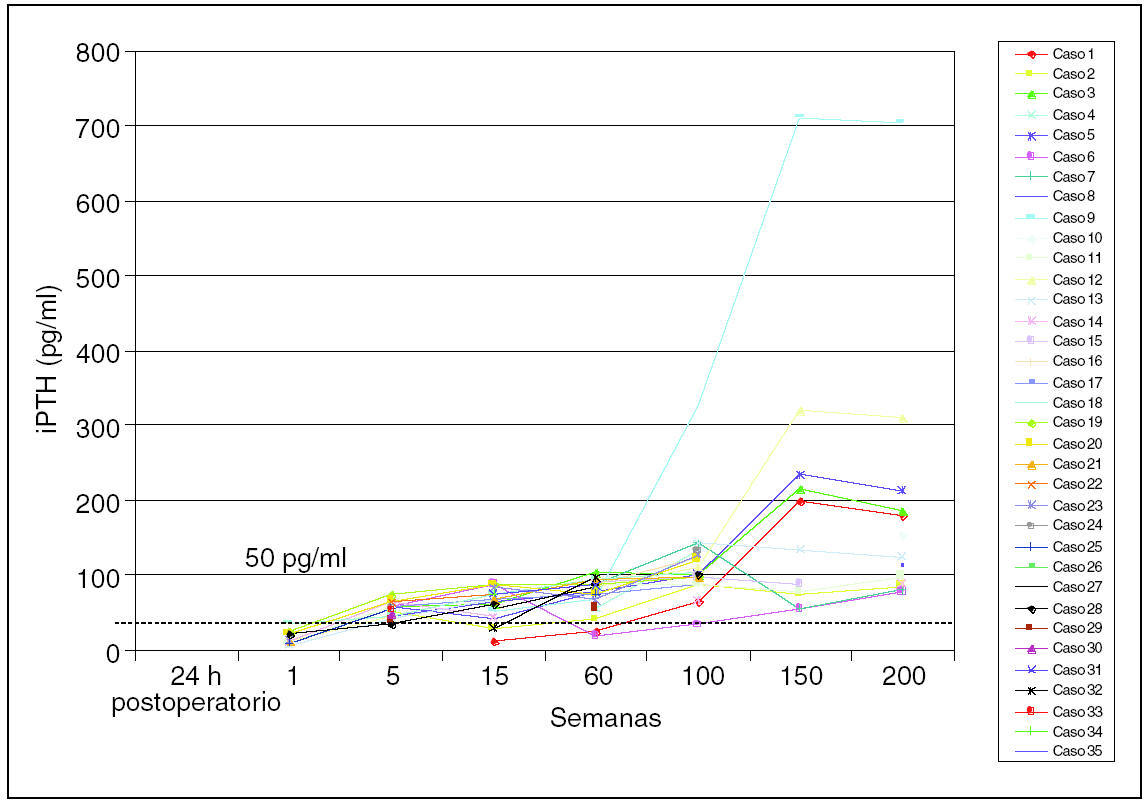
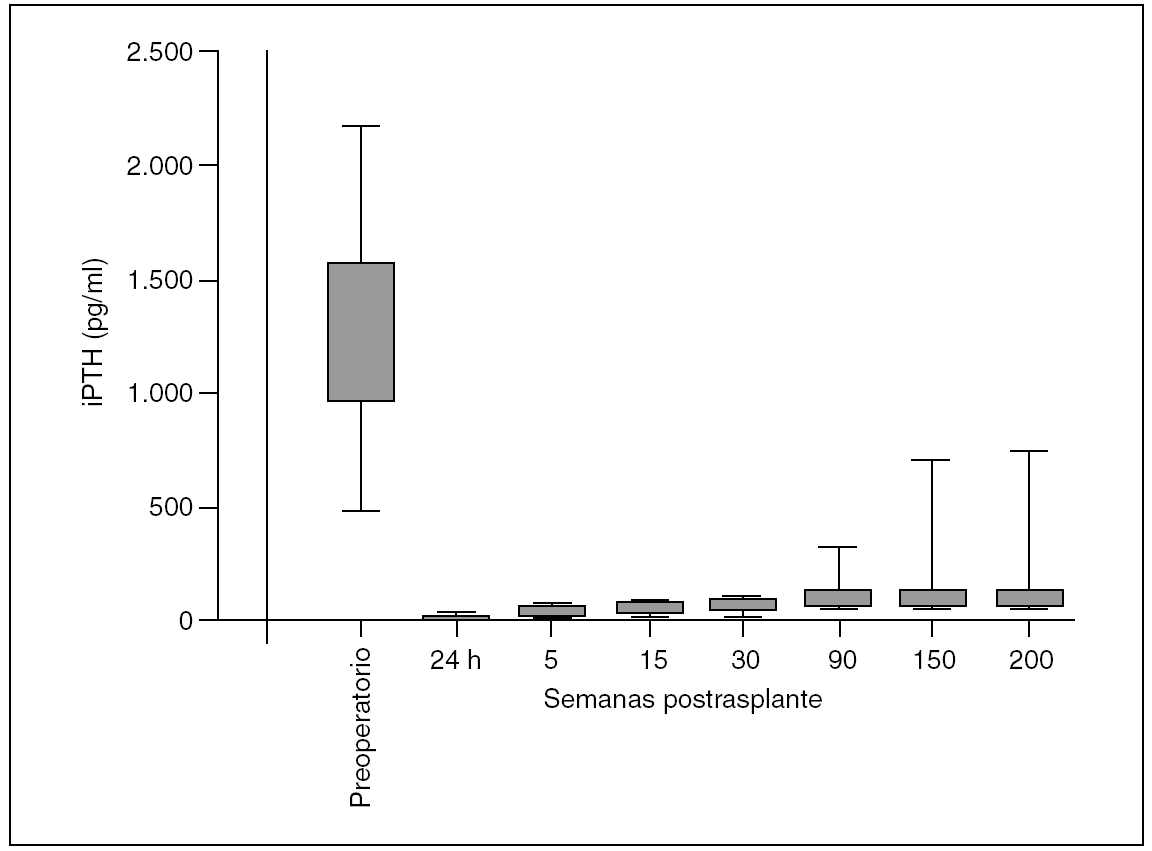
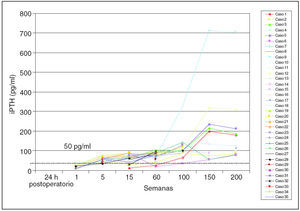
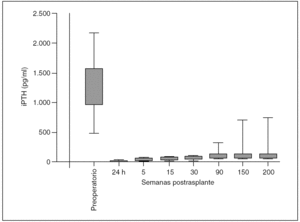
Procedimiento quirúrgico: se extirparon 4 glándulas a cada paciente. En esta serie no se observó ninguna glándula supernumeraria. El examen del timo quitado no demostró glándula adicional alguna. Los valores medios preoperatorios ± desviación estándar de iPTH fueron de 1.245 ± 367,9 (rango, 493-2.160) pg/ml. Después de la TPT y el SCPTx, las concentraciones de iPTH llegaron a ser indetectables en todos los casos a las 24 horas. Se estableció 50 pg/ml como criterio de función adecuada de injerto paratiroideo. Los valores obtenidos fueron: 15,54 ± 10,61 (rango, 6-44) pg/ml a la semana, 57,2 ± 1,9 (rango, 43-74) pg/ml a las 5 semanas, 64,21 ± 9,73 (rango, 11,3-89) pg/ml a las 15 semanas, 75,12 ± 9,05 (rango, 24,6-104,2) pg/ml a las 30 semanas, 101,63 ± 19,85 (rango, 65-143) pg/ml a las 60 semanas, 121,63 ± 27,85 (rango, 62-179) pg/ml a las 100 semanas, 63 ± 19,85 (rango, 68-723) pg/ml a las 150 semanas y 102 ± 18,65 (rango, 68-113) pg/ml a las 200 semanas. La quinta semana parece ser un momento adecuado para valorar la función del tejido trasplantado. La frecuencia de hipoparatiroidismo (cifras de iPTH en suero < 20 pg/ml con una concentración normal o baja de calcio en suero) fue 2/35 (5,71%) a la semana 60, recuperándose para la semana 100. La recidiva relacionada con el injerto (fig. 1) fue del 2,85% (1/35) (figs. 2 y 3).
Fig. 1. Exploración con 99Tc-mibi que demuestra hipercaptación preesternal.
Fig. 2. Determinación postoperatoria seriada de paratirina intacta (iPTH).
Fig. 3. Valores medios de paratirina intacta (iPTH).
Discusión
Los procedimientos comúnmente empleados para tratar actualmente el hiperparatiroidismo renal son: la paratiroidectomía subtotal20 y la paratiroidectomía total con trasplante muscular antebraquial. Con ambas técnicas, se deja una pequeña cantidad de tejido paratiroideo anormal en el paciente. Cuando el fallo renal crónico persiste después de la operación, este tejido glandular es estimulado continuamente y la situación de hiperparatiroidismo puede reaparecer en forma de recidiva, con las consecuencias locales y generales previsibles. Algunos autores abogan por la paratiroidectomía total sin injerto para prevenir estas recidivas. Consideran que la ausencia de PTH no tiene consecuencias clínicas significativas en pacientes en diálisis si es tratado con suplementos de calcio y colecalciferol adecuados15,20,21. Sin embargo, otros investigadores cuestionan estos plateamientos22-24.
Sigue sin precisarse la concentración ideal de PTH intacta en pacientes urémicos; algunos autores la valoran como adecuada entre los 75 y 175 pg/ml25-27. Consideramos que algún valor de PTH parece necesario, por lo que elegimos continuar nuestro programa de autotrasplante paratiroideo, pero en vez de colocar los fragmentos en tejido muscular, optamos por su colocación subcutánea y preesternal, donde pueden ser fácilmente localizados y extirpados en caso de necesidad con anestesia local28.
La extirpación de todo el tejido paratiroideo es esencial para la evaluación correcta de la función de estos injertos29,30. En el presente estudio, todos los pacientes fueron sometidos a exéresis de 4 glándulas paratiroideas, sin que hayamos observado ningún caso supernumerario en esta serie.
Las revisiones sobre este tema16,31, incluido un número importante de pacientes, recogen tasas de hipercalcemia de entre el 5,8 y el 6,6% tras paratiroidectomía subtotal y del 6,6 al 10,7% después de paratiroidectomía total y trasplante muscular17-19,32 y tasas de reintervención del 6 al 8% después de paratiroidectomía subtotal y del 5 al 15% después de paratiroidectomía total y autotrasplante intramuscular. Higgins et al21 observaron que después de 5 años se había extirpado el 30% de los injertos en pacientes en diálisis y que habían sido sometidos a una paratiroidectomía total y autotrasplante intramuscular; sin embargo, la serie incluye a pacientes a quienes se había extirpado menos de 4 glándulas en la exploración del cuello.
En un ensayo clínico clásico prospectivo y aleatorizado, Rothmund et al31 compararon 20 casos de paratiroidectomía subtotal con 20 casos de paratiroidectomía total y trasplante intramuscular antebraquial, con un seguimiento promedio de 40 meses. La hipercalcemia fue menos frecuente y ningún paciente necesitó reintervención después del último procedimiento33.
Otros investigadores resaltan la importancia de la calidad del tejido trasplantado en la valoración de los resultados finales34,35; al comparar la función de células de nódulos en la hiperplasia nodular con la misma función en caso de hiperplasia difusa, deducen que se debe evitar en lo posible la hiperplasia nodular como fuente de injerto, por un aumentado riesgo de recidiva. La visión macroscópica glandular parece suficiente para establecer este criterio y para la selección de la glándula previa al trasplante36. Gagné et al37 informaron que pacientes con hiperplasia nodular tuvieron tasas más altas de recidiva (definido como un valor de iPTH más alto que dos veces el límite normal superior) que los pacientes con hiperplasia difusa. Sin embargo, este hecho no ha sido apoyado por otros autores7. Kinnaert et al no demostraron una relación entre la función paratiroidea y la histología de las piezas quirúrgicas7,28. La tasa de reoperaciones fue la misma para ambos grupos y las concentraciones de iPTH no fueron significativamente más elevadas en los pacientes con hiperplasia nodular. El leve aumento observado podría explicarse realmente por un seguimiento más prolongado en comparación con pacientes con injertos procedentes de glándulas con hiperplasia difusa.
Otros autores25,38,39 han observado que una proporción significativa de pacientes urémicos tratados por cualquiera de los procedimientos presentaron pautas de diálisis muy variables y que podrían influir decisivamente en los resultados evolutivos finales. Ante la falta de consenso sobre los valores adecuados de PTH en pacientes en diálisis por fracaso renal crónico, el hipoparatiroidismo se ha definido arbitrariamente como un descenso de la PTH por debajo de los 20 pg/ml. En verdad, esta definición no incluye a todos los pacientes con una secreción de PTH insuficiente para mantener un recambio óseo normal, pero permiten una comparación con datos previamente publicados. La frecuencia de hipoparatiroidismo (PTH < 20 pg/ml) con una concentración normal o baja de calcio en suero) fue de 35/55 (100%) después de una semana, pero con recuperación hacia valores normales en todos los casos en la quinta semana, menos en un caso que se recuperó en la semana 60.
Las discrepancias informadas entre estudios comparativos pueden atribuirse sólo a diferencias en la técnica quirúrgica cuando la evolución de la función de los injertos paratiroideos depende de múltiples factores, por lo que el conocimiento y la aceptación por parte de los pacientes es de primordial importancia40.
En principio, en este estudio, ninguno de los pacientes urémicos había recibido medicación que contuviese aluminio. Este tipo de medicación ya no se utiliza en nuestra unidad de diálisis. Por lo tanto, no fue necesario estudiar las consecuencias de la intoxicación alumínica y la inhibición de la secreción paratiroidea38. Por otra parte, Berland et al41 encontraron que el contenido de aluminio de las glándulas paratiroideas fue similar a los depósitos de aluminio en hueso y solamente tenían valor significativo las concentraciones de aluminio plasmático. Asimismo, el hipoparatiroidismo se observó también en pacientes no expuestos al aluminio y tiende a ser más frecuente en mujeres, lo que puede indicar que otros factores, posiblemente técnicos, hormonales o ambos podrían ser causales de la función adecuada de los injertos.
El aumento lento pero progresivo de concentraciones de PTH en sangre con el tiempo indica que, en el futuro, algunos pacientes pueden requerir de la extirpación de los injertos trasplantados, como sucedió en uno de los casos por hiperparatiroidismo recurrente, en el que se procedió a la exéresis de 4/5 del injerto, con anestesia local, con normalización de los valores de PTH. El procedimiento es técnicamente más fácil en injertos de disposición preesternal subcutáneas.
En conclusión, los resultados a largo plazo de la paratiroidectomía total con autotrasplante subcutáneo preesternal demuestran viabilidad adecuada y función suficiente del injerto paratiroideo y se comparan favorablemente con datos publicados de otras formas de tratamiento quirúrgico de hiperparatiroidismo renal. Los resultados presentes justifican el uso adicional de este procedimiento. El seguimiento a largo plazo de esta serie puede confirmar, a su debido tiempo, la validez de esta hipótesis.
Correspondencia: Dr. M. Echenique Elizondo.
Universidad del País Vasco. Facultad de Medicina.
P.o Dr. Beguiristain, 105. 20014 San Sebastián (Guipúzcoa).
España.
Correo electrónico: gepecelm@sc.ehu.es
Manuscrito recibido el 19-2-2007 y aceptado el 29-5-2007.