Se calcula que un 50% de los tumores del estroma gastrointestinal están localizados en el momento de su diagnóstico. Hasta en el 95% de estos casos es posible efectuar una resección quirúrgica completa que se convierte en el factor pronóstico más importante. Esta cirugía debe cumplir una serie de requisitos técnicos para que sea realmente efectiva como que debe ser R0, sin rotura tumoral, con preservación de la pseudocápsula, etc. Si bien la mayoría de los tumores del estroma gastrointestinal son gástricos, su localización en otras zonas anatómicas como el esófago, duodeno o recto, obligan al cirujano al empleo de técnicas más complejas. La laparoscopia es cada vez más usada; sin embargo, debemos evitar su uso por grupos poco experimentados o en caso de tumores de gran tamaño. El empleo de la neoadyuvancia ha suscitado un gran interés al permitir resecar con cirugías poco agresivas tumores antes irresecables o en localizaciones anatómicas muy comprometidas. El empleo de la biopsia preoperatoria no esta exento de grandes riesgos de ahí que solo deba emplearse en caso de plantearse un tratamiento neoadyuvante o en caso de existir dudas diagnosticas con otras patologías en pacientes de alto riesgo.
It is estimated that 50% of GIST are located at the time of their diagnosis. A complete surgical resection can be performed in up to 95% of these cases, making this the most important prognostic factor. This surgery must fulfil a series of technical requirements so as to be really effective, as it has to be R0, with no tumour rupture, with preservation of the pseudo-capsule, etc. Although the majority of GIST are gastric, their location in other anatomical areas, such as the oesophagus, duodenum or rectum, require the surgeon to use more complex techniques. Laparoscopy is increasingly used; however, we must avoid its use, due to there being few experienced groups or if there are large tumours. The use of neoadjuvant therapy has revived great interest by allowing to resection tumours that were once non-resectable or in very compromised anatomical locations, with less aggressive surgery. The use of pre-surgical biopsy is not exempt from serious risks, thus it should only be used for establishing a neoadjuvant treatment or if there are diagnostic doubts with other diseases in high risk patients.
La cirugía es el arma terapéutica clave en el manejo del tumor del estroma gastrointestinal (GIST) primario localizado no metastásico. Diversas guías1,2 no solo insisten en este hecho sino que detallan una serie de características que esta cirugía debe reunir así como una serie de recomendaciones respecto de su empleo. Más aún, desde la completa caracterización de los tumores GIST, múltiples han sido las series publicadas. Todo esto haría a muchos pensar que el manejo quirúrgico de estos tumores está perfectamente definido. Nada más lejos de la realidad. Los tumores GIST siguen siendo tumores de historia natural poco conocida, especialmente cuando su tamaño es <2cm; el papel de la laparoscopia, no está del todo aclarado, como tampoco lo está el de la biopsia preoperatoria; y, finalmente, algunas localizaciones anatómicas dificultan la cirugía obligando a modificar notablemente la técnica.
El objetivo de esta revisión es el de detallar las principales limitaciones y controversias de la cirugía en el manejo del GIST primario localizado.
Objetivos y técnica quirúrgicaLos tumores GIST poseen una serie de características que facilitan su tratamiento quirúrgico1–3: son tumores que desarrollan metástasis a nivel hepático y peritoneal pero raramente a nivel linfático4, lo que hace innecesaria la linfadenectomía; poseen un crecimiento exofítico extraluminal, lo que los hace fácilmente localizables; y poseen un crecimiento expansivo, no infiltrativo, que limita las resecciones a efectuar. Sin embargo, son tumores frágiles y muy vascularizados, por lo que su manejo, al objeto de evitar su rotura, debe ser muy cuidadoso1–3.
El principal objetivo de la cirugía del GIST primario localizado es el de su resección1,3,4,8, pues esta, cuando es completa, es el factor pronóstico más importante, con tasas de supervivencia del 40–55% a 5 años3–7 (tabla 1).
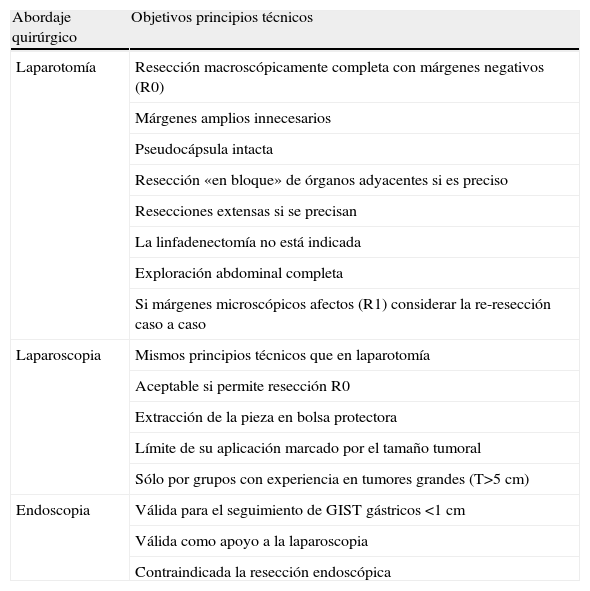
Consideraciones técnicas en la cirugía del GIST primario localizado. Tomado y modificado de Raut et al8.
| Abordaje quirúrgico | Objetivos principios técnicos |
| Laparotomía | Resección macroscópicamente completa con márgenes negativos (R0) |
| Márgenes amplios innecesarios | |
| Pseudocápsula intacta | |
| Resección «en bloque» de órganos adyacentes si es preciso | |
| Resecciones extensas si se precisan | |
| La linfadenectomía no está indicada | |
| Exploración abdominal completa | |
| Si márgenes microscópicos afectos (R1) considerar la re-resección caso a caso | |
| Laparoscopia | Mismos principios técnicos que en laparotomía |
| Aceptable si permite resección R0 | |
| Extracción de la pieza en bolsa protectora | |
| Límite de su aplicación marcado por el tamaño tumoral | |
| Sólo por grupos con experiencia en tumores grandes (T>5cm) | |
| Endoscopia | Válida para el seguimiento de GIST gástricos <1cm |
| Válida como apoyo a la laparoscopia | |
| Contraindicada la resección endoscópica |
En la mayoría de las ocasiones estas resecciones pueden efectuarse mediante resecciones muy limitadas de carácter segmentario o «en cuña» del foco tumoral (>65%), mientras que en otras ocasiones el cirujano se ve obligado a efectuar resecciones anatómicas más extensas, e incluso, resección de órganos adyacentes «en bloque»9. Se ha demostrado que la extensión o agresividad quirúrgica no se relaciona con la supervivencia de los enfermos10,11.
La resección de un GIST debe ser no disruptiva, esto es, debe preservar la pseudocápsula y no romper el tumor. La preservación de la pseudocápsula es clave para evitar dejar focos tumorales. De hecho, su rotura equivaldría a una resección R2, de ahí que no se recomiende la enucleación simple. Nishimura121,13 llega a comunicar una tasa de recurrencia local del 33% en tumores enucleados. Asimismo, la rotura tumoral también equivale a una resección R2, al reducir la supervivencia media de 46 meses a 17 meses13–17.
Al tratarse de tumores expansivos, con frecuencia nos los encontramos íntimamente adheridos a estructuras vecinas pero sin infiltrarlas. En estos casos la resección «en bloque» es mandatoria1–3.
Como hemos comentado, estos tumores raramente metastatizan vía linfática13,18–20, por lo que la linfadenectomía rutinaria es innecesaria, salvo si existe evidencia de afectación ganglionar grosera7. Sí que es precisa, y así lo recomiendan algunos autores, la peritonectomía local, con el objeto de eliminar un potencial sembrado tumoral peritoneal local6,13,15,21.
A estos aspectos técnicos específicos se suman otros de carácter más general, entre los que se incluyen la necesidad de efectuar una exploración abdominal completa a fin de descartar la presencia de metástasis peritoneales y/o hepáticas o a nivel de la transcavidad de los epiplones o el Douglas1,2.
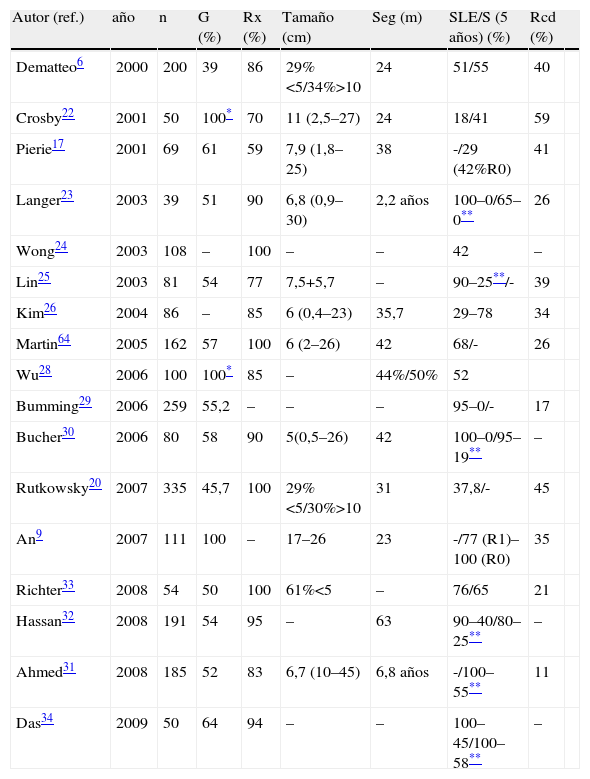
En la tabla 2 se exponen los resultados de las principales series publicadas6,9,17,20,22–34. Su análisis revela que son escasas las series con grandes números, y además de carácter retrospectivo; que incluyen tanto tumores primarios, como recurrencias locales, e incluso metástasis, dificultándose notablemente el análisis de los datos. Son escasísimas las series que incluyan GIST de localizaciones específicas, estando constituidas la mayoría de ellas a expensas de GIST gástricos9. Destacan unas altas tasas de resecabilidad (>80%) con bajas tasas de morbimortalidad, aunque desde el punto de vista oncológico existe una gran variabilidad intercentros debido a la diferente incidencia de factores de riesgo como su localización, índice mitótico, etc., o el empleo de imatinib.
Principales series quirúrgicas (n>50) desde el año 2000
| Autor (ref.) | año | n | G (%) | Rx (%) | Tamaño (cm) | Seg (m) | SLE/S (5 años) (%) | Rcd (%) | |
| Dematteo6 | 2000 | 200 | 39 | 86 | 29%<5/34%>10 | 24 | 51/55 | 40 | |
| Crosby22 | 2001 | 50 | 100* | 70 | 11 (2,5–27) | 24 | 18/41 | 59 | |
| Pierie17 | 2001 | 69 | 61 | 59 | 7,9 (1,8–25) | 38 | -/29 (42%R0) | 41 | |
| Langer23 | 2003 | 39 | 51 | 90 | 6,8 (0,9–30) | 2,2 años | 100–0/65–0** | 26 | |
| Wong24 | 2003 | 108 | – | 100 | – | – | 42 | – | |
| Lin25 | 2003 | 81 | 54 | 77 | 7,5+5,7 | – | 90–25**/- | 39 | |
| Kim26 | 2004 | 86 | – | 85 | 6 (0,4–23) | 35,7 | 29–78 | 34 | |
| Martin64 | 2005 | 162 | 57 | 100 | 6 (2–26) | 42 | 68/- | 26 | |
| Wu28 | 2006 | 100 | 100* | 85 | – | 44%/50% | 52 | ||
| Bumming29 | 2006 | 259 | 55,2 | – | – | – | 95–0/- | 17 | |
| Bucher30 | 2006 | 80 | 58 | 90 | 5(0,5–26) | 42 | 100–0/95–19** | – | |
| Rutkowsky20 | 2007 | 335 | 45,7 | 100 | 29%<5/30%>10 | 31 | 37,8/- | 45 | |
| An9 | 2007 | 111 | 100 | – | 17–26 | 23 | -/77 (R1)–100 (R0) | 35 | |
| Richter33 | 2008 | 54 | 50 | 100 | 61%<5 | – | 76/65 | 21 | |
| Hassan32 | 2008 | 191 | 54 | 95 | – | 63 | 90–40/80–25** | – | |
| Ahmed31 | 2008 | 185 | 52 | 83 | 6,7 (10–45) | 6,8 años | -/100–55** | 11 | |
| Das34 | 2009 | 50 | 64 | 94 | – | – | 100–45/100–58** | – |
G(%): porcentaje de casos gástricos; n: número de pacientes; ref: referencia bibliografica; Rcd: tasa de recidiva; Rx (%), porcentaje de enfermos resecados; S: supervivencia; Seg (m), seguimiento medio en meses; SLE: supervivencia libre de enfermedad.
A continuación vamos a describir de forma pormenorizada el papel de la cirugía en el manejo de los GIST según la localización del mismo.
EsófagoEs una localización muy infrecuente, habiéndose descrito solo 50 casos desde 1999 en la US National Cancer Database3. Más aún, los GIST esofágicos suponen solo el 1% de los 1.458 GIST de la base de datos del Surveillance Epidemiology and End Results35,36.
Los GIST esofágicos se confunden fácilmente con los leiomiomas; no existe una capa serosa que los cubra, de modo que el riesgo de rotura es extremadamente alto; y la resección esofágica es una técnica que comporta alta morbimortalidad. Estos hechos, unidos a la rareza de este tumor, complican enormemente su tratamiento quirúrgico3,36.
Blum et al36 analizan 4 casos, todos en esófago distal, argumentando a favor de la esofaguectomía frente a la enucleación para tumores grandes y aquellos cercanos a la unión gastroesofágica (UGE). En caso de tumores pequeños (<2cm) confinados en la pared esofágica en pacientes de alto riesgo podría efectuarse una resección local siempre y cuando se obtengan márgenes de resección negativos. Para este mismo autor, la dificultad del diagnóstico diferencial respecto de un leiomioma, y el diferente abordaje terapéutico de ambas entidades, obligan, a pesar de sus riesgos, a la biopsia preoperatoria mediante ecoendoscopia36. En contra de esta opinión, un reciente estudio37 sobre 7 pacientes argumenta a favor de la enucleación videotoracoscópica en tumores bien delimitados, de carácter benigno y <5cm, mientras que en tumores >5cm el autor recomienda la esofaguectomía como técnica de elección. A diferencia de Blum36 emplea el PET como método de diagnóstico diferencial entre leiomioma y GIST.
En resumen, la enucleación no es una opción terapéutica que podamos recomendar de forma generalizada salvo para grupos con gran experiencia37, debiéndose optar por la resección local en caso de tumores <2cm, siempre y cuando podamos asegurar una resección R0, o por una resección standard en tumores >2cm3,36.
EstómagoEs la localización más frecuente y con la que más experiencia se posee, disponiéndose de abundantes datos clínicos, patológicos y pronósticos1–3. En general la técnica quirúrgica empleada mayoritariamente es la resección «en cuña». Así, en una serie de 140 pacientes38,39, el 68% fue tratado mediante resecciones «en cuña», el 28% mediante gastrectomías parciales y solo un 4% precisó de una gastrectomía total. La mayoría de las series quirúrgicas no encuentras diferencias en términos de supervivencia a largo plazo entre las gastrectomías y las resecciones «en cuña»14,38–41.
Como hemos dicho, la resección «en cuña», frecuentemente vía laparoscópica, es la técnica más empleada1–3. Ocasionalmente, el cirujano puede encontrarse con tumores gástricos de gran tamaño íntimamente adheridos a estructuras vecinas, obligando a efectuar resecciones «en bloque» muy extensas y agresivas9,6,39,40. Como alternativa, se ha planteado la posibilidad de un tratamiento neoadyuvante que reduzca el tamaño tumoral y con ello la extensión de la cirugía42.
DuodenoSuponen el 4,5% de todos los GIST43,44 y suelen localizarse en la 2.a porción duodenal45.
Se describen 3 técnicas quirúrgicas basicas: la excisión local «en cuña» con cierre duodenal primario; la resección duodenal segmentaria más duodenoyeyunostomía; y la duodenopancreatectomía cefálica (DPC)44. En una revisión de Miettinen45, el 45% de los casos se trató mediante una excisión local, un 20% se trató mediante una DPC, y el 20% restante mediante una resección segmentaria. En las series publicadas, entre un 20–80% de los pacientes son tratados mediante una DPC45–48. Si consideramos que solo un 30% de estos GIST posen un alto riesgo de recidiva y que la DPC es un procedimiento de alta morbimortalidad, se plantea la posibilidad del sobretratamiento44.
La elección de cualquiera de estas técnicas dependerá de su valor oncológico, del tamaño tumoral y la distancia a la que se encuentra el tumor de la ampolla de Vater, así como de su relación con la cara pancreática duodenal43–49. La resección local «en cuña», si bien, técnicamente posible en tumores duodenales de pequeño tamaño, parece inferior oncológicamente a la resección segmentaria al comunicarse un mayor número de recurrencias locales14. Sin embargo, las tasas de supervivencia y recidiva entre DPC y resección segmentaría son comparables48,50–52. Estos datos favorecen el empleo de la resección segmentaria, pues es mejor oncológicamente que la excisión local sin la morbimortalidad de la DPC44. En este sentido, algunos autores efectúan resecciones segmentarias incluso en tumores adyacentes a la papila de Vater49 con diversas modificaciones técnicas, muy complejas y no exentas de complicaciones a fin de evitar la estenosis de la papila3,44,50,53,54.
Por regla general y en tumores de muy pequeño tamaño (<1cm) y a más de 2cm de la ampolla, es posible emplear una excisión «en cuña»3,50; mientras que los tumores grandes (>3cm) localizados en la 3.a–4.a porción duodenal se tratarán mediante resecciones segmentarias3,54. La DPC quedaría reservada para tumores periampulares o de tamaño >3cm localizados en la 1.a–2.a porción duodenal en donde sea imposible técnicamente una resección segmentaria. Serán las preferencias y experiencia de cada cirujano conjuntamente con los factores locales, las que marcarán la técnica emplear3.
Intestino delgadoEs la segunda localización por orden de frecuencia, La técnica de elección es la resección segmentaria mas anastomosis término terminal sin linfadenectomía3. En localizaciones especiales como en el caso del ángulo de Treizt, es preferible la resección seguida de duodenoyeyunostomía3. Los tumores pequeños yeyunoileales plantean el problema de su localización. Para ello se recomienda el empleo de la endoscopia de doble balón pues permite su localización mediante tatuaje preoperatorio y diagnóstico diferencial respecto del linfoma mediante biopsia3,55–59. En caso de tumores grandes (>5cm) o cercanos al Treizt es preferible el abordaje abierto.
Una alta proporción de estos tumores suele invadir órganos adyacentes, lo que obliga a resecciones extensas22. Más aún, y dado su crecimiento exofítico con afectación de la serosa, existe un alto potencial de diseminación tumoral peritoneal. Esto explica las altas tasas de metástasis peritoneales que estos enfermos desarrollan a medio plazo (41–66%)22,6,60. De hecho, se considera a estos tumores como de mal pronóstico3,61–66, con una tasa de mortalidad relacionada con el tumor del 39%3,67.
ColonMuy infrecuentes (<5% del total)3,68, la técnica de elección es la colectomía segmentaria sin linfadenectomía3. Estos tumores poseen una extraordinaria malignidad, calculándose que hasta el 70% de estos GIST son malignos3,69,70. Una reciente publicación del Memorial Sloan Ketering Cancer Center3,63 calcula para estos tumores una tasa de supervivencia libre de enfermedad de solo el 20% a 6 años3.
RectoEs la tercera localización en orden de frecuencia3,71. Debido a su localización, se asocian a una elevada tasa de resecciones incompletas (R1), que alcanzan en algunas series, como la del MSKCC, hasta el 38% de los casos3,63,72.
La técnica de elección dependerá del tamaño tumoral y su localización71–74. La técnica más habitual es la resección anterior sin excisión del mesorecto al no existir afectación ganglionar, lo que no solo facilita la técnica si no que evita un potencial daño al sistema nerviosos autonómico de la región. En tumores pequeños de <3cm con escaso crecimiento extrarectal se puede optar por la excisión transanal3,75, mientras que si el tumor es grande (>5cm) y posee un importante componente extraluminal anterior o posterior se recomienda el abordaje trans-sacro de Kraske3,76,77 o el transvaginal3,78. En tumores de mayor tamaño y localización distal, la amputación abdominoperineal de Miles es la técnica de elección3.
En un intento de hacer técnicamente resecable un tumor, efectuar una cirugía menos agresiva con menor morbimortalidad, especialmente con el ánimo de preservar esfínteres, se ha explorado el potencial papel de la neoadyuvancia con imatinib previa a cirugía79–83. La bibliografía disponible está compuesta en su mayoría de casos sueltos y muy escasas series de casos84. Destaca la serie de Haller85 que comunica su experiencia con 10 GIST rectales, de los que 6 eran localmente avanzados y 4 rectales bajos. En todos los casos se consiguió una resección R0, no siendo preciso el empleo de colostomía en ningún caso. La mayoría de los autores reseñan que la neoadyuvancia incrementa la resecabilidad tumoral y la posibilidad de preservación de órganos, gracias a una disminución del tamaño tumoral84.
GIST epiploicos, mesentéricos o adheridos a órganos vecinosEn estos casos debe considerarse, no una cirugía limitada, si no una resección «en bloque» de toda la enfermedad visible y de todas las estructuras involucradas2,13,20,86. Lógicamente, se trata de una cirugía muy compleja asociada a una importante morbimortalidad que debe valorarse respecto de su beneficio oncológico13,87.
Principales controversiasPapel de la neoadyuvanciaUna de las grandes limitaciones del tratamiento quirúrgico del GIST primario viene dada por su presentación en localizaciones anatómicamente «difíciles» o por la presencia de tumores de gran tamaño. Cuatro son los factores que determinan la aplicabilidad de la neoadyuvancia1,42: capacidad de lograr la resecabilidad tumoral; disminuir la extensión necesaria de la cirugía para lograr una resección R0; mejorar el resultado funcional esperado; y disminuir el riesgo de rotura tumoral.
Los tumores esofágicos precisan de una cirugía de alto riesgo peri operatorio, y si bien la neoadyuvancia no va a modificar la técnica, si va a lograr reducir sus riesgos al endurecer el tumor y disminuir el riesgo de rotura y sembrado tumoral42. Los GIST duodenales pueden beneficiarse de una reducción del tamaño tumoral al permitir resecciones duodenales limitadas42. En el caso de GIST gástricos de gran tamaño suele ser necesario el empleo de resecciones masivas «en bloque». La neoadyuvancia podría facilitar el empleo de resecciones gástricas más limitadas42. Donde sí vamos a lograr un cambio en el abordaje técnico es en los tumores rectales, pues una reducción tumoral puede facilitar una cirugía preservadora de esfínteres42. En cuanto se refiere al riesgo de rotura tumoral, factores como la hipervascularidad, la presencia de áreas quísticas intratumorales o tumores de gran tamaño se asocian con un alto riesgo de rotura y diseminación celular neoplásica. En estos casos, la neoadyuvancia reduce el riesgo de rotura de forma muy notable3,42,89.
Todas estas recomendaciones hay que tomarlas con cautela al basarse en datos proporcionados por series con un escaso número de pacientes y realizados por grupos con gran experiencia. Más aún, esta actitud no está exenta de riesgos, fundamentalmente el de «perder» al enfermo en un intento de reducir el tamaño tumoral y que este no responda haciéndose irresecable. Es por esto que nuestra recomendación, al igual que la guía GEIS, sea la de remitir estos enfermos a centros con experiencia, en el contexto de estudios bien diseñados de carácter prospectivo88.
Papel de la laparoscopiaEl papel de la laparoscopia en se ha visto facilitado porque estos tumores son de frecuente localización gástrica, lo que los hace técnicamente muy accesibles; porque son de fácil localización al poseer un crecimiento exofítico; y porque no precisan de linfadenectomía1–3. Sin embargo, su aplicación presenta 3 grandes controversias: 1) el manejo de tumores >2cm; 2) la localización y tratamiento de tumores intraluminales submucosos90–92, y 3) y la resección de tumores localizados en la UGE, antro píloro y cara posterior gástrica90.
Inicialmente la guía de la NCCN de 200486 limitaba el empleo de la laparoscopia a tumores gástricos <2cm debido al alto riesgo de sembrado tumoral por manipulación y rotura tumoral. Diversas publicaciones obligaron a re-evaluar estas recomendaciones. Así Novitsky93, en una serie de 50 casos resecados vía laparoscópica y con un tamaño medio de 4,4cm (tabla 2), no evidencia diferencias en términos de recurrencias o eficacia respecto de una serie abierta histórica. Este autor, así como otros13,94–96 sugierieron que las indicaciones de la NCCN deberían expandirse pues estaban dirigidas a evitar el uso de la laparoscopia por grupos inexpertos en un intento de evitar un incremento en la tasa de rotura tumoral intraoperatoria. Otani10, en base a sus resultados, considera que en tumores de 2–5cm o tumores <2cm pero en crecimiento deben tratarse mediante laparoscopia pura, mientras que los tumores >5cm localizados cerca del píloro o el cardias serian ideales para laparoscopia asistida con la mano97. Estos resultados, así como otros, han hecho que en la guía de la NCCN de 20071 se recomiende la cirugía laparoscópica en tumores de hasta 5cm, mientras que aquellos con diámetros mayores seria subsidiarios de una laparoscopia asistida. De nuevo, las limitaciones impuestas en caso de tamaños >5cm tiene su base en que estos tumores son más frágiles, más vascularizados, con mayor componente necrótico, todo lo que los hace más frágiles, y, además, con una pseudocápsula mayor y una mayor probabilidad de que estén adheridos a estructuras vecinas13,93. Por ello, solo aquello centros con gran experiencia en cirugía laparoscópica deberían resecar GIST de gran tamaño. En cualquier otra circunstancia, la conversión a cirugía abierta es mandatoria13,93,98,99. En este sentido, los principales factores asociados con la conversión son: tumores localizados en la UGE, invasión local de órganos adyacentes, asociación con otras lesiones tumorales, perforación tumoral preoperatoria, adherencias intensas y tamaño tumoral grande7,12.
En pequeñas lesiones submucosas o de crecimiento intraluminal podría plantearse la resección endoscópica. Sin embargo, la alta tasa de perforaciones y de bordes afectos (R1) obliga a replantear esta indicación100. En estos casos es preferible el abordaje combinado laparoendoscópico, que se indica, sobre todo, en lesiones de la cara anterior gástrica. El uso de la endoscopia intraoperatoria permite la identificación del tumor, facilita su resección y permite el control y chequeo de la línea de sutura90. Así, en algunas series90, la localización tumoral laparoscópica solo pudo hacerse en el 23% de los casos, mientras que cuando se hizo conjuntamente con la endoscopia, se localizaron el 99% de las lesiones41,90,101–106. Por otra parte la endoscopia permite mejorar la exposición tumoral, ayudando al cirujano en la decisión sobre qué técnica de resección emplear; mejorar, gracias a una mejor visión, la colocación de la línea de grapas, evitando con ello la estenosis de la luz gástrica; y verificar la completa excisión tumoral90,107–109. En caso de GIST de localización posterior, es posible emplear el abordaje transgástrico90,93,97, también asistido por abordaje combinado laparoendoscópico o asistido con la mano10,93.
La UGE y el antro píloro plantean problemas técnicos específicos, pues a este nivel la resección «en cuña» laparoscópica posee110,111 un alto riesgo de estenosis112,113, por lo que muchos centros consideran el abordaje mediante laparotomía como standard3,45,113,114. Recientemente se ha comunicado la posibilidad de un abordaje combinado laparoendoscópico, especialmente para tumores de <3cm y llevado a cabo por grupos muy experimentados115,116. En otras ocasiones, especialmente en caso de tumores grandes, son precisas gastrectomías parciales117,118 e incluso resecciones más extensas3. El antro prepilórico plantea problemas técnicos similares, y si bien en tumores <3cm es posible la resección laparoscópica, en tumores de >3cm es preferible una gastrectomía distal, abierta o laparoscópica, mientras que en tumores de >10cm es preferible un abordaje abierto de entrada3.
El abordaje laparoscópico de los GIST debe seguir los principios oncológicos antes descritos para la cirugía abierta1,119, siendo, en general, la resección «en cuña» la opción técnica preferida6,39,93,120–122. Como consideración especial reseñar que la extracción del tumor debe hacerse en bolsa protectora para evitar implantes en puertos de entrada de los trócares; y que es muy importante el orientar la línea de grapado longitudinalmente al eje gástrico para evitar la estenosis de la luz3,107.
Por supuesto, nunca debe aceptarse un abordaje laparoscópico potencialmente R1 si el abordaje abierto garantizaría una resección R08. Si bien la mayoría de los GIST son gástricos y de fácil localización, no ocurre lo mismo en el caso de tumores de pequeño tamaño o localizados en intestino delgado. En estos casos es precisa su localización preoperatoria mediante tatuaje endoscópico97, o intraoperatoria mediante endoscopia o eco laparoscopia.
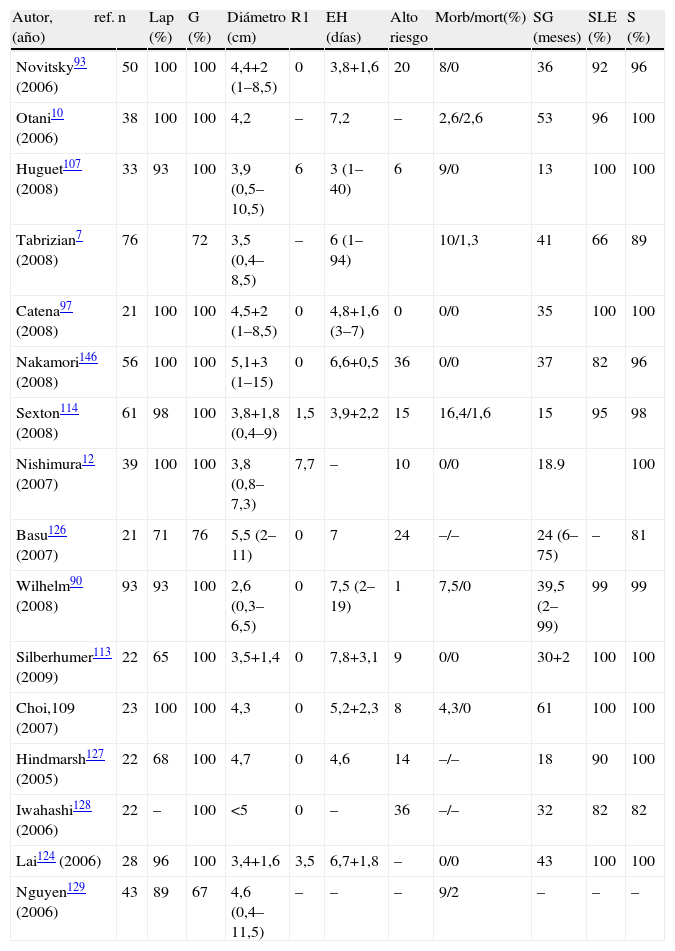
En el análisis de la literatura disponible (tabla 3) destaca que de las series analizadas, todas menos una97,123 operan tumores >2cm, con rangos que oscilan entre 1–7,5cm97. Este abordaje posee unas tasas de recurrencia similares o inferiores a las de la cirugía abierta, con bajas tasas de conversión (0–3,4%)7,110,114,124, aunque algunos autores llegan a comunicar tasas del 14,5%7. Por otra parte la morbimortalidad es mínima, la estancia hospitalaria muy reducida, y no se observan problemas relacionados con la herida quirúrgica. Hemos de señalar que no existen estudios prospectivos randomizados que comparen cirugía abierta vs laparoscópica114,125, disponiéndose solo de estudios comparativos respecto de series por vía abierta históricas. De todas formas estos resultados deben ser valorados con cautela: estas series se centran en GIST gástricos, de mejor pronóstico que los extragástricos, existiendo además un sesgo de selección hacia enfermos «mejores»93.
Principales series (n>20) de GIST resecados vía laparoscópica desde el año 2005
| Autor, ref. (año) | n | Lap (%) | G (%) | Diámetro (cm) | R1 | EH (días) | Alto riesgo | Morb/mort(%) | SG (meses) | SLE (%) | S (%) |
| Novitsky93 (2006) | 50 | 100 | 100 | 4,4+2 (1–8,5) | 0 | 3,8+1,6 | 20 | 8/0 | 36 | 92 | 96 |
| Otani10 (2006) | 38 | 100 | 100 | 4,2 | – | 7,2 | – | 2,6/2,6 | 53 | 96 | 100 |
| Huguet107 (2008) | 33 | 93 | 100 | 3,9 (0,5–10,5) | 6 | 3 (1–40) | 6 | 9/0 | 13 | 100 | 100 |
| Tabrizian7 (2008) | 76 | 72 | 3,5 (0,4–8,5) | – | 6 (1–94) | 10/1,3 | 41 | 66 | 89 | ||
| Catena97 (2008) | 21 | 100 | 100 | 4,5+2 (1–8,5) | 0 | 4,8+1,6 (3–7) | 0 | 0/0 | 35 | 100 | 100 |
| Nakamori146 (2008) | 56 | 100 | 100 | 5,1+3 (1–15) | 0 | 6,6+0,5 | 36 | 0/0 | 37 | 82 | 96 |
| Sexton114 (2008) | 61 | 98 | 100 | 3,8+1,8 (0,4–9) | 1,5 | 3,9+2,2 | 15 | 16,4/1,6 | 15 | 95 | 98 |
| Nishimura12 (2007) | 39 | 100 | 100 | 3,8 (0,8–7,3) | 7,7 | – | 10 | 0/0 | 18.9 | 100 | |
| Basu126 (2007) | 21 | 71 | 76 | 5,5 (2–11) | 0 | 7 | 24 | –/– | 24 (6–75) | – | 81 |
| Wilhelm90 (2008) | 93 | 93 | 100 | 2,6 (0,3–6,5) | 0 | 7,5 (2–19) | 1 | 7,5/0 | 39,5 (2–99) | 99 | 99 |
| Silberhumer113 (2009) | 22 | 65 | 100 | 3,5+1,4 | 0 | 7,8+3,1 | 9 | 0/0 | 30+2 | 100 | 100 |
| Choi,109 (2007) | 23 | 100 | 100 | 4,3 | 0 | 5,2+2,3 | 8 | 4,3/0 | 61 | 100 | 100 |
| Hindmarsh127 (2005) | 22 | 68 | 100 | 4,7 | 0 | 4,6 | 14 | –/– | 18 | 90 | 100 |
| Iwahashi128 (2006) | 22 | – | 100 | <5 | 0 | – | 36 | –/– | 32 | 82 | 82 |
| Lai124 (2006) | 28 | 96 | 100 | 3,4+1,6 | 3,5 | 6,7+1,8 | – | 0/0 | 43 | 100 | 100 |
| Nguyen129 (2006) | 43 | 89 | 67 | 4,6 (0,4–11,5) | – | – | – | 9/2 | – | – | – |
EH: estancia hospitalaria; G(%): porcentaje de casos gástricos; Lap: porcentaje de casos tratados vía laparoscópica; Morb/mort: morbimortalidad; n: número de pacientes; R1: porcentaje de enfermos con bordes microscópicamente afectos; ref: referencia bibliográfica; S: supervivencia; SG (meses): seguimiento medio en meses; SLE: supervivencia libre de enfermedad.
La conferencia de consenso sobre GIST de 20042 afirmaba que los márgenes microscópicos positivos o R1 no se había visto que comprometieran la supervivencia. De igual forma se expresaba la guía de la NCCN de 200486. Sin embargo, esta misma guía, en su actualización de 20071 si incluye los márgenes microscópicos negativos como un objetivo de la cirugía.
Los resultados aportados por las series disponibles son contradictorios. De Matteo6 compara 65 casos R0 vs. 15 R1. Este autor, al igual que otros15–17,22,28,130,134,135, no encuentra diferencias ni en la tasa de recurrencias (33 vs. 30%, respectivamente) ni en la de supervivencia, enfatizando, por ello, la resección macroscópicamente completa. En fuerte contraste, Gouveia131 compara 78 casos R0 vs. 18 R1. La tasa de recurrencia de los R0 fue del 9 vs. 27.8% en los casos R1. Otros autores23,31,132 tambien consideran los margenes microscópicos como un factor pronóstico de gran importancia14,16,19,23,28,39,131,133.
Esta controversia es de difícil solución131. Solo se dispone de un escaso número de pequeñas series que abordan este problema; series, que sufren un sesgo de selección al incluir, en diferentes proporciones, tumores con diversos factores de riesgo como el tamaño o el grado tumoral136. Se ha observado que existe una asociación entre tamaño, grado tumoral y resección incompleta, esto es, es más fácil lograr una resección R0 en tumores pequeños de bajo grado y al revés19. Dado que los tumores de bajo grado precisan, por lo general, cirugías menos agresivas, se explica el que algunos estudios comuniquen que las resecciones locales poseen menores tasas de recurrencia que las segmentarias14,132. Dado que las variables grado de diferenciación, tipo de cirugía y radicalidad de la misma aparecen siempre ligadas, la interpretación estadística se hace muy compleja. Más aún, es muy frecuente la presencia de falsos (+) relacionados con la retracción de la pieza tras su fijado previo análisis patológico o por la resección del margen grapado. Finalmente, el análisis de los datos queda con frecuencia falseado por la administración de terapias adyuvantes con imatinib6,19,137.
En base a lo expuesto, podemos afirmar que no hay datos suficientes que justifiquen márgenes de resección amplios para reducir el riesgo de recidiva8,39, remarcándose que una resección macroscópicamente completa con un margen de 1cm es más que suficiente. De hecho, un margen de seguridad de 1–2cm, que incluye los 5mm de potencial extensión microscópica del tumor, logra en todos los casos una resección R093,128.
En caso de tumores localmente avanzados se recomienda el intentar resecar macroscópicamente el tumor sin prestar atención a la potencial afectación microscópica de los márgenes si con ello se evita el resecar estructuras vitales9. Si que sería recomendable el análisis intraoperatorio de la pieza a fin de confirmar que es una resección R0137. Salvo en caso de cirugía paliativa, la resección R2 no es una opción15.
Otro problema que se plantea es qué hacer si el informe patológico final revela una resección R1. A día de hoy no hay evidencia de que tras resecar macroscópicamente un GIST, la presencia de márgenes (+) obliguen a la re-resección1. Aún así, es muy importante la opinión del cirujano, en el sentido de si éste cree que el informe patológico refleja fielmente el procedimiento quirúrgico o no, y no se trata de un falso positivo1. En caso contrario, el paciente debe ser cuidadosamente re-evaluado y aquellos pacientes de buen riesgo quirúrgico, con lesiones fácilmente re-identificables y resecables y de alto riesgo de recidiva, deben resecarse31,39.
Tumores microscópicosLas lesiones <1cm son extraordinariamente frecuentes, hasta el punto que en estudios de autopsias se encuentran en el 22,5% de los casos, y en el 35% de las piezas de gastrectomías138,139. Son de carácter incidental, de pequeño tamaño, asintomáticos, y de historia natural desconocida. Su manejo es muy controvertido, y si bien el control endoscópico seriado es una opción lógica140, recomendándose la resección solo en caso de incremento en su tamaño o aparición de síntomas, con frecuencia el endoscopista reseca estas lesiones140, tecnica que posee una alta tasa de márgenes (+), por lo que no debe recomendarse8.
Las lesiones de 1–2cm, al ser de mayor tamaño, son con frecuencia sintomáticas pero siguen teniendo una historia natural desconocida. En general se favorece su resección, especialmente vía laparoscópica. Algunos autores favorecen la observación de estas lesiones dado su bajo riesgo estimado en base a su bajo tamaño y su posible localización (especialmente si es gástrica). Sin embargo, desconocemos su tasa mitótica, factor de riesgo de gran importancia, cuya estimación mediante biopsia es muy dificultosa8.
En base a lo expuesto, recomendamos la resección quirúrgica en tumores de >2cm; en todos los tumores extra-gástricos, independientemente de su tamaño; y en los tumores de <1cm sintomáticos o en crecimiento. En tumores de 1–2cm se puede optar por un tratamiento individualizado aunque es preferible la resección vía laparoscópica. La observación más control endoscópico seriado se indicaría en tumores de <1cm asintomáticos y estables. De todas formas, debemos enfatizar que, a día de hoy, no existen guías que nos ayuden a manejar estos pacientes141.
Biopsia preoperatoriaDebido al alto riesgo de rotura, hemorragia y diseminación tumoral, la biopsia preoperatoria debe evitarse en todos aquellos tumores potencialmente resecables en pacientes de bajo riesgo quirúrgico1,6,13. La biopsia solo estaría indicada en caso de irresecabilidad en donde se plantee un tratamiento neoadyuvante; y en caso de existir fuertes dudas diagnósticas con otras lesiones tumorales de tratamiento diferente al GIST como el páncreas ectópico, linfomas, leiomiomas esofágicos, etc., especialmente en pacientes de alto riesgo quirúrgico9,13,16,18. La biopsia intraoperatoria por congelación solo se indicaría si debemos de excluir la posibilidad de un linfoma o un adenocarcinoma durante el curso de una cirugía de un potencial GIST13.
La biopsia endoscópica convencional suelen ser infructuosa dada la localización submucosa de estos tumores142. De hecho, solo un 35% de las biopsias logran obtener material submucoso142. Por contra, la punción ecoendoscópica posee una tasa de éxito del 80–90%143, permite identificar la capa anatómica donde se origina el tumor así como las características del mismo97,100,144,145, mientras que la punción permitiría la identificación de células c-kit (+), claves para el diagnóstico107. A pesar de todo, el diagnóstico es difícil de establecer en base a las escasas células obtenidas por PAAF, o porque con frecuencia las biopsias solo obtienen material necrótico o hemorrágico1,6. A estas limitaciones hay que sumar la dependencia que del observador posee la técnica144,145. En una reciente revisión, se cifra en un 50%, la tasa de diagnóstico preoperatorio exitoso97. En general es preferible la biopsia mediante PAAF efectuada mediante eco endoscopia frente a la PAAF percutánea guiada por ECO/TC, debiéndose efectuar el análisis patológico siempre en centros especializados.