Introducción. En la actualidad continúa el debate sobre cuál debe ser el tratamiento primario de la acalasia: dilatación o cirugía. En la última década han aparecido dos nuevas opciones: la inyección de toxina botulínica y la cirugía mínimamente invasiva.
Objetivo. Evaluar los resultados del abordaje laparoscópico de la acalasia.
Pacientes y método. Desde abril de 1993 a diciembre de 1999 han sido intervenidos 50 pacientes mediante cirugía mínimamente invasiva. Doce enfermos fueron tratados por toracoscopia y 47 por laparoscopia, realizándose esofagomiotomía de Heller y funduplicatura tipo Dor (n = 45) o Toupet (n = 2). Siete enfermos habían sido dilatados y 21 habían recibido toxina botulínica intraesfinteriana.
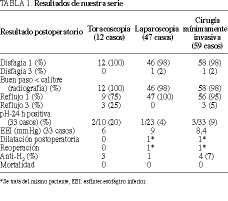
Resultados. No hubo conversiones. Se detectaron tres microperforaciones intraoperatorias que se suturaron. El tiempo medio de intervención fue de 150 min. Un paciente presentó mal vaciamiento esofágico, siendo reintervenido 2 años y medio más tarde. Se detectaron tres complicaciones postoperatorias, dos en el grupo de toracoscopia (neumotórax persistente y derrame pleural) y una en el de laparoscopia (neumonía). La estancia media fue de 3 días. El seguimiento medio ha sido de 30 meses, con un solo caso que no presentó mejoría de la dis fagia y 2 casos de esofagitis por reflujo. La manometría y la pH-metría postoperatorias en 33 pacientes pusieron de manifiesto un descenso de la presión del esfínter esofágico inferior a 9 mmHg (6-12 mmHg).
Conclusiones. Los datos de la bibliografía demuestran que la cirugía es el tratamiento más eficaz a largo plazo de la acalasia. La miotomía de Heller por laparoscopia ha demostrado al menos tan buen resultado como la cirugía abierta, y puede ser la primera opción en el tratamiento de la acalasia.
Introduction. The debate as to whether the primary treatment of achalasia should consist of dilatation or surgery continues. Over the past decade, two new options have been introduced: injections of botulinum toxin and minimally invasive surgery.
Objective. To evaluate the outcome of laparoscopic treatment of achalasia.
Patients and method. Between April 1993 and December 1999, 59 patients underwent minimally invasive surgery to treat achalasia. Thoracoscopy was employed in 12 and laparoscopy in 47. The procedure consisted of Heller esophagomyotomy, followed by either Dor (n = 45) or Toupet (n = 2) fundoplication. Seven patients had undergone dilatation and 21 had received intrasphincteric botulinum toxin.
Results. There were no conversions. Intraoperative microperforations were detected in three cases and were sutured. The mean operative time was 150 minutes. One patient presented poor esophageal emptying and required a second operation one and a half years later. There were three postoperative complications: two in the thoracoscopy group (persistent pneumothorax and pleural effusion) and one in the laparoscopy group (pneumonia). The mean hospital stay was 3 days. The mean follow-up was 30 months, during which dysphagia failed to improve in only one patient and there were two cases of reflux esophagitis. Postoperative manometry and pH-metry were carried out in 3 patients. The mean lower esophageal sphincter pressure fell to 9 mmHg (range: 6 to 12 mmHg).
Conclusion. A review of the literature demonstrates that surgery is the most effective long-term treatment of achalasia. Given the fact that the results with the Heller laparoscopic myotomy are at least as successful as those observed with open surgery, this procedure may be the treatment of choice for achalasia.
Introducción
El término griego Acalasia, "falta de relajación", fue introducido por Hurst en 1915. En sentido estricto, no describe la verdadera naturaleza de la enfermedad, que está caracterizada no sólo por la ausencia de coordinación en la relajación del esfínter esofágico inferior (EEI) sino también por la inadecuada propulsión del cuerpo esofágico. En 1898, Rusell describe un tipo de balón hidrostático, siendo Plummer, años más tarde, el que populariza el tratamiento por medio de la dilatación.
Los fundamentos del tratamiento quirúrgico de la acalasia fueron propuestos por Ernest Heller en 1913 con la descripción de una doble miotomía anterior y posterior. El procedimiento fue modificado por Zaaijer en 1923, realizando una sola miotomía en la cara anterior. Desde entonces el debate continúa sobre cuál debe ser el tratamiento primario de la acalasia: dilatación o cirugía. Sin embargo, en la última década del siglo han aparecido dos nuevas opciones: la inyección intraesfinteriana de toxina botulínica y la cirugía mínimamente invasiva toracoscópica1-3 y laparoscópica4-9 cuyos resultados han sido superponibles a los obtenidos por cirugía abierta10.
Pacientes y método
Desde abril de 1993 a diciembre de 1999 fueron remitidos 60 pacientes para tratamiento quirúrgico de acalasia, 59 de los cuales habían sido seleccionados para cirugía mínimamente invasiva. Todos fueron operados por uno de los autores (CVJL). Un solo paciente fue directamente intervenido de forma abierta por presentar un gran esófago sigmoideo. La aplicabilidad del procedimiento mínimamente invasivo fue del 98,5%, ya que no hubo conversión a cirugía abierta. Los primeros 12 enfermos, hasta marzo de 1995, fueron tratados por toracoscopia izquierda, añadiendo un antirreflujo tipo Belsey-Mark IV modificado en 9 ocasiones. Los 47 pacientes restantes fueron abordados por laparoscopia, realizándose en todos ellos una esofagomiotomía de Heller y una funduplicatura anterior de 180° tipo Dor en 45 ocasiones y una funduplicatura posterior de 240° tipo Toupet en los dos restantes, debiéndose estos últimos a una reintervención por Heller laparoscópico fallido y una reintervención tras resección de leiomioma esofágico supracardial.
Todos los pacientes presentaban disfagia, con pérdidas variables de peso y un período de evolución entre varios meses y varios años. La regurgitación era el segundo síntoma más frecuente. Siete enfermos habían sido dilatados previamente en 1-3 ocasiones. A 21 pacientes se les había aplicado toxina botulínica intraesfinteriana en 1-2 ocasiones.
El diagnóstico se basó en los datos radiológicos, endoscópicos y manométricos. Según el grado de dilatación esofágica los pacientes fueron clasificados como grado I (menos de 4 cm) 15 pacientes, grado II (entre 4 y 7 cm) 40 pacientes, y grado III (más de 7 cm) 4 enfermos.
Se descartó malignidad mediante endoscopia en todos los casos y no se observó esofagitis por reflujo en ninguno.
La manometría demostró una presión media del esfínter esofágico inferior de 32 mmHg, con ausencia de relajación o relajación incompleta en todos ellos. El hallazgo más común en el cuerpo esofágico fue la aperistalsis, sin que existiera peristalsis primaria en ninguna ocasión. No se realizaron estudios preoperatorios pH-métricos ni escintigráficos.
Técnica quirúrgica
La técnica quirúrgica de la esofagomiotomía transtoracoscópica izquierda, ha sido descrita en otro artículo2. Al haberla abandonado prácticamente en su totalidad no insistiremos en este aspecto.
Técnica de Heller por laparoscopia. Se coloca al paciente en posición de litotomía con anti-Trendelenburg de 15°. El cirujano se sitúa entre las piernas, el primer ayudante, que porta la cámara, en el lado derecho del paciente, y el segundo ayudante en el lado izquierdo. El procedimiento se realiza con óptica de 0°. El neumoperitoneo se realiza con aguja de Veress, y es mantenido a 12 mmHg.
Trocares. Utilizamos 5 trocares, dos de 10 mm y tres de 5 mm. El primer trocar, de 10 mm, se coloca en la unión del tercio superior con los dos tercios inferiores de la línea xifoumbilical. La cámara será mantenida en dicho lugar durante todo el procedimiento. El segundo trocar, de 10 mm, se coloca subxifoideo y alojará el retractor hepático. Un tercer trocar, de 5 mm, en la línea medioclavicular izquierda, rozando el reborde costal, alojará la tijera, el gancho o el porta en su caso, todos ellos instrumentos que manejará la mano derecha del cirujano. El cuarto trocar, de 5 mm, se situará en la línea axilar anterior izquierda para introducir una pinza de agarre para el estómago. Será manejada por el segundo ayudante junto con el retractor hepático. El quinto trocar, también de 5 mm, situado en la línea medioclavicular derecha, a mitad de distancia de la línea xifoumbilical, alojará la pinza de disección o el aspirador, que serán manejados por la mano izquierda del cirujano.
Pilar derecho y membrana frenoesofágica. La primera referencia en la cirugía de la región hiatal es el pilar derecho del diafragma. Comienza la disección aproximadamente en la zona media del pilar, ascendiendo en sentido de las agujas del reloj hasta seccionar la membrana frenoesofágica y localizar y liberar de manera incompleta el pilar izquierdo. En esta manio bra identificaremos el nervio vago anterior. A continuación la bramos un túnel mediastínico en la cara anterior del esófago, manteniendo siempre intactas las adherencias posteriores del mismo.
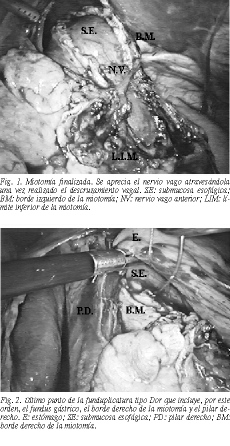
Miotomía de Heller. El esófago es mantenido tenso mediante una pinza de tracción aplicada en la región subcardial. La miotomía comienza unos 3 cm aproximadamente por encima de la unión esofagogástrica y a la derecha del nervio vago anterior. Tras la apertura con minitijeras de la capa longitudinal y transversal, se identifica el plano liso mucoso. A partir de aquí la miotomía asciende mediante sección con coagulación monopolar de las dos capas musculares esofágicas. Para evitar la lesión térmica de la mucosa, antes de la sección se realiza una tracción hacia arriba con una de las hojas de la tijera. Esta disección a veces no es totalmente exangüe, dependiendo del grado de periesofagitis. Se continúa la sección hasta la desaparición de la hipertrofia muscular esofágica, lo cual viene a coincidir, aproximadamente, con una miotomía de unos 7-8 cm de longitud en el esófago. Completada la zona superior nos dirigimos al punto de inicio de la miotomía y cambiamos la tijera por el gancho. En este momento hacemos una disección del nervio vago anterior desde este punto hasta bien pasada la unión esofagogástrica, de modo que la línea de la miotomía cruzará el vago anterior, dejándolo a su derecha. Esta maniobra (descruzamiento vagal) es absolutamente imprescindible para realizar la sección completa del esfínter. En este punto, las referencias anatómicas no son precisas en cuanto a determinar si el esfínter se ha seccionado por completo, ya que su longitud y su grado de infundibulización son variables (fig. 1). Por ello, utilizamos la endoscopia intraoperatoria.
Endoscopia intraoperatoria. Ha sido realizada en todos los casos y siempre por el mismo endoscopista (MSM). Aparte de informarnos sobre la existencia de una microperforación, así como de la longitud de la miotomía y el control del antirreflujo, su uso nos parece trascendente para tener un control objetivo de que el esfínter ha sido seccionado completamente. De la observación endoscópica hemos deducido dos aprendizajes: que el esfínter tiene una longitud variable y se infundibuliza en mayor o menor grado en el estómago, y que cuando el cirujano cree haber completado la sección del esfínter, habitualmente resta 1 cm para que la sección sea completa. En este momento se efectúa la medición de la longitud de la miotomía (7-9 cm).
Funduplicatura anterior 180° tipo Dor. Una vez seleccionada la zona de fundus, se comienza la sutura con material irreabsorbible, puntos sueltos, que incluyen fundus, pilar izquierdo y el borde izquierdo de la miotomía. Con 4 puntos es suficiente para completar este borde izquierdo. Otros tantos puntos que toman el fundus, el borde derecho de la miotomía y el pilar derecho (fig. 2), completan la funduplicatura anterior de 180° tipo Dor. En ella se pretende que queden al menos 3 cm de esófago intraabdominal anclados por la sutura de los bordes de la miotomía a los pilares. La endoscopia intraoperatoria nos permite confirmar la ausencia de angulación de la zona distal esofágica, así como comprobar la hemivalva anterior. En 2 pacientes intervenidos previamente en la región esofagogástrica, se movilizó posteriormente el esófago, añadiendo en estos casos una hemivalva posterior tipo Toupet. No se deja drenaje.
Resultados
Complicaciones intraoperatorias
Se detectaron tres microperforaciones intraoperatorias, una en la intervención de Heller toracoscópica y dos en la laparoscópica, siendo suturadas con material reabsorbible. En ninguno de los 21 pacientes con inyección de toxina botulínica preoperatoria hubo perforación durante la miotomía. La pérdida hemática no superó los 200 ml, no requiriendo ningún paciente transfusión intra ni postoperatoria. No hubo necesidad de conversión a cirugía abierta en ningún caso. El tiempo medio de intervención fue de 150 min.
Evolución postoperatoria
A todos los pacientes se les realizó un tránsito con gastrografín en las primeras 12-24 h postoperatorias. No se detectó ninguna extravasación de contraste, reanudando en ese momento la alimentación oral. En los pacientes con microperforación esofágica se siguió el mismo criterio, reanudando la alimentación oral si el tránsito con gastrografín era normal, que lo fue en todos los casos. Sólo en un paciente se evidenció mal vaciamiento esofágico siendo reintervenido 2 años y medio más tarde.
Se detectaron tres complicaciones postoperatorias, dos en el grupo de toracoscopia (neumotórax persistente y derrame pleural) y una en el de laparoscopia (neumonía).
La estancia media postoperatoria fue de 3 días.
Seguimiento
El seguimiento medio ha sido de 30 meses. La evaluación clínica de la disfagia y el reflujo se realizó mediante la clasificación propuesta por Vantrapen11: el estudio radiológico con contraste demostró la desaparición del segmento estenótico, la reducción del calibre esofágico, la ausencia de propulsión esofágica y el vaciamiento gástrico normal en todos los casos menos en uno, en el que persistía la estenosis.
La endoscopia gastrointestinal superior realizada 6 meses tras la intervención detectó esofagitis por reflujo grado I-II en 2 pacientes que sufrieron pirosis nocturna. El otro enfermo que padecía pirosis se negó a la realización de la endoscopia. Todos pertenecían al grupo de toracoscopia. En el grupo de laparoscopia ningún paciente presentó pirosis, no detectándose esofagitis en ningún caso.
Se consiguió realizar manometría y pH-metría postoperatoria pasados 6 meses de la intervención a 33 pacientes. La manometría puso de manifiesto un descenso de la presión media de reposo del EEI a 9 mmHg (6-12 mmHg). En un solo enfermo la presión fue de 21 mmHg, y correspondió a la paciente sometida a dilatación postoperatoria y posteriormente reintervenida por laparoscopia 2 años y medio más tarde de la primera intervención.
Se detectó reflujo patológico mediante pH-metría de 24 h en 3 pacientes de los 33 (9%) a los que se realizó: dos de ellos presentaban pirosis y el restante estaba asintomático. En todos ellos el reflujo fue catalogado como leve-moderado, siendo sometidos a tratamiento antisecretor. En el grupo de toracoscopia (n = 10), 2 pacientes (20%) presentaron reflujo patológico, tras haberse añadido en uno técnica antirreflujo y en otro no. En el grupo de laparoscopia se realizó pH-metría a 23 pacientes, siendo patológica en uno en el que se había realizado una intervención de Toupet, 1/23 (4%). No se detectó pH-metría patológica en ninguno de los 22 pacientes sin movilización esofágica y antirreflujo Dor. Los resultados se analizan en la tabla 1.
Discusión
Hoy día disponemos de cuatro opciones en el tratamiento inicial de la acalasia: la terapia farmacológica, la dilatación neumática, la cirugía abierta (toracotomía o laparotomía) y la cirugía mínima invasiva, toracoscópica o laparoscópica.
No es nuevo el intento de modificar la presión del EEI mediante fármacos. Se demostró que el nifedipino, que bloquea los canales del calcio, es capaz de reducir la presión del EEI, pero no de reducir los síntomas de acalasia. La inyección intraesfinteriana de toxina botulínica ha sido recientemente utili zada. Los síntomas mejoran en cerca de dos tercios de los enfermos, con una duración de meses a 1,3 años. Estudios comparativos de toxina botulínica frente a cirugía han demostrado la superioridad de esta última opción12, reservando actualmente la toxina para pacientes de alto riesgo quirúrgico o en espera de intervención.
Vantrapen y Helleman11 publicaron en 1980 el resultado del tratamiento mediante dilatación neumática en 537 enfermos, con un promedio de 3-4 dilataciones por paciente. El índice de perforación fue del 2,6%, la mortalidad del 0,2% y la media de seguimiento de 7,8 años. La suma de excelentes y buenos resultados alcanzó el 77%.
La revisión de la bibliografía americana de dilatación en acalasia entre los años 1980 y 1990, realizada por Ferguson13 en 1991 sobre 899 pacientes evidenció el siguiente resultado: mejora de la disfagia con una sola dilatación en el 71% de los pacientes, requiriendo subsecuentes dilataciones el 16%. Tras la dilatación el índice de reflujo gastroesofágico fue de 23%. El índice de mortalidad se situó en el 0,3%, principalmente debido a perforaciones. Un 8% de enfermos debieron ser sometidos a miotomía de Heller.
La revisión de la bibliografía mundial hasta 1985 realizada por Andreollo y Earlam14, en la que reunieron más de 5.000 pacientes intervenidos de acalasia demostró un 89% de excelente o buen resultado, una mortalidad operatoria del 0,2% y un índice de reintervenciones del 2,9%. La miotomía fue realizada por toracotomía en el 56% de los pacientes y por laparotomía en el 44% restante, siendo los resultados similares en todo excepto en la incidencia de reflujo gastroesofágico. La miotomía sin antirreflujo por toracotomía fue del 7,7%, mientras que por laparotomía alcanzó el 13,2%. Si se añadió un antirreflujo, la incidencia fue del 7,3 y del 7,4% para la toracotomía y la laparotomía, respectivamente.
Existen varios trabajos retrospectivos que comparan los resultados de la dilatación y la miotomía en pacientes con acalasia. Los resultados obtenidos en la Clínica Mayo15 analizaban a 431 pacientes tratados con dilatación y a 468 con miotomía, obteniendo resultados excelentes o buenos en el 65% del grupo de dilatación, comparado con el 85% del grupo de miotomía (p < 0,001). La mortalidad fue similar, y los malos resultados fueron del 19% para la dilatación y del 6% para la miotomía. Sólo el 3% de los pacientes quirúrgicos desarrollaron reflujo postoperatorio.
Csendes16 realizó el único estudio prospectivo, aleatorizado que compara la dilatación neumática con la miotomía realizada por laparotomía. Se añadió una funduplicatura 180° tipo Dor. Con un seguimiento a 62 meses los resultados fueron favorables para la cirugía, con un 95% de casos excelentes o buenos frente a un 65% para la dilatación.
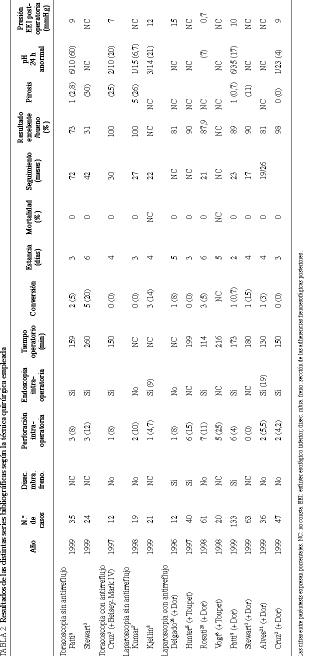
La primera serie publicada de miotomía de Heller por toracoscopia corresponde a Pellegrini1 en 1992, utilizando la endoscopia intraoperatoria. Nuestro comienzo de la serie por toracoscopia sin antirreflujo fue siguiendo las ideas de Ellis17. El propósito era la sección parcial controlada del EEI de manera que, consiguiendo un presión posquirúrgica de 10-12 mmHg, se eliminaba la disfagia con una tasa baja de reflujo (6%). Sin embargo, pronto se hizo evidente la dificultad de esta técnica incluso utilizando la endoscopia intraoperatoria, ya que no existen límites anatómicos precisos y la longitud del EEI es variable de un sujeto a otro. Frente a la disyuntiva de persistencia de la disfagia por miotomía incompleta o la aparición de reflujo por miotomía excesiva, se optó por la sección completa del EEI añadiendo a partir del tercer caso un mecanismo antirreflujo tipo Belsey-Mark IV modificado. Con ello, las presiones postoperatorias conseguidas eran de 6-7 mmHg con una tasa de resultados excelentes o buenos del 100%. La incidencia de pirosis fue del 25% y la tasa de reflujo comprobada por pH-metría del 20%. Esta incidencia contrasta, sin embargo, con el 60% expresado en otro estudio9, en el que no se añadió antirreflujo. En cualquier caso, la realización de una funduplicatura por toracoscopia es un procedimiento muy dificultoso, siendo una de las razones de su abandono temprano por nuestra parte. Hoy día, prácticamente ningún grupo practica ya la miotomía de Heller por toracoscopia.
En 1991, Cushieri4 publica la intervención de Heller por laparoscopia. Esta operación se concibió intentando conservar las adherencias posteriores y laterales del esófago y añadiendo un antirreflujo tipo Dor, técnica que ya había demostrado en cirugía abierta su eficacia con una tasa baja de reflujo postoperatorio, del 8,6%18. En 2 casos en los que hubo que movilizar posteriormente el esófago se optó por un antirreflujo tipo Toupet, técnica que ha demostrado ser eficaz a largo plazo19. Aunque hay autores que defienden que no es necesario añadir antirreflujo a la técnica laparoscópica si no hay movilización esofágica, los resultados obtenidos distan de ser satisfactorios con una incidencia de pH-metría patológica entre el 6,7 y el 21%. Como en cirugía abierta, en la intervención de Heller por laparoscopia hay autores partidarios de movilizar circularmente el esófago añadiendo una funduplicatura posterior de Toupet5,6. Por desgracia, no hay estudios de pH-metría postoperatoria para evaluar el reflujo. Es probable que la funduplicatura anterior de Dor sea insuficiente cuando el esófago es movilizado por completo, pudiendo alcanzar tasas de reflujo del 17%9. Sin embargo, sin seccionar las adherencias posteriores esofágicas y con antirreflujo de Dor puede obtenerse una tasa del 6,5%20. Nuestros propios resultados muestran una tasa de reflujo del 4%, siendo el único caso de reflujo un paciente al que se movilizó circularmente el esófago por estar previamente intervenido de un leiomioma esofágico supracardial y en el que se realizó una funduplicatura de Toupet. Para la técnica de Heller-Dor la tasa es del 0%, cifra inferior a la obtenida en laparotomía18, la cual puede explicarse por la longitud de esófago intraabdominal mayor de 3 cm que se ha dejado siempre en laparoscopia (tabla 2).
El uso de la endoscopia intraoperatoria se ha demostrado útil a la hora de seleccionar la longitud inferior de la miotomía21, pudiendo hacer cambiar al cirujano en sentido de seccionar más abajo en el 56% de los casos. Aunque algún autor, pionero de esta técnica, la haya abandonado en la actualidad9, nosotros la seguimos utilizando, ya que nos parece imprescindible pa ra la sección completa del esfínter, la detección de microperforaciones y el control de la funduplicatura.
Algunos autores han relacionado el índice de perforación con la inyección preoperatoria de toxina botulínica por la fibrosis que ocasionaría en la capa submucosa22. Los 2 casos de perforación en la miotomía de Heller por laparoscopia se produjeron al principio de la serie y no hemos detectado esta complicación en ninguno de los pacientes sometidos a inyección de toxina botulínica en el preoperatorio.
Al estratificar a los pacientes según la edad se observa que la dilatación es inefectiva en más de 50% de los pacientes menores de 40 años o adolescentes. Asimismo, se ha demostrado23 que en las acalasias poco evolucionadas, tratadas inicialmente mediante dilatación, la tasa de perforación es más alta y el resultado clínico peor (7% de resultados excelentes) que cuando son tratadas inicialmente mediante cirugía (93% de resultados excelentes). Se sabe, asimismo, que los pacientes con esófago no dilatado y con escaso tiempo de evolución tratados quirúrgicamente, pueden recuperar el peristaltismo de manera parcial24. Estos argumentos apoyan la cirugía como primera opción en el tratamiento de la acalasia en sujetos jóvenes, con corta evolución de la enfermedad y esófago no dilatado. Pero también ante un esófago dilatado se ha mostrado la eficacia de la miotomía de Heller por laparoscopia25.
En definitiva, los datos de la bibliografía demuestran que la cirugía sigue siendo el tratamiento más eficaz y con mejor resultado a largo plazo en el tratamiento de la acalasia. Los argumentos en contra, como eran un postoperatorio doloroso con una estancia hospitalaria de más de una semana, han desaparecido con la cirugía laparoscópica. La miotomía de Heller por laparoscopia ha demostrado al menos tan buen resultado como el obtenido con laparotomía, tanto en lo referente a complicaciones como al alivio de la disfagia y la prevención del reflujo postoperatorio. Por ello, la miotomía de Heller por laparoscopia puede ser, y es en nuestro caso, la primera opción en el tratamiento de la acalasia26.