El síndrome de Zollinger-Ellison (Z-E) está caracterizado por tumores productores de gastrina responsables de la aparición de úlceras recurrentes en el tracto gastrointestinal. El abordaje quirúrgico y la extensión de la resección tumoral son todavía controvertidos.
MétodosDe febrero de 2005 a febrero de 2014 se intervino a 6 pacientes con Z-E, 4 hombres y 2 mujeres, con una mediana de edad 46,8 años (22-61). Dos pacientes presentaban una neoplasia endocrina múltiple-1 (NEM-1). El diagnóstico se estableció por la determinación de gastrina basal en ayunas >200pg/ml (VN < 100). Para el diagnóstico de localización se utilizó el octreoscan (6/6), la tomografía axial computarizada (TAC) (6/6) y la ultrasonografía endoscópica (USE) (1/6).
ResultadosEl octreoscan fue positivo en 5 pacientes. La TAC localizó el tumor en todos los pacientes: páncreas (2), duodeno (3, uno confirmado por USE), entre el conducto biliar y la vena cava (uno). El abordaje laparoscópico se utilizó en 4 pacientes, 2 pacientes fueron convertidos a cirugía abierta. Entre las técnicas quirúrgicas se realizaron: 2 duodenopancreatectomías cefálicas con preservación pilórica (DPCPP), una pancreatectomía distal con preservación esplénica, una resección nodular duodenal, una resección duodenal segmentaria y una resección nodular extrapancreática. La anatomía patológica demostró metástasis linfáticas en 2 pacientes con gastrinomas pancreáticos y en un paciente con gastrinoma duodenal. La estancia hospitalaria mediana fue 11,3 días (10-14). Durante el período de seguimiento clínico, con una mediana de 76,83 meses (5-108), todos los pacientes presentaron una gastrina en ayunas normal
ConclusionesLa cirugía puede ofrecer la curación en pacientes con Z-E. El abordaje laparoscópico permanece limitado a casos seleccionados.
Zollinger-Ellison syndrome (Z-E) is characterized by gastrin-secreting tumors, responsible for causing refractory and recurrent peptic ulcers in the gastrointestinal tract. The optimal approach and the extension of tumor resection remains the subject of debate.
MethodsDuring the period February 2005 and February 2014, 6 patients with Z-E underwent surgery, 4 men and 2 women with a median age 46.8 years (22-61). Two patients were affected with multiple endocrine neoplasia type-1 (MEN-1). Fasting gastrin levels greater than 200pg/ml (NV: <100) was diagnostic. Radiologic imaging to localize the lesion included octreoscan 6/6, computer tomography (CT) 6/6, and endoscopic ultrasonography (EUS) 1/6.
ResultsThe octreoscan was positive in 5 patients. The CT localized the tumor in the pancreas in 2 patients, in the duodenum in 3 patients (1 confirmed by EUS) and between the common bile duct and vena cava in one patient. The laparoscopic approach was used in 4 patients, 2 patients converted to open surgery. The following surgical techniques were performed: 2 pylorus-preserving pancreatico-duodenectomy (PPPD), one spleen-preserving distal pancreatectomy, one duodenal nodular resection, 1 segmental duodenectomy and one extrapancreatic nodular resection. Pathological studies showed lymph nodes metástasis in 2 patients with pancreatic gastrinomas, and in one patient with duodenal gastrinoma. The median follow-up was 76,83 months (5-108) and all patients presented normal fasting gastrin levels.
ConclusionsSurgery may offer a cure in patients with Z-E. The laparoscopic approach remains limited to selected cases.
Los gastrinomas son tumores endocrinos poco frecuentes con una incidencia de 0,5-1/1.000.000 habitantes/año y los segundos en frecuencia, precedidos por el insulinoma. La incidencia es mayor en hombres que en mujeres y la edad media de presentación se encuentra entre los 45 y 50 años1. Las manifestaciones clínicas de este tumor están asociadas a la hipersecreción de gastrina, produciéndose una elevación de ácido gástrico, que es el responsable de la aparición del síndrome de Zollinger-Ellison, caracterizado por la aparición de úlceras gastroduodenales y yeyunales, y la alteración de la motilidad gastrointestinal, que ocasiona diarreas hasta en un 70% de los casos2. Los gastrinomas pueden presentarse de manera esporádica (70%) o formando parte del síndrome de neoplasia endocrina múltiple tipo 1 (NEM-1) 3. A pesar de que estos tumores son de crecimiento lento, en el 60-70% de los casos son malignos y en un 25% de los casos tienen un crecimiento rápido4.
El diagnóstico de localización de los gastrinomas ha cambiado de manera favorable en los últimos años con la utilización de la tomografía axial computarizada (TAC), la ultrasonografía endoscópica (USE) y sobre todo la gammagrafía a través de la inyección de un análogo de la somatostatina, el octreotido, que se fija en los receptores de somatostatina del tumor5. Esta última prueba tiene una elevada sensibilidad diagnóstica cuando el tumor es mayor de 2cm (96%), sin embargo desciende a un 30% cuando los tumores son menores de 1cm5. El diagnóstico de gastrinoma exige la demostración de una elevación de la gastrina en ayunas y, en casos de duda, esta elevación se hace más evidente con la inyección de secretina6,7.
El control clínico de la enfermedad puede hacerse con la administración de los inhibidores de la bomba de protones, pero es la cirugía la que permite la curación de hasta el 40% de los pacientes con gastrinoma esporádico y, en los casos de gastrinomas asociados a la NEM-1, la prevención de la transformación maligna8. La elección de la técnica quirúrgica es motivo de controversia con relación al tipo de abordaje abierto o laparoscópico y a la extensión de la cirugía, conservadora o radical.
El motivo de este trabajo es el análisis de los resultados inmediatos y a largo plazo de la cirugía en pacientes con gastrinoma esporádico y en pacientes con gastrinomas asociados a NEM-1.
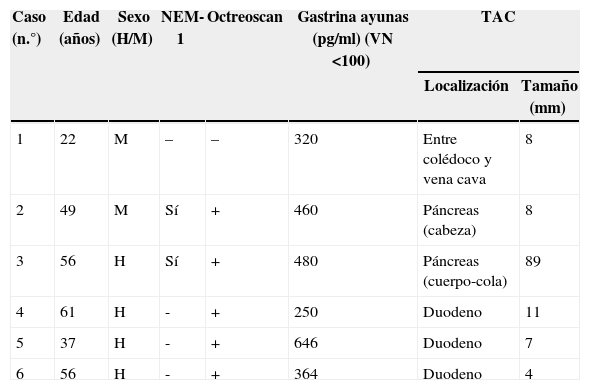
Pacientes y métodoDurante el período de tiempo comprendido entre febrero del 2005 y febrero del 2014, han sido diagnosticados de síndrome de Zollinger-Ellison e intervenidos quirúrgicamente, 6 pacientes, 4 hombres y 2 mujeres, con una mediana de edad de 46,8 años (22-61). Todos los pacientes habían padecido molestias gastrointestinales y habían presentado úlceras gástricas o duodenales múltiples demostradas por gastroscopia. Los datos demográficos de los pacientes y los métodos diagnosticados utilizados se presentan en la tabla 1. Un paciente (caso 5) fue intervenido por una perforación de un ulcus duodenal y otro paciente (caso 6) presentó una hemorragia digestiva alta por esofagitis erosiva. Dos pacientes tenían historia familiar de NEM-1: en un paciente (caso 2) el padre había fallecido por un gastrinoma maligno con metástasis hepática; el otro paciente (caso 3) había sido intervenido de una paratiroidectomía subtotal por hiperparatiroidismo primario. Este último paciente había presentado en el último año episodios de pancreatitis aguda recurrente con hiperamilasemia.
Datos demográficos de los pacientes y métodos diagnosticados utilizados
| Caso (n.°) | Edad (años) | Sexo (H/M) | NEM-1 | Octreoscan | Gastrina ayunas (pg/ml) (VN <100) | TAC | |
|---|---|---|---|---|---|---|---|
| Localización | Tamaño (mm) | ||||||
| 1 | 22 | M | – | – | 320 | Entre colédoco y vena cava | 8 |
| 2 | 49 | M | Sí | + | 460 | Páncreas (cabeza) | 8 |
| 3 | 56 | H | Sí | + | 480 | Páncreas (cuerpo-cola) | 89 |
| 4 | 61 | H | - | + | 250 | Duodeno | 11 |
| 5 | 37 | H | - | + | 646 | Duodeno | 7 |
| 6 | 56 | H | - | + | 364 | Duodeno | 4 |
−: negativo; +: positivo; NEM-1: neoplasia endocrina múltiple tipo 1; TAC: tomografía axial computarizada.
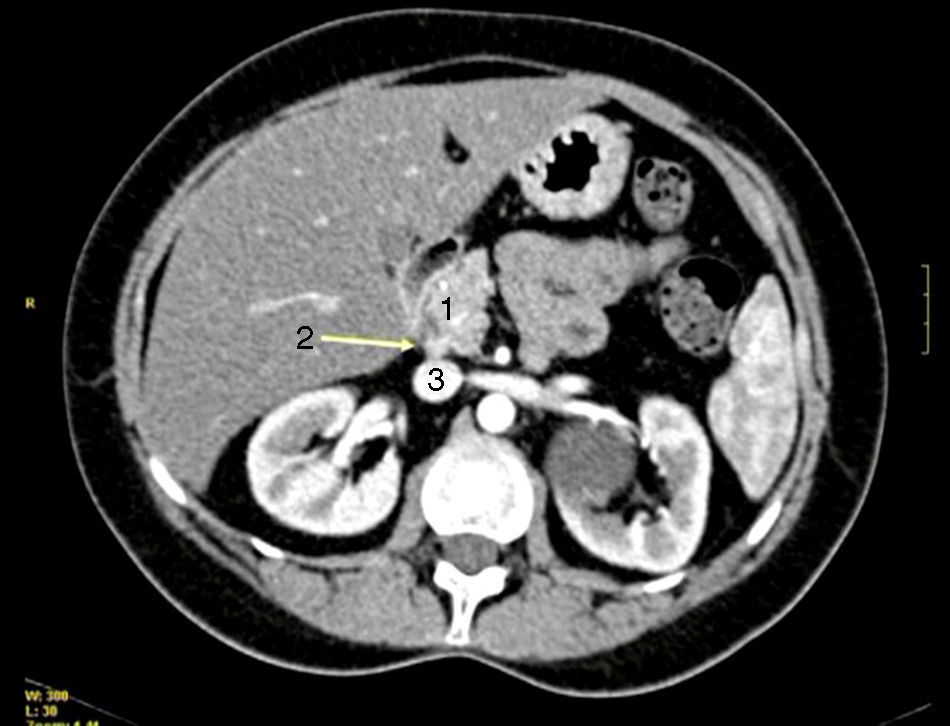
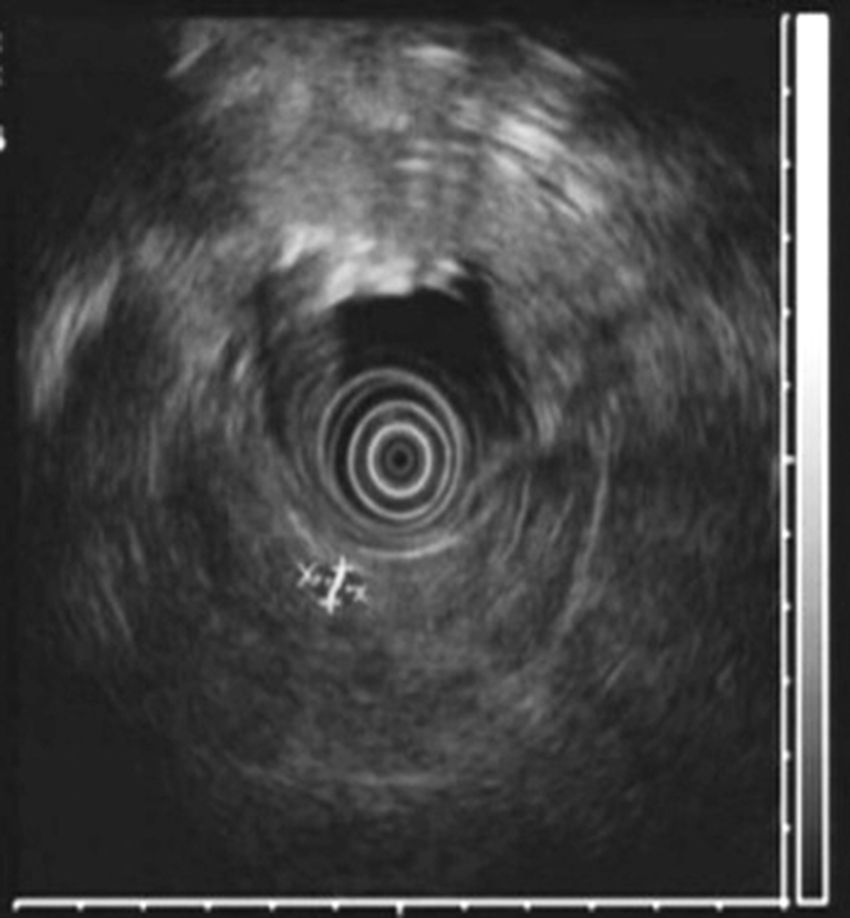
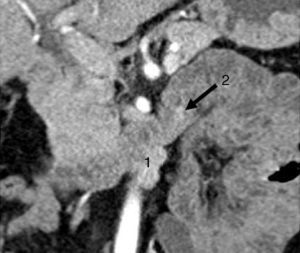
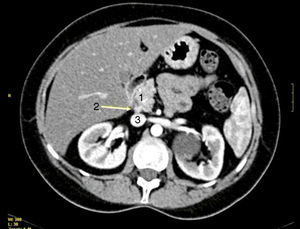
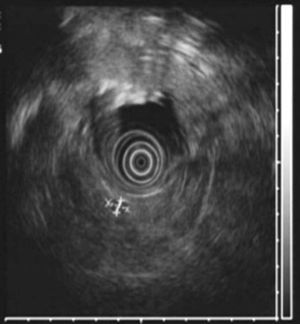
Todos los pacientes presentaban una elevación de gastrina en ayunas >200pg/ml (VN < 100), con una mediana de 420pg/ml (250-646). En 2 pacientes (casos 1 y 4) se realizó el test de estimulación con secretina, mostrando niveles de gastrina sérica de 1.000 y 1.500pg/ml respectivamente. El octreoscan fue positivo en 5 pacientes. La TAC objetivó uno o varios nódulos en la región de la cabeza del páncreas (caso 2), en el cuerpo-cola del páncreas (caso 3), en el duodeno (casos 4, 5 y 6) (fig. 1) y entre el colédoco y la vena cava (caso 1) (fig. 2). La USE confirmó el diagnóstico del caso 4 (fig. 3).
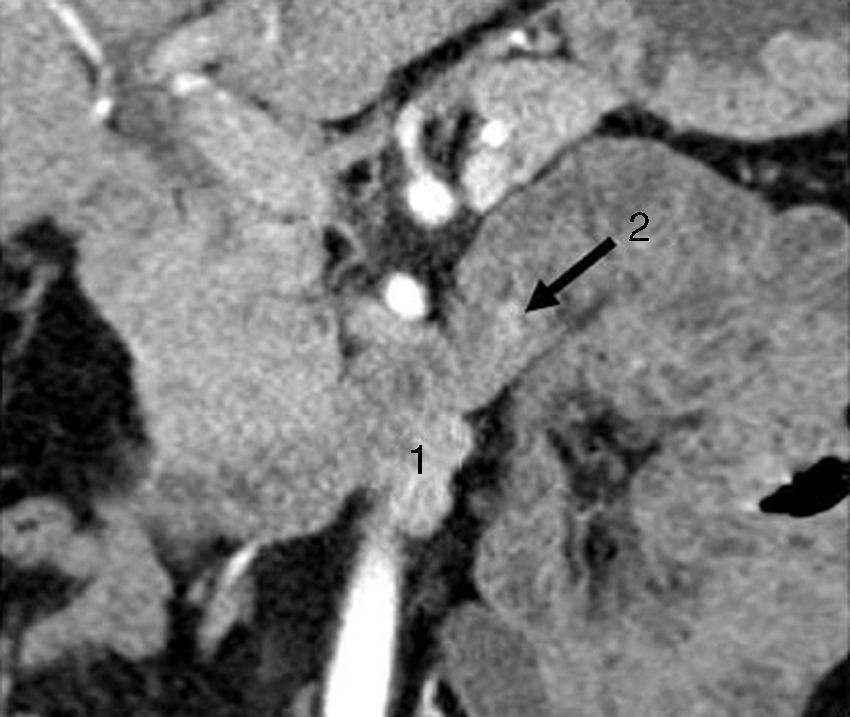
TAC que objetivó una lesión bilobulada, hipervascular en fase arterial, en la 3.ª porción duodenal (borde inferior), que crecía caudalmente de forma exofítica (27×11mm) y que correspondía a ganglios linfáticos metastásicos (1). A unos 2cm distal a esta lesión, una segunda imagen hipervascular, de 7mm, que resultó ser un gastrinoma de la tercera porción duodenal (2).
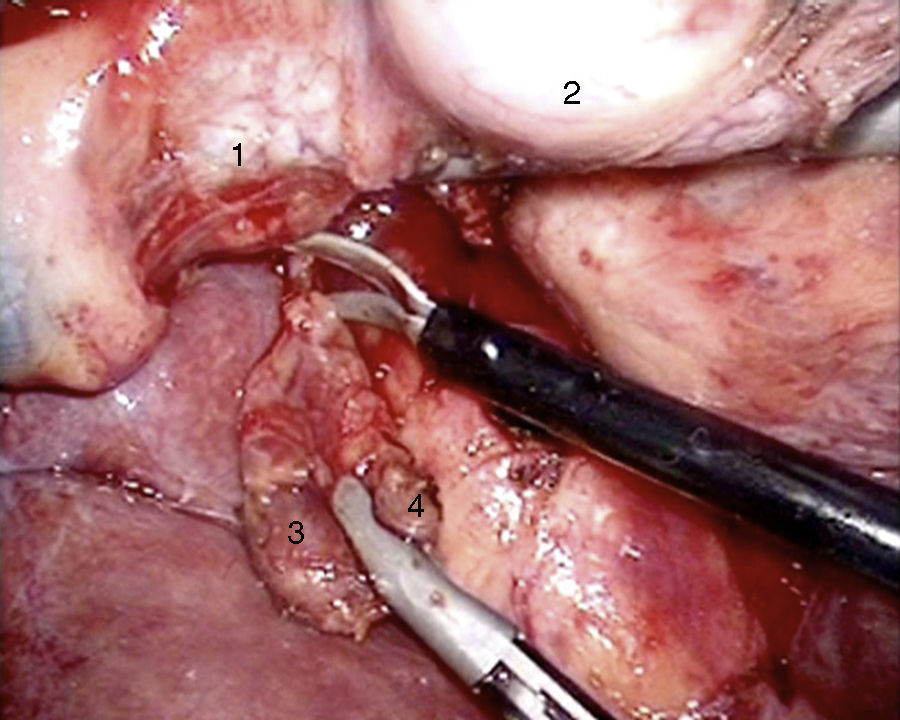
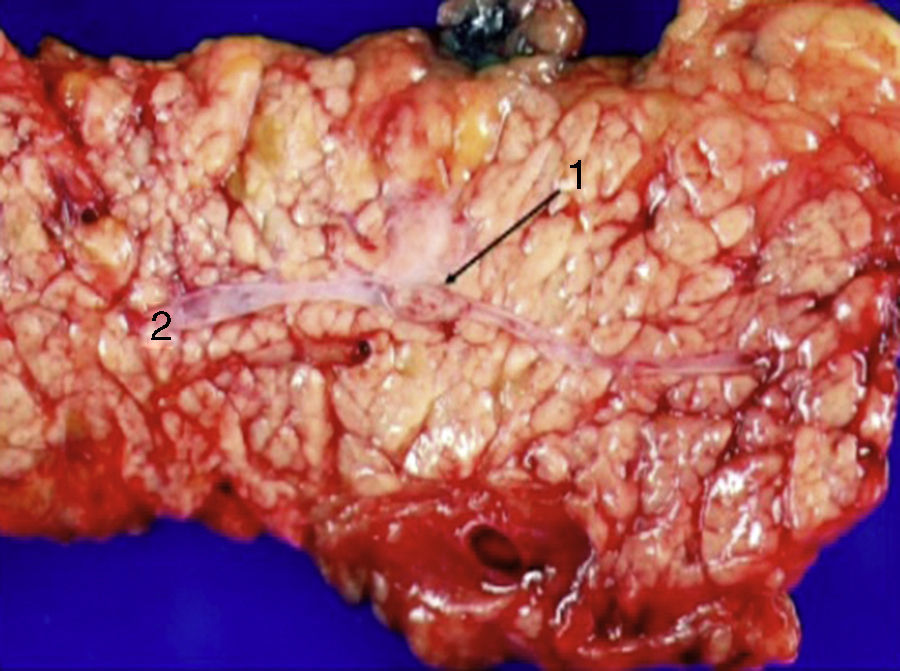
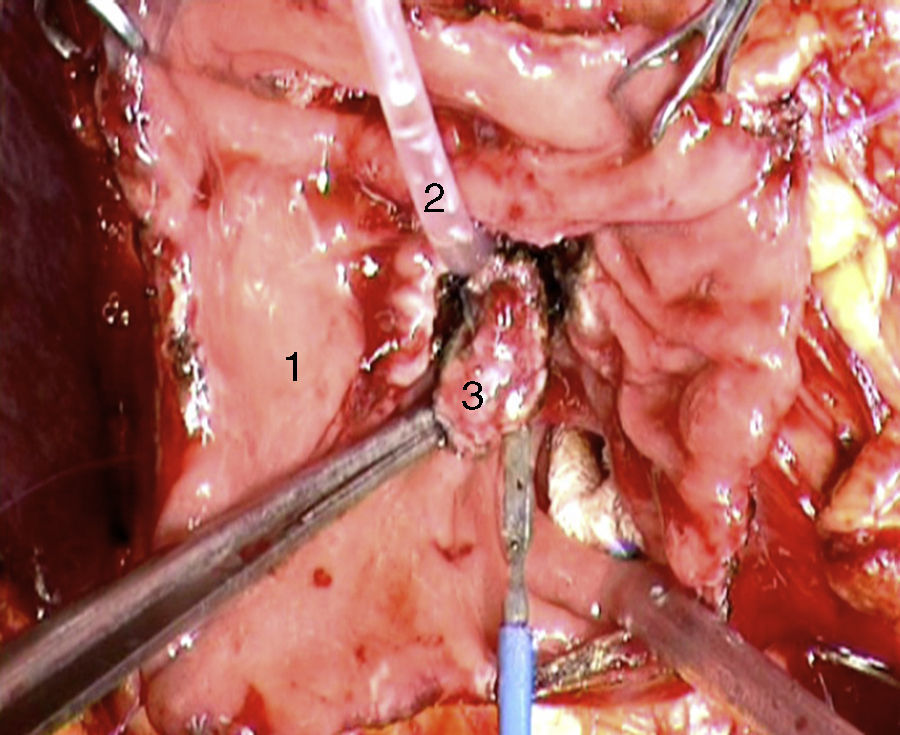
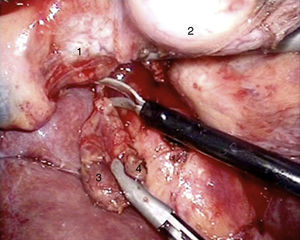
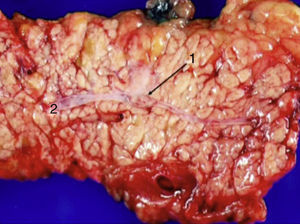
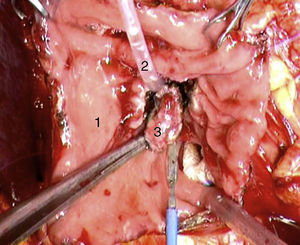
El abordaje laparoscópico se eligió en 4 pacientes: en un paciente (caso 1) se encontró un nódulo en la cara posterior de la entrada del colédoco en el páncreas que fue extirpado, confirmándose en la biopsia peroperatoria la presencia de un gastrinoma en un ganglio linfático y descartando la presencia de metástasis en los ganglios linfáticos regionales (fig. 4). La anatomía patológica definitiva confirmó el diagnóstico de gastrinoma linfático primario. En otro paciente (caso 3) se completó con éxito una pancreatectomía corporodistal con preservación esplénica según la técnica de Warshaw. La anatomía patológica demostró 2 gastrinomas, en el cuerpo-cola del páncreas, uno de ellos comprimía el conducto de Wirsung, ocasionando dilatación distal (fig. 5). Dos pacientes precisaron conversión a cirugía abierta. En un paciente (caso 6) se encontró un nódulo extrapancreático en la región del proceso uncinado del páncreas; la biopsia peroperatoria demostró que se trataba de una metástasis linfática. Se realizó una duodenopancreatectomía cefálica con preservación pilórica (DPCPP). En la pieza extirpada se halló un gastrinoma de 4mm en la segunda porción duodenal. En otro paciente (caso 4) la ecografía intraoperatoria demostró un nódulo de 11mm localizado en la cara posterior del duodeno adyacente a la papila duodenal. Mediante la conversión a cirugía abierta se realizó una duodenotomía longitudinal. Una cánula de plástico introducida a través del orificio papilar en el colédoco facilitó la extirpación local del gastrinoma, con identificación posterior de la salida del conducto pancreático (fig. 6).
El abordaje abierto se indicó inicialmente en la paciente (caso 2) con gastrinoma asociado a NEM-1, realizando una DPCPP. La anatomía patológica de la pieza extirpada demostró la presencia de un gastrinoma pancreático de 8mm y metástasis linfáticas en uno de los 10 ganglios extirpados. En otro paciente (caso 5) se realizó una duodenectomía segmentaria (porción distal de la segunda porción duodenal y hasta la región medial de la tercera porción duodenal) y una linfadenectomía peripancreática. La anatomía patológica demostró un gastrinoma duodenal de 7mm y 2 metástasis linfáticas.
Los pacientes intervenidos con abordaje laparoscópico presentaron un curso postoperatorio sin incidencias y fueron dados de alta a los 11 días de la intervención. En el grupo de 2 pacientes después de DPCPP, uno tuvo un curso postoperatorio sin incidentes y fue dado de alta a los 14 días de la cirugía; otro presentó una fístula pancreática tipo B según el International Study Group of Pancreatic Fistula (ISGPF) y fue dado de alta a los 22 días de la cirugía. La estancia hospitalaria (sin complicaciones) fue de 14 días en el paciente de resección local del gastrinoma periampular y de 10 días en el paciente con resección duodenal segmentaria.
La mediana de seguimiento fue de 76,83 meses (5-108). Todos los pacientes están asintomáticos y con niveles normales de gastrina en ayunas. La normalidad encontrada en los niveles de gastrina también incluye a los pacientes con síndrome NEM-1 (casos 2 y 3), tras 6 y 7 años de la cirugía; una mujer de 49 años con un gastrinoma localizado en la región duodeno-páncreas y un varón de 56 años con un gastrinoma múltiple en el cuerpo-cola del páncreas. Son estos pacientes los que presentan a largo plazo un mayor riesgo de recidiva de la enfermedad. La paciente del caso 1 puede considerarse como un gastrinoma linfático primario ya que, transcurridos 9 años de la cirugía, no se han producido manifestaciones clínicas o bioquímicas de la enfermedad y mantiene niveles de gastrina normales.
DiscusiónLa historia natural de los gastrinomas difiere en los casos de gastrinoma esporádico de los asociados a una neoplasia endocrina múltiple tipo 19. El gastrinoma esporádico presenta metástasis linfáticas en el momento de la cirugía hasta en un 40-70% de los casos y el 20-40% los pacientes presentan metástasis hepáticas no resecables. Los gastrinomas en pacientes con NEM-1 son frecuentemente pequeños (algunos indetectables en las exploraciones radiológicas), múltiples con una propensión a la diseminación metastásica10.
Las dificultades que se le presentan al cirujano en la cirugía del gastrinoma son enormes, lo que explica que las opciones técnicas sean motivo de debate11. Hasta un 30% de los pacientes son intervenidos con el diagnóstico de gastrinoma oculto, sin localización preoperatoria11,12. En esta situación el cirujano debe focalizar su atención en el llamado triángulo del gastrinoma, un área anatómica definida en su límite superior por la unión del conducto cístico y del conducto hepático común, el límite inferior por la unión de la 2.ª y 3.ª porciones duodenales y el límite medial por el cuello y el cuerpo del páncreas dorsal y ventral13. Entre el 65 y el 90% de todos los gastrinomas encontrados en la cirugía se localizan en la región del segmento duodenal y de la cabeza pancreática. Los gastrinomas duodenales se localizan con mayor frecuencia en la primera porción duodenal (56%), segunda (32%), tercera (6%) y cuarta (6%)12,13. En el páncreas se localizan con más frecuencia en la cabeza que en el cuerpo (2:1) y en el 10% de los casos en ambos sitios.
El abordaje laparoscópico en la cirugía del gastrinoma es controvertido. Norton y Jensen14 han dado 4 razones para contraindicar la cirugía de acceso mínimo: 1) la localización de los gastrinomas en el duodeno ocurre de 3 a 10 veces más frecuentemente que en el páncreas; 2) la localización preoperatoria de los gastrinomas duodenales puede ser difícil (tamaño<1cm); 3) un elevado porcentaje de los gastrinomas duodeno-pancreáticos asocian metástasis en los ganglios regionales (50-70%); 4) la localización de estos tumores en el llamado triángulo del gastrinoma no facilita una cirugía que normalmente asocia un tiempo operatorio prolongado y en ocasiones puede necesitar de una duodeno-pancreatectomía.
Algunas de estas razones han sido las que llevaron a la conversión a cirugía abierta en 2 de nuestros pacientes. En un caso, la ecografía intraoperatoria demostró un tumor de 11mm en la pared posterior del duodeno, en íntimo contacto con la papila duodenal. En el otro caso, durante la exploración laparoscópica de la región del duodeno-páncreas, se encontró un tumor de 11mm extrapancreático en la región del proceso uncinado del páncreas, en íntimo contacto con la pared duodenal; la biopsia peroperatoria demostró la presencia de metástasis ganglionar. Se decidió una duodeno-pancreatectomía cefálica, observando en la pieza quirúrgica un tumor de 4mm en la región duodenal. Sin embargo, en nuestra experiencia el abordaje laparoscópico tuvo éxito en 2 pacientes: en uno de ellos el gastrinoma estaba localizado entre el conducto biliar y la vena cava, y resultó tratarse de un gastrinoma linfático primario; el otro paciente con un NEM-1, presentaba gastrinomas múltiples, en el cuerpo-cola del páncreas, y se realizó una pancreatectomía distal con preservación esplénica según la técnica de Warshaw.
En la literatura han sido pocos los casos de gastrinomas en los que el abordaje laparoscópico se ha completado con éxito, por lo que este tipo de abordaje debe aconsejarse solo en casos muy seleccionados15–17.
En la cirugía del gastrinoma esporádico, una vez localizado el tumor, también es debatida la técnica quirúrgica de elección: cirugía conservadora (enucleación) o cirugía de resección tumoral, con linfadenectomía selectiva o linfadenectomía sistemática.
Giovinazzo et al.18 han revisado los resultados de 20 pacientes diagnosticados de síndrome de Zollinger-Ellison en un período de 19 años. Presentaron recidiva tumoral el 8% de los pacientes intervenidos mediante resección tumoral, y el 100% (4 pacientes) a los que se realizó una enucleación. El escaso número de pacientes en esta experiencia no es concluyente sobre el posible beneficio de la cirugía conservadora. Además hay otros factores que han sido identificados como importantes en la recidiva de la enfermedad después de la cirugía: sexo femenino, historia corta de Zollinger-Ellison, niveles elevados de la gastrina sérica en ayunas, tamaño tumoral >3cm y localización pancreática.
Bartsch et al.4 en un estudio retrospectivo que incluye a 48 pacientes con gastrinoma esporádico, con un periodo de seguimiento de hasta 21 años, han analizado los factores pronósticos y la importancia de la linfadenectomía en el pronóstico de la enfermedad. En un grupo de pacientes la linfadenectomía regional se utilizó de manera selectiva y en otro grupo se realizó la linfadenectomía sistemática, que incluye la extirpación de los ganglios pancreáticos, pancreaticoduodenales, del ligamento hepatoduodenal y de los situados entre la aorta y la vena cava. Este último grupo asoció un mayor porcentaje de curación bioquímica de la enfermedad y demostró una tendencia más favorable en los tiempos de supervivencia tanto de la enfermedad específica, como de la libre de enfermedad. En este estudio se observaron los siguientes factores de mal pronóstico: localización pancreática, el tamaño del tumor ≥25mm, Ki-67 de más del 5%, gastrina preoperatoria ≥3.000pg/ml y la presencia de metástasis hepáticas.
La definición de curación por la cirugía del gastrinoma esporádico depende del tiempo de seguimiento de estos pacientes y del estudio que haya sido elegido para este seguimiento14,19. Los resultados son muy favorables si el tiempo es corto y si el análisis de la recidiva de la enfermedad se basa tan solo en la detección radiológica de los tumores. El método diagnóstico más fiel es la determinación de gastrina. De esta manera se estima que la curación alcanza al 40% de los pacientes a los 10 años de la cirugía1,3,19.
La existencia de un gastrinoma primario en un ganglio linfático ha sido motivo de controversia. Esta posibilidad está confirmada por un estudio que demuestra la presencia de células neuroendocrinas en ganglios linfáticos abdominales20. En la literatura hay ejemplos de pacientes que fueron curados a corto y largo plazo después de la cirugía21,22. Norton et al.23 analizan la experiencia de 176 pacientes con el síndrome de Zollinger-Ellison que fueron intervenidos durante un periodo de 17 años y encontraron que 26 pacientes (15%) seguidos durante 10 años cumplieron los criterios de gastrinoma linfático primario. Durante este seguimiento, 16 pacientes (12%) permanecen curados y en 6 pacientes reapareció la enfermedad. Estos autores señalan la dificultad que puede tener el cirujano para predecir en el acto operatorio si el ganglio linfático sospechoso es un gastrinoma primario o una metástasis de un gastrinoma duodenal o pancreático. En casos de duda el cirujano debe proseguir en la búsqueda del tumor primario y la extirpación y biopsia de otras cadenas ganglionares peripancreáticas. De esta manera se evitará dejar inadvertido un gastrinoma que probablemente necesitaría de una cirugía más extensa. En nuestro paciente, la extirpación del nódulo que señalaba la exploración radiológica resultó ser un gastrinoma linfático primario que cumplía los criterios, al presentar una normalización de la gastrina inmediatamente después de la cirugía y ausencia de síntomas clínicos en 9 años de seguimiento.
El debate continua en la cirugía del gastrinoma asociado a NEM-124,25. En estos pacientes la recurrencia de la enfermedad es del 95% a los 3-5 años de la cirugía. La cirugía radical con pancreático-duodenectomía o pancreatectomía subtotal no han demostrado un mayor beneficio que aquellas cirugías, no tan extensas, cuando los tumores han podido ser identificados preoperatoriamente. El objetivo de la operación sería la curación bioquímica de la enfermedad. Norton et al.19 han observado una curación inicial postoperatoria, a los 5 y a los 10 años del 60, 40 y 34% respectivamente. Ellison et al.8 han recogido la experiencia de series quirúrgicas que incluían entre 4 y 48 pacientes, indicando que la curación bioquímica es variable entre un 0 y un 38%. A pesar de la elevada recurrencia de la enfermedad, la cirugía debe indicarse siempre que sea posible, para la prevención de enfermedad metastásica a distancia25. La mortalidad de estos pacientes a largo plazo es la mitad que la de los pacientes no operados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.