La colectomía subtotal y la anastomosis ileoanal con reservorio son la técnica de elección para el tratamiento quirúrgico de la colitis ulcerosa. Su utilización en la enfermedad de Crohn (EC) es controvertida. Se realiza una revisión de la literatura para determinar la evidencia científica actual sobre la utilidad de los reservorios ileoanales en los pacientes con EC. No existen ensayos clínicos que aborden específicamente este tema. La evidencia científica actual se basa en series de casos y en estudios retrospectivos. La EC debería seguir siendo una contraindicación para la anastomosis ileoanal con reservorio. Un reducido número de autores consideran la anastomosis ileoanal con reservorio una buena alternativa para pacientes con EC seleccionados. Ambos grupos coinciden en que los resultados funcionales son buenos.
La evidencia científica actual no recomienda la anastomosis ileoanal con reservorio en pacientes con enfermedad de Crohn.
Ileal pouch-anal anastomosis has become the standard surgical procedure for the treatment of ulcerative colitis and familial polyposis of the colon. Nevertheless, its use in Crohn's disease patients remains controversial. A review was carried out in order to determine the present scientific evidence on the usefulness of ileal pouch-anal anastomosis in Crohn's disease patients. There are no clinical trials analysing this issue. Scientific evidence is based on case series and retrospective studies. Most authors agree that Crohn's disease remains a contraindication for ileal pouch-anal anastomosis, due to the high rate of complications and pouch failure. Nevertheless, a small group of authors consider ileal pouch-anal anastomosis as a good alternative for selected Crohn's disease patients. Both groups agree that if the pouch can be preserved, functional results are good.
According to our review, current scientific evidence does not recommend ileal pouch-anal anastomosis for Crohn's disease patients.
Desde su primera descripción en 1978 por Parks et al1, la panproctocolectomía con reservorio ileoanal (RIA) se ha convertido en la técnica de elección para el tratamiento quirúrgico de la colitis ulcerosa (CU) y la poliposis colónica familiar2,3. Sin embargo, su utilización en pacientes con enfermedad de Crohn (EC) continúa siendo controvertida. Así, aunque la mayor parte de la comunidad medicoquirúrgica considera que la EC es una contraindicación absoluta para la realización de un reservorio ileoanal, debido a la alta tasa de complicaciones que conlleva, algunos autores han comunicado buenos resultados con esta técnica en ese tipo de pacientes.
La alternativa al RIA en los pacientes con EC que requieren una panproctocolectomía es, en la mayoría de las ocasiones, la ileostomía terminal definitiva, con las inevitables consecuencias biopsicosociales que esto conlleva, especialmente en pacientes jóvenes con una expectativa de vida elevada. Por ello, es de interés plantearse cuál es la evidencia científica actual para poder indicar —o contraindicar— esta técnica en pacientes con EC. Éste fue el objetivo del presente estudio.
Experiencias previasLa controversia sobre la posibilidad de realizar reservorios ileanales en pacientes con EC tiene su origen en los primeros trabajos que buscaron soluciones distintas a un mismo problema. Por un lado, los autores que analizaron las anastomosis ileoanales o ileorrectales, aunque sin realizar, por entonces, ningún tipo de reservorio y, por otro, los que analizaron los reservorios en ileostomías terminales. Así, Watts et al4 en 1977 comunicaron buenos resultados para la anastomosis ileorrectal, tanto para pacientes con EC como para pacientes con CU sometidos a colectomía total. Ese mismo año, Flint et al5 comunicaron sus buenos resultados sobre 37 pacientes con EC, pero sin enfermedad perianal, en los que se realizaba anastomosis ileorrectal de forma electiva. Posteriormente, Ambrose et al6, del grupo de Birmingham, aseguraron que la anastomosis ileorrectal es una buena alternativa para pacientes con EC seleccionados. No obstante, conviene tener en cuenta que, a pesar de concluir que es una buena alternativa, la tasa de reoperación a los 10 años fue de casi el 50% y la tasa de recurrencia, el 64%. Conclusiones similares obtuvieron Longo et al7 considerando la anastomosis ileoanal como una alternativa cuando el recto no presenta actividad de la enfermedad y la función esfinteriana se encuentra conservada. Por su parte, Grobler et al8 concluyeron que, aunque la tasa de complicaciones es elevada tras la proctocolectomía restauradora, sus resultados funcionales son buenos.
Por otro lado, los reservorios de Kock (ileostomías continentes) se empezaron a realizar tanto para EC como para CU. Nils Kock seleccionó a pacientes con enfermedad limitada al colon, la mayoría diagnosticados inicialmente de CU pero cuyo diagnóstico definitivo había cambiado a EC9. De este modo, de los 280 pacientes tratados con reservorios de Kock, 49 tenían EC. Un paciente murió en el postoperatorio y el 27% tuvo complicaciones. En 8 (16%) el reservorio tuvo que ser retirado, en 4 de ellos por recurrencia de la enfermedad. De los 40 pacientes restantes, otros 17 tuvieron recurrencia, 6 en el segmento ileal proximal del reservorio, 5 en el reservorio solamente y 6 en ambos sitios. Como resultado final, 37 pacientes (de 49) tuvieron una ileostomía continente. Con estos resultados, Kock et al9 concluyeron que solamente se debería realizar este procedimiento en casos seleccionados de EC. Otros autores10 también comunicaron malos resultados con esta técnica y consideraron que la EC es una contraindicación firme a su realización.
Situaciones por las que se decide realizar un RIA en un paciente con ECExisten dos escenarios en los que un paciente con EC puede ser candidato a un RIA. El primero de ellos, posiblemente el más frecuente en la práctica diaria y con el que la mayoría de los especialistas se habrá encontrado en alguna ocasión, corresponde a los pacientes cuyo diagnóstico inicial no es de EC, sino de CU o colitis indeterminada (CI). De hecho, el diagnóstico diferencial entre la EC y la CU es, en ocasiones, extremadamente difícil de establecer, de forma que algunos autores han considerado que estas dos enfermedades son indistinguibles en un 10–15% de los casos11. Esto sería especialmente cierto en pacientes con una inflamación intestinal grave, en quienes las ulceraciones profundas pueden atravesar múltiples capas de la pared del intestino, con o sin granulomas, sin otros hallazgos que permitan confirmar la EC12. Según Peyrègne et al13, la dificultad para el diagnóstico radica en que la presencia de granulomas no es constante en la EC y puede verse también en otras patologías, como la CU y la enteritis infecciosa, o en los rectos desfuncionalizados. Las ulceraciones en forma de fisuras pueden verse en las diverticulitis. Los abscesos crípticos reflejan la actividad de la enfermedad y tampoco son específicos. La colitis fulminante es, asimismo, una conocida causa de confusión, debido a la inflamación discontinua y transmural que se produce. De este modo, en un porcentaje considerable de pacientes el diagnóstico de EC se establece tras el estudio anatomopatológico de la pieza de resección quirúrgica o tras la aparición de complicaciones postoperatorias propias de la EC, una vez que el RIA ya está confeccionado. En este supuesto, se plantea una situación no deseada previamente, en la que el paciente es portador de un RIA que, de haberse conocido el diagnóstico con anterioridad, no se habría realizado.
El segundo escenario correspondería al paciente ya diagnosticado de EC en el que, por el motivo que fuere, es necesario realizar una colectomía total y se decide, de forma electiva, la restauración del tránsito digestivo mediante el RIA.
Manifestaciones clínicasLos síntomas clínicos aparecidos más frecuentemente en el RIA de la EC consisten en diarrea, dolor abdominal y molestias pelvianas, similares a los síntomas de la reservoritis y al síndrome del reservorio irritable que se ve en los pacientes con CU14. Shen et al14 clasificaron la afección del RIA en la EC en 3 tipos: EC inflamatoria, EC fibroestenótica y EC fistulizante. Según su análisis, las características demográficas y clínicas no serían diferentes entre los tres grupos, aunque los síntomas predominantes sí que se relacionaron con los diferentes fenotipos, de forma que el 92% de los pacientes con EC inflamatoria tuvieron diarrea y/o dolor, el 64,7% de los pacientes con EC fibroestenótica tuvieron síntomas oclusivos y el 51,6% de los pacientes con EC fistulizante tuvieron síntomas de drenaje fistuloso. La EC fistulizante se asoció numéricamente con un mayor riesgo de fallo del reservorio. El principal factor de riesgo para la EC inflamatoria sería la puntuación de la endoscopia del asa aferente; para la EC fibroestenótica, serían la puntuación de la endoscopia del asa aferente y del asa ciega, y para la EC fistulizante, el sexo femenino, la menor edad, el diagnóstico preoperatorio de CI y uso de antiinflamatorios no esteroideos15. Según esos autores, como cada fenotipo se asocia con unos factores de riesgo, su etiología sería también diferente. Por lo tanto, la identificación y el manejo de algunos factores de riesgo modificables podrían reducir la morbilidad asociada con el RIA en la EC.
Ettore et al16 analizaron los cambios histológicos que se producían en los RIA, tanto en la EC como en la CU. Según sus análisis, aunque la reservoritis fue más frecuente en los pacientes con EC (el 56 frente al 28%) los cambios histológicos (incluida la displasia) fueron similares en ambas enfermedades. Por lo tanto, aunque el íleon terminal de los pacientes con EC parece más predispuesto a la inflamación clínica que en los pacientes con CU, las diferencias histológicas no son significativas. No obstante, las lesiones perianales y las fístulas, como las fístulas reservorio-cutáneas, reservorio-vejiga y reservorio-vagina, en ausencia de complicaciones posquirúrgicas tales como abscesos, fallo anastomótico o sepsis, deberían indicar el diagnóstico de EC14. Las fístulas y los abscesos pueden ser complicaciones postoperatorias de una CU. Generalmente, debería considerarse el diagnóstico de EC si las fístulas o los abscesos se desarrollan más de 12 meses tras la realización del RIA y si hay granulomas en la histología14. Las lesiones ulceradas en el asa aferente, proximal al reservorio, y las estenosis ulceradas en ausencia de terapia antiinflamatoria no esteroidea también indicarían EC14,17.
Resultados de los diferentes estudiosDe acuerdo con los dos escenarios descritos anteriormente, los estudios que han evaluado la utilidad de los RIA en la EC se pueden dividir en dos tipos: a) estudios con diagnóstico preoperatorio de EC, y b) estudios con diagnóstico postoperatorio de EC.
Estudios con diagnóstico preoperatorio de ECEn este tipo de estudios se incluyen los trabajos de un reducido grupo autores que han considerado la realización de los RIA de manera electiva en pacientes diagnosticados de EC. Entre ellos, el grupo del Hospital Lariboisière de París (Francia) y del Hospital Queen Elizabeth de Birmingham (Reino Unido) son los que más experiencia han acumulado con el paso de los años. En 1996, Panis et al18,19 comunicaron los resultados de 31 pacientes intervenidos de manera electiva entre 1985 y 1992. Según sus datos, no habría diferencias en cuanto a morbimortalidad o funcionalidad del reservorio comparando la CU con la EC. Posteriormente, esos mismos autores20 confirmaron que los buenos resultados se mantenían a largo plazo, con un seguimiento medio de 10 años. Por el contrario, Mylonakis et al21, comparando los resultados del RIA con los de la ileoproctostomía en pacientes con EC, encontraron mayor tasa de complicaciones en el RIA, aunque los resultados funcionales cuando se conseguía mantener el reservorio eran buenos.
La principal ventaja de este tipo de estudios es que el diagnóstico de EC puede considerarse como cierto antes de la intervención quirúrgica, lo que disminuye la influencia del error diagnóstico en los resultados. No obstante, presentan serias limitaciones. La más importante es que se trata de series de casos, en los que no hubo aleatorización de pacientes y, por lo tanto, la decisión de realizar una u otra técnica quirúrgica se basa en las características de cada paciente, lo que dificulta las comparaciones. Por otra parte, los criterios de selección en estos estudios suelen establecerse de manera arbitraria, lo que impide el análisis de los factores relacionados con la mayor o menor efectividad de la técnica. En los trabajos de la escuela parisina, así como en los de la escuela británica, los RIA se practicaron únicamente en pacientes libres de afección ileal o rectal. Es decir, las indicaciones para realizar una u otra técnica fueron diferentes, por lo que resulta imposible establecer qué pacientes serían buenos candidatos al RIA y cuáles no.
En resumen, no existen ensayos clínicos aleatorizados que permitan comparar el RIA con otras técnicas en pacientes con EC. Hasta la fecha, los únicos estudios prospectivos disponibles son series de casos, que cuentan con un reducido número de pacientes y en los que se recomienda el RIA únicamente en pacientes seleccionados, que no presenten actividad rectal o ileal de su enfermedad.
Estudios con diagnóstico postoperatorio de ECDado que, como se ha visto, es relativamente frecuente que pacientes diagnosticados de CU sean diagnosticados finalmente de EC —una vez realizada la colectomía y, por lo tanto, el RIA—, éstos son los estudios más abundantes en la literatura. En este grupo de estudios pueden distinguirse, asimismo, dos subtipos: los que analizan de forma genérica los factores de riesgo para el fallo de un RIA y concluyen que el diagnóstico de EC es uno de estos factores, y los que analizan de manera específica a un subgrupo de pacientes diagnosticados de EC y comparan sus resultados con los de un grupo diagnosticado de CU:
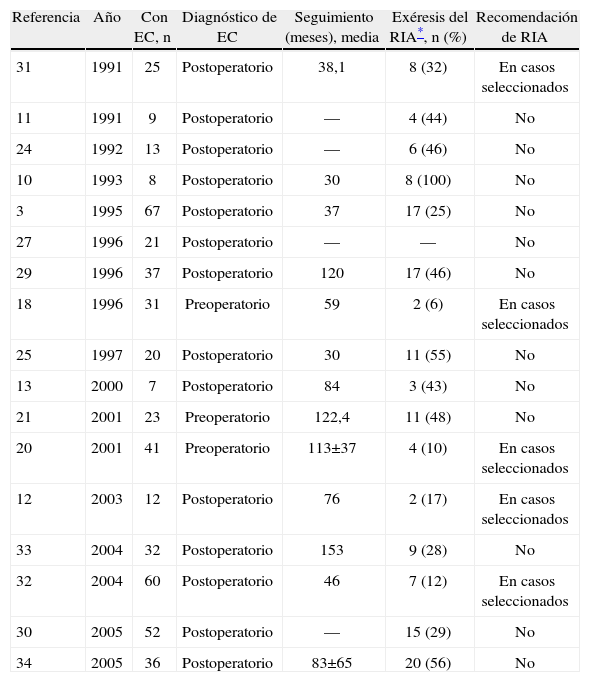
Estudios que analizan los factores de riesgo de los RIAEn un estudio retrospectivo sobre más de 1.000 pacientes con RIA, Fazio et al3 analizaron los factores de riesgo de complicaciones y de fallo del reservorio. Aunque el número de pacientes diagnosticados finalmente de EC fue únicamente de 67, de los 34 pacientes con fallo del reservorio, 17 fueron diagnosticados de EC, lo que supone una elevada tasa de fallo en este grupo. Sin embargo, una de las conclusiones positivas de su estudio fue que los resultados funcionales y la calidad de vida eran similares en la EC, la CU y la CI. El mismo autor22 en 2003 propuso un modelo para cuantificar el riesgo de fallo del RIA, en el que se incluía el diagnóstico de EC como uno de los factores con mayor influencia. Según ese análisis, el riesgo de perder el reservorio fue 9 veces mayor en los pacientes con EC en el análisis univariable y 4 veces mayor en el análisis multivariable al introducir factores de confusión relacionados con la EC, tales como la presencia de fístulas o la sepsis perianal. Foley et al23 encontraron que la necesidad de ileostomía tras el fallo de un RIA era mucho mayor en pacientes con EC cuando se los comparó con pacientes con CU (el 36,8 frente al 1,4%). Así, un diagnóstico de EC podía predecir, significativamente, la necesidad posterior de ileostomía tras la realización de un RIA. Resultados similares obtuvieron Gemlo et al24, que concluyeron que los malos resultados funcionales, la sepsis pelviana y un diagnóstico no sospechado de EC eran los factores relacionados más directamente con el fallo del reservorio. MacRae et al25 estudiaron a 551 pacientes con RIA y encontraron que las anastomosis manuales, la tensión en el reservorio, el uso de una ileostomía de desfuncionalización y el diagnóstico de EC se asociaban con un mayor riesgo de fallo del reservorio. Ozuner et al26 no encontraron que la EC fuera un factor de riesgo de exéresis, aunque admitían que el número de pacientes era demasiado bajo para obtener diferencias significativas. Paye et al27 analizaron exclusivamente las fístulas de los RIA y encontraron que la EC no sospechada era uno de los factores de riesgo relacionados con su aparición. Rossi et al28 encontraron que, de 75 pacientes sometidos a RIA por sospecha de CU, el 45% de los que tuvieron abscesos o fístulas y todos los que presentaron abscesos presacros como consecuencia de la dehiscencia anastomótica fueron posteriormente diagnosticados de EC. En resumen, según la mayoría de los autores, el diagnóstico de EC tras la realización de un RIA por sospecha de CU es uno de los factores de riesgo más importantes de que se produzca el fallo del reservorio.
Estudios que analizan solamente pacientes con ECDiversos autores han comunicado pobres resultados con los RIA realizados en pacientes con EC8,13,29–31. El denominador común de todos estos estudios es que los RIA presentan una tasa de complicaciones excesivamente elevada, lo que contraindica o al menos no hace recomendable su realización en pacientes con EC. No obstante, todos los trabajos coinciden en que, si se consigue mantener el reservorio, los resultados funcionales son buenos, equiparables a los obtenidos en la CU. Sin embargo, no todos los autores coinciden con estas conclusiones. De este modo, Hartley et al32 encontraron una menor tasa de complicaciones (12%), lo que los llevó a apoyar la realización de estudios prospectivos para evaluar la utilidad de los RIA en pacientes seleccionados con EC. No obstante, conviene tener presente que, cuando el diagnóstico se fundamentó en las manifestaciones clínicas, el porcentaje de complicaciones fue mayor que cuando éste se basó en el análisis anatomopatológico. Como sucedió también en otros estudios33,34, las características preoperatorias, como afección rectal activa, no fueron predictivas del fallo del RIA, por lo que, aunque el RIA podría ofrecerse a pacientes seleccionados y especialmente motivados, la falta de criterios para poder determinar los factores de riesgo de fallo hace difícil la decisión. El único estudio español sobre este tema, publicado por De Oca et al12, no fue capaz de demostrar diferencias significativas en cuanto a complicaciones a corto o largo plazo de los RIA realizados en pacientes con CU frente a los RIA realizados en pacientes con EC. Así, no encontraron que la EC, por sí misma, fuera un factor de riesgo de exéresis del reservorio. No obstante, los autores admitieron que sus resultados eran insuficientes para recomendar el RIA en pacientes con EC.
La principal limitación de este tipo de estudios radica en el sesgo de selección que suponen, pues el RIA solamente se realiza en los pacientes con síntomas o signos de colitis ulcerosa y no en todos los casos de EC. Quizá los resultados en pacientes seleccionados con EC que presentasen ciertas características pudiesen ser diferentes. En resumen, la mayoría de los autores coinciden en que la tasa de complicaciones de los RIA realizados en pacientes por sospecha de CU y que finalmente son diagnosticados de EC es excesivamente elevada. No obstante, cuando se consigue mantener el reservorio los resultados funcionales son buenos.
Explicación de las diferencias entre estudiosEs difícil interpretar las importantes diferencias observadas según los distintos autores en cuanto a los resultados, especialmente la proporción de pacientes que requirieron la exéresis del RIA en el seguimiento (tabla 1). Una posible explicación a estas diferencias pudiera ser la variabilidad en los criterios establecidos para el diagnóstico de EC. Según Brown et al34, los pacientes con EC tendrían un pronóstico mucho peor que los pacientes con CI y éstos, a su vez, peor que la CU. De este modo, existe cierto consenso en que los resultados del RIA en pacientes con CI y con CU son buenos, mientras que los de la EC son, como se ha visto anteriormente, mucho peores. Así, es posible que los estudios que presentan mejores resultados hayan incluido a pacientes que otros autores habrían considerado CI. De hecho, las tasas de complicaciones son proporcionalmente más altas cuando el diagnóstico de EC se basa en la presencia de granulomas epitelioides35. Además, no es lo mismo que el diagnóstico se base en las manifestaciones clínicas que en criterios anatomopatológicos, como confirmaron Hartley et al32. Por otra parte, la presencia de reservoritis crónicas o resistentes a tratamiento se ha considerado, en ocasiones, como un dato propio de una EC no diagnosticada preoperatoria o peroperatoriamente, aunque Subramani et al36 no encontraron que esta asociación fuese cierta. Del mismo modo, como apuntaron Goldstein et al37 tras la revisión de 8 piezas de resección quirúrgica de pacientes diagnosticados de CU que tuvieron complicaciones propias de la EC, la aparición de complicaciones similares al Crohn en el postoperatorio o años después de la realización de un RIA por la sospecha de CU no debe modificar el diagnóstico inicial, a no ser que se reexaminen las piezas originales. Por otra parte, Fazio et al3 analizaron dos periodos concretos de estudio (1983–1988 frente a 1989–1993), y encontraron mayor tasa de complicaciones y de exéresis del reservorio en el primer periodo. Resultados similares obtuvieron De Oca et al12. Por ello, habría que valorar también el grado de especialización del cirujano o del centro para poder comparar resultados. De igual modo, conviene tener presente que los pacientes con EC representan un diferente grado de actividad de la enfermedad, con un comportamiento biológico distinto, de forma que, cuando el diagnóstico se establece por complicaciones postoperatorias, habría un importante sesgo, pues se trataría de un grupo con un comportamiento, a priori, más agresivo. Por otra parte, dado que el RIA no es un tratamiento curativo de la enfermedad de base, pues la EC debe ser considerada crónica, el tiempo de seguimiento podría tener cierta influencia en los resultados. Finalmente, en la mayoría de los estudios que han analizado los resultados de los RIA en pacientes con EC, se los comparó con los obtenidos en pacientes con CU. Los resultados del RIA en los pacientes con EC son, indiscutiblemente, peores que los obtenidos en pacientes con CU o poliposis colónica familiar. Sin embargo, en un interesante editorial sobre este tema, Phillips38 afirmó que esta situación es como comparar manzanas con naranjas, ya que se trata de enfermedades distintas. Los resultados del RIA en los pacientes con EC no parecen peores que los obtenidos para cualquier otra técnica restauradora en la EC. Por lo tanto, no se debería comparar la EC con la CU, sino las diferentes técnicas realizadas en la EC entre sí.
Algunos estudios en los que se analizan los resultados de los RIA en la EC
| Referencia | Año | Con EC, n | Diagnóstico de EC | Seguimiento (meses), media | Exéresis del RIA*, n (%) | Recomendación de RIA |
| 31 | 1991 | 25 | Postoperatorio | 38,1 | 8 (32) | En casos seleccionados |
| 11 | 1991 | 9 | Postoperatorio | — | 4 (44) | No |
| 24 | 1992 | 13 | Postoperatorio | — | 6 (46) | No |
| 10 | 1993 | 8 | Postoperatorio | 30 | 8 (100) | No |
| 3 | 1995 | 67 | Postoperatorio | 37 | 17 (25) | No |
| 27 | 1996 | 21 | Postoperatorio | — | — | No |
| 29 | 1996 | 37 | Postoperatorio | 120 | 17 (46) | No |
| 18 | 1996 | 31 | Preoperatorio | 59 | 2 (6) | En casos seleccionados |
| 25 | 1997 | 20 | Postoperatorio | 30 | 11 (55) | No |
| 13 | 2000 | 7 | Postoperatorio | 84 | 3 (43) | No |
| 21 | 2001 | 23 | Preoperatorio | 122,4 | 11 (48) | No |
| 20 | 2001 | 41 | Preoperatorio | 113±37 | 4 (10) | En casos seleccionados |
| 12 | 2003 | 12 | Postoperatorio | 76 | 2 (17) | En casos seleccionados |
| 33 | 2004 | 32 | Postoperatorio | 153 | 9 (28) | No |
| 32 | 2004 | 60 | Postoperatorio | 46 | 7 (12) | En casos seleccionados |
| 30 | 2005 | 52 | Postoperatorio | — | 15 (29) | No |
| 34 | 2005 | 36 | Postoperatorio | 83±65 | 20 (56) | No |
EC: enfermedad de Crohn; RIA: reservorio ileoanal.
En resumen, estas y otras dificultades diagnósticas podrían haber alterado, en uno u otro sentido, el resultado de algunos trabajos, lo que justificaría, al menos en parte, las diferencias encontradas.
Manejo de un RIA en un paciente con ECAnalizadas las causas y las consecuencias de los RIA en pacientes con EC, conviene plantearse, por último, qué se debe hacer cuando estos reservorios ya están presentes en un paciente con EC, es decir, cuál es el manejo ideal de los RIA en pacientes con EC.
El primer concepto que conviene dejar claro es que, si no hay complicaciones del reservorio y dado que los resultados funcionales a largo plazo son buenos, no es obligatorio convertir un RIA en una ileostomía terminal simplemente porque no se la considere una buena opción en estos casos. Es decir, una vez se tiene el RIA en el paciente con EC, es necesario poner todos los medios al alcance para preservar su funcionalidad. No obstante, dada la baja frecuencia con la que se realizan RIA en pacientes con EC, los datos sobre el tratamiento disponibles en la literatura son escasos. Así, antes de la generalización de las terapias inmunomoduladoras y biológicas, la mayoría de las complicaciones debían ser tratadas con la desfuncionalización o con la exéresis del reservorio. Actualmente, sin embargo, la utilización de multitud de fármacos, entre ellos antibióticos, aminosalicilatos, corticoides, inmunomoduladores y anti-TNF (infliximab, adalimumab, etc.)14, y de terapias endoscópicas permite mantener el reservorio en muchos pacientes18,39,40. Berrebi et al41 comunicaron buenos resultados con azatioprina para el tratamiento de la recurrencia de la EC en 2 reservorios ileoanales. Según su experiencia, los tratamientos inmunosupresores serían una buena alternativa a la ileostomía en estos pacientes. Hartley et al32 también demostraron el papel beneficioso de los inmunosupresores (azatioprina y 6-mercaptopurina) en la prevención de la recidiva de la enfermedad en los pacientes en que se había modificado el diagnóstico de CU a EC. Ricart et al42 comunicaron buenos resultados con 1-4 infusiones de infliximab a dosis de 5mg/kg para el tratamiento de complicaciones del RIA en 7 pacientes diagnosticados de EC, incluso para lesiones fistulosas, con cierre de los trayectos. Por otra parte, las lesiones fibroestenóticas pueden ser tratadas bien con dilataciones neumáticas14, bien con estenoplastia40.
En resumen, la recurrencia de la enfermedad o la aparición de complicaciones en el RIA de pacientes con EC no predicen, necesariamente, la necesidad de exéresis o de desfuncionalización. Aunque la tasa de complicaciones es elevada, es probable que pueda mantenerse la funcionalidad del reservorio.
No existe suficiente evidencia científica para poder recomendar la realización de un reservorio ileoanal en pacientes con EC sometidos a colectomía total. La mayoría de los grupos consideran que la EC es una contraindicación para realizar un RIA. Por otro lado, los grupos con mejores resultados en estas situaciones recomiendan realizarlo en pacientes seleccionados, especialmente cuando no haya afección en el íleon y en el recto. Aunque la tasa de exéresis o desfuncionalización del reservorio es elevada en los pacientes con EC; en caso de que éste pueda mantenerse con tratamientos médicos y endoscópicos, los resultados funcionales son buenos, equiparables a los RIA realizados por otros motivos.