En el sigloIV, durante la dinastía china Dong Jin, el médico Ge Hong describió con buenos resultados la administración oral de una suspensión preparada a base de heces humanas en pacientes con intoxicación alimentaria o diarrea severa. De 5 años a la fecha se inicia el trasplante de microbiota fecal con el fin de tratar diversos padecimientos y no solo la diarrea severa por Clostridium difficile. Este trabajo de investigación tiene como objetivo confirmar que el trasplante de microbiota intestinal logra reducir el impacto negativo de diversas enfermedades como la diarrea severa, el síndrome de intestino irritable, la ansiedad, las alergias y el síndrome metabólico. Este estudio preliminar trata de 6 pacientes a quienes se realizó trasplante de microbiota intestinal, con edades de 83, 76, 66, 37 y 36 años (4 hombres y 2 mujeres).
En ellos se realizó trasplante de microbiota intestinal y se observó mejora sintomática hasta del 70%. Los resultados se consignan en 3 tablas.
La metodología seguida para el trasplante de microbiota es la misma que la de otros investigadores para el tratamiento de la diarrea por C. difficile y otras enfermedades.
La discusión aborda los problemas planteados en otras partes del mundo en el manejo de diferentes entidades patológicas, así como los avances genéticos obtenidos.
En las conclusiones se presentan resultados alentadores.
In the fourth century, during the Chinese Dong Jin dynasty, the doctor Ge Hong described good results after the oral administration of a suspension prepared from human faeces in patients with severe diarrhoea or food poisoning. Faecal microbiota transplantation has been used for five years in order to treat different diseases in addition to the severe diarrhoea caused by Clostridium difficile1.
This paper aims to confirm that intestinal microbiota transplantation succeeds in reducing the negative impact of diseases such as severe diarrhoea, irritable bowel syndrome, anxiety, allergies, metabolic syndrome and others and that it is not only indicated for severe diarrhoea caused by C. difficile.
This preliminary study included six patients who underwent faecal microbiota transplantation, aged 83, 76, 66, 37 and 36 years (four men and two women). An improvement in symptoms of 70% was observed. The methodology and criteria to be followed with donors are described and the results are listed in three tables.
The methodology followed for the microbiota transplant is the same as that reported by other researchers for the treatment of C. difficile diarrhoea and other diseases.
The discussion addresses the issues raised in other parts of the world in handling different pathologic entities, as well as genetic advances.
The conclusions show encouraging results.
La microbiota intestinal es el ecosistema microbiano del intestino; incluye especies nativas que colonizan el tracto gastrointestinal para siempre y un grupo variable de microorganismos vivos que se detectan por periodos. Las bacterias nativas se adquieren al nacer, durante el primer año de vida, mientras que las bacterias en tránsito se adquieren a través de los alimentos, bebidas u otras fuentes.
El término microbiota define a la comunidad de microorganismos vivos residentes en el intestino. La microbiota del intestino humano es una de las comunidades bacterianas con mayor densidad. Una vez establecida la microbiota en un individuo, cambia poco con el tiempo. Los cambios en la microbiota intestinal, el aumento de la permeabilidad intestinal y la endotoxemia posiblemente juegan un papel importante en el desarrollo del estado inflamatorio crónico.
Existen factores extrínsecos como la carga microbiana del ambiente, factores microbianos cotidianos como hábitos y tipos de alimentos, composición de la microflora materna, estrés, y el consumo de agua clorada que provocan alteraciones menores comparadas con las producidas por el consumo regular de antiinflamatorios, laxantes, antiácidos, antibióticos, la quimio y la radioterapia. Los cambios que se generan en el intestino por los factores anteriormente señalados impactan en el equilibrio de la microbiota intestinal, reducen las poblaciones dominantes y favorecen la emergencia de patógenos oportunistas.
Existen factores intrínsecos como la carga genética, fisiología del huésped y nutrición endógena que alteran, igualmente, el equilibirio de la microbiota.
Los factores mencionados conducen al fenómeno llamado disbiosis, que consiste en las alteraciones cualitativas o cuantitativas de la microbiota del tubo digestivo, y que producen sobrecrecimiento o reducción de la microbiota. Existen, actualmente, agentes bioterapéuticos como los probióticos, prebióticos y simbioticos para mantener el equilibrio harmonioso de la microbiota. Pueden ser administrados como parte de la dieta.
Los datos experimentales sugieren que la microbiota ejerce funciones metabólicas, que contribuyen a la recuperación de nutrientes y energía de sustratos no digeribles; además, la colonización microbiana es esencial para el desarrollo normal del sistema inmune, de modo que parece influir en la homeostasis, entre carga antigénica ambiental y respuesta inmune, como sucede en la enfermedad inflamatoria crónica del intestino, en la que el sistema inmune reacciona frente a antígenos microbianos no nocivos1.
El conocimiento sobre la composición bacteriana de la microbiota intestinal se basaba principalmente en la información obtenida por cultivo de muestras de heces o de biopsias intestinales. En el análisis bacteriológico convencional de la flora fecal por aislamiento de bacterias anaerobias estrictas, estas superan en número a las aerobias, por un factor de al menos 100 o 1,000 especies anaerobias por cada especie aerobia. Según la metodología tradicional, los géneros predominantes son Bacteroides, Bifidobacterium, Eubacterium, Clostridium, Lactobacillus, Fusobacterium y diversos cocos anaerobios. No obstante, los investigadores siempre han estado conscientes de que la información obtenida por cultivo es incompleta, porque las técnicas de cultivo de anaerobios en el laboratorio tienen muchas limitaciones y porque más del 50% de las células bacterianas observadas mediante examen microscópico de muestras fecales no se recuperan en medios de cultivo2. La microbiota es el conjunto de microorganismos que se localizan de manera normal en distintos sitios del cuerpo humano. Su composición incluye virus, hongos, protozoarios, arqueas y bacterias. Las arqueas son microorganismos unicelulares de morfología procariota (sin núcleo ni organelos membranosos internos), son diferentes a las bacterias. Estos microorganismos, junto con el resto de la microbiota, son trascendentes en las acciones positivas del trasplante de microbiota fecal3.
El trasplante fecal es la infusión de suspensión de heces procedentes de un individuo sano hacia el tubo digestivo de un enfermo. Recibe diversas denominaciones, como bacterioterapia fecal, repoblación fecal, reconstitución de flora fecal, transferencia de microbiota intestinal. Sin embargo, el nombre más utilizado en la literatura es trasplante de microbiota fecal pues se trata de un verdadero trasplante.
Nosotros denominamos al procedimiento trasplante de microbiota intestinal, ya que no se trata de heces fecales sino del resultado de un procedimiento que las diluye y precipita, por lo que es mejor denominarlas de esta manera.
Material y métodoEquipo usado: enteroscopio Olympus de un balón.
Se presenta el estudio preliminar de 6 pacientes a quienes se realizó trasplante de microbiota intestinal. Con edades de 83, 76, 66, 37 y 36 años (4 hombres —2 de 83 años— y 2 mujeres), estos pacientes cursaban con 2, 6, 7, 9 y 10 padecimientos diferentes, respectivamente (2 pacientes con 2 comorbilidades). El trasplante fue en 3 casos a través del yeyuno; en 2 casos en colon y en un caso mixto (yeyuno y colon).
En todos los casos hubo mejoría clínica de algunos síntomas, que variaron de 5 a 7 en escala de 0 a 10. En ninguno caso aparecieron complicaciones de ningún tipo (eructos, náuseas, calambres abdominales u otros).
MaterialCasos clínicosCaso 1 (RMS)Masculino de 83 años que cursa con ansiedad de 7 en escala de 0 a 10, asma bronquial, síndrome de intestino irritable, variedad diarrea, con 6 evacuaciones al día y dolor abdominal en flanco izquierdo, hipertensión arterial, arritmia completa por fibrilación auricular, insuficiencia vascular periférica en ambas piernas, hipoacusia de oído derecho, hipertrofia prostática benigna y obesidad.
Se administraron 200ml de microbiota en colon ascendente, 100ml en colon transverso y 200ml en colon descendente. Se detectaron ulceraciones tipo amibiasis en colon sigmoides, con colon espástico. No hubo complicaciones por el trasplante.
Al finalizar el trasplante cedió el broncoespasmo. Decidimos no administrar metronidazol para la amibiasis, dimos quinfamida y se retiró la urgencia para evacuar. No administramos ansiolíticos y la ansiedad la observamos de 4 (escala de 0 a 10). Ingresó con 7. A los 3 días la diarrea disminuyó a 2 al día. El dolor abdominal desapareció. Los estudios de laboratorio reportaron ácido úrico de 7.5.
Caso 2 (LRR)Masculino de 83 años que cursa con enfermedad celiaca con evacuaciones diarreicas de 6 a 8 al día y ansiedad de 8, en escala de 0 a 10.
Se administraron 500ml de microbiota a través de enteroscopia en yeyuno.
Se detectó pólipo gástrico, que se extirpará posteriormente.
Al quinto día las evacuaciones diarreicas fueron cediendo hasta quedar solo en 2, tolerables. La ansiedad disminuyó a 4.
Caso 3 (EHT)Femenina de 76 años, que cursa con ansiedad de 7 (escala de 0 a10), enfermedad diverticular del colon, síndrome de intestino irritable, variedad mixta; con 5 evacuaciones en días alternos y dolor abdominal en colon. Diabetes mellitus tipo 2, estable del adulto, hipertensión arterial e insuficiencia vascular periférica en miembro podálico derecho, con úlcera varicosa cicatrizada.
Se realiza trasplante de microbiota intestinal, aplicando 200ml en colon ascendente, 100ml en colon transverso y 200ml en colon descendente, sin complicaciones. Se encontró enfermedad diverticular del colon hasta ángulo hepático y espasmos del colon moderados. La ansiedad disminuyó a 4 (escala de 0-10) a la semana y la diarrea, al tercer día, era de una deposición diaria. El dolor en marco cólico persistió durante 2 semanas, hasta desaparecer.
Caso 4 (MVMA)Femenina de 66 años, que cursa con ansiedad de 8 (escala de 0 a 10), fibromialgia, síndrome de intestino irritable, variedad diarrea, con 3 evacuaciones al día y dolor en colon sigmoides. Gastropatía medicamentosa, neuralgia facial del lado izquierdo, dislipidemia, hígado graso, diabetes mellitus tipo 2 estable del adulto, obesidad y alergia al frío.
Se realiza trasplante de microbiota intestinal en yeyuno y colon: 250ml en yeyuno, a través de enteroscopio, 100ml en colon ascendente, 50ml en colon transverso y 100ml en colon descendente. No hubo complicaciones. Se detectó hernia hiatal de 3cm (posiblemente quirúrgica), gastropatía y colon espástico. Se administra tratamiento para la hernia hiatal (inhibidores de la bomba de protones).
Al día siguiente presentó evacuaciones diarreicas en número de 8 y dolor abdominal. La paciente señaló numerosos conflictos personales de múltiples orígenes. Se dan Lactobacillus LB, Lactobacillus fermentum y Lactobacillus delbrueckii 4 tabletas juntas y luego una cada 12h, durante 4 semanas; bromuro de pinaverio, una cada 8h durante 2 semanas. Al terminar, una cada 12h por 2 meses; mesalazina, tabletas de 500mg una cada 8h durante una semana; butil-hioscina, tabletas de 10mg una cada 8h durante 4 días, y continuar con pantoprazol de 40mg, una tableta cada 12h por 4 semanas. Las evacuaciones y el dolor ceden paulatinamente hasta retirarse completamente en 2 semanas.
A la fecha, la fibromialgia no presenta actividad. El ultrasonido de control del hígado graso redujo de segundo a primer grado. La ansiedad disminuyó a 6 (escala de 0 a 10).
Caso 5 (JLHF)Masculino de 37 años que cursa con síndrome de mala absorción intestinal y ansiedad de 9 (escala de 0 a 10). Con diarrea en número de 6, así como dolor abdominal. El cuadro le ha hecho perder 12kg en un mes, y hay hiporexia, astenia y adinamia. Se realiza trasplante de microbiota intestinal por vía yeyunal (500ml), y se toman biopsias de yeyuno (4). Persistió la diarrea, hasta una semana en la que se corrigió totalmente, dejó de bajar de peso y solo persistió el dolor abdominal, que cedió en 2 semanas. La ansiedad disminuyó a 3 (escala de 0 a 10). Las biopsias confirmaron el diagnóstico de síndrome de mala absorción con vellosidades disminuidas en tamaño.
Caso 6 (CCZ)Masculino de 36 años, que cursa con ansiedad de 8 (escala de 0 a 10), síndrome metabólico (hipertensión arterial, hígado graso y obesidad), y alergia a determinar. Se realiza trasplante de microbiota intestinal y se detecta hernia hiatal de 4cm con esofagitis (posiblemente quirúrgica) y 3 úlceras esofágicas. Datos de Helicobacter pylori. Se administraron por yeyuno 500ml de microbiota a través de enteroscopio, sin complicaciones.
Se da seguimiento a un mes del trasplante de microbiota intestinal y refiere que la ansiedad ha disminuido hasta 5 (de 0 a 10), así como rechazar la ingesta de grasa (tacos, cerdo, refrescos, o platos abundantes). Ya no se marea. No lleva una dieta obligada. Bajó 1kg y 2 tallas. Se trató la hernia hiatal con inhibidores de la bomba de protones, así como con procinéticos y mejoró. Quedó pendiente el tratamiento del H. pylori, que se hará 6 meses después del trasplante.
MétodoLaboratorioEl donador debe ser menor de 60 años, no obeso, diabético, sin cirugías intestinales y no haber tomado antibióticos en los últimos 6 meses.
Realizar la historia clínica completa. De ser donador potencialmente sano, pedir: Entamoeba histolytica; Giardia lamblia; Blastocystis hominis; Dientamoeba fragilis: coprocultivo, antígeno de rotavirus y adenovirus en heces (antígenos de adenovirus, antígenos de rotavirus). Clostridium difficile (toxinas A y B). Reacciones luéticas (VDRL). Perfiles de hepatitis A, B y C. Anticuerpos de virus de inmunodeficiencia humana 1 y 2. Prueba presuntiva. Anticuerpos anti-citomegalovirus IgG. Anticuerpos Epstein-Barr IgG. Perfil de inmunoglobulinas: inmunoglobulina A, inmunoglobulina E, inmunoglobulina M e inmunoglobulina G.
El interrogatorio debe incluir la búsqueda de enfermedad inflamatoria intestinal, pólipos colónicos, síndrome de intestino irritable y considerar que el donador haga ejercicio.
Microbiota para administración yeyunalEn campana de flujo laminar, mezclar 2h antes del trasplante 60g de heces fecales con 500ml de agua. Homogeneizar, en batidora.
Filtrar la mezcla a través de gasa estéril (3 capas) y depositar 500ml de alícuota en un frasco de plástico estéril, tapando al final con tapón de hule.
Colocar en el tapón del frasco una aguja hipodérmica del número 18, al interior del mismo, durante 5s y retirar la aguja.
De no utilizar la alícuota de inmediato se puede refrigerar, no congelar. El frasco debe permanecer en posición vertical. Esta mezcla es la microbiota.
Se lleva la microbiota al área del trasplante.
Microbiota para administración por colonEn campana de flujo laminar, mezclar 2h antes del trasplante 180g de heces fecales con 500ml de agua. El resto de la preparación será igual que para la administración por yeyuno.
Endoscopia yeyunalPrevia realización de estudios preoperatorios, se aplica 6h antes del trasplante un enema evacuante con 45ml de glicerol y una tableta de loperamida de 2mg si el paciente no es estreñido.
Se induce al paciente y se revierte al concluir el trasplante.
Se lleva a cabo endoscopia revisando el esófago, estómago y duodeno.
Se toma biopsia para H. pylori. En pacientes con enfermedad inflamatoria intestinal, sospecha de proceso maligno o indicación precisa se toman biopsias y se envían para el estudio histopatológico.
Se pasa el enteroscopio de balón hasta 2cm después del ángulo de Treitz.
Se administran en el yeyuno 500ml de microbiota por el tubo anexo del enteroscopio de balón.
En caso necesario (alta sospecha de recidiva), dejar sonda nasoyeyunal (una semana) para ser utilizada para nuevo trasplante de microbiota intestinal.
Al finalizar la administración de la microbiota concluirá el trasplante. Se da una tableta de loperamida de 2mg.
ColonoscopiaSe prepara el colon y 6h antes del trasplante se administra una tableta de loperamida de 2mg, en caso de que el paciente no sea estreñido.
Se induce al paciente y se revierte al concluir el trasplante.
Se realiza la colonoscopia. En pacientes con enfermedad inflamatoria intestinal, sospecha de proceso maligno o indicación precisa se toman biopsias y se envían para el estudio histopatológico.
Se administra la microbiota: 200ml en colon derecho, 100ml en colon transverso y 200ml en colon descendente.
Si no hay otro procedimiento «extra» que realizar se concluye el estudio. Se administra una tableta de loperamida de 2mg.
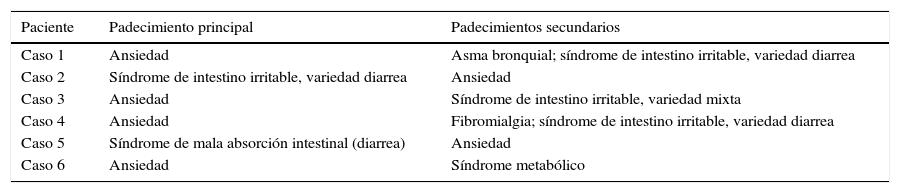
ResultadosLas tablas 1-3 incluyen las enfermedades que condujeron al trasplante de microbiota intestinal, la cronicidad de los padecimientos y los resultados del trasplante.
Enfermedades que condujeron al trasplante de microbiota intestinal
| Paciente | Padecimiento principal | Padecimientos secundarios |
|---|---|---|
| Caso 1 | Ansiedad | Asma bronquial; síndrome de intestino irritable, variedad diarrea |
| Caso 2 | Síndrome de intestino irritable, variedad diarrea | Ansiedad |
| Caso 3 | Ansiedad | Síndrome de intestino irritable, variedad mixta |
| Caso 4 | Ansiedad | Fibromialgia; síndrome de intestino irritable, variedad diarrea |
| Caso 5 | Síndrome de mala absorción intestinal (diarrea) | Ansiedad |
| Caso 6 | Ansiedad | Síndrome metabólico |
Cronicidad de los padecimientos
| Paciente | Padecimiento principal | Padecimientos secundarios |
|---|---|---|
| Caso 1 | Ansiedad (6 años) | Asma bronquial (3 años); síndrome de intestino irritable, variedad diarrea (3 años) |
| Caso 2 | Síndrome de intestino irritable, variedad diarrea (2 meses) | Ansiedad (5 años) |
| Caso 3 | Ansiedad (8 años) | Síndrome de intestino irritable, variedad mixta (4 años) |
| Caso 4 | Ansiedad (7 años) | Fibromialgia (2 años); síndrome de intestino irritable, variedad diarrea (3 años) |
| Caso 5 | Síndrome de mala absorción intestinal (diarrea, 1 mes) | Ansiedad (2 años) |
| Caso 6 | Ansiedad (4 años) | Síndrome metabólico (5 años) |
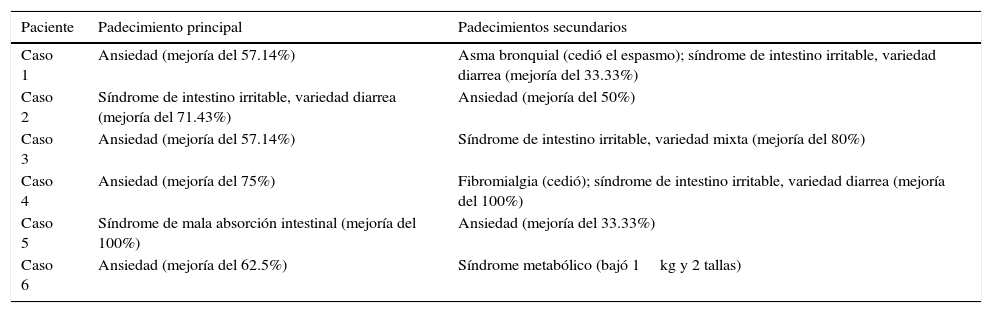
Resultados del trasplante de microbiota intestinal
| Paciente | Padecimiento principal | Padecimientos secundarios |
|---|---|---|
| Caso 1 | Ansiedad (mejoría del 57.14%) | Asma bronquial (cedió el espasmo); síndrome de intestino irritable, variedad diarrea (mejoría del 33.33%) |
| Caso 2 | Síndrome de intestino irritable, variedad diarrea (mejoría del 71.43%) | Ansiedad (mejoría del 50%) |
| Caso 3 | Ansiedad (mejoría del 57.14%) | Síndrome de intestino irritable, variedad mixta (mejoría del 80%) |
| Caso 4 | Ansiedad (mejoría del 75%) | Fibromialgia (cedió); síndrome de intestino irritable, variedad diarrea (mejoría del 100%) |
| Caso 5 | Síndrome de mala absorción intestinal (mejoría del 100%) | Ansiedad (mejoría del 33.33%) |
| Caso 6 | Ansiedad (mejoría del 62.5%) | Síndrome metabólico (bajó 1kg y 2 tallas) |
Las bacterias que viven en el intestino han evolucionado durante millones de años y gracias a estos microorganismos se entrena el sistema inmunológico, se previenen alergias y enfermedades, como la diabetes mellitus, la obesidad y algunos trastornos neurológicos.
Al intestino se le conoce como «el segundo cerebro», ya que existen más de 100 millones de neuronas en el tracto intestinal (más que en la médula espinal o en el sistema nervioso periférico) y muchas contienen los mismos neurotransmisores que el cerebro.
Enfermedades que se pueden tratar con trasplante de microbiota intestinal (fecal) son: alergias alimentarias y del aparato respiratorio; anorexia nerviosa; ateroesclerosis (aún en revisión); cáncer de colon (sí, en animales de laboratorio); C. difficile; colitis fulminante; colitis pseudo-membranosa4,5; colitis ulcerativa crónica inespecífica6; diabetes mellitus tipo 1; diarrea severa por antibióticos; diarrea severa, no reversible; enfermedad celiaca (aún en revisión); enfermedades cardiovasculares (aún en revisión); enfermedades neurológicas; esclerosis múltiple7; estreñimiento; hiper o hipotiroidismo; obesidad mórbida; púrpura trombocitopénica idiopática8; síndrome de intestino irritable; síndrome de fatiga crónica; síndrome metabólico; sobrecrecimiento bacteriano; sprúe colagenoso; sprúe tropical; trastornos autoinmunes (artritis reumatoide, dermatomiositis, esclerodermia, fibromialgia, lupus eritematoso, osteoartritis y osteoartrosis); trastornos eosinofílicos del aparato digestivo; trastornos neurodegenerativos y trastornos del neurodesarrollo.
El trasplante de microbiota intestinal puede realizarse a través de sonda nasogástrica, por endoscopia hasta el duodeno, por enema evacuante, o por colonoscopia.
Preferimos la aplicación a través de enteroscopio, ya que se coloca la microbiota en yeyuno; existen 3 zonas de estrechez que impiden su regreso (esfínter esofágico inferior, píloro y pinza del ángulo de Treitz), así como por reportar la literatura más efectividad por la vía digestiva alta.
El donador puede ser pariente cercano o cualquier persona sana. Es preferible que esté a base de dieta líquida durante 3 días, con el fin de que las heces presenten consistencia semilíquida y faciliten el procedimiento9.
En una revisión de 317 pacientes, tratados en 27 diferentes series, el trasplante de microbiota fecal fue efectivo en el 92% para infección por C. difficile10.
Los resultados se basaron en el tipo de donador; la vía de administración; el volumen de lo trasplantado, y el tratamiento después del trasplante. Los efectos adversos son mínimos. Cuando se utiliza el aparato digestivo superior han sido observados: eructos, náuseas, calambres abdominales, que ceden espontáneamente el mismo día. El trasplante se realizó cuando los tratamientos convencionales no dieron resultado. Se ha utilizado en urgencias y es mejor, comparado con el uso de anticuerpos monoclonales provenientes de toxinas A, B y C de C. difficile.
Lo que es alentador es que los nuevos estudios indican que las bacterias intestinales están haciendo más que simplemente digerir la comida y mantener un sistema inmune saludable. Además de lo expresado, contribuyen a nuestra salud física y emocional. Un hecho incuestionable es que existen por encima de un trillón de estos microorganismos viviendo en el intestino y pesan de 1,300 a 1,400g; lo mismo que pesa el cerebro11.
En el Hospital Johns Hopkins, preocupados por los efectos adversos de los antibióticos en niños con diarrea, por el incremento de los pacientes no respondedores a antibióticos (un cuarto de los casos), así como por el aumento de pacientes nuevos (3 millones en los EE.UU. cada año), están instrumentando un programa de trasplante fecal, que busca disminuir los elevados costos para tratar el problema (3 billones cada año en los EE.UU.)12. Consideran también las 14,000 muertes cada año en el mismo país, por diarreas.
Es sabido que cuando se matan los «microorganismos buenos» del intestino con antibióticos se suele producir una alteración conocida como «disbiosis»13 (estado de desbalance en la salud del paciente).
Los pacientes suelen considerar como natural el manejo del trasplante de microbiota intestinal en infecciones recurrentes por C. difficile, sobre todo cuando es un médico quien propone el trasplante de microbiota intestinal14.
Generalmente, el manejo del C. difficile con metronidazol o vancomicina se asocia a un 20-30% de recurrencia. Es en estos casos en los que el trasplante de microbiota intestinal juega su papel más significativo15.
No se produce resultado alentador en el 100% de los casos, mas sí en la mayoría de los mismos16.
Ha sido señalado que los pacientes con recidiva de diarrea por C. difficile mejoran con el nuevo trasplante de microbiota intestinal17, además de observar que el rol del metabolismo de ácidos biliares en el colon es significativo y que después del trasplante se detectan ácidos biliares secundarios. Asimismo, el metabolismo de las sales biliares y de los ácidos biliares primarios y secundarios alterados se corrigen con el trasplante de microbiota intestinal18.
Se han llevado a cabo estudios heterogéneos profundos sobre la microbiota observando que no es igual en las distintas zonas terrestres, y que también es diferente dependiendo de la localización corporal19,20. Asimismo, se ha comprobado que el 60% de las células inmunitarias se localizan en el intestino21,22.
Borody en Sydney, Australia, y Khoruts en Minneapolis, Minnesota23, llevaron a cabo una excelente revisión del trasplante de microbiota fecal y señalaron lo siguiente: la introducción de técnicas modernas, dentro de las que se incluye la «tecnología de secuencia dirigida al ácido ribonucleico» —incluyendo las capacidades computacionales—, así como las nuevas técnicas analíticas han revolucionado la ciencia y dan una excelente oportunidad para las investigaciones sobre el trasplante de microbiota fecal. Asimismo, los proyectos europeos y estadounidenses MetaHIT y Human Microbiome, que buscan determinar los organismos causantes de las enfermedades, son toda una realidad24.
Algunos autores están utilizando el análisis filogenético de cultivo independiente de la secuencia codificada de 16S rARN en afecciones por C. difficile para determinar recurrencias25.
Hasta el año 2009, 150 pacientes habían recibido trasplante de microbiota fecal por recurrencias de C. difficile, a través de enema, sonda nasoduodenal o tubo nasogástrico, con resultados alentadores. Esta técnica se llevó a cabo ya que el rol de inmunoglobulinas, vacunas, probióticos y antibióticos no era totalmente claro26.
La microbiota intestinal regula tanto la salud como la enfermedad y ayuda a prolongar la vida27,28.
Un grupo de gastroenterólogos han publicado normativa acerca del trasplante de microbiota fecal para tratar el C. difficile, con lo que no solo se acepta el procedimiento, sino que se definen los pasos a seguir29.
En la Ciudad de México se realizó trasplante de microbiota fecal a domicilio, reportando buenos resultados. El caso fue para C. difficile recurrente, como los que han sido reportados en la literatura mundial30.
Se ha comprobado que el trasplante de microbiota fecal da resultado en infección recurrente por C. difficile. Se reporta hasta un 100% de éxito en procedimientos efectuados una sola vez31.
Otros autores refieren que no solo el trasplante de microbiota fecal sirve para C. difficile recurrente, sino también para tratar la enfermedad infamatoria intestinal, la pouchitis y el síndrome de intestino irritable32, observando buenos resultados en ellos. Asimismo, señalan a Bennet como el primero en usar este tipo de trasplante en enfermedad inflamatoria intestinal, en el año 1989.
La microbiota trasplantada perdura de 4 semanas hasta un año, dependiendo del tipo de administración, de la cantidad administrada y de las características propias del receptor y del donador. Puede aparecer incremento temporal de la proteína C reactiva33,34.
Conclusionesa) Los resultados preliminares obtenidos en este proyecto de investigación son similares a los de otros investigadores. b) Hasta este momento no ha habido complicaciones inherentes al trasplante. c) Los resultados de mejoría manifestados por los pacientes han fluctuado entre 1-2 semanas a partir de la fecha en que se hizo el trasplante. d) Con el trasplante se obtiene mejoría clínica, que llega hasta el 70%. e) Se hará seguimiento cuatrimestral clínico y bioquímico durante un año a partir del momento en que se hizo el trasplante de microbiota intestinal. f) Se informará nuevamente resultados y conclusiones cuando los investigadores de este trabajo hayan trasplantado a 25 pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
AutoríaLos autores están realizando el estudio con una metodología personal. Si alguien desea llevar a cabo el procedimiento deberá recibir la autorización por escrito de los mismos.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.