El gen TJP1 codifica para una proteína ZO-1, necesaria para el reclutamiento de las ocludinas y claudinas en las uniones estrechas y participa en la polarización celular. Tiene diferentes variaciones cuya frecuencia ha sido estudiada en numerosas poblaciones; sin embargo en México no hay estudios de este gen, siendo necesarios ya que sus polimorfismos pueden ser usados en estudios de asociación en medicina y en cirugía. Por tal motivo el objetivo de este estudio fue estimar la frecuencia de alelos y genotipos del polimorfismo rs2291166 del gen TJP1 en población mestiza de México; así como estimar el efecto conformacional del cambio de un aminoácido.
Material y métodosSe incluyeron 473 individuos. El polimorfismo rs2291166 se identificó por PCR-PASA y PAGE al 7% teñida con nitrato de plata. El efecto conformacional de cambio de aminoácido se realizó in silico con los servidores ProtPraram Tool y Search Database with Fasta.
ResultadosEl alelo más frecuente en las dos poblaciones es el alelo ancestral (T). Se encontró una distribución similar a otras poblaciones respecto a los genotipos. El polimorfismo está en equilibrio de Hardy-Weinberg, p>0.05. El cambio de aspartato por alanina produce un cambio conformacional.
ConclusionesEl estudio revela alta frecuencia del alelo ancestral en población mexicana del polimorfismo rs2291166 y produce un cambio en la estructura de ZO-1.
TJP1 gene encodes a ZO-1 protein that is required for the recruitment of occludins and claudins in tight junction, and is involved in cell polarisation. It has different variations, the frequency of which has been studied in different populations. In Mexico there are no studies of this gene. These are required because their polymorphisms can be used in studies associated with medicine and surgery. Therefore, the aim of this study was to estimate the frequency of alleles and genotypes of rs2291166 gene polymorphism TJP1 in Mexico Mestizos population, and to estimate the conformational effect of an amino acid change.
Material and methodsA total of 473 individuals were included. The rs2291166 polymorphism was identified PASA PCR-7% PAGE, and stained with silver nitrate. The conformational effect of amino acid change was performed in silico, and was carried out with servers ProtPraram Tool and Search Database with Fasta.
ResultsThe most frequent allele in the two populations is the ancestral allele (T). A genotype distribution similar to other populations was found. The polymorphism is in Hardy-Weinberg, p>0.05. Changing aspartate to alanine produced a conformational change.
ConclusionsThe study reveals a high frequency of the ancestral allele at rs2291166 polymorphism in the Mexican population.
En la era posgenómica tres paradigmas son de interés en la cirugía general, la realización de procedimientos quirúrgicos personalizados, predicción; así como prevención de complicaciones pre-, inter- y posquirúrgicas1–3. En la población mexicana hay pocos estudios en los genes, y estos se han enfocado al proceso de la fibrogénesis, el caso de polimorfismos en los genes TGF-β, PAI-1, AT, que se asocian con la contractura capsular mamaria posmamoplastia o de respuesta al tratamiento del pirfenidone4–6. Recientemente se ha propuesto como marcador en la clínica quirúrgica al polimorfismo rs1345365 de ELMO17.
Además de estos genes, se requieren buscar nuevos marcadores, que puedan ser utilizados en enfermedades cotidianas del cirujano oncólogo, urólogo, ginecólogo, internista y del gastroenterólogo; como son: la pancreatitis aguda, pancreatitis crónica, mola hidatiforme; así como varios tipos de cáncer (tiroides, páncreas, vías biliares, hígado y colon). Por lo cual se propone a las variantes en el gen TJP1 (Tight Junction Protein-1) como indicadores en la práctica personalizada de estas. Esto por dos razones: primero, que el gen TJP1 codifica para la proteína ZO-1 (Zona Occludens-1), que forma parte de las uniones estrechas o contactos célula-célula, porque participa en la diferenciación celular, citocinesis y quimiotaxis8–12. Segundo, porque se ha reportado alteración en la arquitectura de ZO-1 en modelos animales, en estudios in vivo y cultivos de tejido, en dos grupos: ya sea por disminución de la expresión de la proteína y, otro por incremento; para el primer caso, corresponde a embarazos molares parciales, mola hidatiforme completa, colangiocarcinomas intrahepáticos como en extrahepáticos, tumores de la vesícula biliar, tumores de mama en estadio 4TLM12–16. En el segundo grupo, está el adenocarcinoma ductal pancreático, estadio I-II de cáncer colónico y carcinomas de colon con metástasis al hígado17–22. Recientemente se ha reportado el incremento de TJP1 en el 71% de los casos con neoplasias gastrointestinales, donde la expresión es proporcional al diámetro del tumor, el grado histológico, y la sobrevida de los pacientes22; por ejemplo, en el cáncer pulmonar de células no pequeñas, la expresión de este gen es un indicador de buen pronóstico, acorde a la escala TNM23.
Las evidencias sugieren que en cirugía, los marcadores genéticos ideales de TJP1 son aquellos que conducen a cambios de aminoácido, porque modifican la estructura de las proteínas con reducción o ganancia de su función, también por acúmulo de estas. En ambos casos se produce enfermedad por alteración estructural24. También aquellos loci en sitios crípticos intrónicos, en regiones promotoras o potenciadoras, porque aumentan o disminuyen la expresión génica y por lo tanto, de la proteína.
Los estudios del gen TJP1 son limitados a nivel mundial, solo hay cuatro polimorfismos con locus en regiones intrónicas estudiados en los fenotipos del espectro autista, respuesta al tratamiento de los antipsicóticos y, keratocono25–27. Por otra parte, de 155 polimorfismos de la clase SNP (Single Nucleotide Polymorphism, polimorfismo de cambio de un solo nucleótido) y tres DIV (Deletion, Insertion, Variación, variación del tipo deleción/inserción) registrados, que conducen a cambios de aminoácido, solamente seis han sido analizados en población mexicoamericana, de ellos, la variante rs2291166 está asociada con albuminuria. Este polimorfismo consiste en una transversión T >G en el exón 23, codón 1334, que conduce al cambio de aspartato por alanina en un dominio aún no caracterizado funcionalmente en ZO-1. En población mexicana no hay reportes previos de estos, por lo que se vuelve un reto su estudio, ya que la estructura de la variación genética de los grupos étnicos, constituye una contribución significativa a este tema; por lo que es necesario como un paso previo a un estudio de asociación, para determinar si un polimorfismo está presente y pueda ser validado, como marcador en la clínica-quirúrgica.
ObjetivosAnalizar la frecuencia de alelos y genotipos, así como establecer el equilibrio Hardy Weinberg en la población mestiza mexicana, con respecto al polimorfismo rs2291166 (p.D1334A) con locus g.29716773T>G del gen TJP1. Por otra parte, comparar las frecuencias obtenidas con otras poblaciones y establecer mediante el análisis in silico, si el polimorfismo rs2291166 conducía a un cambio conformacional en la proteína ZO-1.
Material y métodosa) Captación probandos. El trabajo fue un estudio descriptivo, en el cual se incluyeron 473 probandos sanos (n=946 cromosomas), con una edad oscilante entre los 18-82 años, los cuales correspondían a casos con una ancestría mestiza (nacido en México, con un apellido de origen español y ancestros de origen mexicano, tres generaciones hacia atrás). Fueron captados del centro Desarrollo Integral de la Familia (DIF) municipal Chapala Jalisco, de los Laboratorios Tolsa, del Hospital Regional Valentín Gómez Farías, de la Delegación Sur en el Estado de Oaxaca, de la Sociedad de Gerontogeriatría del Estado de Jalisco A. C. (SOGEJAL), del Instituto de Investigaciones sobre la Salud Pública de la Universidad de la Sierra Sur, del Instituto de Genética Humana, Centro Universitario de Ciencias de la Salud (CUCS) de la Benemérita Universidad de Guadalajara.
Todos los participantes firmaron la carta de consentimiento informado.
Este trabajo forma parte del proyecto intitulado: «Estudio de tamizaje poblacional para la identificación de factores de riesgo ambientales y genéticos, asociados al desarrollo de enfermedades complejas relacionadas con la nutrición en el occidente así como sur de México», con números de registro IBM/DIF/2010-2012 y IISSP/BAMM/03, aprobado por los Comités de Investigación, Ética y Bioseguridad. Fue realizado acorde a la Declaración de Helsinki y a los principios del tratado de Belmont.
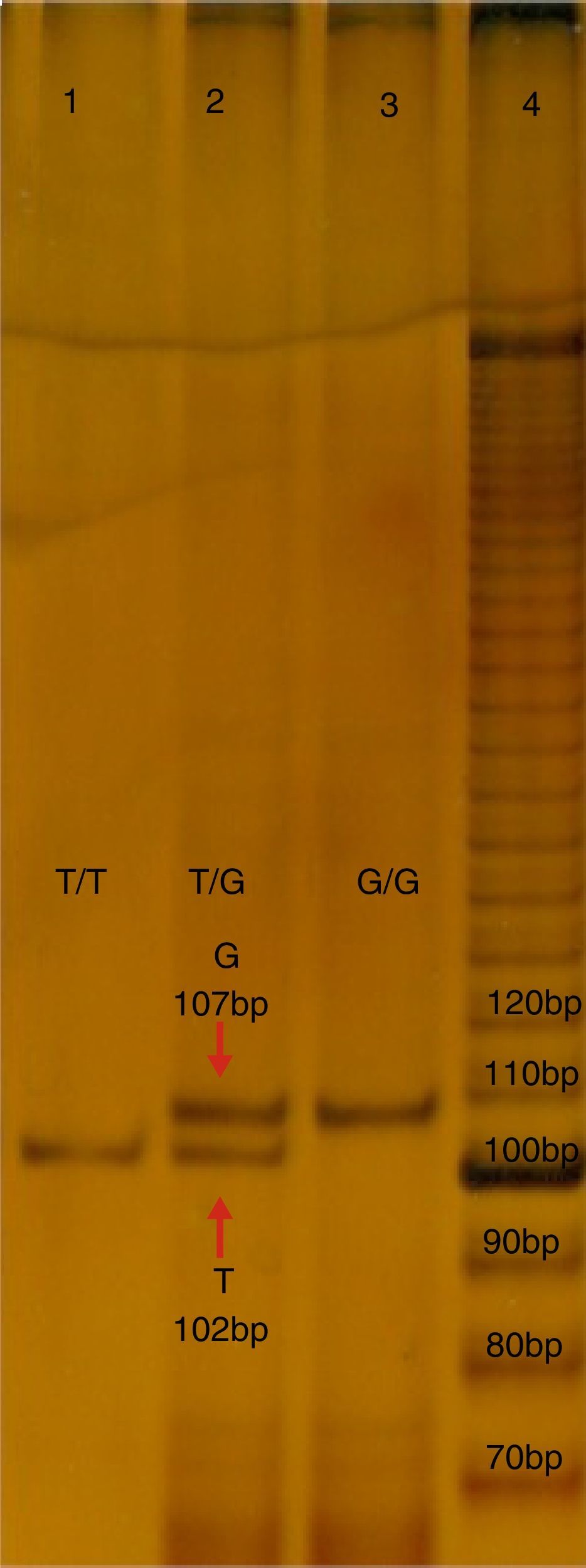
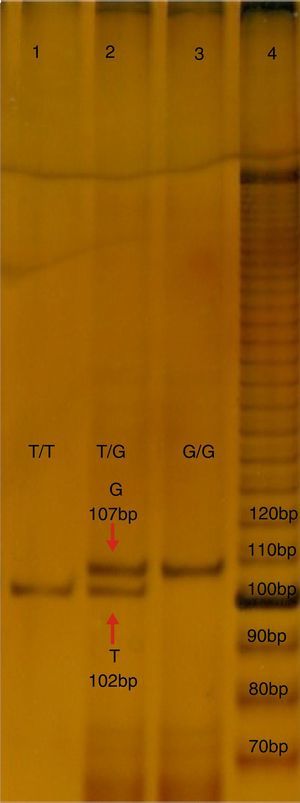
b) Estudio molecular. Se obtuvieron cinco mililitros de sangre periférica de cada probando, en un tubo con ácido Etilendiaminotetraacético (EDTA), que fue utilizado para aislar el DNA mediante un kit comercial (GeneCatcher, Invitrogen). La detección del polimorfismo rs2291166 fue mediante la reacción en cadena de la polimerasa alelo específico (PCR-PASA). Para lo cual se diseñaron los iniciadores: FW1G 5¿- CTTCATCTTCTTCAGGTT-3¿, FW2A 5¿-ATATTCTTCATCTTCTTC AGG TG¿-3, RW3 5¿-GTCATTCATTATCTGTTAGG-3¿ (Genosys Sigma-Aldrich). El programa de amplificación realizado en el termociclador TECHNE modelo TC-412, consistió en 30 ciclos: 95°C, durante 5 minutos (desnaturalización inicial), a 95°C, por 30 segundos (desnaturalización), 48°C, 45 segundos (hibridación), a 72°C, 30 segundos (polimerización), con una extensión final de 72°C, 5 minutos. La mezcla de reacción; Buffer KCl 2.5 μl (1X), MgCl21.5 μl (25 mM), 0.5 μl de dNTP's (0.2 mM), 0.5 μl de cada iniciador (25 pmoles), 2 μl de templado de ADN (200 ng), DNA Pol Taq 0.3 μl (3 U/ul) (Invitrogen), y finalmente 17.20 μl de agua, reacción final 25 ml. Los productos de PCR se analizaron mediante electroforesis en poliacrilamida en la proporción 19:1 al 7%, con ulterior corrimiento electroforético con buffer TBE 1X por 1.5 horas a 200 volts, 80-84 mA. Los productos se diferenciaron por los tamaños; el de 102 pb corresponde al alelo T, mientras que el de 107 pb corresponde al alelo G, como se observa en la figura 1.
Electroforesis en poliacrilamida al 7%, TBE 0.5X, del PCR-PASA para el SNP rs2291166 de TJP1. En el carril número 4 corresponde al corrimiento del marcador de 10 bases (life-tecnologies). El carril 1 y 3 corresponden a muestras de probandos homocigotos T y G, el carril 2 corresponde a un heterocigoto. Bp:pares de bases.
c) Análisis conformacional. Para determinar si el polimorfismo rs2291166 conducía a un cambio conformacional, se analizó la estructura primaria y secundaria de la proteína ZO-1 realizada mediante escaneo en los siguientes software; ProtPraram Tool disponible en la página http://web.expasy.org/protparam, así como Search Database with Fasta con acceso en la página http://Fasta.bioch.virginia.edu/fasta_www2/, considerando los siguientes parámetros: estructura secundaria (Hydropathy/Secondary-Structure/Garnier plot para 4 estados); α-hélices, hojas-β, vueltas y colas). En ambos casos se introdujo en el portal respectivo la secuencia FASTA con número de referencia NCBI>gi|666335569|ref|NP_001287954.1[Homo sapiens], en dos versiones; una con el residuo aspartato1334 y la otra con alanina 1334.
d) Análisis estadístico. Se estableció la tasa del alelo menor (MAF, MinorAllele Frequency) por conteo directo. Para validar las diferencias en la distribución de alelos y genotipos con base en las frecuencias observadas con las esperadas, se utilizó la χ2. Se consideró en equilibrio Hardy Weinberg si la suma de los valores de χ2 eran menores de 9.21 y p<0.001 con un grado de libertad.
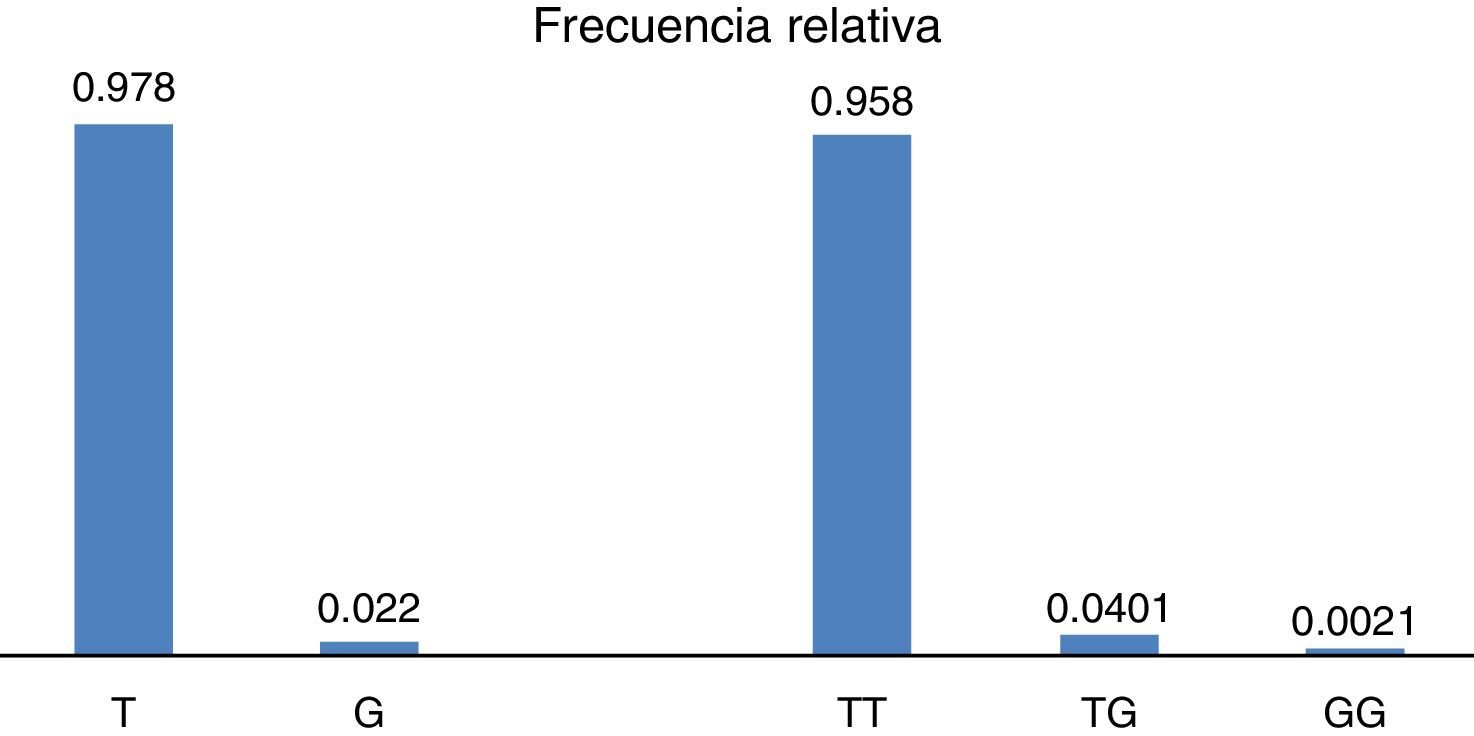
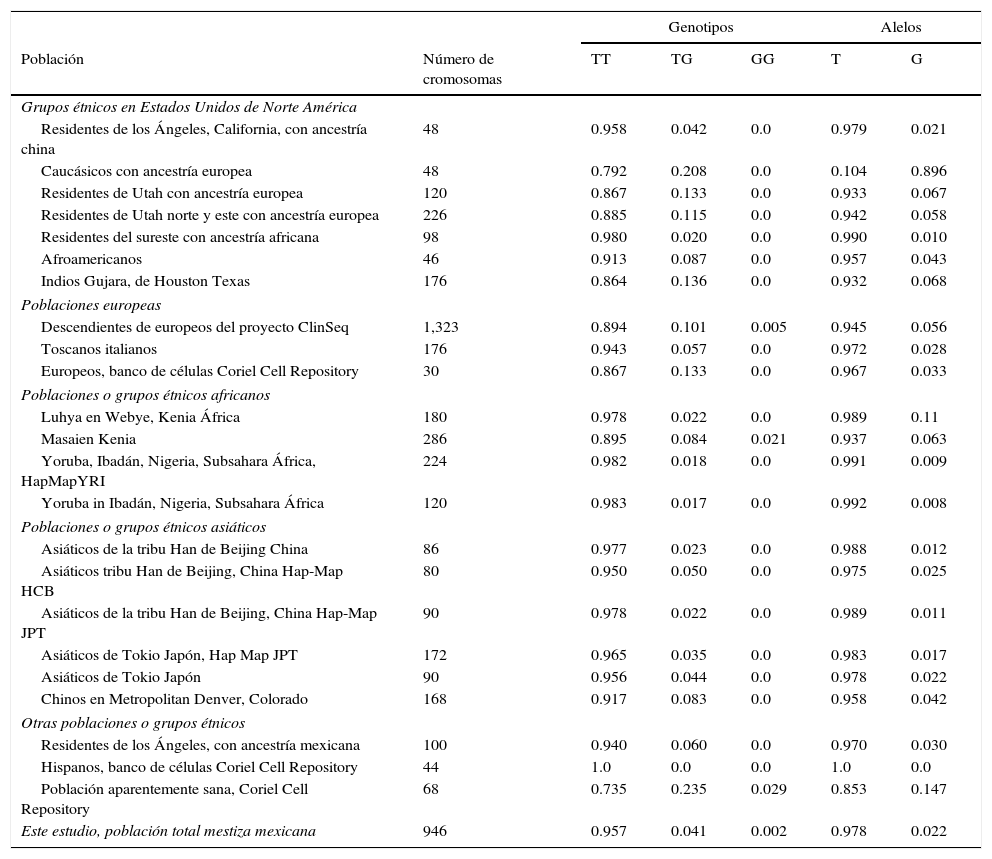
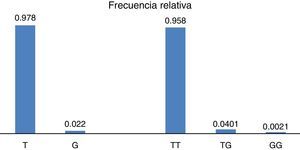
ResultadosEn relación a la distribución de alelos del polimorfismo rs2291166 del gen TJP1, la frecuencia relativa (fr) en la población mexicana mestiza total analizada fue la siguiente: 0.978(n=925) para el alelo ancestral o silvestre T y 0.022 (n=21) para el alelo G (fig. 2). La tasa MAF fue G=0.022/21. La distribución de genotipos la siguiente: 0.958 para los homocigotos T (n=453), 0.0401 para los heterocigotos (n=19) y 0.0021 para los homocigotos G (n=1), como se observa en la figura 2. El índice de heterocigocidad promedio en la población total analizada fue de 0.05 y el de homocigocidad de 0.95. Los homocigotos G fueron escasos en la población analizada. Al comparar las frecuencias relativas de alelos y genotipos rs2291166 con las otras poblaciones reportadas en el banco de SNP, encontramos una distribución similar para los diferentes grupos étnicos, en las cuales el genotipo homocigoto G es poco frecuente, este solo se ha descrito en población Maasai en Kenia (fr=0.021) y en población aparentemente sana de la colección AGI-ASP (Coriel Apparently Healthy Collection) (fr=0.029) (tabla 1).
Frecuencia de alelos y genotipos del polimorfismo rs2291166 del gen TJP1
| Genotipos | Alelos | |||||
|---|---|---|---|---|---|---|
| Población | Número de cromosomas | TT | TG | GG | T | G |
| Grupos étnicos en Estados Unidos de Norte América | ||||||
| Residentes de los Ángeles, California, con ancestría china | 48 | 0.958 | 0.042 | 0.0 | 0.979 | 0.021 |
| Caucásicos con ancestría europea | 48 | 0.792 | 0.208 | 0.0 | 0.104 | 0.896 |
| Residentes de Utah con ancestría europea | 120 | 0.867 | 0.133 | 0.0 | 0.933 | 0.067 |
| Residentes de Utah norte y este con ancestría europea | 226 | 0.885 | 0.115 | 0.0 | 0.942 | 0.058 |
| Residentes del sureste con ancestría africana | 98 | 0.980 | 0.020 | 0.0 | 0.990 | 0.010 |
| Afroamericanos | 46 | 0.913 | 0.087 | 0.0 | 0.957 | 0.043 |
| Indios Gujara, de Houston Texas | 176 | 0.864 | 0.136 | 0.0 | 0.932 | 0.068 |
| Poblaciones europeas | ||||||
| Descendientes de europeos del proyecto ClinSeq | 1,323 | 0.894 | 0.101 | 0.005 | 0.945 | 0.056 |
| Toscanos italianos | 176 | 0.943 | 0.057 | 0.0 | 0.972 | 0.028 |
| Europeos, banco de células Coriel Cell Repository | 30 | 0.867 | 0.133 | 0.0 | 0.967 | 0.033 |
| Poblaciones o grupos étnicos africanos | ||||||
| Luhya en Webye, Kenia África | 180 | 0.978 | 0.022 | 0.0 | 0.989 | 0.11 |
| Masaien Kenia | 286 | 0.895 | 0.084 | 0.021 | 0.937 | 0.063 |
| Yoruba, Ibadán, Nigeria, Subsahara África, HapMapYRI | 224 | 0.982 | 0.018 | 0.0 | 0.991 | 0.009 |
| Yoruba in Ibadán, Nigeria, Subsahara África | 120 | 0.983 | 0.017 | 0.0 | 0.992 | 0.008 |
| Poblaciones o grupos étnicos asiáticos | ||||||
| Asiáticos de la tribu Han de Beijing China | 86 | 0.977 | 0.023 | 0.0 | 0.988 | 0.012 |
| Asiáticos tribu Han de Beijing, China Hap-Map HCB | 80 | 0.950 | 0.050 | 0.0 | 0.975 | 0.025 |
| Asiáticos de la tribu Han de Beijing, China Hap-Map JPT | 90 | 0.978 | 0.022 | 0.0 | 0.989 | 0.011 |
| Asiáticos de Tokio Japón, Hap Map JPT | 172 | 0.965 | 0.035 | 0.0 | 0.983 | 0.017 |
| Asiáticos de Tokio Japón | 90 | 0.956 | 0.044 | 0.0 | 0.978 | 0.022 |
| Chinos en Metropolitan Denver, Colorado | 168 | 0.917 | 0.083 | 0.0 | 0.958 | 0.042 |
| Otras poblaciones o grupos étnicos | ||||||
| Residentes de los Ángeles, con ancestría mexicana | 100 | 0.940 | 0.060 | 0.0 | 0.970 | 0.030 |
| Hispanos, banco de células Coriel Cell Repository | 44 | 1.0 | 0.0 | 0.0 | 1.0 | 0.0 |
| Población aparentemente sana, Coriel Cell Repository | 68 | 0.735 | 0.235 | 0.029 | 0.853 | 0.147 |
| Este estudio, población total mestiza mexicana | 946 | 0.957 | 0.041 | 0.002 | 0.978 | 0.022 |
Alelos: T o G; ClinSeq:a Large-Scale Medical Sequencing Clinical Research Pilot Study; genotipos: homocigotos T (TT) o G (GG), heterocigoto (TG); HapMap:mapa de haplotipos, catálogo de variantes genéticas comunes en humanos; HCB:muestras de la fase 3 del grupo étnico Han de Beijín China; JPT:muestras de la fase 3 de población japonesa de Tokio; YRI:muestras de la fase 3 de población con ancestría Yoruba de Ibadán Nigeria, África.
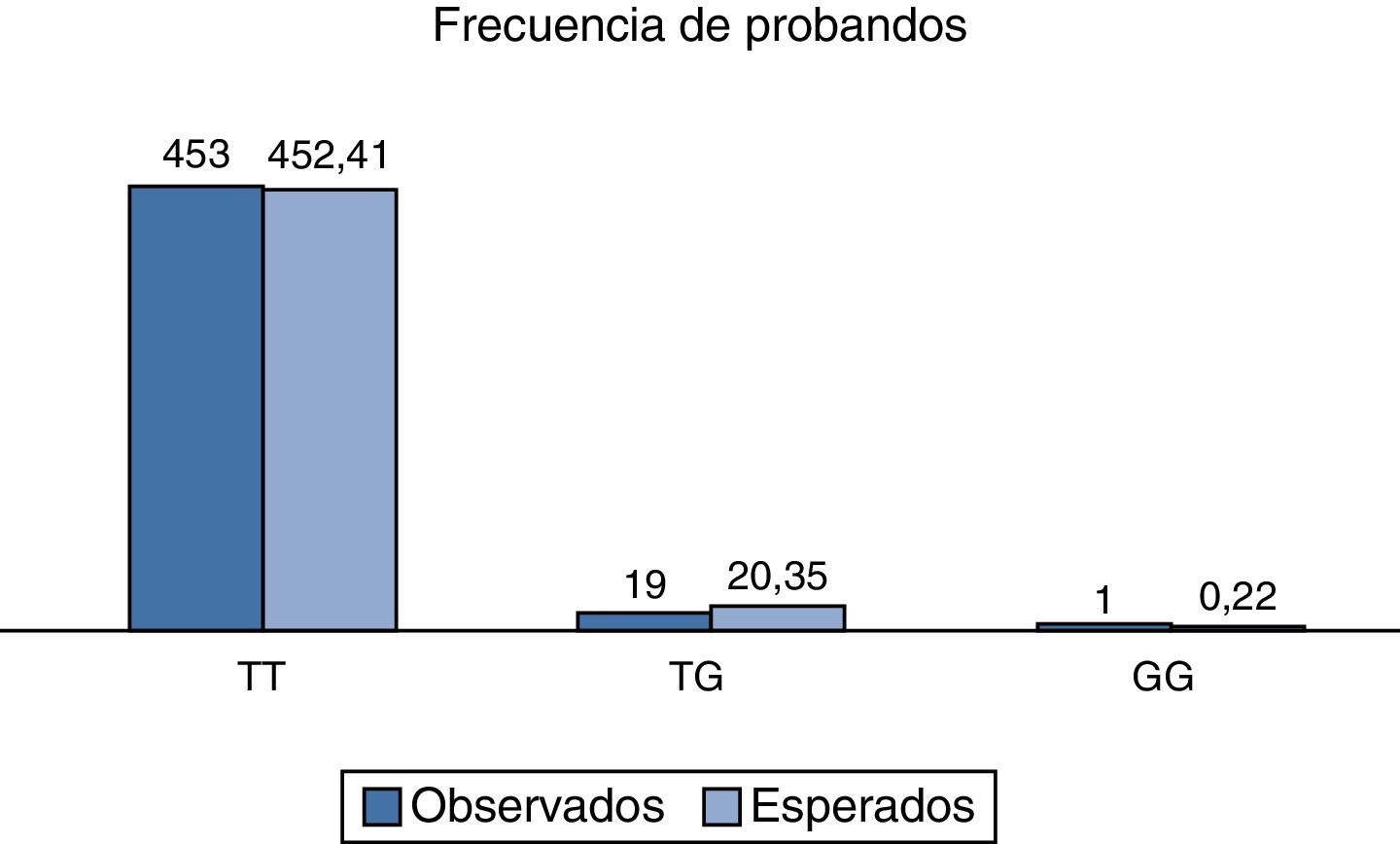
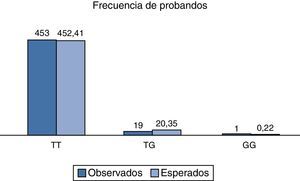
Al analizar la distribución de las frecuencias relativas observadas, así como al compararlas con las esperadas, se encontró un valor de χ2 de 2.3, respectivamente para la población total analizada, y con un valor de p>0.05; por lo tanto, el polimorfismo rs2291166 del gen TJP1, está en equilibrio Hardy Weinberg, como se observa en la figura 3, que es muy similar a lo reportado en otras poblaciones (tabla 1).
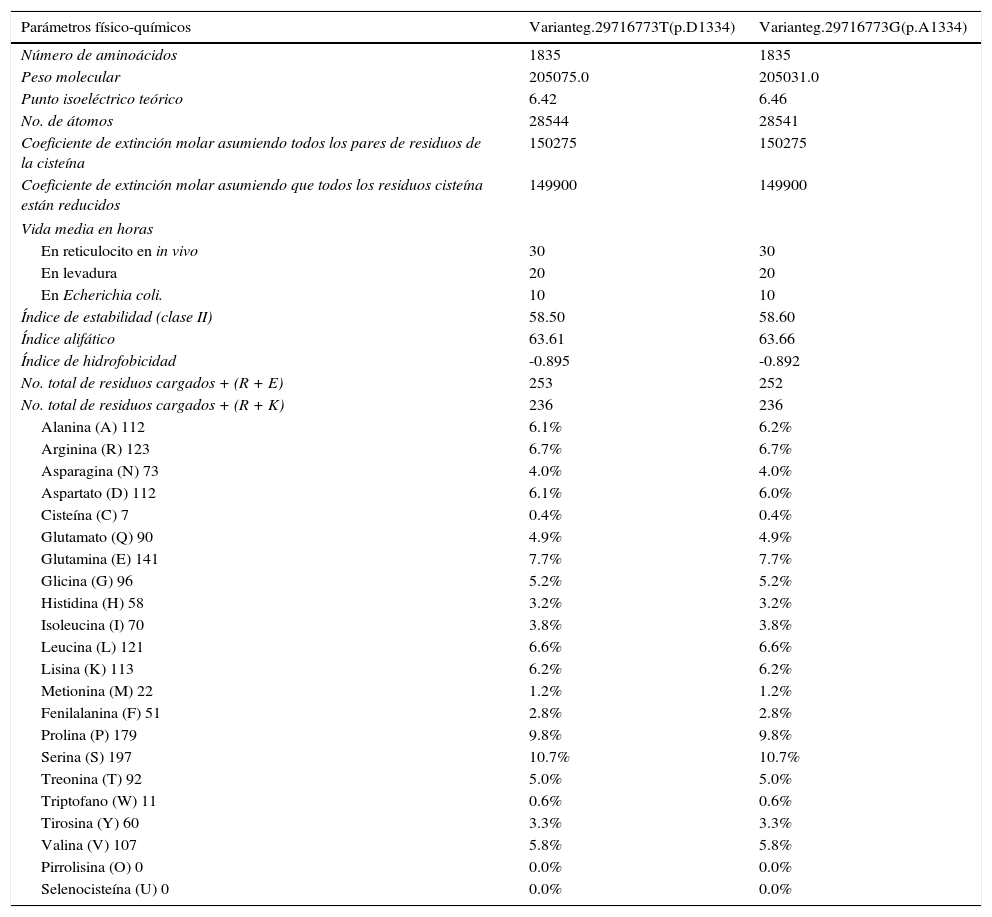
El estudio in silico de la estructura primaria muestra diferencias entre las variantes g.29716773T (p.D1334) y g.29716773G (p.A1334) para el peso molecular, punto isoeléctrico, índice de estabilidad, índice alifático, índice de hidrofobicidad, número de residuos con carga positiva, porcentaje de aspartato; así como en el porcentaje de alanina (tabla 2). La variante ancestral g.29716773T produce un punto isoeléctrico menor, una proteína más estable (aunque es clase II) y conduce una ZO-1 con mayor índice de hidrofobicidad. El estudio de la estructura secundaria muestra que la variante ancestral g.29716773T de TJP1 produce una proteína ZO-1 con mayor contenido de vueltas-β y menos contenido de α-hélices (tabla 3, fig. 4).
Efecto del polimorfismo rs2291166 en la estructura primaria de ZO-1
| Parámetros físico-químicos | Varianteg.29716773T(p.D1334) | Varianteg.29716773G(p.A1334) |
|---|---|---|
| Número de aminoácidos | 1835 | 1835 |
| Peso molecular | 205075.0 | 205031.0 |
| Punto isoeléctrico teórico | 6.42 | 6.46 |
| No. de átomos | 28544 | 28541 |
| Coeficiente de extinción molar asumiendo todos los pares de residuos de la cisteína | 150275 | 150275 |
| Coeficiente de extinción molar asumiendo que todos los residuos cisteína están reducidos | 149900 | 149900 |
| Vida media en horas | ||
| En reticulocito en in vivo | 30 | 30 |
| En levadura | 20 | 20 |
| En Echerichia coli. | 10 | 10 |
| Índice de estabilidad (clase II) | 58.50 | 58.60 |
| Índice alifático | 63.61 | 63.66 |
| Índice de hidrofobicidad | -0.895 | -0.892 |
| No. total de residuos cargados + (R + E) | 253 | 252 |
| No. total de residuos cargados + (R + K) | 236 | 236 |
| Alanina (A) 112 | 6.1% | 6.2% |
| Arginina (R) 123 | 6.7% | 6.7% |
| Asparagina (N) 73 | 4.0% | 4.0% |
| Aspartato (D) 112 | 6.1% | 6.0% |
| Cisteína (C) 7 | 0.4% | 0.4% |
| Glutamato (Q) 90 | 4.9% | 4.9% |
| Glutamina (E) 141 | 7.7% | 7.7% |
| Glicina (G) 96 | 5.2% | 5.2% |
| Histidina (H) 58 | 3.2% | 3.2% |
| Isoleucina (I) 70 | 3.8% | 3.8% |
| Leucina (L) 121 | 6.6% | 6.6% |
| Lisina (K) 113 | 6.2% | 6.2% |
| Metionina (M) 22 | 1.2% | 1.2% |
| Fenilalanina (F) 51 | 2.8% | 2.8% |
| Prolina (P) 179 | 9.8% | 9.8% |
| Serina (S) 197 | 10.7% | 10.7% |
| Treonina (T) 92 | 5.0% | 5.0% |
| Triptofano (W) 11 | 0.6% | 0.6% |
| Tirosina (Y) 60 | 3.3% | 3.3% |
| Valina (V) 107 | 5.8% | 5.8% |
| Pirrolisina (O) 0 | 0.0% | 0.0% |
| Selenocisteína (U) 0 | 0.0% | 0.0% |
Efecto del polimorfismo rs2291166 en la estructura secundaria de ZO-1
| Estructura secundaria | Varianteg.29716773T(p.D1334) | 1,835 aminoácidos | Varianteg.29716773G(p.A1334) | 1,835 aminoácidos |
|---|---|---|---|---|
| Parámetro | Número de residuos | % de residuos | Número de residuos | % de residuos |
| α-hélices (H) | 453 | 24.9 | 454 | 25.0 |
| Hojas-β (E) | 359 | 19.7 | 359 | 19.7 |
| Vueltas-β (T) | 450 | 24.7 | 449 | 24.7 |
| Colas aleatorias (C) | 573 | 31.5 | 573 | 31.5 |
Efecto conformacional del polimorfismo rs2291166 de TJP1 en ZO-1. De amarillo subrayado se aprecia el cambio de aminoácido y de verde el cambio conformacional que se caracteriza por una introducción de una vuelta-β asociada a la alanina en el residuo 1334. El color de esta figura solo puede apreciarse en la versión electrónica del artículo.
Este es el primer estudio realizado en la población mexicana, que muestra la frecuencia de alelos y genotipos del polimorfismo rs2291166 de TJP. El alelo T, los genotipos TT, TG fueron los más frecuentes, como en mexicoamericanos y otras poblaciones (tabla 1)8. El genotipo homocigoto G (GG) del SNP rs2291166, solo ha sido reportado en una muestra amplia de más de 1,000 Europeos (proyecto ClinSeq; A Large-Scale Medical Sequencing Clinical Research Pilot Study) (fr=0.005), en los Maasai de Kenia (fr=0.021), en población aparentemente sana de la colección AGI-ASP (fr=0.029) y ahora en México (fr=0.002). Estos resultados se puede explicar por tres hipótesis: la primera, la cual postula que las frecuencias presentadas en este estudio son producto del mestizaje, apoyado en algunos reportes previos con Y-STR's (Short Tandem Repeats), que muestran hasta un 3-5% de ancestría africana y un 65% de ancestría europea28. La segunda, que argumenta que la frecuencia de alelos se conservó durante el mestizaje de los nativos amerindios, como se ha observado para los alelos *A, *B y *C del polimorfismo (GC) del gen para la fosfatasa ácida de eritrocitos29. La tercera, que refiere que la baja frecuencia del homocigoto G está relacionada con una selección en contra, teniendo un efecto fenotípico severo asociado a la muerte por daño renal, lo que se apoya por los estudios realizados en los mexicoamericanos por Lehman et al8. Por otra parte, también se validó que la variante rs2291166, sí es un polimorfismo presente en México, ya que su distribución de genotipos está en equilibrio de Hardy Weinberg y para establecer este parámetro fue necesario un estudio previo de asociación, para reducir la posibilidad de falsos positivos o sesgos de información relacionados con la falta de verosimilitud del marcador, como lo reporta Topete-González et al.7.
En el presente trabajo, se incluyó un número mayor de probandos de los reportados en el banco de SNP's, muy similar a la muestra de descendientes de europeos del proyecto ClinSeq, lo que reduce de manera importante la posibilidad de estos sesgos, proporcionando certeza de los resultados presentados30, lo que se refleja con la detección de portadores homocigotos G, cuya frecuencia es muy escasa; por otra parte, el estudio in silico revela un efecto patogénico del SNP rs2291166 de TJP1, ya que la transversión T>G se traduce en la sustitución de aspartato por valina, que lleva a un cambio conformacional en ZO-1. La variante p.1334D produce una isoforma más estable (tabla 2, fig. 4), este cambio se correlaciona con las modificaciones en la estructura primaria; índice de hidrofobicidad, que es mayor en la isoforma ancestral (tabla 2). Estos resultados más la asociación de la variante p.1334D>A, con la tasa urinaria de albumina/creatinina y con albuminuria, apoyan la teoría de la patología conformacional en la patogénesis de las enfermedades, como lo ha postulado Hayden et al.24. El efecto del cambio estructural tendrá que ser demostrado por estudios de isoelectroenfoque, cristalografía y difracción con rayos X que se puede realizar porque las dos isoformas de ZO-1 presentan punto isoeléctrico diferente; sin embargo, estas perspectivas no formaron parte de los objetivos de este estudio.
Si consideramos que la pancreatitis aguda, la mola hidatiforme y varios tipos de cáncer, tienen en común la alteración de la arquitectura celular, sea por pérdida de moléculas de contacto célula-célula o por el incremento en la expresión de estas moléculas, y de la movilidad a través de la matriz extracelular; por lo tanto, el polimorfismo rs2291166 de TJP1 debe ser analizado para determinar el efecto en el riesgo de desarrollo, tomando en cuenta que estas alteraciones son causadas también por cambios estructurales de las proteínas del citoesqueleto como de la matriz extracelular. También pueden ser marcadores de susceptibilidad para enfermedades complejas o emergentes, donde está alterada la arquitectura de las uniones estrechas (ZO-1), como se ha demostrado en cultivos de células de leucemia aguda y síndromes mielodisplásicos, mediante el silenciamiento por hipermetilación31–33. Para el caso de las infecciones por cosackievirus, adenovirus, virus de la hepatitis C, virus de la inmunodeficiencia humana tipo 1 (HIV) y por papilomavirus (VPH); en los primeros la infección es contenida siempre y cuando las uniones estrechas epiteliales intestinales mantengan su estructura; para el segundo, virus de la hepatitis C se une a las uniones estrechas promoviendo la retención de las ocludinas en el retículo endoplasmático; y para el tercer y cuarto casos, la expresión de proteínas del HIV en la mucosa epitelial cervical correlacionan con la disrupción de ZO-1, e incrementan la expresión del pseudovirión del papilomavirus para la penetración de las células basales así como las parabasales, en las cuales inicia el ciclo de vida del HIV. Así, la alteración de ZO-1 potencia la carcinogénesis de cérvix asociada a papilomavirus, relevante para los ginecólogos colposcopistas34–36. La predisposición genética del SNP rs2291166 para gastritis por Helicobacter pylori, será de los futuros trabajos a realizar, ya que este produce disrupción de ZO-1, en las células epiteliales gástricas37.
Por último, los cambios de aminoácido modifican a la estructura y función de las proteínas (para ZO-1, la permeabilidad celular), por ello es obligado analizar el efecto de polimorfismos de ZO-1 con problemas cardiovasculares, ya que en células endoteliales, y en triglicéridos producto de hidrólisis de la lipoproteína lipasa, incrementan la permeabilidad de ZO-1, y la hipercolesterolemia sérica produce alteración en la distribución y vía de la PI3K (fosfatidil-inositol-3-quinasa). En insuficiencia cardiaca por cardiomiopatía isquémica o dilatada, también existe una marcada disminución de ZO-1 y la conexina 4338–40.
En dermatología los polimorfismos de TJP1 como el SNP rs2291166 pueden ser un factor modificador de la severidad en dermatosis caracterizadas por la pérdida de la arquitectura de la piel, como psoriasis y epidermólisis bullosa. Esto se ve apoyado en que la psoriasis está relacionada con la resistencia a la insulina, y la expresión de TJP1 es regulada positivamente por IGF-1(insulin-like growth factor type 1, factor de crecimiento semejante a la insulina tipo 1), como se ha demostrado en cultivos de células de carcinoma epidermoide41,42.
ConclusionesSe estableció la frecuencia de alelos y genotipos así como el equilibrio Hardy Weinberg en la población mexicana, con respecto al polimorfismo rs2291166 del gen TJP1, por lo cual queda validado para realizar futuros estudios de asociación en el campo de la clínica-quirúrgica en México. También se estableció la similitud de la distribución relativa de alelos y genotipos con otras poblaciones, asemejándose a las poblaciones europeas y africana. Y finalmente in silico se demostró que este polimorfismo conduce a un cambio putativo estructural de la proteína ZO-1, generando dos isoformas, la isoforma ancestral o p.1334D, que proporciona una proteína con más estabilidad conformacional.
FinanciamientoFinanciado por el Laboratorio de Variación Genética y Enfermedad, de la Benemérita Universidad de Guadalajara y al Grupo Multidisciplinario para el Estudio Integral de las Enfermedades Metabólicas e Infecciosas en población mexicana.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Sergio A. Ramirez Garcia y Luis Javier Flores Alvarado, ya que ambos autores contribuyeron igual al desarrollo del trabajo. Por su apoyo técnico y colaboración; a los becarios del Programa de Incorporación a la Investigación Temprana en Ciencias Biomédicas y Sociales, Delegación Sur de SOGEJAL 2010-2012: Jareth Marco Cruz Bastida y Jafet Said Cruz Bastida, que participaron en la recolección de muestras, toma de los consentimientos informados, análisis estadístico, diseño de cuadros y figuras. También a la Sra. Dora Cervantes, Presidenta y Mtra. Magdalena Cruz, Directora para el periodo 2010-2012 del Sistema para el Desarrollo Integral de la Familia de la Delegación Chapala Jalisco, por el apoyo de la Consulta Externa de la Unidad de Investigación Biomolecular, para captación de probandos. Al Gerente General de Laboratorios Tolsa Eduardo Ascuita Ramos por su apoyo para la realización del estudio.